基于熵权TOPSIS模型的桃儿七种子超低温保存条件筛选
久西加 王玉辉 陈红刚,2 王惠珍,2 曾翠云,2 杜 弢,2*
(1.甘肃中医药大学和政药用植物园,和政 731200;2.西北中藏药协同创新中心,兰州 730000)
桃儿七(Sinopodophyllum hexandrum)为小檗科(Berberidaceae)桃儿七属(Sinopodophyllum)多年生草本植物,主要分布于我国陕西、甘肃、青海、云南、四川和西藏等地[1],其果实及根茎均能入药,具有祛风除湿、调经活血功效[2]。但近年来由于原生生境的破坏及市场需求量的增多导致其资源匮乏,目前被列为国家二级濒危保护植物[3]。当前利用种子进行繁殖是解决桃儿七资源问题的有效方法之一,但其种子容易失活,不易保存,严重制约了扩繁生产。
超低温冷冻技术可以安全地保存许多植物的种子、花粉、胚及其繁殖体[4]。而针对种子的超低温保存同样是珍稀濒危植物离位保存的重要方式,也是实现种质资源长期保存的重要手段。在种子的超低温保存中,种子含水量是影响保存效果的关键因素。种子含水量过高时,超低温保存会在细胞中形成冰晶体,导致冻结危害,而含水量过低时,又会导致细胞水分大量流失,从而降低种子活力[5]。马尾松(Pinus massoniana)种子的含水量在6.1%时,其细胞抗氧化能力强,膜系统损伤小,细胞代谢旺盛,超低温保存效果较好[6]。而九里香(Murraya exotica)种子含水量在7%时最适宜进行超低温冷冻保存[7]。另外,适宜的冷冻方式也是决定超低温保存是否有效的关键因素,缓慢冷冻法具有良好的脱水效果,直接冷冻法则可以极大地避免迅速降温带来的细胞伤害,而玻璃化冷冻法则可以使材料进入玻璃态,从而对材料起到保护作用[8]。如快速冷冻法是羯布罗香(Dipterocarpus turbinatus)种子进行超低温保存的最佳冷冻方式[9],而高良姜(Alpinia officinarum)种子则最适宜玻璃化冷冻保存[10],目前桃儿七主要通过种子进行扩繁生产,且前人对于桃儿七种子的研究主要集中于其休眠机理的探索,对于其种子超低温保存条件的研究鲜见报道,研究桃儿七种子的超低温保存条件具有一定的现实意义。因此本研究通过测定不同含水量的桃儿七种子经3 种不同冷冻方式冷冻前后的超氧化物歧化酶(SOD)、过氧化物酶(POD)活性,丙二醛(MDA)、总蛋白(TP)、可溶性淀粉、可溶性糖含量以及种子生活力等的变化,并利用熵权TOPSIS 法进行综合评价,旨在从生理生化的角度探索适宜桃儿七种子的超低温保存条件,为实现其种质资源的长期保存提供方法指导。
1 材料与方法
1.1 材料来源
桃儿七种子采于甘肃中医药大学和政药用植物园(35°15′48″N,103°24′21″E),并由甘肃中医药大学药学院杜弢教授鉴定确认。种子经清水浸泡揉搓,去掉果肉,过筛剔除瘪粒和缺损的坏粒,自然阴干,置于冰箱中4 ℃储存备用。
1.2 浸泡法和硅胶干燥法处理桃儿七种子
将桃儿七种子分为4组,每组10~15 g,分别采用硅胶干燥2 h、自然阴干及浸泡2 h 和5 h 等方式获得含水量分别为1.6%、9.6%、20.9%和30.5%的桃儿七种子。含水量的测定依据国家农作物种子检验规程GB/T 3543.6 进行。各含水量种子设对照组和处理组,对照组直接进行指标测定,处理组经超低温保存后进行指标测定。
1.3 种子超低温冷冻处理
冷冻处理分为3 组,分别为直接冷冻组、缓慢冷冻组和玻璃化冷冻组。
直接冷冻组:将放有桃儿七种子的冷冻保存管不经过任何试剂处理直接投入-196 ℃液氮冷冻保存7 d后取出待测。
缓慢冷冻组:将桃儿七种子放入加有冷冻保护剂PVS2 的冻存管中,先置于冰箱中4 ℃处理30 min,取出后立即放入冰箱中-20 ℃冷冻60 min,而后迅速投入液氮罐内保存7 d后取出待测。
玻璃化冷冻组:将桃儿七种子放入加有装载液LS 的冻存管中,常温下处理20 min 后,倾倒装载液LS,加入冷冻保护剂PVS2并放置于冰上冷冻30 min,而后更换成新鲜的预冷过的PVS2(0 ℃),并迅速投入至液氮罐中保存7 d后取出待测。
冷冻保护剂(PVS2)为30%甘油+15%乙二醇+15%二甲亚砜+0.4 mol·L-1蔗糖的Murashige-Skoog(MS)液体培养基,装载液LS 为2 mol·L-1甘油+0.4 mol·L-1蔗糖的MS液体培养基。
1.4 解冻处理
将经过超低温保存的桃儿七种子从液氮(-196 ℃)中取出,迅速投入水浴中40 ℃解冻10 min,其中玻璃化冷冻组和缓慢冷冻组用洗涤溶液US(含1.2 mol·L-1蔗糖的MS 溶液)洗涤10 min,蒸馏水清洗浸泡种子3次,每次2 min,用滤纸擦干种子表面的水分后待测。
1.5 种子生活力的测定
选取对照组和处理组种子各50粒进行种子生活力的测定,3次重复。采用TTC 染色法测定种子生活力。
1.6 相关生理指标的测定
对照组和处理组种子经液氮研磨后,采用南京建成生物工程研究所提供的试剂盒对可溶性糖、淀粉、总蛋白、过氧化物酶、超氧化物歧化酶及丙二醛的含量进行测定。
1.7 数据处理
采用SPSS26.0 软件进行方差分析,用平均值和标准误表示测定结果,并用Duncan 法进行多重比较;利用SPSSAU 平台对数据进行正/逆向化和标准化处理,再进行熵权TOPSIS 分析;采用Origin软件绘图。
2 结果与分析
2.1 含水量及超低温冷冻方式对种子生活力的影响
由图1 可知,4 种含水量的桃儿七种子经不同的超低温冷冻方式保存后,其种子生活力均呈现不同程度的下降,其中含水量为1.6%、9.6%和20.9%的桃儿七种子经缓慢冷冻后其种子生活力相较对照组无显著变化(P>0.05),生活力均在82%以上。而含水量为30.5%的桃儿七种子不论经过何种超低温冷冻方式保存后,其种子生活力均呈现显著下降(P<0.05),且降幅明显。
2.2 含水量及超低温冷冻方式对种子内可溶性糖含量的影响
由图2 可知,4 种含水量的桃儿七种子经不同的超低温冷冻方式保存后,种子内可溶性糖含量均显著上升(P<0.05),其中含水量为9.6%的种子经直接冷冻后,可溶性糖含量较对照组增幅最大,而含水量为1.6%、20.9%、30.5%的种子经玻璃化冷冻后可溶性糖含量增幅最大。

图2 不同含水量及超低温冷冻方式下种子内可溶性糖的含量变化Fig.2 Changes of soluble sugar content in seeds under different water content and ultra-low temperature freezing methods
2.3 含水量及超低温冷冻方式对种子内淀粉含量的影响
图3显示,除含水量为20.9%的桃儿七种子经直接冷冻后,淀粉含量显著上升(P<0.05)外,其余各处理组种子内淀粉含量较对照组均显著下降(P<0.05);含水量为1.6%的种子总体降幅最大,其中经直接冷冻后的种子内淀粉质量分数降至172.71 mg·g-1;而含水量为9.6%和30.5%经玻璃化冷冻后,其降幅较其他处理组较小。
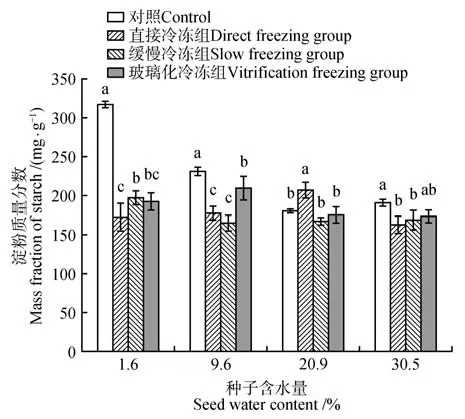
图3 不同含水量及超低温冷冻方式下种子内淀粉的含量变化Fig.3 Changes of starch content in seeds under different water content and ultra-low temperature freezing methods
2.4 含水量及超低温冷冻方式对种子内总蛋白含量的影响
图4 显示,含水量为9.6%、20.9%的桃儿七种子经超低温保存后,种子内总蛋白质质量分数均较对照显著升高(P<0.05),且均以缓慢冷冻组增幅最大,分别增至12.10、16.16 mg·g-1;而含水量为1.6%和30.5%的种子随冷冻方式的不同,蛋白质含量变化呈现不同的趋势,其中含水量为1.6%的种子经玻璃化冷冻后较对照显著上升(P<0.05),增幅达179.65%。而含水量为30.5%的种子经直接冷冻后,蛋白质含量较对照显著上升(P<0.05),经玻璃化冷冻后显著下降(P<0.05),但缓慢冷冻组较对照无显著差异(P>0.05)。

图4 不同含水量及超低温冷冻方式下种子内总蛋白的含量变化Fig.4 Changes of total protein content in seeds under different water content and ultra-low temperature freezing methods
2.5 含水量及超低温冷冻方式对种子内过氧化物酶活性的影响
如图5 所示,除含水量为1.6%的桃儿七种子外,其余各含水量的桃儿七种子经超低温保存后,种子内POD 活性均呈现下降趋势;其中含水量为20.9%的种子经缓慢冷冻后降幅最大,为251.23%(P<0.05);含水量为30.5%的种子经玻璃化冷冻后,种子内POD 活性较对照无显著差异(P>0.05)。

图5 不同含水量及超低温冷冻方式下种子内POD 的活性变化Fig.5 Changes of POD activity in seeds under different water content and ultra-low temperature freezing methods
2.6 含水量及超低温冷冻方式对种子内超氧化物歧化酶活性的影响
由图6 可知,含水量为20.9%的桃儿七种子,各处理间的SOD 活性较对照均无显著差异(P>0.05);其余含水量的种子经超低温冷冻保存后,SOD 活性较对照总体均呈下降趋势;含水量为1.6%的种子经玻璃化冷冻后,SOD 活性较对照无显著变化;而含水量为9.6%以及30.5%的种子在3种冷冻方式下均较对照显著下降,其中含水量为30.5%的种子经玻璃化冷冻后降幅最大。

图6 不同含水量及超低温冷冻方式下种子内SOD 的活性变化Fig.6 Changes of SOD activity in seeds under different water content and ultra-low temperature freezing methods
2.7 含水量及超低温冷冻方式对种子内丙二醛含量的影响
图7 显示含水量为9.6%、20.9%的桃儿七种子,各处理组的MDA 含量较对照组均呈现下降趋势,且均以缓慢冷冻组降幅最大;含水量为1.6%的种子经直接冷冻或者缓慢冷冻后,种子内MDA含量显著上升,而经玻璃化冷冻后又显著下降;含水量为30.5%的种子经缓慢冷冻或者玻璃化冷冻后,MDA含量显著上升,其中玻璃化冷冻组种子内的MAD质量摩尔浓度增至27.56 nmol·mg-1。
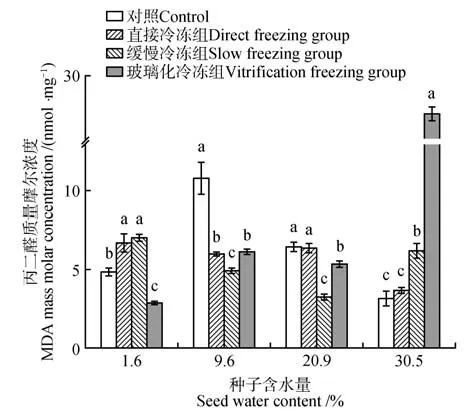
图7 不同含水量及超低温冷冻方式下种子内MDA 的含量变化Fig.7 Changes of MDA content in seeds under different water content and ultra-low temperature freezing methods
2.8 熵权TOPSIS分析
由于单一指标无法较好地衡量最佳的种子含水量和超低温冷冻方式,故引入熵权TOPSIS 模型对各处理组进行综合评价。以不同处理方式为组别,以7个相关指标与其对照组的差值建立评价不同含水量及不同冷冻方式下桃儿七种子的初始化决策矩阵。其中种子内可溶性糖含量、淀粉含量、总蛋白质含量3种营养物质,POD 和SOD 2种抗氧化系统酶,其指标为越大越优型,而种子生活力及MDA则为越小越优型指标。需先对变量进行逆向化处理,最后通过归一化处理计算分析得到权重(见表1)及评价结果(见表2)。表2 结果表明,本试验中不同处理组综合排序靠前的分别是含水量为1.6%的玻璃化冷冻组种子,含水量为9.6%的直接冷冻组和缓慢冷冻组的种子。

表1 熵值法计算权重结果Table 1 Results of weight calculation by entropy method
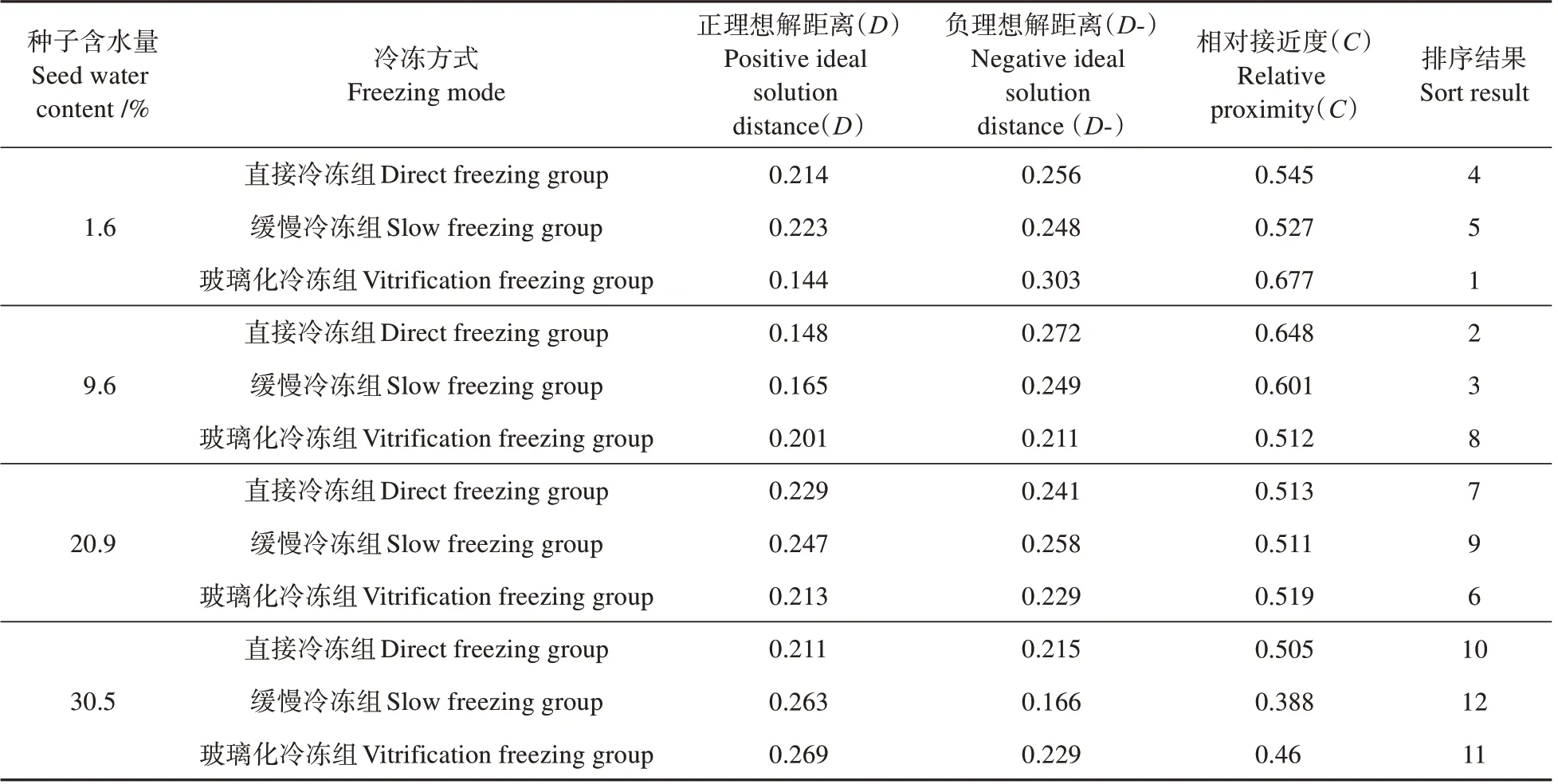
表2 TOPSIS评价计算结果Table 2 Calculation results of TOPSIS evaluation
3 讨论
3.1 基于种子生活力的桃儿七种子超低温保存条件筛选
种子生活力是种子潜在萌发能力的体现,研究表明,超低温保存能使一些短命性种质资源(葱韭类种子)[11]和具有休眠特性的种质资源——红豆杉(Taxus wallichianavar.chinensis)种子[12]长期保持种子生活力。然而在利用超低温保存技术保存种子的过程中,含水量会对保存后的种子生活力产生极大的影响,如不同含水量的樟树(Cinnamomum camphora)种子经超低温保存后,种子内的脱氢酶活性及相对电导率均呈现极显著的差异[13]。肉豆蔻(Myristica fragrans)种子在含水量为27.15%时经超低温保存后,种子生活力降幅最小[14]。本研究结果表明,含水量为1.6%、9.6%和20.9%的桃儿七种子经缓慢冷冻后,种子生活力保持较好,较对照无显著差异(P<0.05),说明1.6%~20.9%的种子含水量以及缓慢冷冻方式是桃儿七种子适宜的超低温保存条件。
3.2 基于营养物质的桃儿七种子超低温保存条件筛选
可溶性糖、淀粉及蛋白质都是种子内重要的原料物质,为种子的萌发提供能量[15]。种子经超低温保存后,仍具有充足的营养物质是其再次恢复活性的关键。同时,在植物细胞中,可溶性糖和蛋白质是保护性物质之一,在植物遭受高温或者低温胁迫时大量积累,并通过增加细胞液浓度,降低细胞渗透势等方式提高环境耐性[16-17]。研究表明[18],含水量3.6%玉蝉花(Iris ensata)种子经超低温保存后种子内可溶性蛋白质质量分数显著高于其他处理组;马尾松种子在含水量为6.1%时,经超低温保存后可溶性糖、可溶性蛋白含量均达到最大[6]。本研究结果表明4 种含水量的桃儿七种子经超低温保存后种子内可溶性糖和总蛋白质含量总体呈上升趋势,且含水量为9.6%的桃儿七种子,经直接冷冻后,可溶性糖含量较对照显著升高,经缓慢冷冻后其总蛋白质含量增幅最大,但各含水量种子经超低温保存后种子内淀粉含量总体呈下降趋势。这可能是由于种子遭遇低温环境后,促使淀粉在α-淀粉酶的作用下分解为可溶性糖,用以提高种子抗逆性的结果。就种子内营养物质的变化而言,含水量为9.6%的桃儿七种子经直接冷冻或缓慢冷冻为最佳的超低温保存条件。
3.3 基于抗氧化系统的桃儿七种子超低温保存条件筛选
SOD 和POD 在种子中的功能多样,能够参与生长素的代谢、细胞壁的延伸和加厚、活性氧和活性氮的代谢以及植物的抗病作用等各种生理活动[19]。同时,SOD 和POD 也能清除在迅速降温过程中由活性氧导致的脂质过氧化和细胞毒害作用,而丙二醛是脂质过氧化作用的最终分解产物,能抑制细胞保护酶的活性,从而降低抗氧化物的含量,其含量经常被看作是植物遭受逆境伤害的指标[20],SOD、POD活性与MDA含量之间的平衡关系直接决定着植物细胞内氧化/抗氧化系统的调节功能。研究表明[21],益智(Alpinia oxyphylla)种子中MDA 及SOD 的含量随超低温冷冻时间的延长呈上升趋势,SOD 含量的增加减轻了低温带来的膜质过氧化作用;高山栲(Castanopsis delavayi)种子中MDA 含量经超低温冷冻保存后呈上升趋势,但在含水量为20.36%的种子中增幅最小[22],MDA 所造成的毒害作用也最弱;同样,胡杨(Populus euphratica)种子经超低温保存后MDA 含量也呈上升趋势,但含水量为4.30%时,种子中SOD 活性最高,从而抑制了MDA 的产生[23]。本研究结果表明,除含水量为1.6%的桃儿七种子经缓慢冷冻后,POD活性显著上升(P<0.05)外,其余各处理组种子中SOD及POD活性均呈下降趋势。说明各含水量桃儿七种子在超低温保存后均受到一定程度的冷害损伤,使种子内活性氧水平升高,抗氧化酶活性降低。但MDA含量除在含水量为30.5%的种子中上升外,在其余各含水量种子中均保持平稳或下降趋势。这可能是桃儿七种子经超低温保存后,可溶性糖、蛋白质等营养物质和过氧化物系统以互补的方式共同发挥作用,从而维持植物细胞中的活性氧稳态,抵抗低温导致的细胞损害的结果。
4 结论
为了综合衡量出适宜桃儿七种子的超低温保存条件,本试验引入TOPSIS模型对各处理组的7个指标进行分析。结果表明,含水量为1.6%的桃儿七种子经玻璃化冷冻或含水量为9.6%的种子经直接冷冻或缓慢冷冻为桃儿七种子最佳的超低温保存条件。但含水量为9.6%的种子为自然阴干,且直接冷冻法和缓慢冷冻法较玻璃化冷冻法在实际操作中更为便捷。综上,桃儿七种子液氮超低温保存技术是可行的,且种子经自然阴干后采用直接冷冻法或缓慢冷冻法是最适宜的超低温冷冻保存条件。

