野生茯苓鉴定及其木质纤维素降解酶系研究
覃雯 尹立伟 胡婷 杨春成 武琳 黄祝 胡雅楠
摘 要:为揭示茯苓木质纤维素降解酶系及培养方式对其主要酶系的影响,该研究通过对野生茯苓菌株进行培养特性的显微观察,利用3对引物PCR扩增进行系统发育学的鉴定,经定性培养筛选出优势菌株YX1,采用酶标仪测定不同条件下茯苓纤维素酶、半纤维素酶和木质素降解酶的活力大小。结果表明: (1)茯苓有菌丝体、子實体和菌核3 种形态特征。(2)PCR分别获得rDNA-ITS序列1 652 bp、核糖体大亚基序列 660 bp和翻译延伸因子序列545 bp,提交至 NCBI,登录号分别为 ON129554、ON129553和 ON155840。(3)纤维素酶和半纤维素酶在有松木屑和无松木屑条件下,外切β-葡聚糖酶(CBH)、内切β-葡聚糖酶(EG)、β-葡萄糖苷酶(BGL)最高分泌量分别为16 ~ 17 U·mL-1、32 ~ 35 U·mL-1、36 ~ 37 U·mL-1;木聚糖酶、甘露聚糖酶和α-葡萄糖苷酶最高分泌量分别为28 ~ 38 U·mL-1、280 ~ 342 U·mL-1、9 ~ 11 U·mL-1;锰过氧化物酶(MnP)、漆酶(laccase)、木质素过氧化物酶(LiP)这3种木质素降解酶在4种不同培养液中均有微弱的酶活性,木质纤维素酶中的酶活性大小依次为甘露聚糖酶>木聚糖酶>BGL>EG>CBH>α-葡萄糖苷酶>LiP>MnP>Laccase,纤维素酶和半纤维素酶酶活性之间存在显著差异(P<0.05)。综上表明,该研究结合形态学与分子鉴定,明确了野生茯苓YX1的分类地位,与褐腐菌在亲缘关系上既有联系又存在遗传差距,为茯苓产生木质纤维素降解酶系的降解机制提供了基础酶学参考。
关键词: 茯苓, ITS序列, 纤维素酶, 半纤维素酶, 木质素降解酶
中图分类号:Q945.8
文献标识码:A
文章编号:1000-3142(2023)04-0712-11
Abstract:In order to reveal the effects of Wolfiporia cocos lignocellulolytic enzymes and culture methods on its main enzymes, the main lignocellulolytic enzymes of W. cocos were determined in this study. The microscopic observation of the culture characteristics of the wild W. cocos strains was carried out, three pairs of primers were used for PCR amplification to carry out phylogenetic identification, and the dominant strain YX1 was screened by qualitative culture and finally the activities of cellulase, hemicellulase and ligninolytic enzymes under different conditions were determined by microplate reader. The results were as follows:(1) W. cocos had mycelium, fruiting body and sclerotium three morphological characteristics. (2) PCR obtained rDNA-ITS sequence of 1 652 bp, ribosomal large subunit sequence of 660 bp and translation elongation factor sequence of 545 bp, and submitted to NCBI,accession numbers were ON129554, ON129553, and ON155840, respectively. (3) The highest secretion of exo-β-glucanase(CBH), endo-β-glucanase(EG) and β-glucosidase(BGL) in the presence or absence of sawdust was 16-17 U·mL-1, 32-35 U·mL-1, 36-37 U·mL-1; The maximum secretion of xylanase, mannanase and α-glucosidase was 28-38 U·mL-1, 280-342 U·mL-1, 9-11 U·mL-1. The three ligninolytic enzymes manganese peroxidase (MnP), laccase, and lignin peroxidase (LiP) had weak enzymatic activities in four different cultures, the magnitude of enzymatic activities in lignocellulases were in the order of mannanase > xylanase > BGL> EG > CBH > α-glucosidase > LiP > MnP > laccase, and there were significant differences between cellulase and hemicellulase enzymatic activities (P<0.05). In conclusion, this study combines morphological and molecular identification to clarify the taxonomic status of YX1, which has both relationship and genetic gap with brown rot fungi, and provides a basic enzymatic reference for the degradation mechanism of the lignocellulolytic enzymes system produced by W. cocos.
Key words: Wolfiporia cocos, ITS, cellulase, hemicellulase, ligninolytic enzymes
木质纤维素降解酶(lignocellulolytic enzymes)是分解木质纤维素主要的降解酶系,木質纤维素是地球上数量最为丰富且可再生的自然资源之一,全球每年可产生1.11×1011亿t木质纤维素(Tadesse & Luque, 2011),木质纤维素的生物降解是一个涉及众多酶系参与的高度复杂的过程,可低消耗、低污染、高效率地转化利用自然界中的生物质能源(Macdonald et al., 2011;杨立霞等, 2016a),为了更好地利用木质纤维素,国内外学者们开始关注木质纤维素降解酶的研究与应用。
茯苓(Wolfiporia cocos)是一种木材褐腐真菌,又称玉灵、茯灵、万灵桂、茯菟等,大多寄生在马尾松(Pinus massoniana)或赤松(P. densiflora)等树种的根上(王晓霞, 2012)。木质纤维素酶是多组分的复合酶系统,在降解木质纤维素时起催化作用,既包括与纤维素和半纤维素降解相关的水解酶类,又包括与木质素降解相关的氧化酶类。纤维素酶(cellulase, Cels)是一类能够水解纤维素的β-D-糖苷键并生成葡萄糖的多组分酶的总称,它们能够分泌一系列的外切β-葡聚糖酶(exo-β-glucanase, CBH)、内切β-葡聚糖酶(endo-β-glucanase, EG)和β-葡萄糖苷酶(β-glucosidase, BGL)(Okal et al., 2020)。半纤维素酶(hemicellulase, Hcels)是一个复杂的酶系,主要包括木聚糖酶(xylanase)、甘露聚糖酶(mannanase)和α-葡萄糖苷酶(α-glucosidase)等多种酶(高微微, 2017;Méndez-Líter et al., 2021)。与木质素降解相关的氧化酶类主要包括锰过氧化物酶(manganese peroxidase,MnP)、木质素过氧化物酶(lignin peroxidase,LiP)、漆酶(laccase)等( Upendra et al., 2011)。Yoon 和Kim(2015)研究发现褐腐菌癞拟层孔菌(Fomitopsis palustris)能同时产生3种主要的纤维素酶(内切β-葡聚糖酶、外切β-葡聚糖酶和β-葡糖苷酶),并能降解结晶纤维素。谢君等(2007)报道侧耳(Pleurotus sp. 2)和粗毛栓菌(Trametes gallica)在液体培养基中能够产生很强的木质纤维素降解酶活力且产酶速度较快。安琪等(2015)研究发现,在不同碳源、氮源条件下培养金针菇(Flammulina velutiper)对其羧甲基纤维素酶、木聚糖酶和漆酶活力均有显著影响。篱边粘褶菌(Gloeophyllum saepiarium)能分泌淀粉酶、纤维素酶、半纤维素酶、木质素酶、果胶酶、蛋白酶、脂肪酶、麦芽糖酶、粘胶酶及尿素酶等20多种酶,在一系列复合酶的参与及协同作用下,将极其复杂的植物细胞壁物质分解为简单的碳水化合物(Sista Kameshwar & Qin, 2020)。为了更好地开发与利用茯苓优良菌系,探究茯苓木质纤维素复合酶中的主要酶系,探索木质纤维素酶系能够有效降解木质纤维素资源,加速茯苓菌丝降解速率,缩短菌核形成周期,促进茯苓菌核增产增收,本研究以茯苓为研究对象,研究其木质纤维素复合酶中主要酶系差异及酶活性规律,拟解决以下两个问题:(1)茯苓木质纤维素降解酶能否通过最佳培养基及诱导条件产生纤维素酶、半纤维素酶、木质素降解酶及各酶类间有何差异;(2)茯苓木质纤维素降解酶能否通过不同底物的诱导来提高产酶能力及影响产酶规律,以期为今后木质纤维素相关酶的应用提供理论基础。
1 材料与方法
1.1 菌种来源
野生茯苓(Wolfiporia cocos)菌株于2020年2月,采自安徽省安庆市岳西县中关镇请寨村林区(116°35′ E、30°85′ N)腐朽的松树桩下茯苓菌核,经分离鉴定后现保存在安庆师范大学动植物检疫实验室4 ℃冰箱内,并进行甘油保藏。液体茯苓菌丝YX1保藏在中国典型培养物保藏中心,保藏编号为CCTCC No:M 2021434。
1.2 培养基
固体PDA 培养基:去皮土豆 200 g,葡萄糖 20 g,琼脂粉 17 g,KH2PO4 3 g,MgSO4·7H2O 1.5 g,定容至1 000 mL,121 ℃高压灭菌 30 min,用于茯苓菌丝的培养。
刚果红初筛培养基:羧甲基纤维素钠 2 g,MgSO4·7H2O 1.88 g,KH2PO4 0.5 g,蛋白胨 2 g,琼脂粉 15 g,定容至 1 000 mL,121 ℃高压灭菌 30 min后备用,待菌落生长平皿5 cm时,向培养基中加入1 mg·mL-1刚果红溶液,染色1 h,弃去染液后,加入1 mol·L-1 NaCl溶液,洗涤1 h后观察结果,此培养基用于纤维素分解菌的定性培养和鉴别。
纤维素酶种子培养基:蛋白胨 20 g,羧甲基纤维素钠 10 g,NaCl 5 g,KH2PO4 1 g,用于纤维素酶产酶种子菌摇瓶培养。
纤维素酶产酶培养基:蛋白胨 10 g,酵母膏 15 g,羧甲基纤维素钠10 g,NaCl 5 g,KH2PO4 1 g,pH =7定容至1 000 mL,用于纤维素酶产酶菌摇瓶培养。
LNAS培养基:液体培养基的制备,根据4组不同分组需求选择对应矿质溶液(Kirk et al., 1978;Hatakka &Uusi-Rauva, 1983 )。分别为以下4种培养基:不添加MnSO4·H2O的矿物元素溶液(无锰,A);添加MnSO4·H2O的矿物元素溶液(含锰,B);添加2 g松木屑的矿物元素溶液(有松木屑,C);添加2, 6-二甲氧基苯酚的矿物元素溶液(加2,6-DMP,D),用于木质素降解酶的检测。
1.3序列扩增与系统发育分析
提取茯苓基因组DNA,灭菌刀具刮取约20 mg新鲜菌丝,采用细胞破壁仪充分研磨粉末至细胞破壁,按照真菌试剂盒(UNIQ-10柱式)说明书提取茯苓YX1基因组DNA。PCR采用通用引物对(吴悦妮等, 2020),分别为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCGC
TTATTGATATGC-3′)、 NL1(5′-GCATATCAATAAG
CGGAGGAAAAG-3′) 和NL4 (5′-GGTCCGTGTTTC
AAGACGG-3′)、EF1-688F(5′-CGGTCACTTGATCT
ACAAGTGC-3′)、 EF1-1251R(5′-CCTCGAACTCAC
CAGTACCG-3′)。PCR扩增体系为模板 DNA 0.50 μL,引物10 μmol·L-1 各 1.75 μL,2×Rapid Taq Master Mix 25.00 μL,ddH2O定容至 50.00 μL,以上3种PCR扩增反应条件相同,均为94 ℃ 5 min,94 ℃ 30 s,52~55 ℃退火45 s,72 ℃ 2 min,共35个循环,72 ℃ 10 min,终止4 ℃。PCR产物经1.2%琼脂糖凝胶电泳检测并回收测序,将获得的YX1序列分别提交至NCBI的GenBank,进行BLAST比对,运用分析软件MEGA6.1中的NJ法构建系统发育树(Fan et al., 2015;张绍刚等, 2021)。
1.4 菌株培养
木质纤维素降解酶系皆采用固体PDA培养基进行培养,待菌丝即将长满平板时,使用打孔器进行打孔,每瓶种子培养基中含5个孔径为1 cm菌饼,28 ℃、150 r·min-1于恒温振荡培养箱内培养,纤维素和半纤维素降解酶系测定中,酶液制备皆为待种子培养基内菌丝生长成熟,用移液枪吸取接种至纤维素酶产酶培养基,接种量为每瓶 1.5 mL(邹荣松, 2019),木质素降解酶系检测使用分别添加上文1.2项下4种不同底物的LNAS培养基。在超净工作台内进行提取培养液即胞外酶液,纤维素酶系持续吸取至12 d,木质素酶系持续吸取至 21 d,每次使用移液枪定时定量吸取培养液 1.5 mL,提取的粗酶液离心 13 200 r·min-1,5 min,并进行酶活测定。
1.5 酶活测定
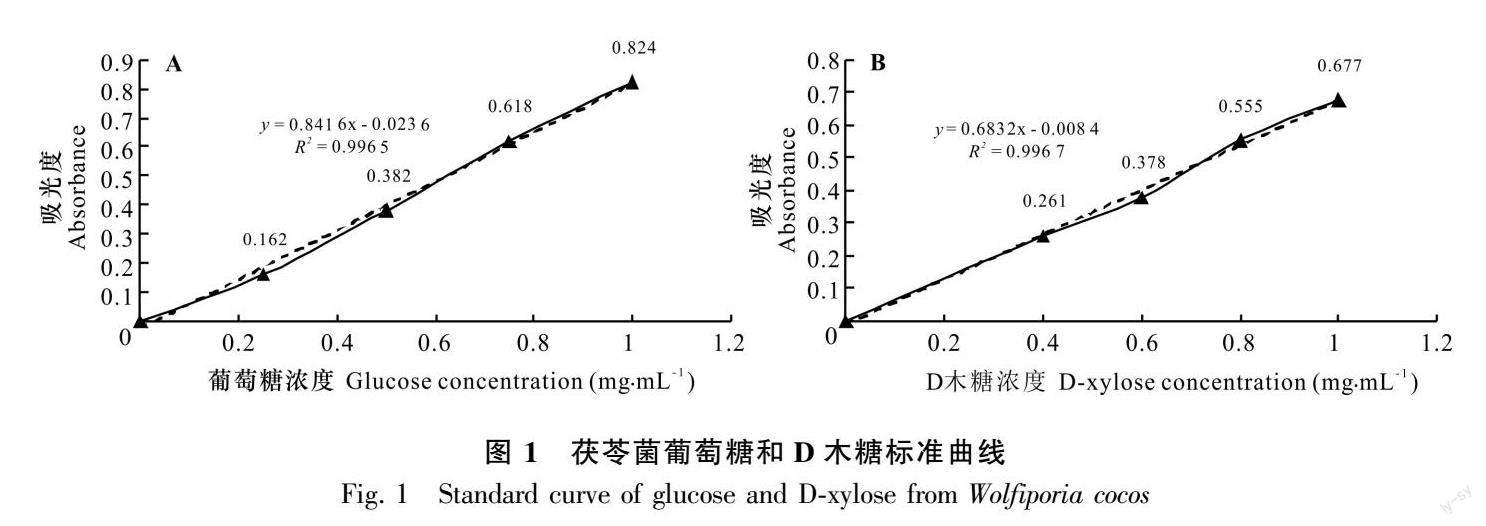
利用酶标仪(Multiskan GO全波长酶标仪)测定310~540 nm波长范围下酶活力的大小。葡萄糖标准曲线的制作:配制1.0、0.75、0.5、0.25、0 mg·mL-1 葡萄糖标准液。D木糖标准曲线的制作:将10 mg·mL-1 D木糖标准液使用蒸馏水稀释至1.0、0.8、0.6、0.4、0 mg·mL-1 即为标准稀释液。酶标仪预热 30 min 以上,调节波长至 540 nm,蒸馏水调零。以标准稀释液为横坐标(x),以其对应的ΔA标准为纵坐标(y),绘制标准曲线,得到线性回归方程 y=kx+b,将ΔA 测定带入公式中得到 x(mg·mL-1)。绘制葡萄糖标准曲线,得到回归方程为 y =0.841 6x - 0.023 6,相关系数 R2 =0.996 5(图1:A);绘制 D木糖标准曲线,得到回归方程为 y =0.683 2x - 0.008 4,相关系数R2 =0.996 7(图1:B)。
1.5.1 纤维素酶活力测定 酶标仪检测外切β-葡聚糖酶(CBH)、内切β-葡聚糖酶(EG)和β-葡萄糖苷酶(BGL)的活性,梯度试验后最终采用 150 μL反应体系。首先,取粗酶液的量依次为 25、50、50 μL;其次,取各自不同体积底物溶液,检测CBH所采用的底物溶液为2%微晶纤维素溶液50 μL,检测EG所采用底物溶液为1%羧甲基纤维素钠溶液 25 μL,检测BGL所采用底物溶液为1%水杨苷溶液 25 μL;放入50 ℃恒温水浴锅中水浴反应,反应时间各依次为120、30、30 min;再次,加入DNS显色液均为75 μL;最后,混匀后沸水浴时长均为5 min,冷却后测定波长在540 nm处的吸光度(高微微, 2017)。酶活单位定义为每分钟分解特定底物释放出1 μmol还原糖所需的酶量。采用无松木屑和有松木屑为对照處理,分别检测第2、第4、第6、第8、第10、第12 d的酶活力,各设置3个重复。
1.5.2 半纤维素酶活力测定 酶标仪检测木聚糖酶、甘露聚糖酶、α-葡萄糖苷酶活性,梯度试验最终采用 200 μL 反应体系。首先,取粗酶液的量依次为 67、67、6.7 μL;其次,各取自不同底物溶液,检测木聚糖酶所采用的底物溶液为0.8%的木聚糖溶液33 μL,检测甘露聚糖酶所采用底物溶液为0.8%的甘露聚糖溶液 33 μL,检测α-葡萄糖苷酶所采用底物溶液为0.4%的pNPG溶液 60 μL;50 ℃恒温水浴锅中水浴反应时间依次为 30、30、60 min;再次,使反应终止,木聚糖酶、甘露聚糖酶均使用DNS显色液终止反应,加入DNS试剂100 μL;最后,混匀沸水浴5 min,冷却后测定波长在 540 nm 处的吸光度(高微微, 2017)。α-葡萄糖苷酶加入1 mol·L-1 Na2CO3溶液66.7 μL终止反应,振荡混匀后测定波长在 410 nm 处的吸光度。酶活单位定义为每分钟分解底物所释放出1 μmol还原糖所需的酶量。采用无木屑和有松木屑为对照处理,分别检测第2、第4、第6、第8、第10、第12 d的酶活力,各设置3个重复。
1.5.3 木质素降解酶活力测定 酶标仪检测锰过氧化物酶、漆酶、木质素过氧化物酶活性,梯度试验后最终采用100 μL反应体系。3种酶分别采用2,6-DMP、藜芦醇(VA)、ABTS为底物,分别测定吸光度在 470、420、310 nm处1~3 min内的变化值。酶活单位(U):上述条件下,每分钟催化 1 μmol 2,6-DMP,ABTS或VA所需的酶量(池玉杰和闫洪波, 2009)。计算中的 ε470=49 600(mol·L-1cm)-1,ε420=36 000(mol·L-1cm)-1,ε310=9 300(mol·L-1cm)-1。
1.6 数据处理
采用Microsoft Excel 软件对数据进行处理和分析,利用SPSS 26.0对数据进行方差分析并评价其差异显著性,使用Origin2018进行图形绘制。
2 结果与分析
2.1 茯苓YX1的生物学特性
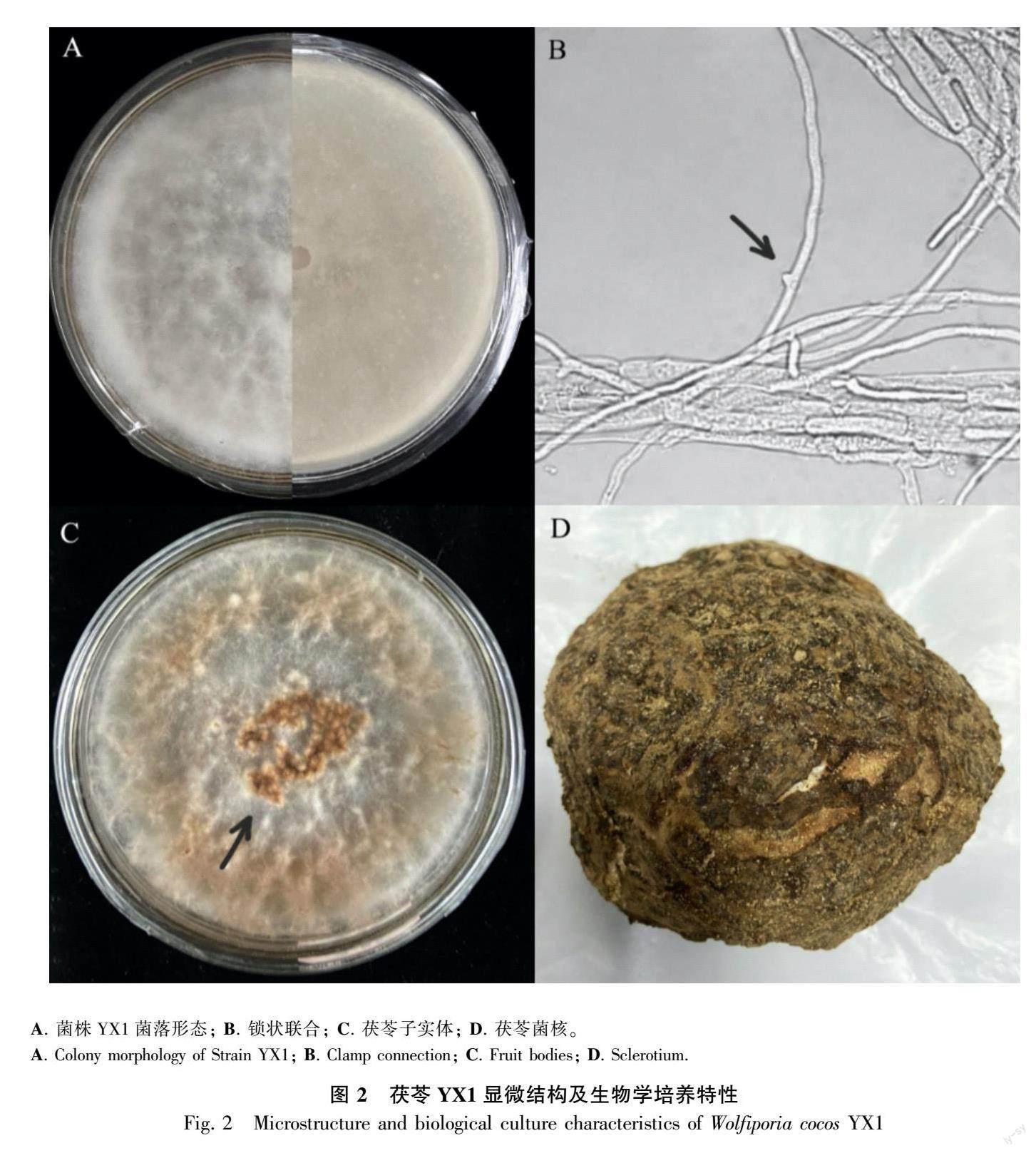
茯苓YX1在PDA培养基上培养4~5 d,于光学显微镜观察菌丝的正反面(图2:A),茯苓菌丝体呈白色绒毛状,菌丝直径 2~5 μm,菌丝光滑无色,多分支,有横隔膜,偶见锁状联合(图2:B)。菌丝生命力旺盛5~7 d可长满平皿,转移至光照培养箱中,进行光暗交替培养,28 d后菌丝衰退呈褐色,子实体呈蜂窝状,平铺聚集群生(图2:C)。茯苓YX1菌核(140~150)mm ×(170~180)mm,呈不规则椭球形等,深褐色、大小不均匀、表面粗糙呈瘤状皱缩、有弹性生命力强,菌核内部呈白色粉质颗粒状,质软,易撕开,菌核晾干后含水率15%~18%,坚硬易破裂(图2:D)。
2.2 茯苓YX1的3条序列与系统发育分析
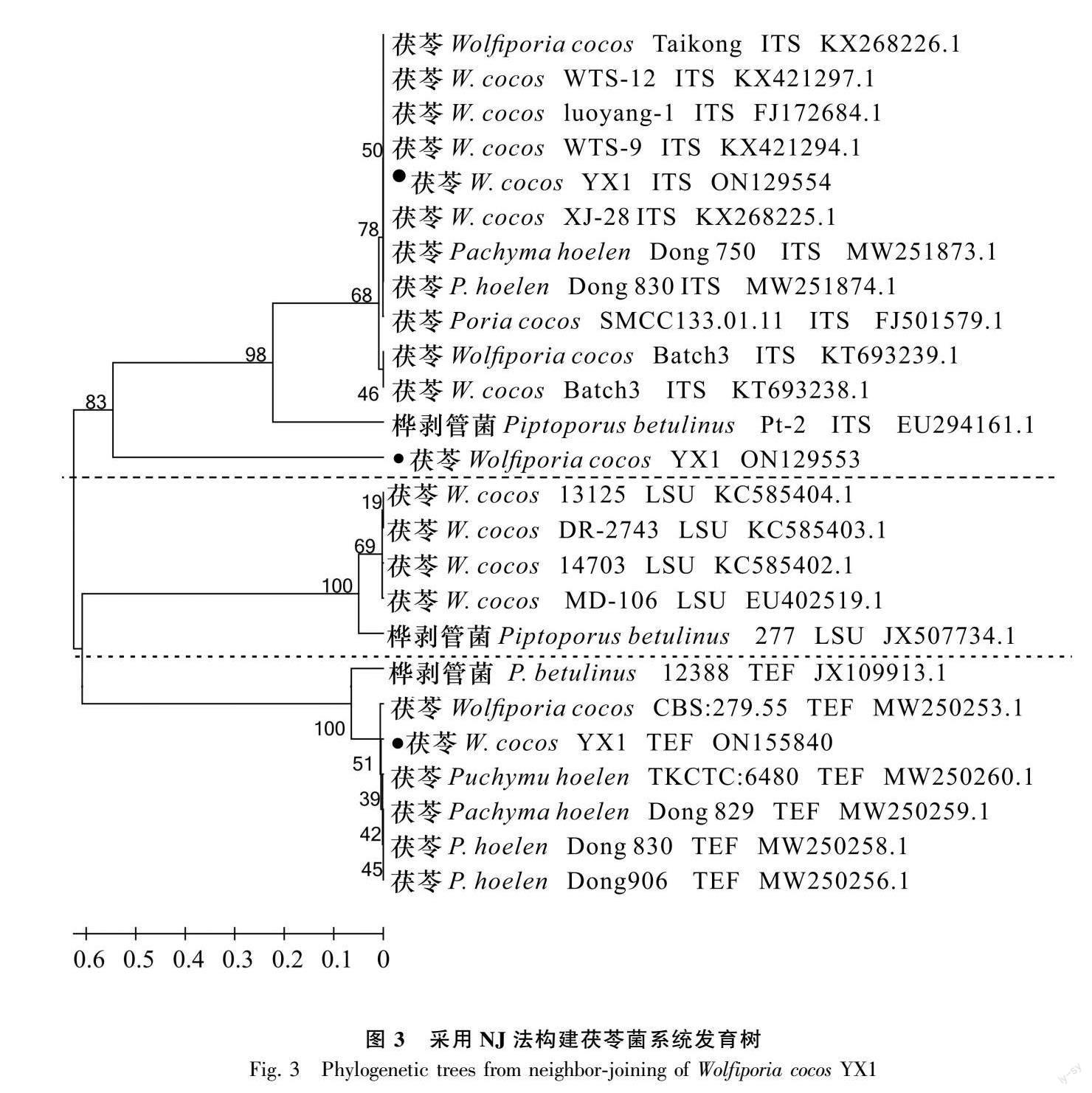
茯苓YX1的PCR产物测序分别得到1 652、660、545 bp的核苷酸序列,将该序列提交到GenBank(NCBI 登录号分别为:ON129554、ON129553、ON155840。鉴定结果表明,茯苓YX1(ON129554)的rDNA-ITS序列为1 652 bp:1~5 bp为18S rRNA序列,6~1 005 bp为ITS1序列,1 006~1 167 bp为5.8S rRNA序列,1 168~1 626 bp为ITS2序列,347~508 bp为28S rRNA序列;茯苓YX1(ON129553)核糖体大亚基(large subunit,LSU)序列为1~660 bp;茯苓YX1(ON155840)翻译延伸因子(translation extension factor, TEF)的CDS编码序列共545 bp分别为1~129 bp、179~320 bp、380~545 bp,根据3条茯苓YX1序列,采用MEGA 6.1 软件构建褐腐菌系统发育树,运用NJ聚类法分析,从图3中可知,系统发育树分为内部转录间隔区(internally transcribed spacer,ITS)、LSU、TEF三部分序列,茯苓菌YX1与 22 个茯苓菌株都较为亲密并聚类在一起,而Pachyma hoelen、Wolfiporia cocos、Poria cocos和Macrohyporia cocos 是茯苓菌的同物异名菌株。茯苓菌种间的遗传距离最为接近,4个同物异名的茯苓ITS、LSU、TEF序列聚类在一起,另外3株褐腐菌桦剥管菌(Piptoporus betulinus) Pt-2、277、12 388菌株为外组群菌株为参照,分别与茯苓菌ITS、LSU、TEF的区间序列既有同源又有差距。在系统发育树上区分了茯苓ITS序列、LSU序列、TEF序列,它们之间又有遗传联系且NCBI中同源性达90%以上,可以明确岳西野生茯苓菌YX1就是茯苓属下的茯苓菌株。
2.3 茯苓木质纤维素酶的酶活
2.3.1 纤维素酶活检测结果
茯苓菌在有松木屑和无松木屑2种培养方式下,检测YX1纤维素酶中β-葡萄糖苷酶(BGL)和内切β-葡聚糖酶(EG)的酶活相当,变化范围在32 ~ 37 U·mL-1之间,而外切β-葡聚糖酶(CBH)变化范围在16 ~ 17 U·mL-1之间(图4)。由图4可知,在有松木屑和无松木屑2种培养方式下2 d时CBH酶活性最大值分别为14.48 U·mL-1和15.87 U·mL-1,第4天酶活性最大值分别为16.71 U·mL-1和16.82 U·mL-1;EG第2天酶活性最大值分别为32.6 U·mL-1和29.35 U·mL-1,第8天有松木屑酶活性达到最大值34.71 U·mL-1,而无松木屑的培养方式第12天酶活性达到最大值32.245 U·mL-1;BGL在有松木屑和无松木屑2种培养方式下第2天时酶活性分别为33.03 U·mL-1和30.46 U·mL-1,第8天时有松木屑酶活性达到最大值36.81 U·mL-1,逐渐降低,而无松木屑的培养方式第10天酶活性达到最大值36.7 U·mL-1。从纤维素酶的整体酶活对比来看,CBH 方差分析表明茯苓3种纤維素酶CBH、EG和BGL活性在有松木屑和无松木屑培养方式和培养时间上表现为显著差异(P<0.05),其中的3种酶之间存在极显著差异(P<0.001);在主体间效应的检验中,3种酶均值分别为14.51、30.71、33.33 U·mL-1,培养方式F=5.53和培养时间F=2.62,均达到显著差异,3种酶F=127.53,均达到极显著差异(表1)。 2.3.2 半纤维素酶活检测结果 茯苓菌在有松木屑和无松木屑2种培养方式下,检测YX1半纤维素酶中甘露聚糖酶活性分泌量最高,变化范围在280 ~ 342 U·mL-1之间,木聚糖酶变化范围在28 ~ 38 U·mL-1之间,α-葡萄糖苷酶变化范围在9 ~ 11 U·mL-1之间(图5)。 由图5可知,在有松木屑和无松木屑2种培养方式下第2天时木聚糖酶活最大值分别为 20.89 U·mL-1和 19.24 U·mL-1;第8天时酶活分别达到酶活性最大值,分别为37.31 U·mL-1和 28.79 U·mL-1;第10天酶活性最大值分别为 21.9 U·mL-1 和 15.37 U·mL-1。甘露聚糖酶在有松木屑和无松木屑2种培养方式下第2天酶活性分别为 275 U·mL-1和 217.49 U·mL-1;第8天时均达到酶活性最大值,分别为341.28 U·mL-1和280.74 U·mL-1;第10天酶活性最大值分别为272.04 U·mL-1和229.09 U·mL-1。α-葡萄糖苷酶在有松木屑和无松木屑2种培养方式下第2天,酶活性分别为9.23 U·mL-1和8.84 U·mL-1;第8天时酶活性最大值分别为10.66 U·mL-1和9.88 U·mL-1;第10天酶活性8.84 U·mL-1和8.77 U·mL-1。实验表明各个酶活力之间存在变化差异,从半纤维素酶的整体酶活对比来看,α-葡萄糖苷酶<木聚糖酶<甘露聚糖酶活性。 方差分析表明茯苓3种半纤维素酶木聚糖酶、甘露聚糖酶和α-葡萄糖苷酶活性在有松木屑和无松木屑2种的培养方式上表现为显著差异(P<0.05),培养时间表现为极显著差异(P<0.001),其中3种酶之间存在极显著差异(P<0.001),在主体间效应的检验中,3种酶均值分别为22.94、270.70、9.29 U·mL-1,培养方式F=5.53和培养时间F=2.62均达到显著差异,3种酶F=127.53均达到极显著差异(表2)。 2.3.3 木质素降解酶活检测结果 茯苓菌在4种不同底物的培养条件下,检测YX1锰过氧化物酶(MnP)酶活性变化范围在0 ~ 0.1 U·mL-1之间,在培养条件A下,提取的酶液检测到第15天的MnP酶活性为0.015 U·mL-1;在培养条件B下,提取的酶液检测到第 15天达到MnP最高酶活性为0.081 U·mL-1;在培养条件C下,提取的酶液检测到第15天的MnP酶活性为0.027 U·mL-1,达 到分泌高峰;在培养条件D下,提取的酶液检测到第21天的MnP酶活性虽然达到分泌高峰,但只有0.025 U·mL-1;对比A无Mn2+和B含Mn2+两种培养条件的结果表明,虽然MnP受到Mn2+的影响,但MnP酶活性变化不大,均在第15天达到分泌高峰;Mn2+是茯苓菌产生MnP的诱导因子之一,MnP酶活性变化规律一致;对比C有松木屑和对照组A无Mn2+相比较,受松木屑影响不明显;加2,6-DMP培养条件D,在21 d内MnP酶活性规律不明显,21 d之后有松木屑培养条件C和加 2,6-DMP 培养条件D仍然存在MnP酶的活性变化。21 d内茯苓菌4种培养条件产生MnP的情况见图6。 茯苓菌在4种不同底物的培养条件下,检测YX1漆酶(Laccase)酶活性变化范围在0 ~ 0.04 U·mL-1之间。在培养条件A下,提取的酶液检测到第 19天 的 Laccase酶活性为0.031 U·mL-1;在培养条件B下,提取的酶液检测到第7天达到 Laccase 最大酶活性为0.033 U·mL-1;在培养条件C下,提取的酶液检测到第9天的 Laccase酶活性为0.025 U·mL-1;在培养条件D下,提取的酶液检测到第9天的Laccase酶活性只有 0.029 U·mL-1;对比A无Mn2+和B含Mn2+两种培养条件的结果表明,Mn2+对产生茯苓菌Laccase没有太大变化;对比4种不同底物 Laccases 的酶活性均较小,并且 Laccase 酶活性变化规律不明显。21 d内茯苓菌在4种培养条件产生 Laccases 的情况见图7。 YX1在4种不同底物的培养条件下,检测木质素过氧化物酶(LiP)酶活性变化范围在0 ~ 0.2 U·mL-1。在培养条件A下,提取的酶液检测到第21天的LiP酶活性为0.023 U·mL-1;在培养条件B下,检测到第11天达到LiP最大酶活性为0.109 U·mL-1;在培养条件C下,检测到第7天的LiP酶活性为0.104 U·mL-1;在培养条件D下,检测到第19天的LiP酶活性只有0.067 U·mL-1;对比A无Mn2+和B含Mn2+两种培养液的检测结果表明,Mn2+并非产生LiP的主要因素;虽然Mn2+有影响LiP酶活性变化,但比较微弱,对比4种不同底物LiP酶活性都比较小且LiP酶活性变化规律不明显。21 d内茯苓菌在4种培养液中产生LiP的情况见图8。 3 结论与讨论 3.1 野生茯苓鉴定 本研究以野生茯苓YX1为研究对象,从团聚的菌丝培养来看,菌丝有隔膜、偶见锁状联合现象,茯苓菌核也为茯苓菌丝团的一个休眠体。新鲜的菌核切开后茯苓肉为白色,也可作为母种或栽培种的结苓肉引。结合分子生物学的鉴定,选取ITS、LSU、TEF序列扩增,分析PCR产物,YX1与桦剥管菌Pt-2、277、12388菌株同为褐腐菌,在亲缘关系上既有联系又有遗传差距。茯苓(Pachyma hoelen)、Wolfiporia cocos、Poria cocos和Macrohyporia cocos 有4种同物异名,在系统发育中它们之间联系紧密,依据2008年《菌物字典》第十版(Kirk et al., 2008)及参照最新编制八界系统的菌物分类学,茯苓YX1(Wolfiporia cocos),隶属于担子菌门(Basidiomycota),蘑菇亚门(Agaricomycotina)蘑菇纲(Agaricomycetes),多孔菌目(Polyporales),拟层孔菌科(Fomitopsi-daceae),茯苓属(Wolfiporia),茯苓(W. cocos)。 3.2 茯苓产纤维素酶和半纤维素酶 本研究前期对茯苓菌产纤维素酶做了定性培养,存在明显的透明圈现象,筛选出的YX1具有降解木质纤维素的能力,并作为定量培养研究菌株YX1进行木质纤维素酶活性的测定。研究发现,纤维素酶和半纤维素酶在有松木屑和无松木屑为底物条件下,具有趋于一致的变化规律。培养方式中无松木屑对照组与有松木屑为底物的实验组相比,除CBH以外,EG、BGL均表现为有松木屑实验组高于无松木屑对照组,从纤维素酶活力之间对比来看,纤维素酶中CBH 3.3 茯苓产木质素降解酶 茯苓是褐腐菌,主要产生纤维素酶和半纤维素酶,也能产生微弱的木质素降解酶活性。茯苓木质素降解酶中除Laccase之外,MnP和LiP均表现为有松木屑实验组高于无松木屑对照组,实验表明添加Mn2+和松木屑为培养底物能够起到诱导作用。Chi等(2007)研究虫拟蜡菌(Ceriporiopsis subvermispora)、平菇(Pleurotus ostreatus)和透明亚卧孔菌(Physisporinus rivulosus)等真菌共培养条件时MnP酶活性,在7 d 之后检测到MnP活性达到最高,几种不同培养方式下所取得的MnP酶活性范围为25~250 U·mL-1,与前人研究结果相比,茯苓产MnP酶活性比较微弱,4种培养方式最高酶活性仅为0.081 U·mL-1。茯苓Laccase培养方式A和B相对比,培养方式B提前达到分泌高峰,但受到Mn2+的影响不大;培养方式C和D,同是第9天达到分泌高峰,与培养方式A无Mn2+相比较,不受松木屑所影响。池玉杰和闫洪波(2009)研究红平菇4种培养方式Laccase酶活性变化范围为36~205 U·L-1,在含Mn2+和无Mn2+条件下的酶活性分泌情况,与本研究结果基本一致,说明Laccase酶活性分泌规律不明显,整体呈波动性变化,相比较茯苓Laccase酶活性都比较微弱,仅为0.025~0.032 U·mL-1。LiP培养方式A和B相对比,LiP受到Mn2+的影响,并且提前达到分泌高峰;培养方式C,第7天就达到分泌高峰,与培养方式A比较,结果表明以松木屑为底物是LiP诱导条件之一;培养方式D,第19天的LiP酶活性达到分泌高峰。王茂成(2013)研究黑木耳、灵芝、灰树花和J201真菌LiP酶活性均在第9天达到最高,分别为121.6、143.5、111.6、145.2 U·mL-1,产酶规律都是以逐渐升高又逐渐降低,达到高峰后仍有产酶能力,这与本研究产LiP含Mn2+和有松木屑的培养方式分泌规律相似,不同之处是达到最大产酶时间,相比较茯苓产LiP酶活性都比较微弱,酶活性仅为0.017~0.109 U·mL-1。从茯苓木质素降解酶活力之间对比来看,木质素降解酶中LiP>MnP>Laccase。由于茯苓产生比较微弱的木质素降解酶,故未对MnP、Laccase和LiP 3种酶活性结果做进一步方差分析。从木质纤维素酶活力之间对比来看,木质素降解酶<纤维素酶<半纤维素酶活性。整体而言,以上结果表明茯苓菌具有分泌木质纤维素酶的能力,作为褐腐菌的茯苓仅仅只有微弱的木质素酶活性,多种酶之间均存在显著性差异(P<0.05)。 综上所述,野生茯苓菌的形态特征与分子生物学鉴定相结合,明确了茯苓的分类地位,揭示其木质纤维素酶系统的主要酶系及与培养条件等之间的联系,因此,该菌株可作为候选菌株进行深入研究。纤维素酶中CBH在培养初期时酶活性达到最大量,半纤维素酶中α-葡萄糖苷酶在培养初期时酶活性达到最大量,而木质素降解酶中的MnP和LiP在培养后期达到分泌最大量。茯苓菌不断的分泌纤维素酶和半纤维素酶较多,分解前期过程中起到主导因素,而木质素降解酶为次要因素。吕聪(2008)研究发现,茯苓分离纯化出2种MnPI和MnPⅡ同工酶,优化后的MnP酶活性高达1 249.7 U·mL-1。因此,后期提高茯苓菌木质纤维素酶的产酶效率,仍需进一步对产酶培养条件进行优化。另外,本研究结果表明木质纤维素降解酶活力的大小差距可能与菌种特性、培养方式及诱导因素等条件有关,木质素降解酶的整体酶活性都较低,这可能与本研究采用限氮培养基、酶标仪检测的敏感性以及褐腐菌茯苓菌本身的生长特性、菌核形成周期有关。本研究结果还表明,茯苓产木质纤维素酶中的酶活性大小依次为甘露聚糖酶>木聚糖酶>BGL>EG>CBH>α-葡萄糖苷酶>LiP>MnP>Laccase。从分解木质纤维素组成结构来看,除木质纤维素酶外,茯苓菌可能还含有丰富的其他辅助酶系,它们以多种酶相互协同参与木质纤维素的降解机制,催化茯苓菌丝不断地聚集,吸收基内、基外的营养,最终形成团聚的菌核,这些推测都有待进一步研究。 参考文献: AN Q, WU XB, WU B, et al., 2015. Effects of carbon and nitrogen sources on lignocellulose decomposition enzyme activities in Flammulina velutipes [J]. Mycosystema, 34(4): 761-771.[安琪, 吴雪君, 吴冰, 等, 2015. 不同碳源和氮源对金针菇降解木质纤维素酶活性的影响 [J]. 菌物学报, 34(4): 761-771.] CHI YJ, HATAKKA A, MAIJALA P, 2007. Can co-culturing of two white rot fungi increase lignin-degradation and the production of lignin degrading enzymes? [J].Int Biodeterior Biodegrad, 59 (1) : 32-39. CHI YJ, YAN HB, 2009. Detection onlaccase, manganese peroxidase and lignin peroxidase in ligninolytic enzymes of Pleurotus djamor [J]. Sci Silv Sin, 45(12): 154-158.[池玉杰, 閆洪波, 2009. 红平菇木质素降解酶系统漆酶、锰过氧化物酶及木质素过氧化物酶的检测 [J]. 林业科学, 45(12): 154-158.] DWIVEPI UN, SINGH P, PANDEY VP, et al.,2011. Structure-function relationship among bacterial, fungal and plant laccases [J]. J Mol Catal B-Enzym, 68(2) : 117-128. FAN X , HYDE KD , LIU J , et al., 2015. Multigene phylogeny and morphology reveal Phaeobotryon rhois sp. nov. (Botryosphaeriales, Ascomycota) [J]. Phytotaxa, 205(2): 90. GAO WW, 2017. The cellulase and hemicellulase activities of three brown rot fungi and their related gene diversity [D]. Harbin: Northeast Forestry University: 10-11; 15-21.[高微微, 2017. 三种褐腐菌的纤维素与半纤维素酶活性及相关基因多样性 [D]. 哈尔滨: 东北林业大学: 10-11;15-21.] HATAKKA AI, UUSI-RAUVA AK, 1983. Degradation of 14C-labelled poplar wood lignin by selected white-rot fungi [J]. Eur J Appl Microbiol Biotechnol, 17(4): 235-242. KIRK PM, CANNON PF, DAVID WM, et al., 2008. Dictionary of the fungi [M]. 10 ed. Trowbridge: Cromwell Press: 744. KIRK TK, SCHULTZ E, CONNORS WJ, et al, 1978. Influence of culture parameters on lignin metabolism by Phanerochaete chrysosporium [J]. Arch Microbiol, 117(3): 277-285. L C, 2008. The research on manganese peroxidase of Poria cocos and the application [D]. Changsha: Central South University of Forestry and Technology: 33-34.[吕聪, 2008. 茯苓菌产锰过氧化物酶及其应用的研究 [D]. 長沙: 中南林业科技大学: 33-34.] MACDONALD J, DOERING M, CANAM T, et al., 2011. Transcriptomic responses of the softwood-degrading white-rot fungus Phanerochaete carnosa during growth on coniferous and deciduous wood[J]. Appl Environ Microbiol, 77(10): 3211 -3218. MNDEZ-LTER JA, DE EUGENIO LI, NIETO-DOMNGUEZ M, et al., 2021. Hemicellulases from Penicillium and Talaromyces for lignocellulosic biomass valorization: A review [J]. Bioresource Technol, 324: 124623. OKAL EJ, ASLAM MM, KARANJA JK, et al, 2020. Mini review: advances in understanding regulation of cellulase enzyme in white-rot basidiomycetes [J]. Microb Pathog, 147: 104410. PENG M, 2016. Studies on the cellulase activity and proteomic of Piptoporus betulinus induced by different substrates [D]. Harbin: Northeast Forestry University: 21-22.[彭木, 2016. 不同地点间桦剥管菌的木材降解相关酶及TRAP和SRAP标记的遗传多样性分析 [D]. 哈尔滨: 东北林业大学: 21-22.] SISTA KAMESHWAR AK, QIN WS, 2020. Systematic metadata analysis of brown rot fungi gene expression data reveals the genes involved in Fentons reaction and wood decay process [J]. Mycology, 11(1): 22-37. TADESSE H, LUQUE R, 2011.Advances on biomass pretreatment using ionic liquids: An overview [J]. Energy Environ Sci, 4(10): 3913-3929. WANG MC, 2013. Screening and identification of lignin degrading fungi and related enzymes activities research [D]. Chongqing: Southwest University: 18-19. [王茂成, 2013. 木质素降解真菌的筛选鉴定及相关酶活性研究 [D]. 重庆: 西南大学: 18-19.] WANG XX, 2012.Preliminary study on the major biological characteristics of single basidiospore isolates of Wolfiporia cocos [D]. Wuhan: Anhui Agricultural University: 1.[王晓霞, 2012. 茯苓单孢菌株主要生物学特性的初步研究 [D]. 武汉: 华中农业大学: 1.] WU YN, FENG K, LI SZ, et al., 2020. In-silico evaluation and improvement on 16S/18S/ITS primers for amplicon high-throughput sequencing [J]. Microbiology, 47(9): 2897-2912.[吴悦妮, 冯凯, 厉舒祯, 等, 2020. 16S/18S/ITS扩增子高通量测序引物的生物信息学评估和改进 [J]. 微生物学通报, 47(9): 2897-2912.] XIE J, HUANG QM, FENG L, et al., 2007. Comparative studies on lignocellulolytic enzyme production in liquid and solid cultures of white-rot fungi [J]. Mycosystema, 26(2): 266-272.[谢君, 黄乾明, 冯蕾, 等, 2007. 白腐菌液体和固体培养产生木质纤维素降解酶的比较研究 [J]. 菌物学报, 26(2): 266-272.] YANG LX, MA XR, WANG YY, et al., 2016a. Biological characteristics of three white-rot fungi and genetic diversity of lignocellulose enzyme related genes [J]. Acta Ecol Sin, 36(7) : 2034-2043. [杨立霞, 马欣然, 王玉英, 等, 2016a. 三种白腐菌生物学特性与木质纤维素酶基因遗传多样性 [J]. 生态学报, 36 (7) : 2034-2043. YANG LX, ZI XX,BADERIHU, et al., 2016b. Study on the properties of enzymes related to cellulose and hemicellulose degradation in Piptoporus betulinus [J]. Heilongjiang Anim Sci Vet Med, (12): 27-33.[楊立霞, 訾晓雪, 巴德日胡, 等, 2016b. 桦剥管菌纤维素和半纤维素降解相关酶性质研究 [J]. 黑龙江畜牧兽医, (12): 27-33.] YOON JJ, KIM YK, 2005. Degradation of crystalline cellulose by the brown-rot basidiomycete Fomitopsis palustris [J]. J Microbiol, 43(6): 487-492. ZHANG SG, HU MJ, LI M, et al., 2021. Identification of the pathogen Lasiodiplodia hormozganensis causing Ixora williamsii dieback [J]. Acta Phytopathol Sin, 51(4): 646-649.[张绍刚, 胡美姣, 李敏, 等, 2021. 矮龙船花枯梢病病原菌Lasiodiplodia hormozganensis的鉴定 [J]. 植物病理学报, 51(4): 646-649.] ZI XX, 2015. Studies on the cellulase activity and proteomic of Piptoporus betulinus induced by different substrates [D]. Harbin: Northeast Forestry University: 10-12.[訾晓雪, 2015. 不同底物诱导下桦剥管菌纤维素酶活和蛋白质组学研究 [D]. 哈尔滨: 东北林业大学: 10-12.] ZOU RS, 2019. Isolation, mutagenesis, and fermentation technology of lignin and cellulose degrading microorganisms from green waste decomposing [D]. Beijing: Beijing Forestry University: 38. [邹荣松, 2019. 园林绿化废弃物腐熟中木质素和纤维素降解菌的筛选诱变及扩繁 [D]. 北京: 北京林业大学: 38.] (责任编辑 李 莉 王登惠)

