鱼类低温应激和损伤的信号通路与调控机制
崔宗斌,任静,龙勇
(1.广东省科学院 微生物研究所,广州 510070;2.中国科学院 水生生物研究所,武汉 430072)
温度是一个十分关键的环境因子,参与动物体几乎所有生命活动的调控.鱼类属于变温动物,其生长、繁殖、能量代谢等对环境温度的变化更为敏感.在一定温度范围内,鱼体可通过调节自身的新陈代谢和生理活动来适应环境的温度变化,但当水体温度超过鱼体耐受范围时就会破坏其生理生化功能,造成机体组织损伤甚至导致鱼死亡[1].近年来,我国水产养殖特别是南方海水养殖发展迅速,然而许多优良鱼类养殖品种,如尼罗罗非鱼(Oreochromisniloticus)[2]、金头鲷(Sparusauraa)和牙鲆(Paralichthysolivaceus)[3],均不具有耐低温的特点,冬季寒潮降临时常出现大量死亡,造成严重的经济损失.本文主要介绍低温胁迫导致鱼体应激反应和损伤的信号通路与调控机制,旨在为培育耐寒养殖鱼类新品种和促进我国水产养殖产业的发展提供理论参考.
1 低温胁迫造成的鱼体损伤
低温作为一种物理信号,可参与鱼体几乎所有的生命活动调控,超出耐受范围的低温可对鱼体的许多组织、器官和系统的结构与功能造成损伤.鱼类在低温条件下的损伤与能否生存,取决于低温暴露的严重程度和持续时间,而且不同种群对急性温度变化的耐受性通常有很大差异[1].在致死低温胁迫下,鱼类在分子、细胞、组织和系统等多个水平发生损伤作用(图1).例如:在分子水平,低温会降低核酸和蛋白质的活性,影响其结构和功能[4];在细胞水平,低温可降低微管蛋白的稳定性以及生物膜的流动性,引起内质网应激反应,使线粒体产生活性氧(Reactive Oxygen Species,ROS),出现功能障碍[5-6].低温胁迫还会影响鱼体各组织和系统的功能,主要包括神经、心血管、免疫等系统.
1.1 低温胁迫与鱼体神经系统
在脊椎动物中,神经系统可快速感知和响应外界温度变化,同时脑部作为神经中枢可参与体温调节,即使是变温脊柱动物也有一定的体温调节能力.在受到降温刺激30 s后,鲤鱼(Cyprinuscarpio)脑部下丘脑周围的内分泌神经元被激活,然后释放促肾上腺皮质激素释放激素(Corticotropin Releasing Hormone,CRH),诱导下游的生理反应[7].有文献报道[8],下丘脑视前区可能是变温脊椎动物最重要的体温调节器,它包含对热敏感和冷敏感的神经元,整合来自身体不同部位的温度信息,并且在外界温度变化过程中,决定体温高低.研究发现,太阳鱼(Lepomiscyanellus)和金鱼(Carassiusauratus)下丘脑的视前区中部和双侧被电损毁后,会打乱其对极端温度的逃避行为,导致体温不再保持恒定[9].大脑中的快速生理适应能力使鱼体能够应对剧烈的温度下降,而不会导致立即死亡.低温胁迫会增加斑马鱼(Daniorerio)大脑中的ROS水平,从而激活过氧化物酶体增殖剂激活受体(Peroxisome Proliferators-Activated Receptors,PPARs),活化的PPARs可以通过增强抗氧化酶的活性或表达来控制鱼脑组织中超氧化物的积累[10].


低温胁迫对神经系统的损伤主要体现在大脑组织结构、功能以及神经行为等方面[11].WESTFALL等[12]发现,短时间低温胁迫可增加小鼠交感神经紧张度以及代谢活动,而长时间处于寒冷条件下,机体的感觉神经和运动神经都会受到抑制,甚至会引起冻僵反应并造成不可逆的损害.另有文献报道[13],小鼠在低温胁迫下出现沮丧、紧张和混乱等现象,并且认知能力下降.研究发现,斑马鱼幼鱼在10 ℃致死低温胁迫下失去运动能力,脑组织切片透射电镜图像出现大量凋亡、坏死和自噬细胞(图2),随着低温暴露时间的延长,存活率逐渐降低,最终全部死亡[14].利用功能性磁共振成像技术,研究者发现鲤鱼在15 ℃低温条件下暴露90 s后,体温调节中枢视中前区被激活,其脑部血流量下降,供血量严重不足,从而影响神经系统的功能[7].
1.2 低温胁迫与鱼体心血管系统
在哺乳动物中的研究表明,低温暴露可以明显增加心血管系统疾病(高血压、心肌梗死、中风等)的发病率和死亡率[15].低温胁迫会导致心肌收缩功能不足和心脏重构,从而使氧化应激增强,抗氧化抵御能力减弱[16].有人发现,在急性冷水刺激下小鼠的血液浓缩,局部组织血红蛋白、红细胞显著升高,血小板高凝集甚至形成血栓[17].许多研究报道[18-19],鱼类的心脏结构、心率、心肌收缩力以及血液生化反应等通常会随着温度的波动而发生变化.虹鳟(Oncorhynchusmykiss)在低温条件下结缔组织增加,心脏肥大,从而导致心脏功能受损、心力衰竭[20].尼罗罗非鱼在13 ℃低温暴露下,红细胞数量、平均红细胞体积以及平均红细胞血红蛋白显著降低[21].将斑马鱼幼鱼暴露于10 ℃致死低温条件下,会导致其围心腔扩大、心率降低、心脏结构异常以及心肌中红细胞减少,大量红细胞积聚在卵黄、腹腔等部位[14].这些研究结果表明,低温胁迫会对鱼体心血管功能造成严重损伤.
1.3 低温胁迫与鱼体免疫系统
鱼类免疫系统是机体执行免疫应答和免疫功能的组织系统,由免疫组织器官(胸腺、脾脏和肾脏)、免疫细胞以及免疫因子组成.鱼类的免疫功能与环境温度息息相关,急性或者慢性的低温暴露都会损害鱼体抵御病原体的能力[22].据报道[23-24],低温(或高温)胁迫会抑制石斑鱼(Epinephelussp)和罗非鱼(Oreochromismossambicus)的免疫力,从而导致石斑鱼对溶藻弧菌以及罗非鱼对链球菌的抵抗力显著降低.暴露于15 ℃低温条件下的牙鲆对病毒性出血性败血症病毒(Viral Hemorrhagic Septicemia Virus,VHSV)敏感,死亡率为24%,而当水温保持在20 ℃时不会观察到死亡个体[25].
与哺乳动物类似,鱼类的免疫系统分为先天性免疫和适应性免疫两大部分.先天性免疫又称为非特异性免疫,由胚系编码的效应分子(抗菌肽、补体)和免疫细胞(巨噬细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、细胞毒性细胞)组成,可识别保守的微生物相关分子模式(Microbe-Associated Molecular Patterns,MAMP).研究表明,鱼体在受到细菌和原生动物病原体攻击时,外周血白细胞(粒细胞、淋巴细胞、单核细胞)的组成受温度影响[22].石斑鱼和罗非鱼分别受到溶藻弧菌、链球菌攻击时,低温条件下血液中白细胞数量显著减少[23-24].此外,暴露于急性或慢性低温条件下的鱼体外周血白细胞的活性普遍受到抑制.虹鳟在5 ℃低温胁迫下2月,其血液中白细胞的吞噬活性相对于15 ℃显著降低[26].巨噬细胞和中性粒细胞是硬骨鱼类最主要的先天免疫细胞,在长期暴露于低温环境下其活性增强,从而可以对其他免疫缺陷进行补偿[27].鱼类个体发育过程中,低温还影响着各种免疫基因的表达,包括促炎性细胞因子、抗病毒途径蛋白和Toll样受体(Toll-Like Receptor,TLR).在欧洲鲈鱼(Dicentrarchuslabrax)和大西洋鲑(Salmosalar)中,长期低温刺激会诱导肿瘤坏死因子(Tumor Necrosis Factor,TNF-α)以及白细胞介素(IL-1β)的表达,表明鱼类在低温胁迫下会引发炎症反应[28-29].斑马鱼在受到干扰素诱导剂(Polyl:C)刺激时,免疫相关基因il1β、ifn1、ifng、inos、irf3和mda5的诱导表达,在低温环境下均受到抑制[30].低温胁迫还会对抗原呈递具有负面影响,从而导致鱼体受到病原体攻击时免疫反应受损[31].
鱼类适应性免疫又称为特异性免疫,具有可诱导、病原体特异等特性,通过免疫细胞(T细胞、B细胞)和体液(抗体)产生免疫记忆.B细胞在抗原刺激下分化为浆细胞,浆细胞可合成和分泌抗体(免疫球蛋白),主要执行机体的体液免疫[32].当鱼体遭遇低温胁迫时,会对B淋巴细胞增殖和功能产生不利影响.在暴露于11 ℃低温条件下,斑点叉尾鮰(Ictaluruspunctatus)血液中的B细胞数量显著减少,直到5周后才恢复到正常水平[33].水体温度在3 h内从25 ℃下降到16 ℃,导致鲤鱼脾脏和血液中B细胞的含量显著降低[34].虹鳟受到病原体感染时,只有在较高温度条件下(15 ℃),B细胞活化标记基因(分泌型igm、膜结合型igt、pax5和blimp1)的表达才会显著上调,表明在低温条件下B细胞对病原体的反应受到损害[35].此外,低温通常会抑制鱼体响应病原体或灭活疫苗时抗体产生的能力.在虹鳟中使用针对病毒性出血败血症病毒(Viral Hemorrhagic Septicemia Virus,VHSV)的DNA疫苗后,养殖水温在15 ℃时观察到的血清抗体滴度比10 ℃高,而在5 ℃低温条件下未检测到抗体,并且暴露于病毒后的种群存活率也与温度有关,表明在较低温度下疫苗接种效率可能降低[36].总之,急性或慢性低温暴露通常会对硬骨鱼类的免疫系统产生抑制作用,特别是适应性免疫,而具体影响取决于温度变化的幅度、持续时间以及鱼的种类(表1).
2 低温胁迫相关的“存活”途径
为了抵抗环境温度变化对机体造成的不利影响,鱼类进化出了十分有效的低温适应机制,即在低温胁迫条件下,鱼体通过生化重构(Biochemical restructuring)和遗传调控,调整细胞内特定分子的种类和数量,建立新的胞内稳态,最终增强低温耐受能力[37].生化重构主要表现为:改变细胞膜流动性,合成低温特异性的同工酶,调整线粒体密度和特性,改变组织结构等.遗传调控包括:表观遗传调控、转录调控、蛋白质翻译后修饰以及代谢物变化等.近年来,随着转录组、蛋白质组以及生物信息学的快速发展,极大地促进了鱼类低温应激反应的分子机制研究.目前,研究者已采用RNA-seq方法研究了鲤鱼(Cyprinuscarpio)、斑马鱼(Daniorerio)、罗非鱼(Oreochromismossambicus)、斑点叉尾鮰(Ictaluruspunctatus)等物种低温胁迫反应和适应的转录反应.在斑马鱼仔鱼中的研究发现,即使在10 ℃致死低温条件下,基因表达也具有适应性反应的特征,并且鱼体对低温的响应依赖于各种生物学过程和信号途径,其中起保护作用的信号通路包括:Ca2+信号通路、MAPK、FoxO以及自噬等[14].

表1 低温胁迫对不同鱼类免疫反应的影响
2.1 Ca2+信号通路
钙离子作为细胞内重要的第二信使,可以发挥信息传递的作用,参与调控各种生物学过程.当机体或者细胞受到外界刺激时,胞内Ca2+浓度通过离子通道介导的胞外游离Ca2+内流以及胞内钙库的释放而增加[38].胞内Ca2+可以与各种传感器和效应器结合以改变它们的构象和活性,从而启动下游信号传导事件.研究表明,高温和低温应激都可以激活机体内钙离子信号通路.在高温条件下,热传感器和钙离子经过一系列信号级联反应将信号传递给热应激转录因子,进而调控热诱导基因的表达[39].我们将表达钙离子荧光指示剂的转基因斑马鱼仔鱼暴露于高温条件下,会引发即时和短暂的钙信号;热应激诱导的钙信号的活性在30 s达到峰值,并在开始暴露后120 s迅速下降至接近基础水平[40].
早期在昆虫和植物中的研究发现,钙离子信号通路在低温应激反应中起着重要的调控作用,是传递低温信号的关键信使[41].昆虫在受到低温胁迫后,细胞膜上的钙离子通道开启,介导胞外Ca2+向胞内流动,进入到细胞内的Ca2+可以结合钙调蛋白,然后激活下游的一些转录因子和信号通路[42].水稻在低温胁迫下,G蛋白信号调节因子(COLD1)与G-蛋白互作激活钙离子通道,触发下游耐寒防御反应[43].抑制钙离子信号通路可以完全消除昆虫的快速低温强化作用(Rapid Cold Hardening,RCH)以及植物低温的适应能力[42].这些研究结果说明钙离子作为低温信使的功能在不同的物种中具有一定的保守性.钙离子信号通路在鱼类低温应激过程中也有可能发挥非常重要的调控作用.对黄姑鱼(Nibeaalbiflora)的大脑和肌肉进行转录表达和定量分析,发现7.5 ℃低温暴露12 h后,钙离子信号通路相关钙结合蛋白7基因(cbp7)显著上调[44].石斑鱼肝脏的转录组研究发现,低温处理(水温以1 ℃/h的速率从28 ℃降至13 ℃并保持1 h)后,有41个差异表达基因富集到钙离子信号通路[45].这些研究结果说明,鱼类在低温胁迫下也能激活钙离子信号通路,但还有待深入研究钙离子信号系统在鱼类低温信号传导、耐寒和低温适应过程中的作用和机制.
2.2 MAPK信号通路
丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)是生物体内非常重要的信号转导因子,当机体或者细胞受到外界环境刺激时可将信号从细胞表面传递到细胞核内部.MAPK家族主要由细胞外信号调节激酶(Extracellular Signal-Regulated Kinase,ERK)、p38和c-Jun氨基末端激酶(c-Jun N-terminal Kinase,JNK)组成.早期研究表明,ERK信号通路主要参与细胞增殖、分化、迁移和凋亡等多种生物学过程[46],而JNK和p38能够被各种环境刺激和遗传毒性胁迫激活[47-48].在拟南芥、水稻等植物中发现,MAPK信号通路参与冷驯化过程,并且有利于提高耐寒能力[49-50].红尾肉蝇(Sarcophagacrassipalpis)在低温条件下暴露10 min,p38蛋白的磷酸化水平显著上升,是启动低温应激反应的重要激酶[51].以上研究表明,MAPK信号通路在不同物种中响应低温胁迫的功能是保守的.
低温信号的感知和细胞内转导对于鱼体在低温胁迫下的适应和生存至关重要.MAPK作为重要的细胞内信号转导系统,参与不同鱼类低温应激响应的调控.我们利用TMT标记定量磷酸化蛋白质组技术,研究离体斑马鱼胚胎成纤维细胞系ZF4在低温应激早期的蛋白质磷酸化修饰,发现在510个蛋白上的702个磷酸化位点发生差异变化;激酶底物预测结果表明,ERK1/2是低温应激过程中调控蛋白质磷酸化的关键激酶,磷酸化水平发生差异变化的蛋白在功能上也与MAPK信号通路有关[52].转录组分析已成为揭示鱼类应激反应及其调控机制的重要手段,人们应用RNA-seq技术检测了不同鱼类响应不同程度低温刺激(急性或慢性低温暴露、短暂或长期低温处理)的转录变化,发现斑马鱼(Daniorerio)[53]、石斑鱼(Epinephelussp)[45]、牙鲆(Paralichthysolivaceus)[3]以及黄姑鱼(Nibeaalbiflora)[44]等在低温胁迫下都能激活MAPK信号通路.此外,我们的生化实验证明,在致死低温暴露过程中,斑马鱼仔鱼的p38和ERK1/2信号通路显著激活,并且在低温处理过程抑制ERK和P38信号通路的活性,会导致斑马鱼低温耐受能力显著降低[14].以上研究结果表明,低温胁迫激活的MAPK信号通路在鱼类耐寒和低温适应过程中起保护作用.
2.3 FoxO信号通路
叉头蛋白O(FoxO)蛋白家族是一类重要的转录调节因子,其结构和功能在从线虫到人类的所有后生动物中都是保守的.FoxO蛋白由DNA结合结构域(DNA Binding Domain,DBD)、核定位信号(Nuclear Localization Signal,NLS)结构域、核输出序列(Nuclear Export Signal,NES)和C端反式激活结构域组成,主要参与调控细胞自噬、凋亡、代谢以及应激反应等生理过程[54].FoxO作为细胞稳态、应激反应的核心调节因子,其活性受多种翻译后修饰控制,包括磷酸化、乙酰化、甲基化和泛素化.研究发现,FoxO家族蛋白参与热休克反应途径和热休克因子1(Heat shock factor 1,HSF1)介导的应激反应.在黑腹果蝇(Drosophilamelanogaster)中,dFoxO可以直接调节各种热休克蛋白(Heat Shock Protein,HSP)的表达,包括应激诱导的HSP70相关伴侣家族[55];在小鼠中,热应激通过Hsp72直接激活FoxO信号通路[56].对鲤鱼、斑马鱼的研究表明,无论是温和还是致死低温刺激都能激活FoxO信号通路,当FoxO的转录活性受到抑制时,松浦镜鲤(Songpumirrorcarp)的低温适应能力以及斑马鱼仔鱼的低温耐受能力都显著降低[14,57].在应激条件下,FoxO信号通路的活性受蛋白激酶B(Protein Kinase B,PKB/Akt)、AMP依赖的蛋白激酶(AMP-Activated Protein Kinase,AMPK)以及JNK调控[58].鲤鱼在低温应激过程中,通过激活JNK信号通路以及抑制AKT信号通路,从而介导FoxO信号通路的激活[57].因此,FoxO信号通路及其调控的下游生物学过程在鱼类耐寒和低温适应过程中起重要作用.
2.4 自噬
自噬是一个将自身细胞成分隔离到溶酶体中进行降解的过程,降解产物可被循环利用构建新的细胞结构或细胞器.这一过程由多种应激源诱导,如营养缺乏、热休克、缺氧、氧化应激和病原体感染.选择性降解的细胞内成分通常包括聚集或无用的蛋白质、受损的细胞质成分、过量的过氧化物酶体以及入侵的微生物等.根据底物进入溶酶体的途径自噬被分为三类:巨自噬、微自噬和分子伴侣介导的自噬[59].巨自噬是最重要且研究最深入的自噬形式,其发生及调控的分子机制包括以下几个阶段:1)自噬起始阶段,由ULK1,FIP200,Atg13三种蛋白形成的ULK1复合物介导,诱导Ⅲ类磷酸肌醇3激酶(Phosphoinositide 3-Kinase,P13K)复合物形成吞噬细胞;2)自噬体的延伸阶段,ATG5,ATG12和ATG16L以及微管相关蛋白轻链3(LC3II)组成的复合物刺激吞噬细胞的伸长;3)随着自噬体的形成,LC3II与蛋白p62结合形成LC3-II-p62复合物,然后自噬体与溶酶体融合以吞噬靶蛋白和细胞器[60].因此,LC3-I,LC3-II和p62通常被认为是自噬过程的激活标志物.
自噬在响应环境变化以控制细胞稳态和新陈代谢方面发挥着重要作用.在正常情况下,自噬维持细胞内稳态,而在饥饿、内质网应激以及外界胁迫(如低温、低氧)等情况下,自噬则起自我保护的生存作用.文献报道,在急性冷刺激早期诱导的HeLa细胞自噬有利于细胞存活,并且低温刺激的同时用自噬抑制剂处理可使细胞内ROS增加,推测自噬是通过降低ROS水平从而对细胞起保护作用[61].在斑马鱼ZF4细胞中发现,在低温应激条件下组蛋白去乙酰化酶10(Histone Deacetylase 10,HDAC10)通过上调细胞自噬相关基因的表达,从而提高细胞在低温胁迫下的存活[62].斑马鱼仔鱼在致死低温胁迫下会诱导自噬相关基因表达,并且在低温暴露过程中加入自噬抑制剂Bafilomycin A1,斑马鱼的抗寒能力显著降低[14].此外,在斑马鱼成鱼肝脏组织中发现,低温胁迫以及饥饿处理会触发线粒体自噬,参与低温环境下肝细胞能量稳态的调节[63],这可能是鱼类抵抗寒冷和饥饿应激的重要代谢策略.
3 低温胁迫相关的“死亡”途径
鱼类在低温胁迫下,最终的命运是存活或者死亡.前文已综述了低温刺激会诱发鱼体的保护性反应,从而增强其在致死低温下的存活率;同时,低温损伤也能激活机体死亡途径,包括p53、凋亡以及坏死性凋亡,从而导致鱼体死亡.研究表明,轻度或者中度损伤以及低水平的死亡信号通常会诱导细胞凋亡,而重度损伤和高水平的死亡信号则会导致坏死性凋亡[64].这些细胞死亡过程可以互相联系,甚至通过重叠的信号通路进行交叉对话,而细胞最终的命运是不同死亡途径相互作用的结果[65].
3.1 细胞凋亡与坏死性凋亡
细胞凋亡(Apoptosis)是机体为维持内环境稳态,自主发生的一种由基因控制的程序性死亡方式,主要由Caspase激酶、衔接蛋白、肿瘤坏死因子受体家族蛋白、Bcl-2家族蛋白等四类因子共同参与和精准调控.细胞凋亡的过程大致可分为以下几个阶段:接受凋亡信号、凋亡调控分子间的相互作用、蛋白水解酶的活化、最后进入连续反应过程.凋亡的启动有两条途径,分别是外在(死亡受体)途径和内在(线粒体)途径[66].当Caspase激酶受抑制条件下,受体相互作用蛋白1(Receptor-Interacting Protein kinase 1,RIP1)和RIP3(Receptor-Interacting Protein kinase 3)结合形成坏死体(Necrosome),并激活混合系列蛋白激酶样结构域(Mixed Lineage Kinase Domain-Like protein,MLKL)从而引发坏死性凋亡(Necroptosis)[67].在细胞凋亡早期,通过对应激后不能恢复细胞进行清除,以达到保护组织免受胁迫损伤的目的;但是当细胞凋亡积累到一定程度时会导致组织受到不可恢复的损伤,最终导致机体死亡.
凋亡和坏死性凋亡能被多种因素触发,包括肿瘤坏死因子(Tumor Necrosis Factor,TNF)、氧化应激、DNA损伤以及各种外界刺激.在细胞水平,低温暴露会显著降低罗非鱼离体神经细胞的融合度,并诱导细胞凋亡[68].在活体水平,不同程度的低温胁迫都会引起不同鱼类的不同组织发生凋亡现象.例如,斑马鱼和罗非鱼成鱼在8 ℃致死低温条件下,鳃组织发生了凋亡现象[69];低温损伤后恢复异常的斑马鱼脑织组中出现凋亡和坏死细胞,转录组分析表明低温暴露和恢复过程中诱导的基因在凋亡和坏死性凋亡途径中持续富集[14].这些研究仅局限于鱼体在低温条件下发生的细胞凋亡和坏死凋亡现象,尚未揭示鱼类在低温胁迫下引发凋亡的分子调控机制,以及细胞凋亡对鱼体耐寒能力有何意义.
冷应激可通过诱导产生过量的ROS来引起氧化应激,当机体中的活性氧水平增加时,消除ROS的抗氧化酶系统会在体内被激活[70].例如,急性低温刺激可诱导ZF4细胞发生氧化应激[71];罗非鱼和河豚(Takifuguobscurus)抗氧化酶基因的表达在低温胁迫下显著增加[72-73].然而,过度的氧化应激会引发对生物体的氧化损伤,从而直接导致细胞凋亡.在遮目鱼(Chanoschanos)中发现,低温胁迫下其肝脏中的氧化应激被诱导,并通过外在凋亡途径导致肝细胞凋亡[74].
低温胁迫可诱发斑马鱼胚胎内质网的应激反应,从而造成线粒体钙超载并向胞质释放细胞色素C,胞质中的细胞色素C与Apaf-1以及Caspase 9形成复合物,激活下游的细胞凋亡执行者Caspase 3,进而引发线粒体介导的细胞凋亡信号通路,最终导致胚胎的死亡[5].此外,还发现斑马鱼仔鱼在低温损伤过程分别抑制凋亡、坏死性凋亡通路,其低温耐受能力显著提高,说明细胞凋亡和坏死性凋亡是低温胁迫导致斑马鱼死亡的关键原因[14].
3.2 p53信号通路
p53蛋白是有着“分子警察”和“人类基因组卫士”之称的抑癌基因,有超过半数癌症的发生伴随着p53基因的突变.在正常细胞中p53被一系列调节因子维持在低水平,例如MDM2作为p53泛素连接酶,能够促进p53的降解.在DNA损伤、细胞应激情况下,p53发生磷酸化和乙酰化而被激活[75],活化的p53选择性的转录激活或抑制下游各个信号通路靶基因的表达,或者直接通过蛋白相互作的方式调节信号通路的开关.当细胞轻度损伤时,p53将会阻滞细胞周期,调节细胞代谢、进行DNA损伤修复;细胞损伤严重至无法修复时,p53则可诱发凋亡途径,或者促进衰老进而引起细胞死亡[76].
文献报道,离体细胞在40 ℃次高温条件下,p53通过抑制过度热激反应来促进细胞存活;然而,在43 ℃超高温度下,诱发DNA损伤,被激活的ATM通过对p53的 S37位丝氨酸磷酸化,来稳定p53蛋白并激活其转录功能,最终诱导细胞凋亡[77].低温条件下,p53信号通路在不同鱼类中被激活.在大黄鱼(Larimichthyscrocea)不同组织中发现,急性低温刺激下p53信号通路相关基因会受到不同程度的影响,并具有组织特异性[78].罗非鱼在8 ℃致死低温条件下,核糖体蛋白(RPL11)与MDM2结合,抑制其泛素化连接酶的活性从而激活p53,并且随着低温暴露时间的延长,p53下游促凋亡相关基因bad和p21的诱导表达,说明低温可通过p53信号通路引发细胞凋亡,从而造成鱼体损伤[79].
4 低温胁迫相关的“存活”与“死亡”途径的互作机制
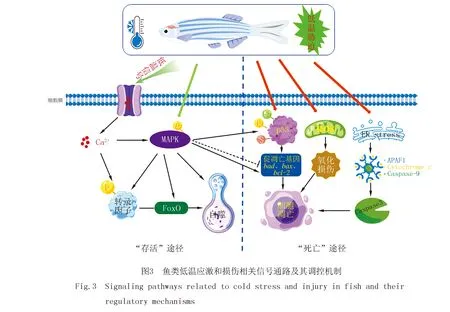
鱼体对低温胁迫的响应依赖于各种生物学过程和信号途径.鱼类的中枢神经系统接收到低温信号后激活离子通道,然后介导胞外Ca2+向胞内流动,进入到细胞内的Ca2+可以结合钙调蛋白[40],从而激活MAPK信号通路以及蛋白激酶C(Protein Kinase C,PKC).激活的MAPK对FoxO、p53、自噬以及凋亡等都有重要的调控作用(图3).在氧化应激诱导小鼠细胞凋亡中,JNK的磷酸化作用可以促进转录因子FoxO1从其阻断蛋白14-3-3中的释放,从而促进FoxO1进入细胞核行使其转录激活的作用[80].在低温条件下,我们发现鲤鱼JNK也会被激活从而调节FoxO信号通路,以保护鱼体免受极端低温胁迫的损伤[57].JNK-FoxO通过调节自噬相关(ATG)基因的表达来激活自噬[81].MAPK信号通路对细胞凋亡具有双重作用,即可以促进细胞凋亡,也可以通过转录调控和翻译后修饰下调促凋亡蛋白和上调抗凋亡蛋白来抑制凋亡[82].在应激细胞中,JNK介导的磷酸化可以稳定和激活p53,从而促进细胞凋亡[83].ERK1/2和p38 MAPK通过磷酸化Caspase-9的Thr125位点,抑制高渗应激引起以及有丝分裂过程中的细胞凋亡[84-85].在低温暴露过程中,抑制斑马鱼的ERK、p38信号通路以及FoxO1的转录活性,会影响p53信号通路和凋亡相关基因的表达,表明FoxO转录因子和MAPKs主要通过调节细胞凋亡来影响斑马鱼的抗寒能力[14].
5 结语和展望
低温胁迫可同时激活鱼体内的存活和死亡信号通路.它们之间相互作用的动态平衡决定鱼体的损伤程度和能否存活.目前,已知钙离子在鱼体感知和传递低温信号过程中起着重要作用,但尚不清楚其如何在低温胁迫下激活MAPK、FoxO等信号通路.以斑马鱼等模式鱼为研究对象,利用磷酸化蛋白质组和转录组学方法,结合使用特异性激活剂和抑制剂,以及遗传学和生化技术手段,将可解析低温胁迫相关信号通路的上游信号分子和信号传导途径.在系统解析低温胁迫信号通路活性调控机制基础上,鉴定关键分子靶标,利用基因编辑、分子模块等育种新技术,有望获得经济鱼类抗寒新品种.此外,低温胁迫可损伤硬骨鱼类的免疫系统,深入研究肠道微生物尤其是益生菌在鱼类抗寒过程中的作用和机制,有望用来提高鱼类的免疫和抗寒能力,促进水产养殖业的发展.

