中学常见的化学反应机理的认知与表征
厉业余

摘要:深化自由基、活化能等概念的理解,强化中学常见的化学反应机理的认知。用“宏观-微观-符号”相结合的方式简明、准确地表征化学反应机理,通过相关案例引导学生建构催化剂、自由基、电子转移等方面的“反应机理表征模型”,学会运用模型表征机理。
关键词:反应机理;认知与表征;模型;“宏-微-符”结合
文章编号:1008-0546(2023)08-0085-05 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2023.08.018
化學的特征是从微观层次认识物质,以符号形式描述物质,在不同层面创造物质。《普通高中化学课程标准(2017年版2020年修订)》关于学业质量水平明确指出:知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响;知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义;能运用宏观、微观、符号等方式描述、说明物质转化的本质和规律。[1]一个化学反应的机理通常比较抽象、复杂,用“宏观-微观-符号”相结合的视角来认知、理解和分析化学反应机理,引导学生更加深入地认知、理解、表征化学反应机理。
一、化学反应机理的认知
研究一个化学反应时,往往需要关注以下两个方面的问题:一是反应的趋势和限度,涉及化学反应方向和化学平衡;二是反应的快慢和反应的历程,涉及化学反应速率和反应机理。这两个方面既有区别,又有联系。[2]化学反应机理的研究,对于揭示化学反应的规律,获得调控化学反应的理论依据,以及日常生活和工农业生产都具有重要的意义。化学反应机理与基元反应、自由基、活化能等概念密切相关。我们只有对中学常见化学反应机理逐步认知、理解,才能简明、准确地表征化学反应机理。
1.基元反应与自由基
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。其中每一步反应都称为基元反应,多个基元反应能反映出化学反应的历程即化学反应机理。[2]基元反应是组成复杂化学反应的基本单元,它是由反应物分子(或离子、原子、自由基)直接作用生成新产物的反应。
自由基是带有单电子的原子或原子团。[2]一个化学反应通常是由若干个基元反应组成的,在外界条件的作用下,基元反应中常有自由基参与。例如:2HI= H2+I2实际上是经过下列两步反应完成的:2HI→H2+2I·,2I·→I2,第一个反应先产生碘自由基,然后2个碘自由基结合成碘分子,这两个先后进行的基元反应反映了2HI=H2+I2的反应机理。
2.活化能
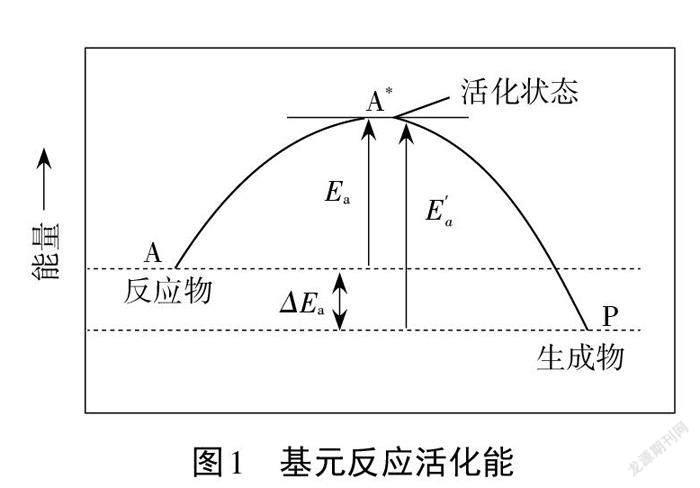
100多年来,随着科技的发展和科学家们的努力,对基元反应的活化能的理解也在不断提高,目前最常见的解释为 Tolman 从统计热力学得出的结论:Ea(T)=<ET (活化分子)>-<ET (反应分子)>(<>指平均值),即在温度 T 时,活化能为全部活化分子的平均能量与全部反应物分子的平均能量的差值。[3]
基元反应发生时,反应物分子A通常先吸收能量转变为活化状态A*,再释放能量转变为生成物P,基元反应的活化能示意图如图1所示。
Ea为正反应的活化能,Ea′为逆反应的活化能。对总反应,活化能没有明确意义,它是各基元反应活化能的特定组合。[4]
二、化学反应机理的表征
化学反应机理大多非常复杂,有的到目前为止还没有确定的解释或者尚未搞清其中的反应机理,因此中学阶段只要求学生了解目前科学界普遍认可的一些反应机理,主要涉及到催化剂、自由基、电子转移等方面一部分反应机理的表征。
1. 催化剂方面反应机理的表征
催化剂的研究一直是化学领域的重要内容,在现代化学工业中,催化剂的应用十分普遍。就近年来化学工业生产与技术的发展趋势而言,催化剂往往成为技术改造和更新的关键,从事这方面研究的科学家多次获得诺贝尔奖。
(1)催化剂作用下的反应历程
科学家普遍认为,催化剂改变反应历程,可以降低反应的活化能,加快反应速率。基元反应的活化能越小,反应速率越快。在多个基元反应的化学反应中,反应的快慢是由最慢的基元反应决定的。催化剂不能提高平衡转化率,不能改变反应的焓变。
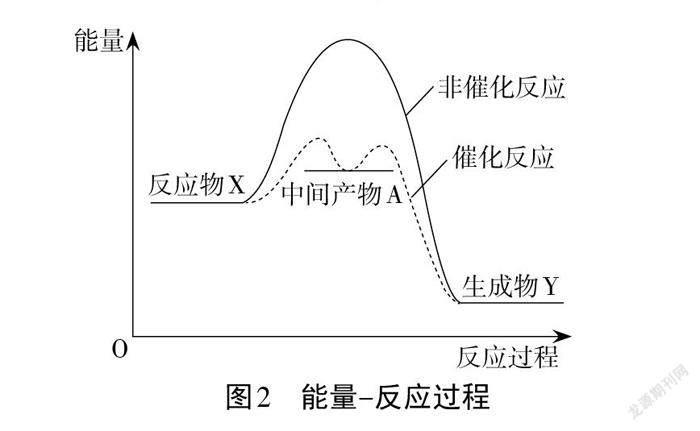
案例1.催化反应和非催化反应的能量-反应过程见图 2,X→Y的反应可看作由X→A,A→Y两步基元反应完成。
催化剂作用下,基元反应的活化能降低,活化分子的百分数提高,反应速率加快。从能量的高低可判断 X→A 是吸热反应,A→Y 是放热反应。中间产物 A→生成物Y的活化能比反应物X→中间产物A反应的活化能小,所以A→Y反应速率较快。反应的快慢是由最慢的基元反应决定的,因此X→Y反应的快慢由X→A反应决定。
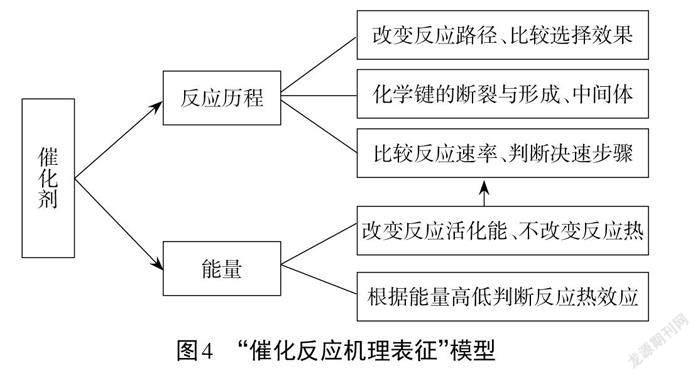
(2)建构“催化反应机理表征”模型
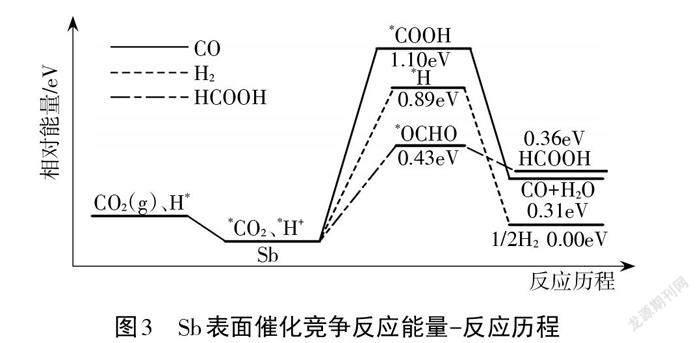
案例 2. 二维锑片(Sb)是一种新型的 CO2电化学还原催化剂。酸性条件下人工固碳装置中CO2气体在 Sb表面发生三种催化竞争反应,其反应历程如图3所示(*表示吸附态中间体)。
由能量-反应历程图可知:使用催化剂Sb改变了反应历程,酸性条件下CO2气体在催化剂表面都生成吸附态中间体,发生三种竞争反应生成不同的产物。三种反应中生成HCOOH吸收的能量最多,该基元反应活化能最低,反应速率最快,而生成 CO 的速率最慢。催化剂 Sb 对三种催化竞争反应有不同的选择性,选择效果为 HCOOH>H2>CO。从反应历程和能量相结合的研究视角,以宏观和微观相结合的思维方式引领学生建构“催化反应机理表征”模型,如图4所示。
2.自由基反应机理的表征
(1)自由基的产生
自由基也称为“游离基”,是指化合物的分子在光、热等外界条件下或者转移电子时,共价键断裂而形成的具有未成对电子的原子或基团。
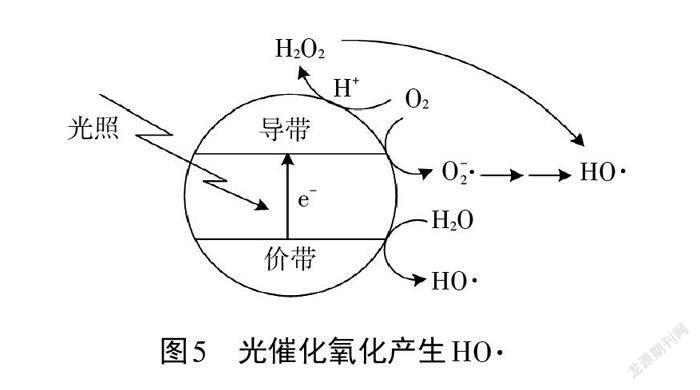
案例3.活性自由基 HO ·可有效除去废水中的苯酚等有机污染物。光催化氧化技术也可生成 HO ·降解有机污染物,其原理如图5所示。光照时,价带失去电子,产生有强氧化性的空穴。请表征价带上产生 HO ·和其他途径产生HO ·的反应机理。
产生自由基 HO ·的反应机理:价带上,H2O 失去电子产生HO ·和H+;光照时,电子从价带跃迁至导带, O2在导带获得电子生成H2O2或O2(-)·,最终转化为HO ·。
(2)建构“自由基反应机理表征”模型
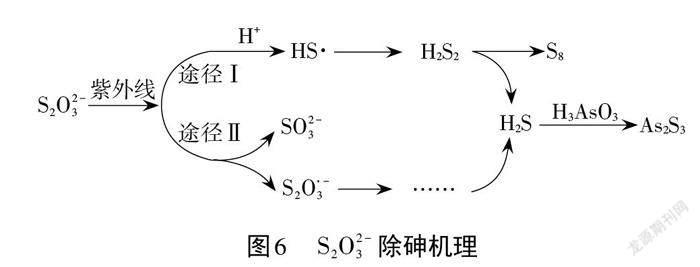
案例4.用硫代硫酸钠(Na2S2O3)替代 Na2S处理含砷酸性废水可避免 H2S 污染。Na2S2O3去除酸性废水中 H3AsO3的反应機理如图6所示(图中“HS ·”为自由基),请表征 S2O 3(2)-经过“途径I”的除砷机理。
“途径I”除砷机理:反应物 S2O 3(2)-和H+在紫外线的条件下生成HS ·,两个HS ·可以结合生成H2S2,H2S2分解得到S8和H2S,H2S 与H3AsO3发生反应生成As2S3,最终达到除砷的目的。
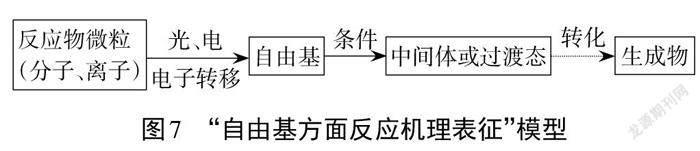
从以上两个问题的分析与解决过程来看,教学过程中应当引导学生善于运用“宏-微-符”相结合的方式,逐步建构“自由基反应机理表征”模型,如图7所示。
3.电子转移反应机理的表征
(1)以电化学为载体
案例5. H2S是一种有害气体,可用多种方法进行脱除。
含 H2S 的酸性溶液对钢管壁的危害如图8所示,钢管壁内部的缺陷处会积聚H2,产生的压力对管壁造成危害。请表征缺陷处产生H2的反应机理。
缺陷处产生 H2的反应机理:溶液中 H+在钢管壁内表面得到Fe失去的电子,生成H原子(H++e-=H),H 原子通过 Fe原子间的空隙扩散到缺陷处,结合成 H2(H+H=H2)。
(2)以氧化还原反应为载体
氧化还原反应的实质是有电子的转移,涉及氧化还原过程的一定伴随着电子的转移,用文字和符号相结合的方式准确地表征这些过程的反应机理。
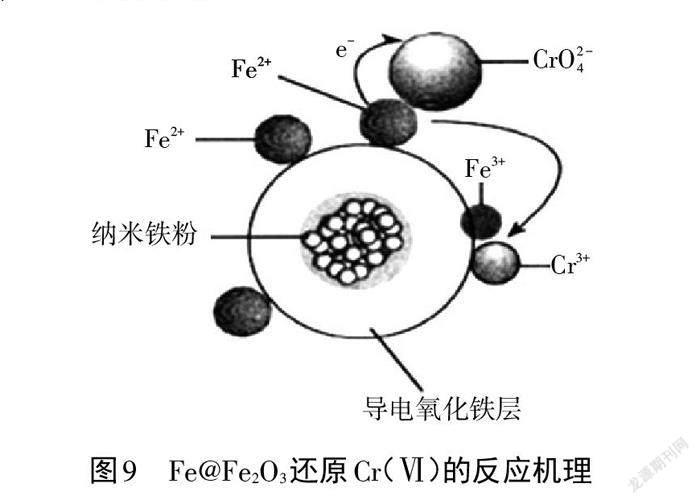
案例6(2021年江苏适应性考试)用氧化铁包覆的纳米铁粉(用 Fe@Fe2O3表示)能有效还原水溶液中的 Cr(Ⅵ)。 Fe@Fe2O3还原近中性废水中 Cr(Ⅵ)的可能反应机理如图9所示。请表征 Fe@Fe2O3中 Fe 还原 CrO4(2)-的反应机理。
Fe@Fe2O3中Fe还原 CrO4(2)-的反应机理:纳米铁粉失去电子,电子经过导电氧化铁层传导,使氧化铁层表面的 Fe3+得到电子被还原为 Fe2+,Fe2+将溶液中的 CrO4(2)-还原为Cr3+,自身被氧化为Fe3+。
(3)以融合催化剂、电化学、电子转移等多方面知识为载体
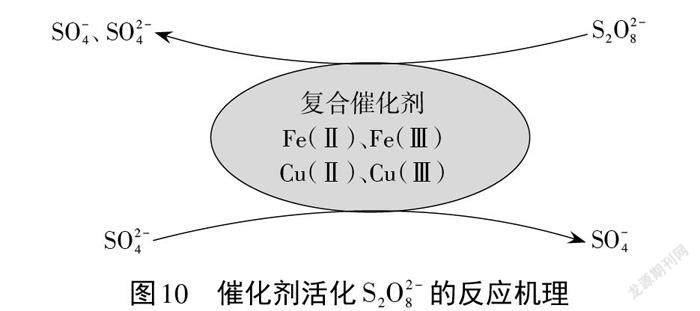
案例7. CuFe2O4是一种复合催化剂,可以催化活化过二硫酸根( S2O 8(2)-),其过程如图10所示。请表征该复合催化剂参与反应并再生的反应机理。
复合催化剂 CuFe2O4活化 S2O 8(2)-的过程涉及催化剂、电子转移等多方面的知识,反应机理相对比较复杂,因此表征该反应机理时要注意分析以下几个方面:(1)反应物 S2O 8(2)-转化为 SO4(2)-得到电子的来源?(2)复合催化剂中存在不同价态的Fe 和Cu,如何说明催化剂参与反应?(3) SO4(2)-转变成 SO4(-)失去的电子转移给哪些微粒,如何说明催化剂又再生了?
复合催化剂参与反应并再生的反应机理:Cu(II)、 Fe(II)失去电子并传递给 S2O生成Cu(III)、Fe(III); Cu(III)、Fe(III)得到 SO4(2)-失去的电子,生成 Cu(II)、 Fe(II);如此循环往复,实现催化剂再生。
(4)建构“电子转移反应机理表征”模型
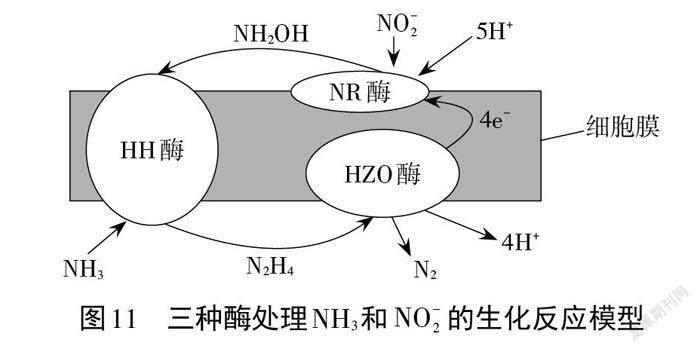
案例8. Jetten等人提出了利用厌氧氨氧化菌细胞中的三种酶处理废水中NH3和 NO2(-)的生化反应模型,其反应机理如图11所示。请表征在NR酶和HH酶作用下的反应机理。
依据图11可知:在 NR 酶的作用下,NO2(-)在酸性介质中(结合H+)得电子生成NH2OH( NO2(-)+5H++4e-= NH2OH+ H2O)。在HH酶的作用下,NH2OH 和 NH3转化为N2H4(NH2OH+NH3=N2H4+H2O)。
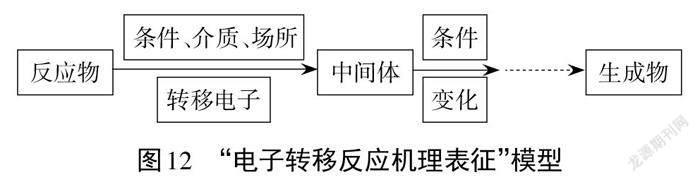
表征反应机理时需要遵循以下几个步骤:(1)确定反应物。箭头从外部指向内部的通常是反应物,如果反应物为电子就表明得到电子。(2)注明反应的条件。如光照、紫外线、催化剂或酶的作用等。(3)指明反应的介质、场所。如酸性介质、碱性介质、熔融盐介质等,阴极、阳极、正极、负极、催化剂表面等场所。(4)标明电子的转移。标明电子的得或失,发生了还原或氧化反应。(5)明确生成物或中间体。箭头从内部指向外部的通常是生成物,反应过程中的箭头通常指向中间体。
研究化学反应机理时,大多数涉及到电子的转移。因此,我们必须明确电子的来源和去向,认知化学反应的历程,才能理解化学反应的实质与机理。教学中可以引导学生从宏观与微观相结合的视角,结构与性质相联系的视角,变化与平衡相统一的视角来认知化学反应机理,用文字和符号相结合的方式简明、合理、准确地表征化学反应机理,逐步建构“电子转移反应机理表征”模型,如图12所示。
(5)运用“机理表征模型”解决实际问题
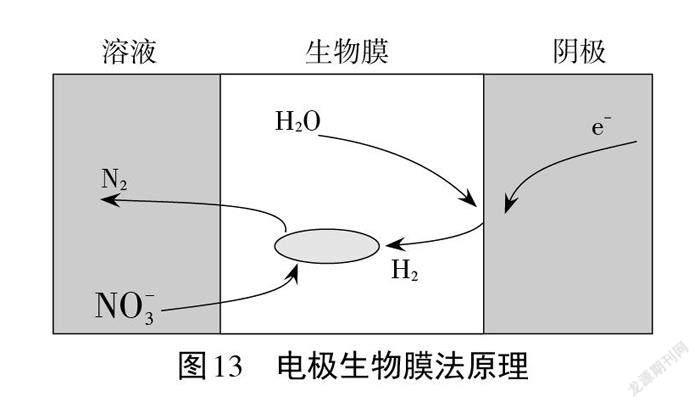
案例9.含氮物质的过量排放会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。电极生物膜法也能有效去除水体中的 NO3(-),进行生物的反硝化反应。其可能反应机理如图13所示,请以必要的化学用语及文字来表征此反应机理。
这是一个实际生活中含氮废水处理的真实问题,涉及到电化学、电子转移方面的机理。依据图13和“机理表征模型”:反应物为H2O,场所在阴极,得电子生成中间体H2,H2与 NO3(-)作为反应物在生物膜中发生还原反应生成无污染的N2,有效去除水体中的 NO3 。该反应机理表征为:H2O在阴极得电子生成H2,2H2O+ 2e- =H2↑+2OH- ,H2与 NO3 在生物膜中发生脱硝反应,2NO3 +5H2=N2↑+2OH- +2H2O。
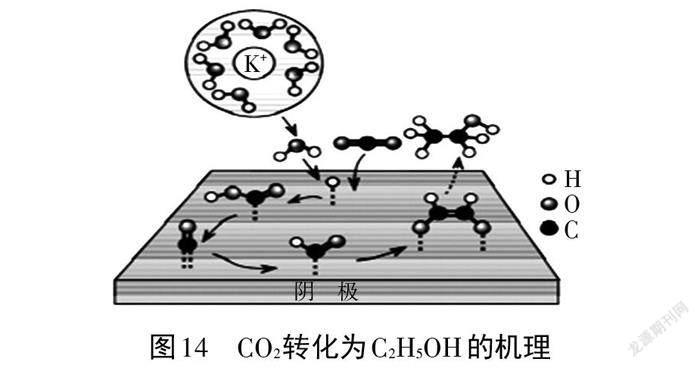
案例 10. 以 KOH 溶液为电解质溶液,CO2在阴极(铜板)转化为C2H5OH的机理如图14所示。(表示氢原子吸附在电极表面,也可用* H表示,其他物种依此类推;部分物种未画出)。
乙醇广泛用于生活和生产中,并且需求量大,寻求制备乙醇的新方法成为当今科技研究的热点之一。该反应研究的是以CO2为原料,以KOH溶液为电解质溶液,在阴极上生成 C2H5OH 的机理。依据图14和“机理表征模型”可知该反应机理:反应物为H2O 和 CO2,场所在阴极,介质为KOH溶液,首先是溶液中的 H2O在阴极表面得到电子生成*H,*H 与 CO2反应生成*COOH,*COOH 与*H反应生成*CO 和H2O,*CO 与*H 与反应生成*CHO,*CHO又结合生成*OHC-CH*O,最后再与*CO、*H结合生成 C2H5OH 和 CO2。阴极使用含 F-的铜板可加快*CO生成*CHO 的速率,其原因可能是含F-的铜板中的 F-与水合钾离子通过库伦作用(或氢键)促进H2O在阴极表面得到电子生成*H。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020.
[2]王晶,郑长龙主编.普通高中教科书(选择性必修1化学反应原理)[M].北京:人民教育出版社,2021.
[3]罗渝然,俞书勤,张祖德,姚天扬等.再谈什么是活化能[J].大学化学,2010,25(3):35~36.
[4]傅献彩,沈文霞,姚天扬,侯文华.物理化学(第五版)(下册)[M].北京:高等教育出版社,2006.

