基于临床数据构建烟雾病与非烟雾病缺血性卒中的鉴别诊断模型
滕勇士, 代淑华, 刘慧勤, 秦灵芝, 薛红飞, 徐佳佳, 李 玮
(1. 郑州大学人民医院/河南省人民医院 神经内科, 河南 郑州, 450003;2. 新乡医学院, 河南 新乡, 453003; 3. 河南大学, 河南 郑州, 450046)
烟雾病(MMD)是一种脑血管疾病,表现为双侧颈内动脉(ICA)远端或大脑前动脉(ACA)、大脑中动脉(MCA)起始段慢性进行性狭窄或闭塞[1]。MMD首发症状主要为脑缺血和脑出血[2]。目前, MMD诊断金标准为数字减影血管造影术(DSA)[3], 但缺少针对MMD缺血性脑卒中的初步筛选方法,且继发于MMD的缺血性卒中与其他病因(非MMD)缺血性卒中的临床表现相似[4], 在缺少DSA、磁共振血管成像(MRA)等影像学检查的前提下,通常与其他病因缺血性卒中难以鉴别[5-6]。因此,本研究利用临床数据构建MMD的鉴别诊断模型,以期实现MMD的早期诊断,降低MMD缺血性卒中患者的误诊率,以及改善MMD患者预后。
1 资料与方法
1.1 一般资料
选取2020年1月1日—2022年5月1日在河南省人民医院脑血管病区确诊为MMD的缺血性卒中患者150例和非MMD缺血性卒中患150例。将纳入研究的MMD和非MMD缺血性卒中患者按照7∶3的比例分为训练组(210例)和验证组(90例)。MMD缺血性卒中患者纳入标准: ① 符合2012年日本MMD诊疗指南中MMD的诊断标准[7], 并经DSA明确诊断为MMD者; ② 经磁共振成像(MRI)及CT确诊处于脑缺血状态者。排除标准: ① 合并有感染、肿瘤、癌症及严重的心、肺、肝、肾疾病者; ② 排除影像学有颅底异常血管影,但合并动脉粥样硬化、自身免疫性疾病、脑膜炎、马凡综合征、结节性硬化症、镰状细胞性贫血等相关疾病者。非MMD缺血性卒中患者纳入标准: 符合第4届全国脑血管学术会议提出的脑卒中诊断标准[8], 并有CT或MRI等影像学表现者。排除标准: 头颅MRA或DSA等影像学检查符合MMD脑血管异常表现者。
1.2 方法
收集所有研究对象的人口统计学特征(性别、年龄)以及脑血管危险因素(高血压病史、糖尿病病史、高脂血症病史、饮酒史、吸烟史); 记录所有患者高同型半胱氨酸血症(HHCY)以及游离三碘甲腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激素(TSH)、总胆固醇(TC)、低密度脂蛋白(LDL)、甘油三酯(TG)、高密度脂蛋白(HDL)、白蛋白(ALB)、同型半胱氨酸(HCY)、尿酸(UA)、血肌酐(SCR)、空腹血糖(GLU)、白细胞(WBC)、淋巴细胞(LYM)、血小板(PLT)、D-二聚体(DD)等实验室相关检查数据。
1.3 统计学分析
基于SPSS单因素回归分析的变量筛选结果,把筛选出的变量(P<0.05)分别纳入Logistic回归、Lasso交叉验证回归、支持向量机(SVM)共3种建模方法,构建鉴别诊断模型。构建模型均使用统计软件(R, version 4.1.3; https://www.r-project.org)进行,并通过C统计量选择最优模型, C统计量越大,模型区分能力越强。使用R语言中的rms包(R rms, version 4.1.3; http://www.r-project.org)绘制列线图,利用列线图评分预估MMD的诊断概率。使用校正曲线评估列线图的预测效能,预测概率越接近45°对角线则预测概率越接近实际概率。
2 结 果
2.1 参与者临床特征
将纳入研究的MMD和非MMD缺血性卒中患者按照7∶3的比例分为训练组(210例)和验证组(90例),分别有105例(50%)和45例(50%)经DSA确诊为MMD的患者分布于2组。训练组和验证组的基线资料见表1。
表1 参与者临床特征

图2 鉴别MMD和非MMD缺血性卒中的列线图
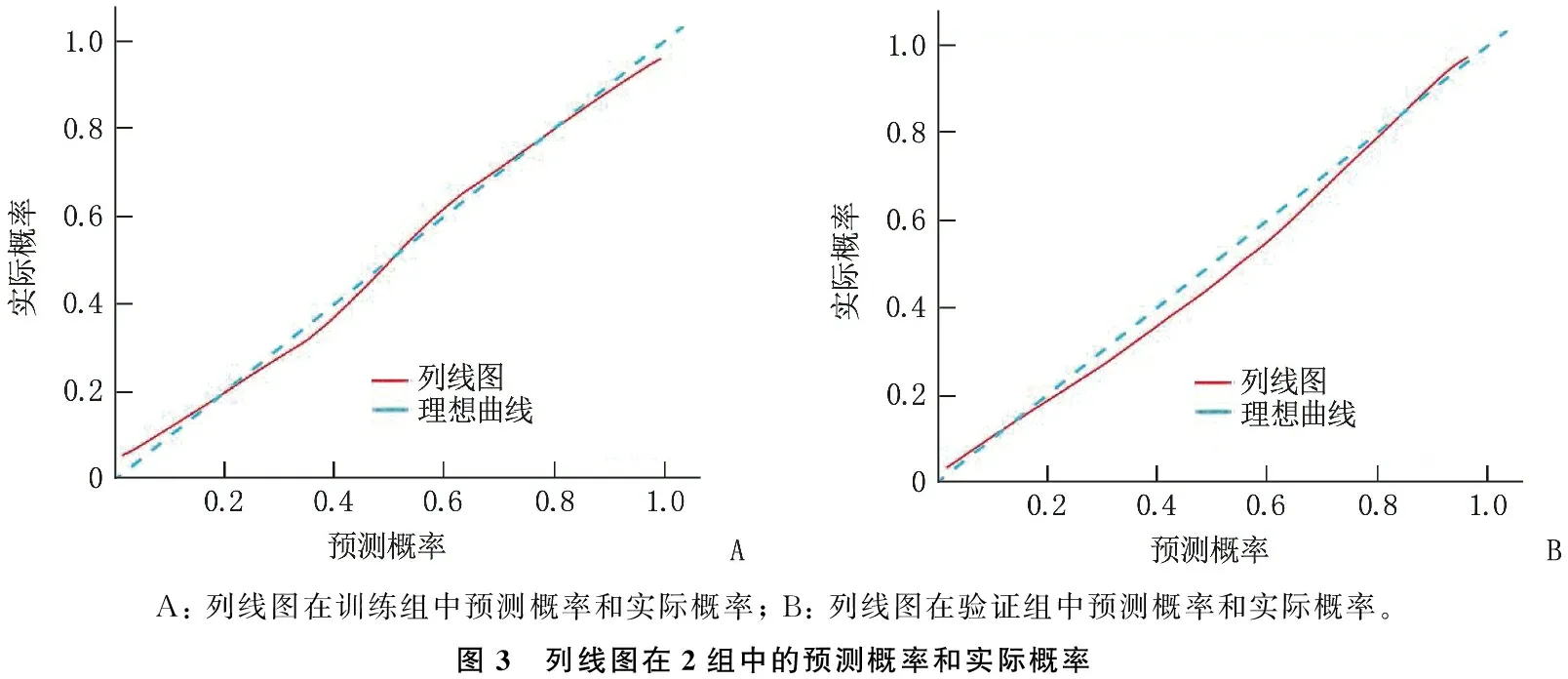
A: 列线图在训练组中预测概率和实际概率; B: 列线图在验证组中预测概率和实际概率。图3 列线图在2组中的预测概率和实际概率
2.2 模型构建与验证
在训练组中进行单因素回归分析。采用单因素回归分析对变量进行初步筛选,以保证模型的可靠性(表2), 并将差异显著(P<0.05)的变量分别纳入Logistic回归、Lasso回归及SVM构建鉴别诊断模型。为了筛选出区分能力最好的模型,本研究分别比较各模型在训练组和验证组的受试者工作特征(ROC)曲线的曲线下面积(AUC), 训练组中Logistic回归AUC为0.87, Lasso回归AUC为0.85, SVM的AUC为0.85, 验证组中Logistic回归AUC为0.88, Lasso回归AUC为0.82, SVM的AUC为0.86, 经过比较Logistic回归模型的C统计量最大,区分能力最好(图1)。
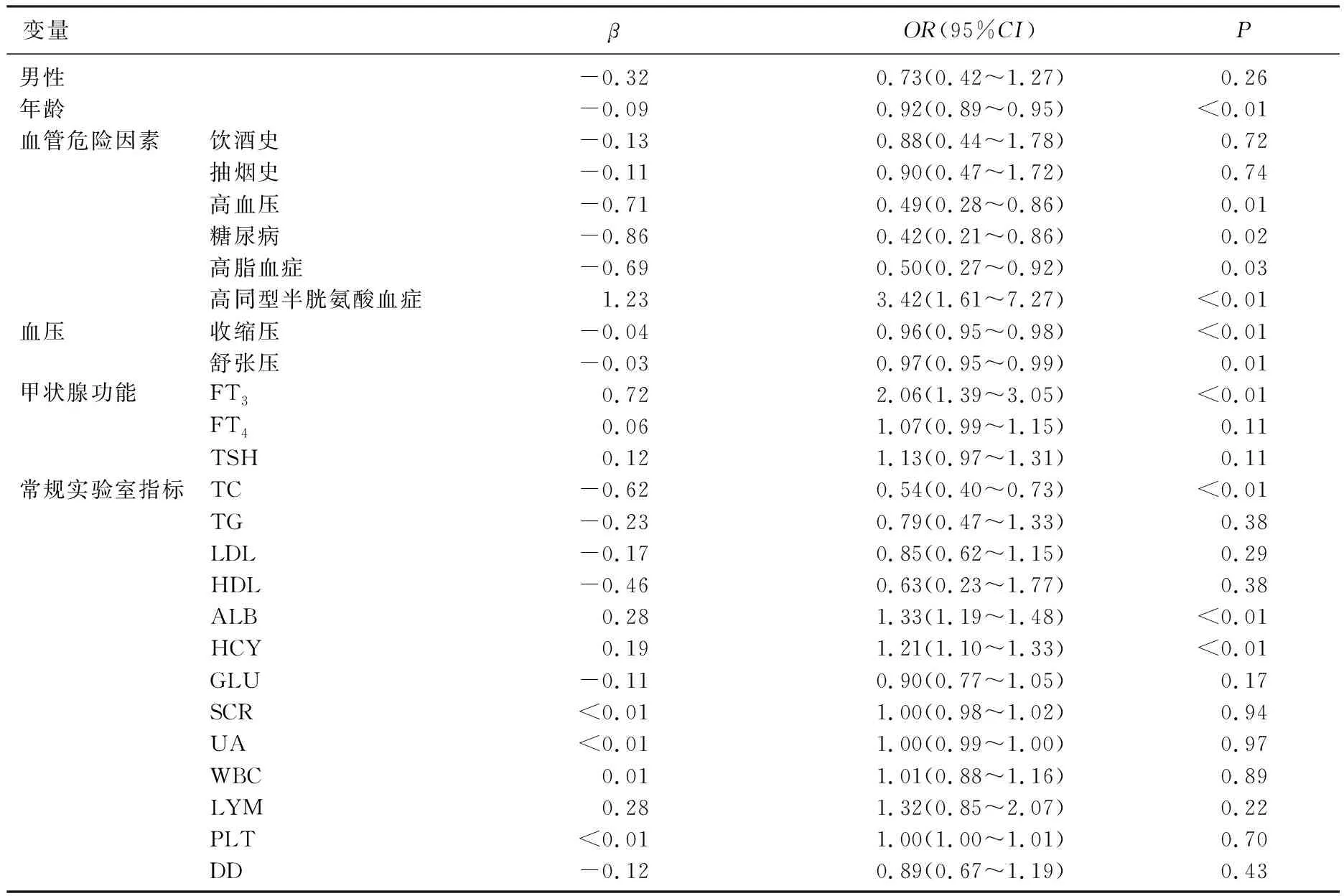
表2 基于训练组数据的单变量Logistic回归分析
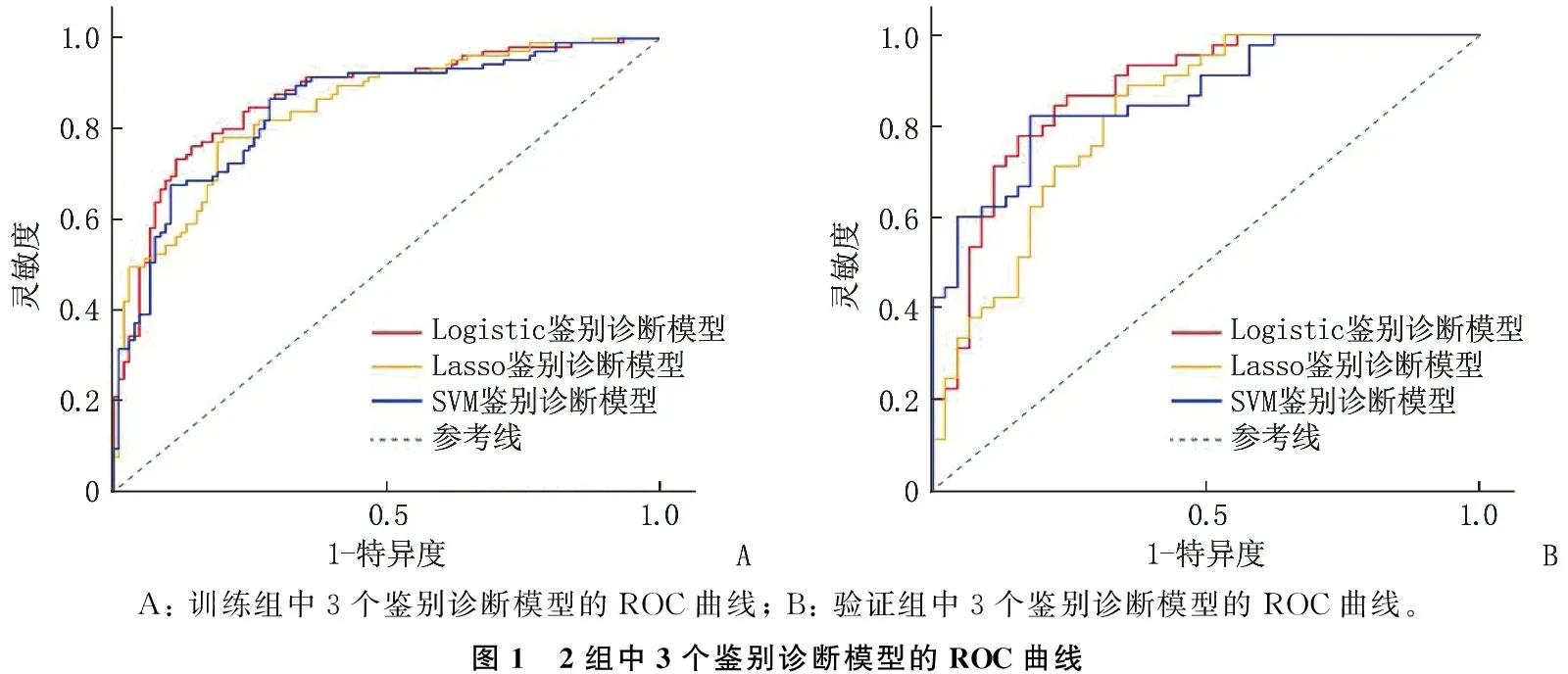
A: 训练组中3个鉴别诊断模型的ROC曲线; B: 验证组中3个鉴别诊断模型的ROC曲线。图1 2组中3个鉴别诊断模型的ROC曲线
2.3 列线图绘制与验证
多因素Logistic回归分析P<0.05的结果用优势比(95%CI)和P表示, FT3、HCY、年龄、收缩压、TC、ALB为MMD缺血性卒中的独立影响因素(P<0.05或P<0.01), 将这些独立影响因素纳入列线图,二分类Logistic回归模型被可视化,见表3、图2。

表3 基于训练组数据的多因素Logistic回归分析
使用列线图时,找到每个变量在相应轴的位置,并向上画1条线来确定每个变量的分数,计算所有变量总分,从总分数轴上对应的点画1条线来确定诊断为MMD的概率。
最后,用列线图去鉴别训练组和验证组中的所有患者,列线图在训练组C统计量为0.87, 具有良好的区分能力。将列线图的预测值与实际值进行比较, Hosmer-Lemeshow(拟合优度检验)P=0.28, 提示模型的校准度好,准确度高。使用验证组数据对列线图进行检验,验证组中C统计量为0.88, Hosmer-Lemeshow检验P=0.19, 列线图同样展示出不错的鉴别能力。利用校正曲线对训练组及验证组的校准度进行可视化,显示预测值与实际值基本上都分布在45°对角线上(图3), 说明构建的模型鉴别能力可靠。
2.4 基于列线图评分的MMD风险
列线图评分的最佳临界值为168分。在训练组使用该临界值去鉴别MMD缺血性卒中患者时,灵敏度、特异度、阳性预测值和阴性预测值分别为0.73、0.89、0.87、0.77; 在验证组中,上述变量分别为0.87、0.76、0.78、0.85, 见表4。
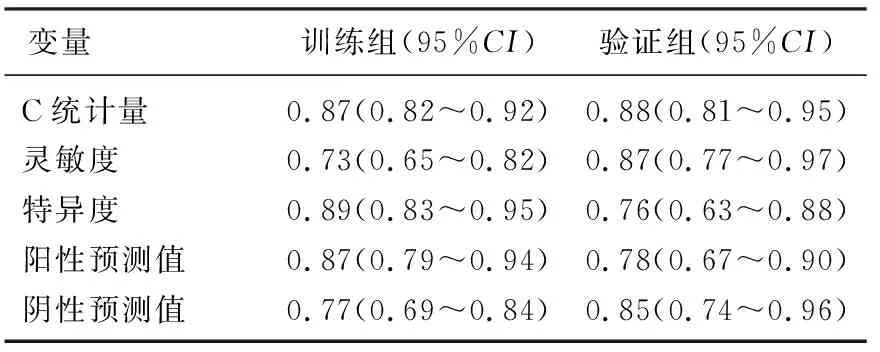
表4 列线图对MMD缺血性卒中鉴别的准确性
3 讨 论
继发于MMD与非MMD的缺血性卒中的临床表现相似,但与非MMD缺血性卒中不同的是, MMD患者可以通过血运重建手术进行治疗[9], 因此能否及时对MMD患者做出诊断并采取有效治疗至关重要。本研究采取易于获得的临床变量建立了一种鉴别诊断模型,该模型最终纳入了FT3、HCY、年龄、收缩压、TC及ALB共6个变量,并用列线图对模型进行了可视化,本研究选取列线图评分168分作为临界值用于鉴别MMD缺血性脑卒中,得分≥168分的患者为MMD缺血性脑卒中的高危组,旨在利用列线图从缺血性脑卒中患者中鉴别出MMD, 降低MMD的误诊率。
诊断MMD的常规方法为DSA、MRA联合MRI[10], 但这些方法仍存在一些局限性。比如DSA作为MMD诊断的金标准,是一种侵入性诊断方法,且不适用于伴有碘过敏、甲状腺疾病患者[11]。
列线图在当前可用的预测模型工具中,不需要依附于特定的计算机软件及大型的电子设备,操作简单。本研究诊断模型可以实现对诊断结果的量化,花费低廉,且具有不错的诊断效能。虽然该模型不能替代DSA诊断MMD, 但可以仅用临床数据对MMD进行筛查,提高临床医生在缺血性脑卒中患者中进行MMD诊断的意识。
本研究发现FT3为MMD的独立相关因素, MMD患者中FT4、TSH水平均高于非MMD卒中患者(OR>1), 提示甲状腺激素及甲状腺自身抗体的水平升高在MMD疾病的演进过程中起关键作用。研究[12-13]表明,在甲状腺功能正常的MMD患者中,其甲状腺激素水平高于正常对照组。一方面甲状腺激素可以直接刺激交感神经兴奋引起颅内大动脉收缩,并对血管壁的完整性有一定损害,进而导致颅内供血血管狭窄。另一方面,甲状腺激素水平升高也会增加脑组织代谢,增加其耗氧量,降低MMD患者颅内氧储备量[14]。相关报道[15]表明,大剂量激素冲击及血浆置换治疗后,患者神经系统症状及颅内血管狭窄情况较前也有所改善。此外MMD和Graves病有共患家族史,表明遗传因素和自身免疫因素可能在这2种疾病中起到了相似的致病作用[16]。本研究最终将FT3纳入列线图中,尽管模型鉴别效能良好,但这仍需要大样本的前瞻性实验进行验证。
本研究发现, MMD患者HCY水平显著高于非MMD缺血性卒中患者。研究[17-18]表明, HCY升高会增加成人及儿童患MMD的风险。HCY的致病机制较复杂, HCY可通过氧化应激反应产生过多的超氧化物,超氧化物与NO反应生成过氧硝酸盐来降低NO的生物利用度[19]。HCY还可以促进平滑肌细胞的DNA合成及有丝分裂过程,促使平滑肌细胞增生及细胞外基质堆积[20-21], 但其并不促进内皮细胞增生,甚至抑制,这与MMD的血管病理相符[22]。但研究[23-24]表明, HCY升高与动脉粥样硬化以及大脑中动脉狭窄密切相关, HCY可作为非MMD缺血性卒中的危险因素。MMD缺血性卒中HCY水平显著高于非MMD缺血性卒中[25], 这与本研究结果相符合。一项研究[26]表明,与HCY代谢相关的MTHFR基因位点rs9651118和TCN2基因位点rs117353193与MMD显著相关,可作为MMD的易感基因,且HCY可直接促进平滑肌细胞增生参与MMD发病,因此MMD患者通常具有更高的HCY水平。
本研究通过比较MMD卒中与非MMD卒中患者的年龄发现, MMD患者出现卒中症状的年龄更小,这与相关研究[25]结果相一致,其研究表明MMD缺血性卒中较非MMD缺血性卒中的发病年龄更早。2组间的年龄差异可能与MMD独特的发病高峰有关(18~44岁居多,可能与遗传因素有关),相关流行病学调查[27]证实了这一点。高血压为脑卒中中最重要的独立危险因素,尤其是收缩压升高的相关性更为显著[28]。高血压状态下,血流对血管壁的冲击导致内膜受损,引起血小板聚集及胆固醇沉积,造成管壁增厚、狭窄,最终导致缺血性卒中。然而MMD缺血性卒中为血管内膜平滑肌细胞增生导致的血管狭窄引起的[22]。本研究发现与非MMD卒中患者相比, MMD患者的收缩压和舒张压明显较低,收缩压(P<0.05)被纳入模型,相关研究[13, 29]与本研究结果相一致。
ALB降低和血脂异常为发生缺血性脑卒中的独立危险因素[30-31]。血脂异常在动脉粥样硬化的发生发展中起着十分重要的作用,且研究[32]表明, TC水平每升高1 mmol/L, 脑卒中的发病风险增加5%,缺血性脑卒中的发病风险增加20%。本研究发现, MMD缺血性卒中患者TC、TG、LDL水平均高于非MMD缺血性卒中患者,尽管TG、LDL并未显示出统计学差异。脑缺血发作期机体处于应激状态,白细胞介素(IL)-6及肿瘤坏死因子-α等炎症因子水平升高,并对ALB的合成呈负性调控[33], 且应激状态下,机体蛋白质消耗增多。尽管高血压、血脂异常及低ALB为缺血性卒中的危险因素,然而基于MMD独特的发病机制,更倾向于一种由炎症、免疫、遗传等因素导致的疾病[34]。高血压对血管壁的损伤、脂质异常导致的斑块沉积以及应急状态下ALB的大量消耗与非MMD缺血性卒中密切相关,所以非MMD缺血性脑卒中患者往往具有更高的血压、血脂和更低的ALB, 但这仍需要多中心大样本的研究进一步验证。本研究存在局限性,首先MMD的发病率相对较低,纳入的样本量不够大,且收集的数据多来自本省居民,具有一定的地域性; 其次,尽管列线图已经表现出良好的鉴别能力,但仍需进行大样本、前瞻性研究以进一步验证列线图的可靠性。

