人促甲状腺激素受体A亚单位蛋白在昆虫细胞体系中的分泌性表达
张 萌,张恺宁,陈子怡,王 玲,伍丽萍,王 悦,刘 冰,施秉银
(1.西安交通大学第一附属医院内分泌科,陕西西安 710061;2.西安交通大学第一附属医院生物样本信息资源中心,陕西西安 710061)
促甲状腺激素受体(thyroid stimulating hormone receptor,TSHR)是G 蛋白耦联受体家族成员之一,主要表达于甲状腺滤泡上皮细胞。TSHR 由764个氨基酸构成,翻译组装时发生分子间裂解,形成二硫键连接的胞外段A 亚单位和跨膜的B亚单位。生理条件下,促甲状腺激素(TSH)与胞外段结合,激活下游信号通路产生cAMP,介导相应的生理功能。
TSHR A 亚单位主要包含氨基酸序列22-289,既是Graves病(Graves’disease,GD)及其并发症Graves 眼病(Graves’ophthalmopathy,GO)的主要自身抗原,也是其防治研究的重要靶点[1]。病理状态下,在二硫键异构酶作用下二硫键断裂,TSHR A 亚单位从细胞膜脱落,诱导机体的自身免疫[2]。临床研究中,GD 患者和GO 患者体内可以检测到TSHR A亚单位的自身抗体[3-4]。动物研究显示,给予Balb/c小鼠注射不同时长和频率的表达人TSHR A 亚单位的腺病毒可以诱导GD 模型和GO 模型[5-6];将人TSHR A 亚单位基因导入NOD.H2h4小鼠体内,可以诱导自身抗体从而建立自发的GD 模型[7]。此外,TSHR A 亚单位蛋白和表达人TSHR A 亚单位的腺病毒的预处理GD 小鼠,均可抑制其GD 的发病率和症状[8-9];将TSHR A 亚基蛋白导入TSHR A-NOD.H2h4小鼠,可以减轻GD 的症状[7]。
获取大量纯度较高的TSHR A 亚单位蛋白对生产促甲状腺素受体抗体、检测患者血清促甲状腺素受体抗体水平以及GD 的防治具有重要意义。而TSHR A 亚单位蛋白作为大片段蛋白,主要的结构是富亮氨酸的β折叠组成的重复区域,有6个必需的糖基化位点[10]。常见的蛋白表达系统包括大肠杆菌、酵母、哺乳动物细胞等,前两者系统存在折叠和糖基化等翻译后修饰的缺陷,哺乳动物细胞系统的成本较高、产量较少。而昆虫细胞在经过糖基化优化等完善后,作为在折叠、糖基化、产量等方面较为均衡的蛋白表达系统,已经进入生物医药领域,在流感疫苗、乙肝疫苗等领域广泛应用,是工业化生产TSHR A 亚单位的良好选择[11-12]。
本研究采用分子生物学技术,拟构建TSHR A亚单位的昆虫细胞分泌表达体系,在草地夜蛾卵巢细胞(sf9)中表达分泌型的TSHR A 亚单位蛋白,为其工业化平台的建设及生产提供前期基础。
1 材料与方法
1.1 材料
1.1.1实验细胞 DH5α大肠杆菌热激感受态细胞(上海唯地生物技术有限公司,DL1001),DH10bac大肠杆菌热激感受态细胞(上海唯地生物技术有限公司,DL1071),草地夜蛾卵巢细胞(Spodoptera frugiperda9,sf9)(美国Invitrogen生物技术有限公司,B82501)。
1.1.2实验试剂 p Fastbac-dual质粒(武汉淼灵生物科技有限公司,P0292),胎牛血清(美国Gibco生物技术有限公司,10100147),Bluo-Gal(美国Gibco生物技术有限公司,15519028),金牌Mix(green)(北京擎科生物技术有限公司,0BH21701),Gel Extraction Kit琼脂糖凝胶回收试剂盒(美国Omega生物技术有限公司,D2500-02),Plasmid Mini Kit质粒提取试剂盒(美国Omega生物技术有限公司,D6943-02),BAC/PAC DNA Mini Kit(美国Omega生物技术有限公司,D2156-01),EasyGeno快速重组克隆试剂盒(北京天根生化科技有限公司,VI201),TSHR抗体(3B12)(美国Santa Cruz生物技术有限公司,sc-53542)。
1.1.3实验仪器 正置光学显微镜(日本Olympus),电泳仪(美国Bio-rad),Turbo全能型快速转印系统(美国Bio-rad),蛋白免疫印迹成像系统(美国Thermo Fisher Scientific),超微量分光光度计(美国Nano-drop)。
1.2 方法
1.2.1重组质粒的构建和鉴定 ①重组基因的设计及引物合成:根据TSHR 22-289、Fastbac-dual及绿色荧光蛋白GFP的序列设计重组蛋白序列,在Fastbac-dual的两个启动子下分别插入TSHR 22-289和GFP的序列。利用Primer5.0设计引物并合成。
②质粒线性化扩增及回收:通过PCR 反应在目的基因插入位点将载体质粒线性化并扩增。使用琼脂糖凝胶回收试剂盒回收线性化载体片段,测定浓度,-20℃保存。
③目的基因扩增及回收:通过PCR 反应从表达TSHR 的质粒psv2-neo-ECE(美国加州大学洛杉矶分校Basil Rapoport教授和陈春荣教授惠赠)上获得TSHR 22-289片段,在该片段的上游5’端引入蜂毒信号肽序列,在上下游都引入与线性化载体匹配的同源序列,扩增并胶回收。
④线性载体同源重组、转化及阳性克隆的提取:使用重组克隆试剂盒对线性化载体和目的基因片段进行同源重组,转化DH5α感受态细胞后将复苏的菌液涂布到含有羧苄青霉素的LB固体平板上,37℃倒置培养过夜。挑取平板上的菌落接种于含有羧苄青霉素的LB培养基,摇床(37℃,225 r/min)振荡过夜,使用质粒小提试剂盒对重组pFastbac-dual-TSHR-GFP质粒进行提取。测定浓度,-20℃保存。
⑤阳性质粒的鉴定:PCR 鉴定重组质粒中的插入片段大小,并对目的基因片段进行回收测序。
1.2.2重组杆粒的生成和鉴定 ①质粒的转化及蓝白斑筛选:将鉴定正确的重组克隆质粒转化入DH10bac感受态细胞,利用含有庆大霉素、卡那霉素、四环素、IPTG 和Bluo-gal的LB琼脂板来对阳性菌落进行蓝白斑筛选, 待培养成单菌落后,统计各稀释度琼脂板上蓝色和白色菌落的数目。
②菌落PCR 鉴定重组杆粒的大小:因为Bacmid DNA 大于135 kb,难以直接测序,先进行PCR 分析确认重组Bacmid中目的基因的存在。p UC/M13正向 引 物5'-CCCAGTCACGACGTTGTAAAACG-3';p UC/M13反向引物5'-AGCGGATAACAATTTCACACAGG-3'。
③重组杆粒的提取及鉴定:使用OMEGA BAC/PAC DNA Mini Kit提取重组Bacmid,使用p UC/M13通用引物及目的基因特异性引物对重组杆粒PCR 鉴定。回收目的基因片段并测序。
1.2.3重组杆状病毒的生产及扩增 ①重组杆粒转染昆虫细胞获得病毒储液并扩增:利用Invitrogen公司的化学转染试剂ExpiFectamine Sf Transfection Reagent,将纯化好的重组Bacmid 转染至复苏好的sf9细胞,置于27℃、无CO2环境孵育3~4 d,观察病毒感染征象,收集上清液,离心弃沉淀获得P0 病毒储液。P0病毒储液是低滴度储液,再次感染sf9细胞生成高滴度的P1储液,4℃避光保存。
②病毒滴度空斑分析:将密度为5×105个细胞/mL的细胞悬液加入6孔板中,贴壁1 h后弃去培养基,分别加入1 m L 不同稀释倍数的病毒培养基,培养1 h;去除培养基,迅速加入2 m L 含有琼脂的空斑培养基,室温下静置1 h使琼脂变硬后培养7~10 d;加入中性红溶液,室温孵育1 h;去除多余染料,计数空斑。
1.2.4重组蛋白的表达及鉴定 影响重组蛋白最佳表达条件的确定的因素有很多,选取感染复数(multiplicity of infection,MOI)和时程来进行条件的优化。MOI=病毒储液滴度×病毒储液体积/细胞数。优化条件分别为MOI=1、2、5、10,及转染时程为48、96、120 h。收集细胞及上清液,每孔的细胞提取总蛋白,-20℃保存。通过Western blotting进行蛋白鉴定。
2 结 果
2.1 重组质粒的构建和鉴定结果
2.1.1质粒线性化及目的基因扩增结果 通过PCR反应,分别将质粒线性化、目的基因扩增,产物经20 g/L琼脂糖凝胶电泳,分别在大于4 000 bp和950 bp处出现特异性条带(图1A)。
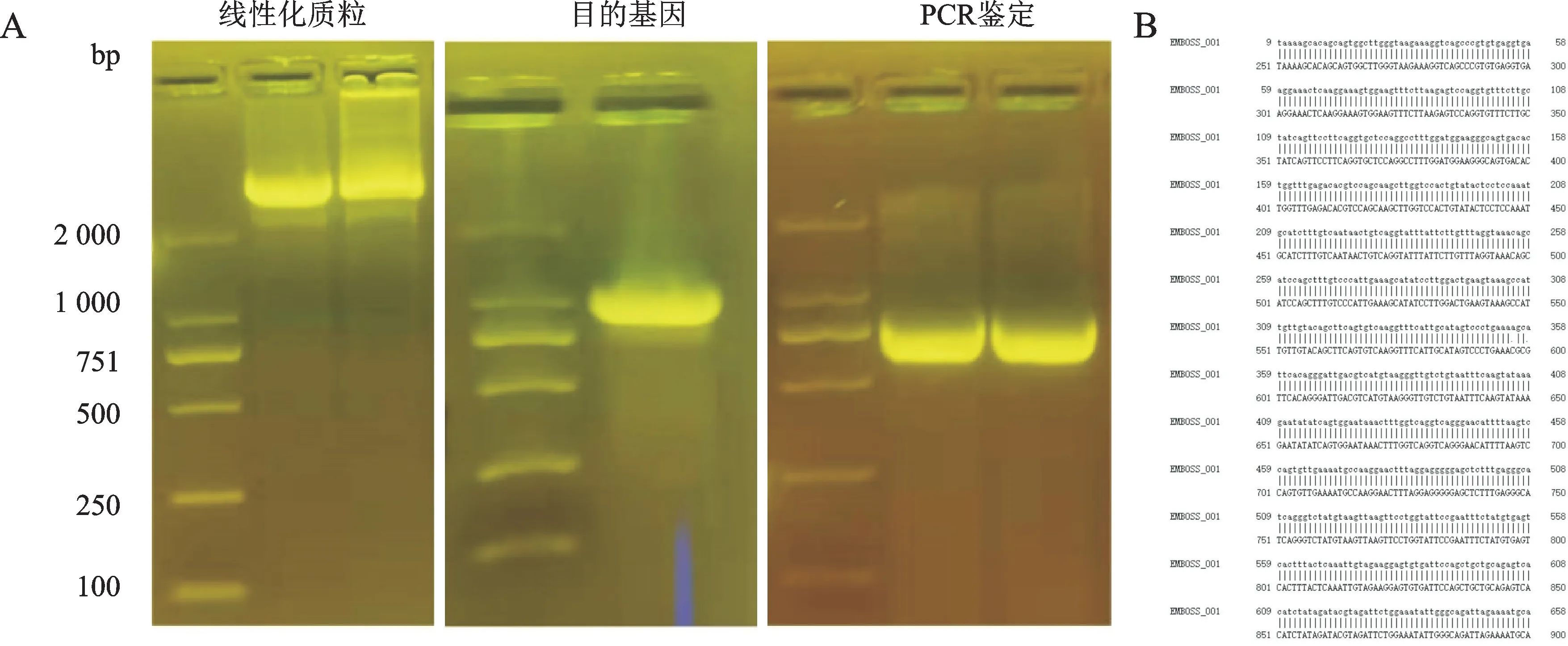
图1 重组质粒的构建和鉴定结果Fig.1 Construction and identification of recombinant plasmid
2.1.2阳性质粒的鉴定结果 转化后抗生素筛选的阳性质粒提取后进行鉴定。PCR 鉴定在800 bp左右处出现特异性条带(图1A),测序结果与基因库结果一致(图1B)。
2.2 重组杆粒的生成和鉴定结果
2.2.1蓝白斑筛选结果 培养48 h后琼脂板上出现蓝白斑:稀释度为100的琼脂板上,菌落较为密集,边界不清晰;稀释度为10-2、10-3的琼脂板上,菌落较少;稀释度为10-1的琼脂板上菌落清晰,白斑较大,选取大而有光泽的白斑进行进一步鉴定(图2A)。
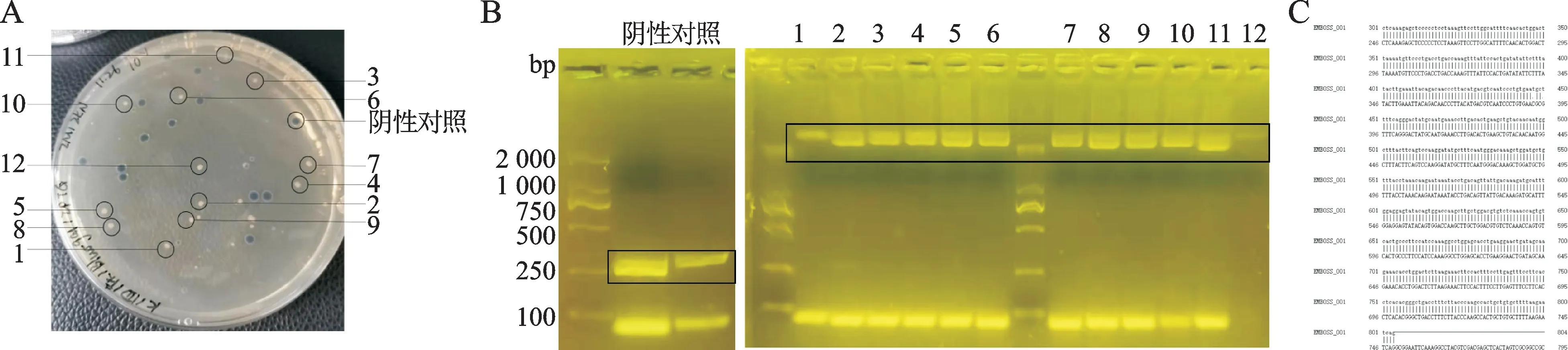
图2 重组杆粒生成和鉴定结果Fig.2 Generation and identification of recombinant bacmid
2.2.2阳性杆粒的鉴定结果 对筛选出来的12个菌落以p UC/M13通用引物进行菌落PCR 鉴定,仅杆粒的PCR 产物大小约300 bp,带有目的基因的杆粒为3 200 bp左右。12个菌落均出现>2 000 bp的特异性条带(图2B)。
挑选数个菌落PCR 阳性的菌液提取重组杆粒以p UC/M13 通用引物和目的基因特异性引物鉴定,p UC/M13通用引物PCR 显示阴性对照在300 bp左右出现条带,4个白色菌落均在3 200 bp左右出现特异性条带;目的基因特异性引物鉴定显示,阴性对照没有出现特异性条带,4个白色菌落均出现在2 000 bp左右特异性条带,大小与预期结果相符。
将通用引物的PCR 产物回收后,利用目的基因引物测序,结果与基因库TSHR 序列进行比对,结果一致(图2C)。
2.3 重组杆状病毒的生产和滴度测定结果
2.3.1转染后的sf9细胞的形态变化 重组杆粒转染昆虫细胞后,分别于48 h和96 h观察到细胞感染的早期和后期征象。显微镜下可见,与对照组细胞相比(图3A),感染了杆粒的sf细胞在96 h出现细胞直径增大25%~50%,细胞核“充满”整个细胞(图3B);120 h出现细胞生长停滞,并出现病毒出芽的颗粒样外观(图3C、图3D)。
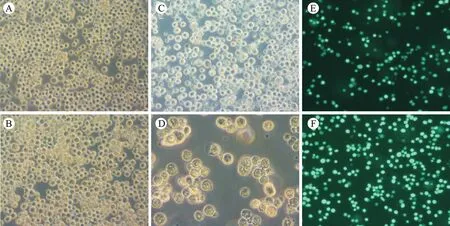
图3 感染后的昆虫细胞形态变化Fig.3 Morphological changes of insect cells after infection
2.3.2P1代病毒扩增的结果 P0代细胞扩增P1代病毒,由于载体上携带有绿色荧光蛋白基因,可在转染24 h和48 h后实时观测到细胞的感染情况(图3E、图3F)。
2.3.3 空斑实验结果 10-4至10-6稀释浓度均可见明显空斑,6孔板的最佳计数范围为3~20个空斑,选择10-6作为稀释浓度(图4),计算空斑数为20。根据公式:滴度(pfu/mL)=空斑数×稀释倍数/菌液体积,计算P1的病毒滴度:20×106/1=2×107pfu/m。

图4 空斑实验结果Fig.4 The results of plaque test
2.4 重组蛋白的表达及鉴定结果
利用已测定滴度的P1病毒储液进行重组蛋白的初步表达,Western blotting鉴定结果显示55 ku处出现了目的条带;且该蛋白主要表达于培养基上清中(图5A)。选取MOI和时程来进行条件的优化,结果显示相对于48 h,72 h 是更好的最佳表达时程,MOI为1时的表达结果最佳(图5B)。
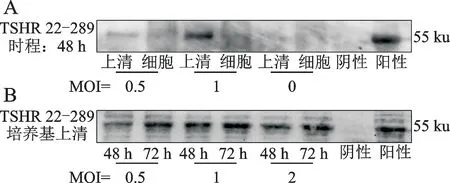
图5 蛋白的鉴定及表达条件优化Fig.5 Protein identification and optimization of expression conditions
3 讨 论
TSHR A 亚单位是GD 的自身抗原和发病核心环节。近年来多项研究显示,其不仅可以诱导多种GD 动物模型[5-6],在GD 的防治中也具备巨大的前景[8-9]。既往涉及TSHR 的科学研究中大多是以中华仓鼠卵细胞(Chinese hamster ovary,CHO 细胞)表达的,但因为哺乳动物蛋白表达系统的产量存在限制,局限了针对TSHR 蛋白的科学研究和产业转化[10,13]。因此,亟需探索一种新的蛋白表达体系用于TSHR A 亚单位的产业转化和基础研究。
作为含有200多个氨基酸的大分子蛋白,TSHR A 亚单位具有独特的蛋白结构,对于其生物学及免疫学功能至关重要[14]。科学家们通过晶体X 射线衍射的方法,对TSHR 的结构和结合位点进行了研究并构建模型[11-12,15]。TSHR A 亚单位主要为富含亮氨酸重复结构域,该区域由11个重复序列的β折叠构成,其凹面是激素和自身抗体的主要结合位点[16]。除了蛋白的序列和折叠的结构以外,蛋白的翻译后修饰对TSHR 的功能也有重要影响。TSHR 的胞外段共有6个糖基化结合位点,研究人员发现,只有保证至少4个位点的糖基化才能使TSH 与该受体的结合并传导下游信号[10]。
因为TSHR A 亚单位的复杂结构,虽然科学家们已经尝试了多种表达系统进行大量克隆表达,但均未建立稳定表达活性TSHR 及其胞外域的体系[13]。目前一致认为以CHO 细胞为代表的真核表达系统是生成构象完整、具有正确空间结构TSHR A 最有效的方法;然而,其表达量非常低,并且大部分以未成熟的形式保留在细胞内,仅少量分泌至培养基中[13]。其他蛋白表达系统如大肠杆菌、酵母表达系统等,其蛋白折叠和修饰能力较弱,无法表达具有稳定结构的目标蛋白。近年来,昆虫细胞表达系统逐步进入科学家们的视野,经过糖基化优化等完善后的昆虫表达系统,作为在折叠、糖基化、产量等方面较为均衡的蛋白表达系统,已经进入生物医药领域,在流感疫苗、乙肝疫苗等领域广泛应用。近期通过构建昆虫表达系统,科学家们分别构建并解析了TSHR 胞外域氨基酸22-260与TSHR 刺激性抗体(M22)、阻断性抗体(K1-70)的复合物的晶体结构,证实了昆虫系统可以表达有完整结构及功能的部分TSHR 胞外段[11-12]。
本研究成功构建了外泌性的TSHR A 亚单位蛋白昆虫细胞杆状病毒表达系统。本系统的优势有以下几点:①本系统通过蜂毒信号肽构建外泌性表达系统,在培养基检测到蛋白,并优化了MOI和时程条件(MOI为1和72 h),较既往的真核表达系统更为优化,在纯化及后期工业化中都具备巨大优势[13]。②该系统表达出来的蛋白质分子质量在55 ku左右,考虑到TSHR A亚单位是具有6个糖基化位点的β折叠为主的多肽,其蛋白分子量在未修饰时为24~27 ku,糖基化修饰后会达到50~60 ku左右[13],因此我们推测该蛋白的相应位点已经充分糖基化。③本系统选择表达的TSHR A 亚单位序列为aa22-289,与既往昆虫系统表达进行蛋白表达TSHR 的研究(aa22-260)并不相同[11-12];对该肽段的选择是因为近年来的结构与功能研究推测LRRD 的重复序列有11个,而不是之前认为的9个[15-16]。④本系统选择了双启动子的质粒,使得可以通过绿色荧光实时定量监测细胞的转染情况,初步估计其滴度,这是对前期昆虫系统表达系统的巨大优化[11-12]。本研究作为前期基础,相信在不远的将来,通过中试、大试等可以建立产业化的平台系统。
综上,本研究构建了TSHR A 亚单位的昆虫细胞杆状病毒表达体系,该体系能够外泌性表达分子质量为55 ku左右的蛋白TSHR 22-289,且蛋白能够成功的糖基化修饰。该系统为其工业化平台的建设及生产提供了前期基础,也为日后针对TSHR 蛋白的研究和GO 病因预防提供了有用的工具。

