基于CT 增强扫描的影像组学在低级别透明细胞肾癌和非透明细胞肾癌鉴别诊断中的价值
路 丽,柳成良,陈德强,孟 亮,任嘉梁
1.河北省沧州市中心医院CT 诊断科,河北 沧州 061000;2.河北省沧州市中心医院超声二科,河北 沧州 061000;3.GE 医疗,北京100176
肾细胞癌为肾脏常见肿瘤,在癌症发病率中排第7 位,每年全世界约10 多万患者因肾癌死亡[1]。常见的肾细胞癌可分为:透明细胞肾癌(ccRCC)和非透明细胞肾癌(non-ccRCC),其中non-ccRCC 主要包括嫌色细胞癌、乳头状肾细胞癌和其他亚型[2]。目前,肾细胞癌的术前诊断多依赖影像学检查,尤其是CT 增强扫描,但在病理亚型精准鉴别上常有误差。穿刺活检是肾细胞癌诊断的金标准,但其可导致肿瘤出血,同时存在取样误差和肿瘤针道播散风险。影像组学弥补了传统影像的不足,将传统视觉影像信息转化成客观数据进行量化研究,并结合影像、基因和临床资料高通量提取、分析肿瘤信息,客观预测肿瘤分类及病理组织分型,辅助临床制订治疗方案。ccRCC与non-ccRCC 的遗传表达模式、生长特征、治疗方案的选择及预后均有不同,其中低级别(Fuhrman Ⅰ、Ⅱ级)ccRCC 的恶性程度及死亡率高于non-ccRCC。新兴的分子靶向治疗可用于ccRCC,提高患者生存率,但对non-ccRCC 的疗效不明显。因此,临床可依据肾细胞癌的病理分型及组织学分级,制订个体化治疗方案。目前对ccRCC 和non-ccRCC 的鉴别尚未分析其病理分级,低级别ccRCC 与non-ccRCC 的区别尚不清楚。本研究旨在探讨基于CT 增强扫描的影像组学在鉴别低级别ccRCC 与non-ccRCC 中的价值,寻找并建立肾细胞癌术前诊断的最佳预测模型。
1 资料与方法
1.1 一般资料
回顾性分析2019 年1 月至2022 年1 月沧州市中心医院收治并经术后病理证实的100 例肾细胞癌患者,其中男54 例,女46 例;年龄28~76 岁,平均(56.70±7.80)岁。100 例中低级别ccRCC 60 例,其中Fuhrman 分级Ⅰ级24 例,Ⅱ级36 例;non-ccRCC 40 例,包括乳头状肾细胞癌15 例,嫌色细胞癌21 例,鳞癌2 例,未分类肾细胞癌2 例。
纳入标准:术前均行肾脏CT 增强扫描,图像清晰;未行放化疗及穿刺。排除标准:图像质量不佳;肿瘤已播散转移;高级别ccRCC。本研究得到医院伦理委员会批准,所有患者均知情同意。
1.2 仪器与方法
使用GE 宝石能谱CT 扫描仪。扫描参数:120 kV,550 mA,层厚、层距均为2.5 mm,螺距1.375。患者取仰卧位,行腹部平扫及增强扫描,范围自横膈水平至髂前上棘水平。经肘静脉采用高压注射器以3.0~3.5 mL/s 流率团注非离子型对比剂碘海醇(碘浓度350 mg/mL),剂量1.5 mL/kg 体质量,分别于注射对比剂后30、80、150~180 s 采集肾脏皮髓质期、实质期、排泄期图像。提取实质期图像特征构建模型[3]。
1.3 图像分割
将CT 实质期图像导入开源ITK-SNAP 软件(http.//www.itksnap.org),于软组织窗下处理图像。由1 位工作5 年的影像医师沿肿瘤边缘逐层手动勾画ROI,再由另1 位工作10 年的影像医师核对。最后所勾画的全部ROI 通过软件自动融合并形成立体感兴趣区(volume of interest,VOI)(图1)。

图1 ROI 勾画示意图 注:患者,男,65 岁,右肾透明细胞肾癌。病灶最大层面(图1a 红箭),勾画ROI(图1b);逐层勾画ROI后由软件融合形成立体感兴趣区(VOI)(图1c)
1.4 特征提取与模型构建
将所有的原始图像和ROI 导入GE A.K.软件中进行特征提取,主要包括直方图特征、形态学特征及纹理特征等。由均值替代异常值及缺失值,对所提取的特征值预处理并对数据进行标准化处理,并按7∶3 的比例将100 例随机分为训练集70 例和测试集30 例。采用一般单变量分析、Spearman 相关分析、多变量逻辑回归分析依次进行特征降维,建立影像组学评分,在获得的690 个特征中筛选出5 个特征,并以此构建出逻辑回归模型。应用逻辑回归模型建立ccRCC 与non-ccRCC 的鉴别预测模型。为避免模型的过度拟合,采用5 折交叉验证方法验证模型精度。构建ROC 曲线、决策曲线评估模型的鉴别性能。
1.5 统计学分析
数据预处理、特征降维均通过A.K.软件完成。使用R 3.5.1 和Python 3.5.6 软件对训练集及测试集的回归模型参数进行评价。应用正态分布检验和方差齐性检验对定量资料进行分析,组间比较行独立样本t 检验或Mann-Whitney U 检验。定性资料组间比较行χ2检验或Fisher 确切概率法。以P<0.05为差异有统计学意义。应用Hosmer-Lemeshow 检验分析训练集与测试集的拟合优度。应用DeLong 检验对训练集与测试集的AUC 值进行比较分析。
2 结果
2.1 训练集与测试集一般资料比较(表1)
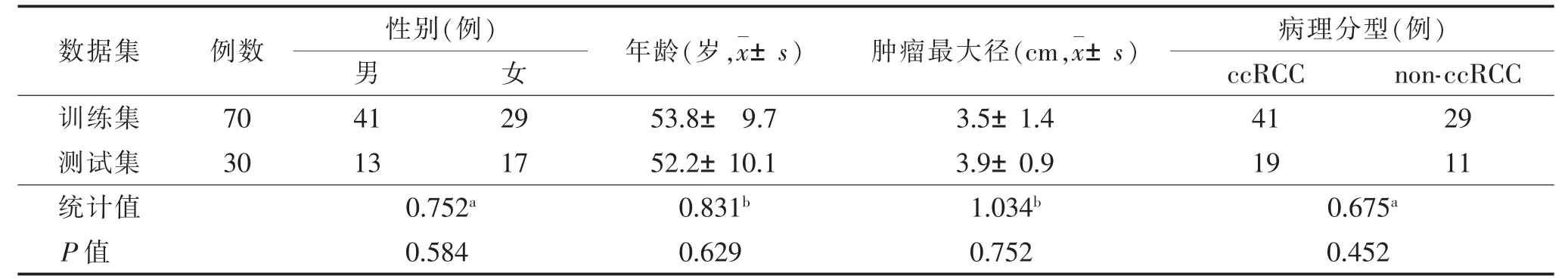
表1 训练集和测试集一般资料比较
100 例肿瘤最大径为1~6 cm,平均(3.8±1.7)cm。训练集和测试集患者的性别、年龄、肿瘤最大径、病理分型比较,差异均无统计学意义(均P>0.05)。
2.2 影像组学特征
筛选出5 个影像组学特征,包括3 个灰度共生矩阵、1 个灰度游程矩阵和1 个一阶特征,相关性分析提示特征之间无显著线性相关,可作为独立预测因子存在(图2)。Hosmer-Lemeshow 检验显示,该模型的拟合优度较好(P>0.05),提示该模型与实际鉴别模型结果一致。采用Hosmer-Lemeshow 检验,绘制校准曲线(图3),结果显示该模型具有良好的校准度。训练集和测试集建立的ROC 曲线提示,在训练集中该模型鉴别效能的AUC 为0.996(95%CI 0.989~1.000),敏感度为0.935,特异度为1.000;在测试集中的AUC为1.000(95%CI 1.000~1.000),敏感度为0.929,特异度为1.000(图4,表2)。应用DeLong 检验对训练集和测试集的AUC 进行比较,差异无统计学意义(P>0.05),说明该模型的预测性能稳定。所构建的决策曲线结果显示,该模型的临床收益较高(图5)。影像组学评分则表明,该模型对低级别ccRCC 和non-ccRCC有较强的鉴别效能(图6)。

表2 训练集与测试集的预测模型结果对照

图2 5 个影像组学特征的相关性分析结果 注:图2a,2b 分别为训练集和测试集5 个特征之间的相关系数。5 个特征之间的相关系数均<0.8,无显著线性关系,可作为独立的预测因子
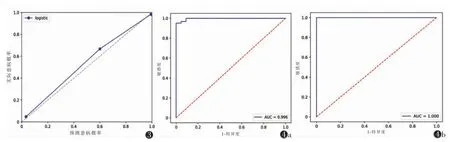
图3 逻辑回归模型的校准曲线 注:虚线代表理想曲线,实线为逻辑回归模型需要校准的曲线 图4 逻辑回归模型预测模型的ROC 曲线 注:图4a 为逻辑回归模型预测模型在训练集中的ROC 曲线,AUC 为0.996。图4b 为逻辑回归模型预测模型在测试集中的ROC 曲线,AUC 为1.000

图5 逻辑回归模型在训练集和测试集的决策曲线 注:图5a,5b 分别为训练集和测试集。横轴下方刻度线为相应概率阈值下的成本和收益比。红线代表该预测模型(DCA),黑色实线代表对所有患者进行治疗(Treat all),水平虚线代表对所有患者均不进行治疗(Treat None)。在阈值0~1.0 范围内,红线明显高于黑色实线和虚线,表明该模型的净收益率高 图6 逻辑回归模型在训练集和测试集的影像组学评分 注:图6a,6b 分别为训练集和测试集。红、蓝线分别代表透明细胞肾癌和非透明细胞肾癌,中间水平表示截断值,红、蓝线分布于两侧,表明该模型预测能力较强
3 讨论
肾细胞癌为肾脏最常见的恶性肿瘤,其中ccRCC约占75%,是最主要的亚型[4],同时也是恶性程度最高且最易转移的亚型,而non-ccRCC 的预后及生存率相对较高[5]。肾细胞癌病理亚型的早期诊断对于临床治疗有重要意义。有研究显示,ccRCC 的病理级别是影响预后的独立因素,ccRCC 的Fuhrman 分级越高,其恶性程度越高,侵袭性越强,生存率越低,而低级别ccRCC 因其恶性度低,可采用多种治疗方案,预后良好[6]。non-ccRCC 的恶性程度亦相对较低,低级别ccRCC 与non-ccRCC 两者之间的恶性程度相似[7],但两者之间潜在的差异目前尚无相关研究报道,准确鉴别两者对临床治疗具有重要意义。新兴的分子靶向治疗可有效治疗低级别ccRCC,提高患者生存率,但对non-ccRCC 的疗效甚微。因此,本研究拟建立一个高准确率的预测模型,在术前准确预测肾细胞癌的病理亚型,以辅助肾细胞癌患者进行个体化治疗,提高和改善预后。
目前,CT 增强扫描依据肿瘤的强化方式及其形态对肾细胞癌亚型的鉴别诊断有一定帮助[8-9],但误诊率较高。随着2012 年影像组学概念[10]的提出,其作为一种新兴技术,通过提取病灶内在的纹理特征,能够无创、全面分析肿瘤生理异质性,在肿瘤鉴别及分析的应用中日趋广泛,并已成功应用于多系统疾病中。李羚等[11]应用列线图预测头颈部恶性肿瘤的淋巴结转移,结果显示CT 值+影像组学标签的准确率、敏感度和特异度均较高,且校准度高,诊断效能良好。邢倩等[12]通过提取肺结节的特征建立不同的影像组学模型,从而对肺结节的影像学性质进行判断,得到肺部影像报告和数据系统(Lung-RADS)分类。樊梦思等[13]利用CT 平扫图像的纹理特征,依赖随机森林影像组学方法鉴别肺腺癌、肺结核与肺隐球菌病,指导临床对患者采取个体化治疗。目前,关于影像组学在肾脏的应用已有相关研究报道,王旭等[14-16]研究报道了利用CT 影像组学特征鉴别ccRCC 肿瘤分级,以及低级别(Fuhrman Ⅰ/Ⅱ)和高级别(Fuhrman Ⅲ/Ⅳ)ccRCC 的差异,并提出影像组学特征可作为ccRCC 的Fuhrman 等级术前评估的生物学标志物。曾祥灵等[17]研究了ccRCC 与乏脂肪性血管平滑肌脂肪瘤的影像组学特征,并建立了两者鉴别的最佳预测模型,提出CT 扫描的优势期相选择。黄忠江等[18]提出临床特征与影像组学特征结合可更好地鉴别肾均质性透明细胞癌与肾乏脂肪血管平滑肌脂肪瘤。Li 等[19]利用影像组学的机器学习方法鉴别肾脏嫌色细胞癌与嗜酸细胞腺瘤。有研究提出,基于CT 的影像组学可预测高级别ccRCC,并对ccRCC 与non-ccRCC 进行鉴别[20-21],然而相关研究仍较少,且在鉴别时未对ccRCC 进行详细病理分级。
研究发现,肾细胞癌病变轮廓于实质期显示最清晰,且灌注良好[22-24],因此本研究亦提取CT 增强扫描的实质期图像特征进行模型构建。本研究对低级别ccRCC 的影像组学特征进行补充,并应用于其与non-ccRCC 的鉴别诊断中。本研究共提取690 个影像组学特征,最终筛选出5 个最有意义的纹理特征对低级别ccRCC 和non-ccRCC 进行鉴别分析,并基于此特征构建逻辑回归模型。本研究中,预测模型在训练集ROC 曲线的AUC 为0.996,敏感度为0.935,特异度为1.000;在测试集的AUC 为1.000,敏感度为0.929,特异度为1.000。结果表明,纹理特征间的相关系数均<0.8,无显著线性关系,可作为独立的预测因子。决策曲线和评分表明,该模型具有较高的净收益率和较高的预测性。以上结果提示,本研究建立的逻辑回归模型能够鉴别诊断低级别ccRCC 与non-ccRCC,且性能稳定。
本研究存在的局限性:样本量相对较小,可能对分析结果有所影响,还需扩大样本深入研究;在分析影像组学特征时,未对non-ccRCC 进行病理分级,今后还需分析不同级别non-ccRCC 的组学特征。
综上所述,基于CT 增强扫描的影像组学模型在鉴别低级别ccRCC 及non-ccRCC 中具有可行性,且具有较高的诊断效能。

