T2DM 合并非酒精性脂肪性肝病患者脂肪变性程度与胰岛素抵抗的相关性
韩凯婷,刘建宪,王振松,孙启玉,甘 洁
1.山东中医药大学,山东 济南 250355;2.山东省立第三医院影像中心,山东 济南250031
2 型糖尿病(type 2 diabetes mellitus,T2DM)以慢性高血糖为特征,是既存在胰岛素分泌缺陷,又存在胰岛素抵抗(insulin resistance,IR)的代谢性疾病[1]。非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)指代谢应激性肝脏损伤,与IR 及遗传易感性密切相关,通常伴随营养过剩、肥胖、代谢综合征和T2DM[2]。研究证实,IR 和肥胖是T2DM 合并NAFLD的共同发病机制[3]。最近,一项对我国NAFLD 的分析报告显示,NAFLD 的总体患病率为29.88%,其中,在T2DM 患者中NAFLD 发病率高达51.83%[4],而在NAFLD 中T2DM发病率约为45%[5]。T2DM 与NAFLD 互为因果,NAFLD 可增加T2DM 心血管等并发症风险,T2DM 亦可增加NAFLD 相关进展期肝病的风险[6]。T2DM 合并NAFLD 患者的早期诊断及其全身脂肪变性程度与IR 的相关性分析对治疗措施的选择、改善患者预后具有重要意义。本研究主要探讨T2DM 合并NAFLD 患者肝脏及全身脂肪变性程度与IR 的相关性,现报道如下。
1 资料与方法
1.1 一般资料
前瞻性收集2021 年12 月至2022 年11 月山东省立第三医院收治的62 例T2DM 患者作为研究对象,根据是否合并NAFLD 分为单纯T2DM 组30 例和T2DM 并NAFLD 组32 例,另选取40 例同期健康体检者作为对照组。
T2DM 组患者纳入标准:①年龄32~70 岁;②参照糖尿病诊断标准[7],空腹血糖(FPG)≥7.0 mmol/L和/或餐后2 h 血糖≥11.1 mmol/L。T2DM 并NAFLD组患者纳入标准:①年龄32~70 岁;②参照糖尿病诊断标准[7]:空腹血糖(FPG)≥7.0 mmol/L 和/或餐后2 h 血糖≥11.1 mmol/L;③参照《非酒精性脂肪性肝病防治指南》[8]中的相关标准,根据腹部B 型超声检查及CT 检查诊断脂肪肝,且肝活检组织学改变符合脂肪肝的病理学诊断标准,符合其中1 项即可入组。对照组纳入标准:①年龄32~70 岁;②糖耐受正常,即FPG<5.6 mmol/L 和/或75 g 糖耐量试验后2 h 血糖<7.8 mmol/L。
T2DM 组患者排除标准:①1 型糖尿病及其他特殊类型糖尿病患者;②合并糖尿病严重急性并发症、机体基础代谢状况严重紊乱者;③临床资料不完整者。T2DM 并NAFLD 组患者排除标准:①有过度饮酒或酗酒史者,过去1 年内每周饮酒男性>210 g,女性>140 g;②病毒性肝炎及自身免疫性肝炎等其他可导致脂肪肝者;③临床资料不完整者。对照组排除标准:①脂肪定量图像伪影较重,不符合测量标准者;②临床资料不完整者。
1.2 仪器与方法
1.2.1 肝脏及全身脂肪定量检测 采用联影uMR588 1.5 T MRI 成像系统,配头线圈和体部12 通道相控阵线圈。患者取仰卧位,行腹部常规轴位T1WI 序列、轴位T2WI 抑脂序列、轴位DWI 序列和全身轴位Whole Body 序列全身脂肪定量扫描,图像后处理利用U-Net 深度神经网络模型实现从锁骨至膝盖各部位脂肪组织的自动化分割测量,其中肝脏质子密度脂肪分数(proton density fat fraction,PDFF)的测量选取肝脏最大层面,避开大血管和胆道结构,手动勾画全肝ROI 进行测量(图1)。
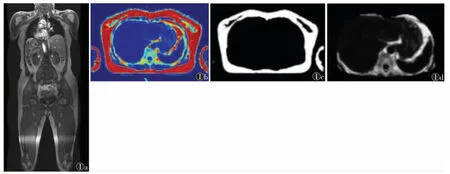
图1 全身脂肪定量图 注:女,36 岁。图1a 为全身脂肪定位图;图1b 为肝脏脂肪含量图,肝脏脂肪含量为(3.90±1.94)%;图1c 为皮下脂肪分布图,皮下脂肪占比(皮下脂肪/全身脂肪)为74.36%;图1d为内部脂肪图,内部脂肪占比(内部脂肪/全身脂肪)为25.64%
1.2.2 血生化指标检测 空腹状态采集5 mL 静脉血,糖化血红蛋白(HbA1c)和FPG 使用Beckman Coulter AU5821 全自动生化分析仪检测;空腹胰岛素(FINS)使用Cobas E-602 全自动电化学发光仪检测。
1.2.3 胰岛功能评估 采用稳态模型计算胰岛素抵抗指数(HOMA-IR),公式为HOMA-IR=FINS×FPG/22.5,其中FINS 单位为mU/L,FPG 单位为mmol/L。
1.3 观察指标
比较3 组年龄、性别构成比、糖尿病病程、BMI、糖代谢指标、脂肪定量结果等相关指标。分析T2DM并NAFLD 组患者脂肪定量指标,包括体脂率(全身脂肪体积/全身体积)、全身脂肪体积、PDFF、皮下脂肪占比(皮下脂肪/全身脂肪)、内部脂肪占比(内部脂肪/全身脂肪)、皮下脂肪/腔内脂肪(腹部),以及以上指标与HOMA-IR 的相关性。
1.4 统计学方法
采用SPSS 23.0 软件行数据分析。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,差异有统计学意义则行多重比较,方差齐时采用Bonferroni 法检验,方差不齐时采用Tamhane’s T2 法检验。计数资料以构成比表示,组间比较采用χ2检验。采用Pearson 相关法分析各脂肪定量指标与HOMA-IR 的相关性。以P<0.05 为差异有统计学意义,以P<0.01 为差异有显著统计学意义。
2 结果
2.1 3 组一般资料和脂肪定量结果比较(表1)
表1 3 组一般资料和脂肪定量结果比较()

表1 3 组一般资料和脂肪定量结果比较()
注:T2DM 为2 型糖尿病,NAFLD 为非酒精性脂肪性肝病,FPG 为空腹血糖,FINS 为空腹胰岛素,HOMA-IR 为胰岛素抵抗指数,HbA1c 为糖化血红蛋白,PDFF 为质子密度脂肪分数。与对照组比较,aP<0.05;与单纯T2DM 组比较,bP<0.05;c 为F 值;d 为χ2 值。
3 组年龄、性别构成比比较,差异均无统计学意义(均P>0.05);单纯T2DM 组与T2DM 并NAFLD组病程比较,差异无统计学意义(P>0.05);单纯T2DM组与T2DM 并NAFLD 组HbA1c、体脂率、皮下脂肪占比、皮下脂肪/腔内脂肪比较,差异均无统计学意义(均P>0.05);单纯T2DM 组FPG、FINS、HOMA-IR、HbA1c、PDFF、内部脂肪占比明显高于对照组,皮下脂肪占比和皮下脂肪/腔内脂肪明显低于对照组,差异均有统计学意义(均P<0.05);T2DM 并NAFLD组BMI、FPG、FINS、HOMA-IR、PDFF、内部脂肪占比、全身脂肪体积明显高于单纯T2DM 组及对照组,差异均有统计学意义(均P<0.05);T2DM 并NAFLD组体脂率明显高于对照组,皮下脂肪占比和皮下脂肪/腔内脂肪明显低于对照组,差异均有统计学意义(均P<0.05)。
2.2 T2DM 并NAFLD 组HOMA-IR 与各脂肪定量指标的相关性(表2,图2)

表2 T2DM 并NAFLD 组HOMA-IR 与各脂肪定量指标的相关性
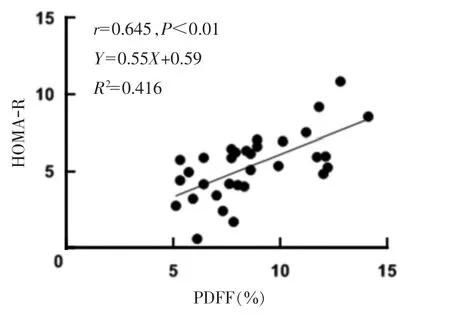
图2 2 型糖尿病(T2DM)并非酒精性脂肪性肝病(NAFLD)组患者胰岛素抵抗指数(HOMA-IR)与质子密度脂肪分数(PDFF)相关性的散点图
Pearson 分析显示,T2DM 并NAFLD 组HOMA-IR与PDFF 呈中度正相关(r=0.645,P<0.01),与体脂率、全身脂肪体积、皮下脂肪占比、内部脂肪占比、皮下脂肪/腔内脂肪无明显相关性(均P>0.05)。
3 讨论
IR 是T2DM 合并NAFLD 的共同发病机制,其可导致胰岛素对脂肪酶活性的抑制作用降低,从而使游离脂肪酸表达上调,若体内脂肪酸无法及时清除并大量氧化,可直接导致甘油三酯大量沉积[9],使肝脏、胰腺及其他组织异位脂肪沉积形成,进一步加重全身IR。当过量脂肪沉积于肝脏时,肝脏的固有免疫细胞(Kupffer 细胞、肝星状细胞等)被激活,释放细胞因子加剧炎症反应,可促进代谢相关性脂肪性肝炎甚至肝纤维化的发生。胰岛素分泌不足进一步加重糖毒性,糖毒性和脂肪毒性两者均可导致T2DM 患者IR 恶化和胰岛素分泌受损,T2DM 和NAFLD 互为因果,形成恶性循环[10]。目前,稳态模型HOMA-IR是临床间接评估人体IR 的主要方法[11]。本研究显示,T2DM 并NAFLD 组HOMA-IR 明显高于对照组及单纯T2DM 组,与既往相关研究[12]结果一致,提示T2DM 合并NAFLD 患者的IR 普遍高于其他人群,IR 与NAFLD 间存在一定联系。Temneanu 等[13]研究显示,T2DM 合并NAFLD 患者肝脏脂肪含量与IR相关性较大。
目前,可用于检测人体脂肪含量的方法较多,《欧洲肝病学会临床实践指南》[14]认为,MRI-PDFF 是肝脏脂肪定量最准确且可重复性好的无创方法。Gatzios等[15]指出,全身脂肪的分布是NAFLD 病情进展的重要驱动因素,内脏脂肪组织面积与NAFLD 发病风险增加相关。朱志良等[16]研究显示,内脏脂肪面积与空腹血糖、胰岛素均呈正相关。刘梅娟等[17]应用定量CT 技术测定受检者腹部脂肪体积和分布差异,且IR随内脏脂肪体积的增加而加重。本研究应用3D Multi-echo Dxion 技术(脂肪定量扫描)和U-Net 深度神经网络模型实现对PDFF 图的脂肪组织分割,计算脂肪在肝脏及全身各器官中所占的体积比,进行脂肪含量的量化分析,以显示全身脂肪的分布和不同器官中的脂肪沉积情况,测量结果的准确性比其他方法稍高。本研究发现,PDFF、内部脂肪占比和全身脂肪体积在对照组、单纯T2DM 组、T2DM 并NAFLD 组中依次升高,而皮下脂肪占比和皮下脂肪/腔内脂肪依次降低,提示PDFF、内部脂肪占比和全身脂肪体积与T2DM、NAFLD、HOMA-IR 三者间可能存在关联,与朱志良等[16,18]研究结果相似。T2DM并NAFLD 组HOMA-IR 随PDFF 的升高而升高,两者呈正相关,与丁智勇等[19]研究结果一致,提示临床对T2DM 的治疗,除基础降糖处理外,还应重视降脂治疗,进一步改善IR,以纠正糖脂代谢异常。本研究虽得出PDFF、内部脂肪占比和全身脂肪体积在对照组、单纯T2DM 组、T2DM 并NAFLD 组中依次升高,皮下脂肪占比和皮下脂肪/腔内脂肪在3 组中依次降低,但在相关性分析中仅得出HOMA-IR 与PDFF 存在正相关,并未得出HOMA-IR 与内部脂肪占比、全身脂肪体积、皮下脂肪占比及皮下脂肪/腔内脂肪相关且有统计学意义的结果,原因可能是本研究T2DM并NAFLD 组患者多为轻度脂肪肝,内脏及全身脂肪沉积量较少,与IR 的关系不显著,因而未得出类似结论。
本研究的不足之处:①为单中心研究,样本量相对较小,具有一定局限性,还需多收集T2DM 合并NAFLD 患者并行多中心研究,以进一步探讨肝脏脂肪含量及全身脂肪分布与IR 的作用机制。②T2DM并NAFLD 组患者的脂肪肝程度较轻,中重度患者样本量较小,入组患者脂肪沉积量较少,与IR 的关系不显著,需增加中重度患者样本进行分层研究。
综上所述,T2DM 合并NAFLD 患者的PDFF、内部脂肪占比及全身脂肪体积明显高于健康人及单纯T2DM 患者,且PDFF 与IR 呈正相关。因此,T2DM患者应定期检测全身脂肪指标,以早期识别轻度NAFLD,在行降糖处理的同时重视降脂治疗,从而有效改善IR,纠正糖脂代谢异常,更好地辅助临床治疗。

