CD146在视网膜血管内皮细胞中的功能和机制
林永 杨汝森 闫东升 陈晓燕 吕帆
病理性新生血管是许多致盲性眼病的共同特征之一。目前临床主要采用激光光凝术和玻璃体腔注射抗血管内皮生长因子(anti-vascular endothelial growth factor,anti-VEGF)治疗相关疾病[1],其中常用的anti-VEGF药物包括贝伐单抗、雷尼珠单抗[2]。尽管anti-VEGF的使用能够有效缓解病情,但部分患者治疗无效[3],以及治疗是否会对神经发育造成影响仍然存在争议[4]。因此,研究治疗视网膜新生血管的新靶点具有重大意义。
黑色素瘤细胞黏附分子又称细胞分化抗原146(Cluster of differentiation 146,CD146)属于免疫球蛋白超家族,是一种约为113 kDa的细胞表面糖蛋白,最早因在人原发性黑色素瘤中高表达而被发现。研究表明,CD146的表达异常还与其他肿瘤有关,如前列腺癌[5]、乳腺癌[6]等。CD146 基因位于人染色体第11号长臂,CD146蛋白结构由胞外区、跨膜区和胞质尾区组成,其中胞质尾区具有蛋白激酶的潜在识别位点,与蛋白激酶结合后可参与信号转导[7]。有研究表明CD146除了是细胞黏附分子,同时也作为血管内皮细胞生长因子受体2(Vascular endothelial growth factor receptor 2,VEGFR2)的共受体,在许多生理和病理性血管生成过程中发挥重要作用[8]。但到目前为止,CD146对视网膜血管内皮细胞的调节作用及其机制尚未完全明了,故本研究旨在探索CD146 在视网膜血管内皮细胞中的作用和机制,为视网膜新生血管相关疾病的临床治疗提供新思路。
1 材料与方法
1.1 实验动物及实验细胞
2021 年1—6 月C57BL/6J孕鼠6 只购于上海维通利华公司。实验动物的饲养遵循温州医科大学动物伦理委员会要求(批号:Wydw-2019-0316)。人视网膜微血管内皮细胞(Human retinal microvascular endothelial cells,HRMEC)购于美国Angio-Proteomie公司。
1.2 实验试剂与仪器
胎牛血清(Fetal bovine serum,FBS)、内皮细胞培养基(Endothelia cell medium,ECM)购于美国Sciencell 公司;0.05%胰酶、转染试剂(LipofectamineTM RNAi MAX Reagent)购于美国Invitrogen公司;体内转染试剂(Polyethylenimine,PEI)购于美国Polyplus transfection公司;小干扰RNA(small interference RNA,siRNA)购于广州锐博生物公司;细胞活力分析试剂购于美国Promega公司;细胞增殖检测试剂盒Click-iT® EdU imaging kits购于美国Invitrogen公司;细胞周期检测试剂盒Cycle test plus购于美国BD公司;Matrigel基质胶购于BD公司;BCA试剂盒购于美国Thermo公司;p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)、磷酸化p38(Phospho-p38 MAPK,P-p38)、Ras同源家族成员A(Ras homolog gene family member A,RHOA)、β-肌动蛋白(β-Actin)抗体购于美国Cell signal technology公司;CD146抗体购于美国Abcam公司;硝酸纤维素膜购于德国GE Healthcare公司。实时定量PCR仪购于美国ABI公司;流式细胞仪购于美国BD公司;SpectraMax M5酶标仪购于美国Molecular Devices公司;激光共聚焦显微镜购于日本蔡司公司;手术显微镜购于德国徕卡公司;动物氧仓、细胞氧仓和氧气监测器均购于Biospherix公司。
1.3 实验方法
1.3.1 细胞培养及细胞缺氧处理 HRMEC培养于含5% FBS、内皮细胞生长因子(Endothelial cell growth supplement,ECGS)、青霉素/链霉素的ECM培养液中,5% CO2、37 ℃培养,90%融合时用0.05%胰酶消化,1:4传代,培养至对数生长期进行后续实验。细胞置于细胞缺氧培养箱,1% O2、5% CO2、37 ℃培养,进行缺氧处理。
1.3.2 siRNA转染 将细胞接种于12 孔板中,待细胞融合50%~60%时,250 μl OPTI-MEM中加入1.5 μl LipofectamineTM RNAi MAX Reagent和5 μl siRNA,室温静置15 min后加入孔板中 。转染12 h后,更换培养基继续培养进行后续实验。为防止脱靶效应,设计2条siRNA链,siRNA的序列为:CD146-1:5'-CCA TCT CCT GGA ACG TCA A-3';CD146-2:5'-GCA CCT CCA CAG AGA GAA A-3'。NC:5'-UUC UCC GAA CGU GUC ACG UTT-3'。
1.3.3 细胞增殖相关实验 细胞活力测定:取96孔板,每孔接种3×103个细胞,siRNA转染培养48 h后,加入细胞活力检测试剂,37 ℃避光孵育2 h,酶标仪490 nm波长测量每孔的吸光度值(Optical density,OD)。细胞增殖实验:细胞转染48 h后用Click-iT®EdU imaging kits试剂对细胞进行免疫荧光染色,检测细胞的增殖情况。细胞周期实验:细胞转染48 h后用0.05%胰酶消化,弃上清,加入Cycle test plus试剂盒中的试剂染色,用细胞流式仪分析细胞周期。以上实验均重复3次。
1.3.4 细胞迁移相关实验 划痕实验:将细胞接种于12孔板,siRNA转染48 h后,用100 μl无菌枪头进行划痕并改用低浓度血清培养基继续培养24 h。显微镜下拍照分别记录0 h和24 h的划痕宽度,计算细胞迁移面积。Transwell实验:siRNA转染细胞48 h后消化并计数,每个transwell小室内接种2.5×104个细胞,24 h后固定、染色,显微镜下拍照记录迁移的细胞数。以上实验重复3次。
1.3.5 血管生成实验 96孔板内每孔加入Matrigel基质胶,置于37 ℃直到基质胶凝固。将siRNA转染后的细胞消化并计数。2×104个细胞每孔加入铺好胶的96孔板,37 ℃、5% CO2培养4~6 h,显微镜下观察血管形成情况,并拍照记录。以上实验重复3次。
1.3.6 OIR模型构建 氧诱导视网膜病变(Oxygen induced retinopathy,OIR)模型是视网膜新生血管相关研究的最常用动物模型,C57BL/6J小鼠出生后第7天(Postnatal 7,P7)连同母鼠一起放入75%±2%O2饲养仓饲养,每日更换母鼠,出生后第12 天(Postnatal 12,P12)放置到常氧环境(21% O2)中继续饲养,在出生后第17天(Postnatal 17,P17)小鼠视网膜新生血管数量达到峰值,取该时期小鼠进行进一步实验。
1.3.7 免疫磁珠法分离小鼠视网膜血管内皮细胞按照本实验室分离的方法[9]进行操作。
1.3.8 免疫荧光染色 OIR小鼠及其正常对照小鼠各4只饲养至P17,取眼球包埋、液氮速冻。冰冻切片机切片后进行固定、通透、封闭。CD146(1:100)和GS-ib4(1:100)4 ℃孵育过夜。荧光二抗室温避光孵育1 h(1:400),PBS清洗二抗,滴上含DAPI的荧光抗淬灭剂,封片。激光共聚焦显微镜下观察拍照。
1.3.9 玻璃体腔注射和视网膜铺片 取P13的OIR小鼠,用PEI配置siRNA后,在手术显微镜下右眼注射siCD146(100 μmol/L)2μl,左眼注射等量无意义小干扰RNA溶液作为对照。小鼠饲养至P17,取眼球,4%多聚甲醛室温固定1 h,体式显微镜下分离视网膜,甲醇通透。PBS清洗后,加入GS-ib4染色剂(1:100),4 ℃避光孵育过夜。PBS清洗后,铺片、封片、荧光显微镜下观察视网膜血管。注射siRNA序列如下:siCD146:5'-CCG AGT TCA TAT CCA GTC A -3';NC:5'-GGC TCT AGA AAA GCC TAT -3'。
1.3.10 Western blot检测蛋白 用含有蛋白酶抑制剂的RIPA裂解液裂解细胞或组织,BCA试剂盒检测蛋白浓度,99 ℃变性。10 μg蛋白上样进行聚丙烯凝胶电泳,300 mA恒流1.5 h转膜至硝酸纤维素膜,5%脱脂牛奶封闭2 h,一抗4 ℃孵育过夜,荧光二抗室温避光孵育1 h,曝光获得目的条带。用Image J软件对条带进行灰度值分析。抗体和稀释倍数如下:CD146(1:1 000)、P-p38(1:1 000)、p38(1:1 000)、RHOA(1:1 000),β-Actin(1:1 000)作为内参。
1.3.11 RNA收集和定量PCR 用Trizol法提取细胞和组织中的RNA,测浓度后,取1 μg RNA进行逆转录合成cDNA,取1 μl cDNA作为模板,加入靶基因上下游引物,用定量PCR仪进行扩增。各引物序列见表1。

表1.引物序列Table 1.Sequences of primers
1.4 统计学方法
实验研究。采用SPSS 20.0统计软件进行分析。各组实验数据符合正态分布且方差齐,以表示。组间数据比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CD146在小鼠视网膜和HRMEC中的表达
P17正常和OIR小鼠的视网膜切片免疫荧光染色结果显示,CD146和视网膜血管共染,见图1A。Western blot结果显示,OIR小鼠视网膜中CD146的蛋白表达是正常小鼠的2倍(t=5.62,P=0.001),见图1B。用免疫磁珠法分离P17 正常和OIR小鼠视网膜的血管内皮细胞,定量PCR结果显示,OIR组小鼠视网膜血管内皮细胞中CD146 mRNA表达水平是正常小鼠的2 倍(t=6.57,P=0.003),见图1C。为了进一步探究缺氧对视网膜血管内皮细胞中CD146 表达的影响,将HRMEC置于1% O2培养箱中培养,Western blot结果显示,缺氧环境中HRMEC上的CD146 表达是正常组的2 倍(t=5.79,P=0.010),见图1D。

图1.CD146在小鼠视网膜和HRMEC中的表达情况A:免疫荧光染色检测CD146 在正常小鼠和OIR小鼠视网膜上的表达,其中红色为视网膜血管GS-ib4染色,绿色为CD146染色,蓝色为DAPI染色细胞核,比例尺:50 μm。B:Western blot检测P17正常小鼠和OIR小鼠视网膜中CD146蛋白的表达,β-Actin作为内参。C:定量PCR检测P17正常小鼠和OIR小鼠视网膜血管内皮细胞中CD146 mRNA的表达情况(n=4;b,与正常小鼠比,P<0.01)。D:缺氧环境下Western blot检测HRMEC中CD146蛋白表达Figure 1.The expression of CD146 in mouse retina and HRMECA: Immunofluorescent staining detected the expression and location of CD146 in retinal sections of OIR and normal mice at P17,red was GS-ib4 stain for vascular,green was CD146 staining,blue was DAPI stain for nucleus,scale bar was 50 μm.B: Western blot assay determined the protein expression of CD146 in OIR and normal mouse retina,β-Actin was used as the internal reference.C: Real-time quantitative PCR detected the mRNA level of CD146 in isolated mouse retinal endothelial cells of OIR and normal mice at P17 (n=4;b,compared with the normal mice,P<0.01).D:Western blot detected the protein expression of CD146 in HRMEC under hypoxic conditions.OIR,oxygen induced retinopathy;CD146,cluster of differentiation 146;HRMEC,human retinal microvascular endothelial cells.
2.2 CD146对HRMEC的活力、增殖、周期的影响
为了防止脱靶效应,设计2条不同的siRNA链(siCD146-1 和siCD146-2)转染细胞,敲减CD146蛋白表达。Western blot和定量PCR结果显示,CD146的表达下降60%以上(siCD146-1:t=5.70,P=0.005;siCD146-2:t=5.92,P=0.004),见图2A—B。MTS、EDU和流式细胞术结果显示:与NC组相比,siCD146-1和siCD146-2的细胞活力(siCD146-1:t=0.09,P=0.931;siCD146-2:t=0.13,P=0.903)、增殖(siCD146-1:t=0.09,P=0.931;siCD146-2:t=0.29,P=0.781)和细胞周期(G1:siCD146-1:t=0.28,P=0.791;siCD146-2:t=0.35,P=0.741。G2:siCD146-1:t=1.87,P=0.134;siCD146-2:t=2.29,P=0.083。S:siCD146-1:t=0.27,P=0.798;siCD146-2:t=0.20,P=0.845)均无明显变化,见图2C—E。

图2.CD146对HRMEC的细胞活力、增殖和细胞周期的影响A:Western blot检测CD146在siRNA转染的HRMEC中的敲减效率。B:定量PCR检测siCD146在HRMEC中的敲减效率;b,与阴性对照组比,P<0.01。C:EDU实验检测siCD146组和NC组中细胞增殖情况,红色为EDU染色,蓝色为DAPI细胞核染色,比例尺:100 μm。D:MTS检测细胞活力。E:流式细胞术检测siCD146组和NC组的细胞周期。G1,DNA合成前期;S,DNA合成期;G2,DNA合成后期Figure 2.The effect of siCD146 on MTS,EDU and the cell cycleA: Western blot assay determined the protein expression of CD146 in HRMEC after CD146 and NC siRNA transfection.B: Real-time quantitative PCR detected the mRNA level of CD146 in siCD146 groups and NC groups.b,compared with the regative control,P<0.01.C: EDU assay detected the ability of HRMEC proliferation,red was EDU stain for proliferating cells,blue was DAPI stain for nucleus,scale bar was 100 μm.D: MTS assay tested HRMEC viability.E: Flow cytometry determined the cell cycle of siCD146 and siNC groups.G1,first gap;S,synthesis;G2,second gap;CD146,cluster of differentiation 146;HRMEC,human retinal microvascular endothelial cells;OD,optical density;NC,negative control.
2.3 CD146对HRMEC迁移和血管形成的影响
划痕实验结果显示,与NC组相比,siCD146转染组细胞的迁移面积明显减少(siCD146-1:t=2.73,P=0.041;siCD146-2:t=4.10,P=0.006),见图3A;迁移特异性实验即Transwell实验进一步显示,与NC组相比,siCD146 转染组迁移到下室的细胞数量明显减少(siCD146-1:t=6.15,P=0.003;siCD146-2:t=3.88,P=0.005),见图3B。血管形成实验结果显示,与NC组相比,siCD146转染组血管形成能力明显减弱(siCD146-1:t=2.81,P=0.048;siCD146-2:t=3.10,P=0.036),见图3C。

图3.CD146对HRMEC迁移和血管形成的影响A:划痕实验检测细胞迁移情况;B:Transwell实验检测细胞迁移情况;C:血管形成实验检测细胞的血管生成能力。比例尺:50 μmFigure 3.The effects of CD146 on the ability of migration and tube formation of HRMECA: Scratch assay tested the effects of CD146 knockdown on HRMEC migration.B: Migratory specific transwell assay further determined the migratory ability in the CD146 siRNA transfected HRMECs.C: The matrigel-based angiogenesis assay tested the effects of CD146 on tube formation.Scale bar was 50 μm.CD146,cluster of differentiation 146;HRMEC,human retinal microvascular endothelial cells;NC,negative control.
2.4 CD146对HRMEC中迁移相关蛋白的影响
CD146 敲减可以明显抑制HRMEC的迁移和血管形成,故本研究采用定量PCR检测迁移及血管生成相关的基因,结果显示VEGF(siCD146-1:t=5.15,P=0.007;siCD146-2:t=5.97,P=0.004)和RHOA(siCD146-1:t=2.95,P=0.042;siCD146-2:t=2.89,P=0.046)的mRNA水平在siCD146 转染组中明显下调,见图4A。Western blot进一步检测蛋白及相关通路蛋白结果显示,与NC 组相比,siCD146转染组中RHOA(siCD146-1:t=3.60,P=0.023;siCD146-2:t=4.12,P=0.015)和P-p38(siCD146-1:t=2.89,P=0.044;siCD146-2:t=3.07,P=0.038)表达均下调,见图4B。
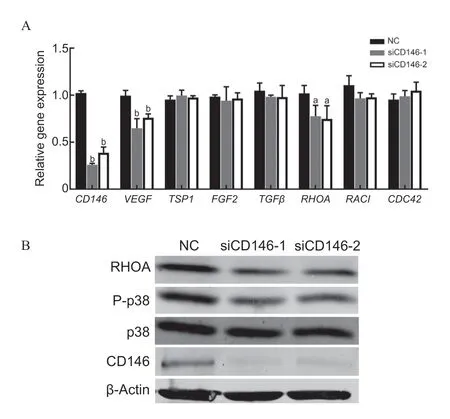
图4.CD146对HRMEC中血管生成和迁移相关蛋白的影响A:定量PCR检测血管内皮细胞迁移、血管生成相关的基因;B:Western blot检测siCD146转染后对HRMEC中RHOA和P-p38蛋白的影响。a,与NC组相比,P<0.05;b,与NC组相比,P<0.01Figure 4.The effects of CD146 on the expression of angiogenesisrelated proteins in HRMECA: Quantitative PCR determined the expression of angiogenesis-related gene.B: Western blot detected RHOA protein,P-p38 protein expression in HRMEC after CD146 and NC siRNA transfection.P-p38,phospho-p38 MAPK;RHOA,ras homolog gene family member A;CD146,cluster of differentiation 146;HRMEC,human retinal microvascular endothelial cells;NC,negative control.a,compared with the control,P<0.05;b,compared with the control,P<0.01.
2.5 玻璃体腔注射siCD146 对小鼠视网膜新生血管的影响
本研究采用小鼠玻璃体腔注射siRNA方法进行视网膜中CD146的敲减。OIR模型制作后,在小鼠P13 对右眼玻璃体腔内注射siCD146,左眼注射无意义小干扰PNA作为对照组NC。定量PCR检测注射效率显示,与左眼相比,右眼中CD146 mRNA表达下调50%(t=7.48,P=0.005),见图5A。视网膜铺片结果显示,siCD146注射组的视网膜新生血管明显减少(t=8.94,P=0.001),无血管区也减少(t=11.24,P=0.001),见图5B。视网膜蛋白Western blot显示,与NC组相比,注射siCD146组中的CD146(t=5.62,P=0.030)、P-p38(t=6.87,P=0.021)、RHOA(t=5.06,P=0.037)表达均下调,见图5C。
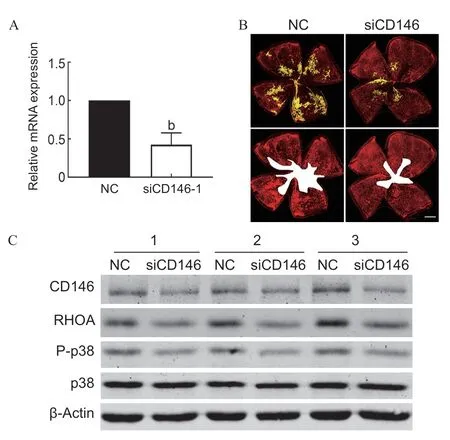
图5.CD146敲减对OIR小鼠视网膜新生血管的影响A:定量PCR检测玻璃体腔注射NC组和CD146 siRNA的效率(n=5,b,与对照组相比,P<0.01);B:玻璃体腔注射siCD146 后,OIR小鼠P17视网膜血管铺片图,比例尺:500 μm;C:Western blot检测视网膜中RHOA、P-p38和p38蛋白的表达Figure 5.CD146 knockdown alleviated OIR retinal neovascularizationA: Quantitative PCR detected the efficiency of vitreous injection of CD146 siRNA (n=5;b,compared with NC,P<0.01).B: Retinal flat-mount images,scale bar was 500 μm.C: Western blot detected RHOA protein,P-p38 and p38 protein expression in the retina.P-p38,phospho-p38 MAPK;RHOA,ras homolog gene family member A;CD146,cluster of differentiation 146;OIR,oxygen induced retinopathy;NC,negative control.
3 讨论
CD146是已知的肿瘤新生血管的重要标记物,在各种肿瘤新生血管的发生、发展中都发挥着重要的作用[10]。本研究发现CD146 在视网膜血管中特异性表达,而在视网膜的其他组织中未见表达,且在视网膜新生血管内皮细胞中的表达升高,提示其参与了视网膜新生血管的发生过程。视网膜血管内皮细胞是新生血管的重要参与者,而缺氧是新生血管的重要诱因[11]。OIR小鼠模型在P7~P12放置于75% O2环境中,之后在正常氧环境中饲养,相对于75% O2是缺氧的环境,从而诱发了视网膜的新生血管,故本研究进一步采用了视网膜血管内皮细胞在1% O2处理来模拟血管内皮细胞的缺氧环境,结果发现在缺氧条件下HRMEC中CD146 表达升高。与本研究结果一致,Abu El-Asra等[12]研究还发现CD146在糖尿病大鼠视网膜中表达明显升高,提示CD146 在缺氧诱导的视网膜新生血管中发挥重要的作用。
本研究进一步发现敲减CD146 可以明显抑制视网膜血管内皮细胞的迁移和血管形成,而对视网膜血管内皮细胞的增殖影响不大。由于在OIR小鼠模型中,同窝小鼠视网膜新生血管情况差异较大,故本研究选择同一小鼠左眼玻璃体腔注射NC siRNA作为对照,右眼注射CD146 siRNA作为观察,减少不同小鼠之间引起的差异。本研究显示,在视网膜中使用体内转染试剂PEI和siRNA一起转染,注射2 μl(100 μmol/L)siCD146,可以明显敲减视网膜中CD146 mRNA和蛋白的表达,并能明显抑制新生血管。而以往研究发现在乳腺癌细胞[13]中敲减CD146可以抑制细胞的增殖和迁移,故推测CD146在视网膜血管内皮细胞中对与增殖相关的基因影响不大,主要通过影响细胞迁移从而影响血管生成。
为了探究CD146 对血管内皮细胞迁移的影响机制,在HRMEC上敲减CD146后检测细胞迁移相关基因,发现VEGFA mRNA、RHOA mRNA和蛋白表达水平都明显下调,而VEGF蛋白没有明显差异。在视网膜中敲减CD146后主要引起Rhoa蛋白表达下调。Rho小G蛋白在血管内皮细胞的骨架重塑、细胞粘附和细胞间连接中都发挥着重要作用,从而调节血管形成。RHOA是其中一员,通过肌动蛋白丝与其运动蛋白非肌动蛋白II的组装诱导应力纤维形成,从而影响细胞的迁移[14]。以往研究发现RHOA参与调控视网膜新生血管的形成,并且抑制RHOA通路在体外可以明显抑制血管生成[15]。本研究在HREMC上敲减CD146,虽然引起VEGF mRNA 水平的稍微下调,但主要是影响RHOA mRNA和蛋白水平的表达。另外,在视网膜中注射siCD146后,主要引起视网膜中RHOA蛋白表达明显下调。RHOA是细胞迁移的重要参与者,故最终能影响新生血管形成。与本研究结果一致,CD146在黑色素瘤细胞[16]和乳腺癌细胞[17]中可以通过激活RHOA促进肿瘤细胞的迁移和侵袭。除此之外,许多信号通路都参与新生血管的生成过程,其中p38 是丝裂原活化蛋白激酶,经外界刺激而激活,引起细胞内蛋白激酶的连锁反应。激活p38信号通路可以引起细胞有丝分裂及细胞迁移[18]。本研究发现在HRMEC和视网膜中敲减CD146后P-p38蛋白表达明显下调,故可以在体内、体外抑制新生血管。利用CD146敲除的小鼠研究发现,CD146缺失的内皮细胞通过抑制p38通路的激活从而抑制细胞的迁移能力和血管生成能力[19]。
综上所述,敲减视网膜血管内皮细胞上CD146可以通过抑制RHOA/p38信号轴,来进一步抑制血管的迁移从而减少视网膜新生血管的形成,提示CD146 可以作为临床上治疗视网膜新生血管的新靶点,为临床治疗视网膜新生血管相关疾病提供新的理论依据和策略。
利益冲突申明本研究无任何利益冲突
作者贡献声明林永:参与收集数据,参与选题、设计及资料的分析和解释,撰写论文;根据编辑部的修改意见进行修改。杨汝森:参与收集数据和实施研究,撰写论文;根据编辑部的修改意见进行修改。闫东升、陈晓燕:参与选题、设计及资料的分析和解释;撰写论文;修改论文中关键性结果、结论,根据编辑部的修改意见进行修改。吕帆:指导课题设计,修改论文;根据编辑部的修改意见进行修改

