枸杞实时荧光定量RT-qPCR内参基因筛选与验证
李浩霞 黄稳娥 柳西宁 朱馨蕾 任晓月 安巍 周军 赵建华


摘要:以9种不同基因型枸杞的不同组织(茎、叶、花、果)和不同发育期(FS1~FS5)的果实为试材,选取Act-1/Act-3、Ef1a、Gapdh、H3b、Acx4、Pp2a、Rh37、Samc、Tub为候选内参基因,利用实时荧光定量技术(RT-qPCR)检测了9个候选基因在不同基因型枸杞的不同组织和不同发育阶段果实中的表达水平。并采用geNorm、NormFinder、BestKeeper、Delta Ct、RefFinder分析方法,评估候选内参基因的表达稳定性,并选择Beat基因验证内参基因。结果表明,Ef1a为不同基因型枸杞的不同组织和5个发育时期果实中表达较稳定的内参基因,Gapdh为表达最不稳定的内参基因;在宁夏枸杞中表达最稳定的内参基因为Rh37,其次为Ef1a。进一步采用Beat基因对不同基因型枸杞的不同组织(茎、叶、花、果)和5个发育时期果实中的表达模式进行验证,表明Ef1a、Act-1基因可作为枸杞稳定的内参基因。
关键词:枸杞;内参基因;实时荧光定量PCR;定量分析
中图分类号:S567.1+90.1 文献标志码:A 文章编号:1002-1302(2023)09-0041-11
基金项目:国家自然科学基金(编号:32060359);宁夏自然科学创新群体基金(编号:2021AAC01001);宁夏回族自治区重点研发计划(编号:2021BEF02002);宁夏经济林遗传改良创新团队项目(编号:2022QCXTD04)。
作者简介:李浩霞(1977—),女,甘肃景泰人,副研究员,主要从事旱作农业和栽培生理研究。E-mail:lihaoxia0943@163.com。
通信作者:赵建华,博士,副研究员,主要从事林木遗传改良与功能基因组学研究。E-mail:zhaojianhua0943@163.com。
枸杞(Lycium)是茄科(Solanaceae)枸杞属(Lycium Linn.)多年生植物,具有抗旱、抗寒、耐盐碱等特性,是改良土壤的先锋树种[1-3]。我国枸杞资源较为丰富。近年来,宁夏农林科学院收集有国内外枸杞属10个种、3个变种以及特异性种质资源 2 000 余份,活体保存20 000余株[4-5]。宁夏枸杞(Lycium barbarum L.)是我國药典收录的唯一枸杞属植物[6]。研究表明,枸杞多糖、甜菜碱、类胡萝卜素、黄酮等是枸杞子中重要的功效物质,具有促进免疫、降低血糖、抗氧化、延缓衰老等生物活性[7-9]。近年来从枸杞子中分离鉴定出枸杞亚精胺A-O,是一种具有抗阿尔茨海默病、抗氧化、抗衰老和神经保护作用的生物活性成分[10-12]。目前,枸杞的研究报道主要集中于栽培育种、资源化利用、营养活性成分研究[13]、生理及药理作用[7-9]和逆境条件下的响应机制[14-15]等方面。在功能基因组层面上的研究较少,仅有少量枸杞基因功能和基因表达模式分析的报道。关于枸杞内参基因筛选的报道的研究材料多用黑果和宁杞1号[16-18]。目前尚未见有关不同基因型枸杞内参基因筛选的报道。
实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)技术是在PCR反应体系中加入荧光作为荧光探针,实时监测PCR反应进程荧光信号积累,并通过制作标准曲线计算待测样本相对表达量的一种技术[19]。它具有灵敏度高、重复性好、可检测大量样本且比常规RT-PCR检出率高等优势[20-21],广泛应用于基因表达水平的分析。但在试验操作过程中,RNA的质量和浓度、cDNA的逆转录过程、PCR的扩增程序和条件等都会影响定量结果[22]。通常需要选取好的内参基因,为目标基因的表达量提供科学参照标准。在植物的RT-qPCR分析中,内参基因包括肌动蛋白基因Actin(Act-1/Act-3)、18S核糖(18S rRNA)、3-磷酸甘油醛脱氢酶基因(GAPDH)、转录延伸因子基因(Ef1a)、多聚泛素酶基因(UBQ)、α微管和β微管蛋白基因(TUA、TUB)、 组蛋白H3b基因(H3b)、4-酰基辅酶A过氧化物酶基因(Acx4)、丝氨酸/苏氨酸蛋白磷酸酶基因(Pp2a)、DEAD-box RNA解旋酶基因(Rh37)、S-腺苷甲硫氨酸合酶基因(Samc)以及亲环蛋白基因(CYP) 等[16-18,23]。在植物内参基因的研究中,内参基因在不同材料、组织、发育时期和试验条件下的表达稳定性存在差异。在小麦中,内参基因Ef1a表达稳定性较好[24]。但在番茄的叶片和根组织中却发现,Ef1a的表达量表现出高度的可变性[25]。赵艺蕊等以山核桃的不同组织及不同试验处理为研究对象,发现山核桃不同组织和处理间的最适内参基因存在差异[26]。张芷睿等利用实时荧光定量PCR技术对大豆不同发育时期的18个组织样本进行内参基因研究,发现出苗期、第1张三叶期、始花期、初荚期的内参基因各不相同[27]。周琳等在彩色马蹄莲的不同品种和组织中也发现最适内参基因是不同的[28]。杨阳等则发现,在不同发育阶段和逆境条件下筛选出的多花黄精块茎的适宜内参基因存在差异[29]。因此,对于不同植物材料和组织,需根据具体的试验要求,对内参基因进行稳定性筛选和验证,以确保试验结果的可靠性。
本研究以9个不同基因型枸杞为试验材料,选取Act-1/Act-3、Ef1a、Gapdh、H3b、Acx4、Pp2a、Rh37、Samc、Tub共9个候选内参基因,以枸杞的不同组织和果实的不同发育阶段为测试样本,分析这些基因的表达稳定性,并通过分析影响枸杞花香主要物质——乙酸苄酯合成的苯甲醇乙酰基转移酶(Acetyl-CoA:benzylalcohol acetyltransferase,BEAT)基因[30]的表达量,进一步验证9个内参基因的稳定性。
1 材料与方法
1.1 材料
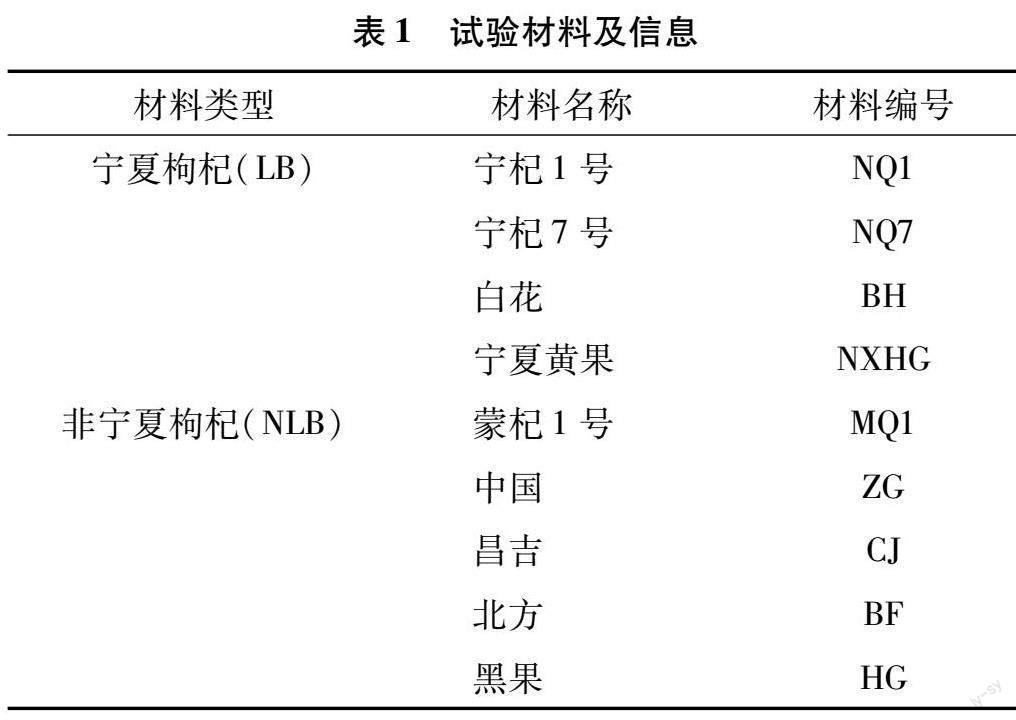
1.1.1 供试枸杞品种及信息 供试枸杞的品种为宁杞1号、宁杞7号、北方、宁夏黄果、黑果、中国、昌吉、蒙杞1号、白花,均来自宁夏农林科学院枸杞科学研究所国家枸杞种质资源圃(38°380′N,106°9′E,海拔1 100 m),树龄8年,于2021年6—7月盛果期,每个品种分别选取3棵无性植株的新枝茎(S)、叶片(L)、未开放或刚开放的花(F)及5个发育阶段(FS1~FS5)的果实,采集样品后速冻于-80 ℃的液氮中,材料信息详见表1。果实5个发育阶段分别为开花后9~12 d(FS1)、14~19 d(FS2)、20~26 d(FS3)、30~37 d(FS4)、34~45 d(FS5)。
1.2.1 仪器设备与试剂 离心机,Centrifuge 5424,德国艾本德股份公司;荧光定量PCR仪,CFX96TM Real-Time System C1000 TouchTM Thermal Cycler,美国 Bio-Rad 公司;超微量紫外可见分光光度计,NanoPhotometer N60 Mobile,Implen公司; 超低温冰箱,DW-HL340,中科美菱低温科技股份有限公司;電泳仪,DYY-11型,北京六一生物科技有限公司;凝胶成像仪,Gel DocxR+,美国Bio-Rad公司;多糖多酚植物总RNA提取试剂盒,50次,天根生化科技(北京)有限公司;乙醇,500 ml,徐州天鸿化工贸易有限公司;巯基乙醇,100 mL,上海士锋生物科技有限公司;Prime-ScriptTM RT reagent Kit with gDNA Eraser (perfect real time)反转录试剂,100次,日本TaKaRa公司;2×Quanti Nova SYBR Green PCR Master Mix,2 500次,凯杰企业管理(上海)有限公司;ddH2O,100 mL。
1.2 方法
1.2.1 枸杞总RNA提取及cDNA合成 采用多糖多酚植物总RNA提取试剂盒分别提取不同基因型枸杞茎、叶、花、果实的5个不同发育阶段的RNA,用1%琼脂糖凝胶电泳检测RNA的完整性,超微量紫外可见分光光度计检测RNA的浓度和纯度,用反转录试剂盒将RNA反转录成cDNA,cDNA于 -20 ℃ 冰箱保存备用。
1.2.2 内参基因的选择及qRT-PCR引物设计 从枸杞转录组数据库中筛选候选内参基因(表2),用Primer Premier 5.0设计候选内参基因的 qRT-PCR 引物,引物由生工生物工程(上海)股份有限公司合成。经PCR扩增后,初步选出9个相对稳定的候选内参基因。其中Actin基因设计2对引物,在实时荧光定量中,通过熔解曲线判断引物的特异性,若熔解曲线为单峰则说明引物特异性好。通过构建标准曲线来计算各引物的扩增效率(E)以及线性相关系数(r)。
1.2.3 qRT-PCR反应条件 在CFX96TMReal-Time System C1000 TouchTM Thermal Cycler荧光定量PCR仪上进行反应。RT-qPCR反应体系(20 μL):2×QuantiNova SYBR Green PCR Master Mix 10 μL、cDNA 5 μL、正向和反向引物(10 μmol/L)各1 μL,ddH2O补足至20 μL。反应程序:95 ℃ 2 min;95 ℃ 30 s,55 ℃ 20 s,72 ℃ 2 min,共40个循环;最后 65 ℃ 开始以0.5 ℃每步升温至95 ℃。枸杞茎、叶、花、果实的5个发育时期,各设3个生物学重复。
1.2.4 引物特异性和扩增效率分析 将等量混匀的所有组织样品的cDNA原液稀释10倍,共设置7个浓度梯度,即100、10-1、10-2、10-3、10-4、10-5、10-6,测定RT-qPCR的标准曲线。程序运行完成后计算扩增效率(E)和线性相关系数r。取2 μL PCR产物,用2%琼脂糖凝胶电泳检测,结合PCR反应后的熔解曲线图确定引物的特异性。
1.2.5 候选内参基因的稳定性评价 利用Microsoft Excel、Origin Pro 8.5软件对获得的原始CT值进行统计与处理。使用geNorm、NormFinder、BestKeeper、Microsoft Excel中的Delta CT方法评估9个候选内参基因的稳定性。geNorm算法确定每个基因的表达稳定性值(M),具有较低M值的候选内参基因具有更稳定的表达[31]。NormFinder使用基于模型的方法来估计候选内参基因表达的变化,为每个候选内参基因分配一个稳定性值,因此具有较低值的候选内参基因更稳定[32]。BestKeeper根据原始数据(CT值)计算候选内参基因的标准偏差(SD),SD值越低被认为越稳定[33]。Delta-CT方法通过两两比较计算平均SD值;较低的SD值表示基因较稳定[34]。最后,RefFinder是一种基于网络的综合算法,用于评估和筛选候选内参基因,它集成了4个计算程序(geNorm、NormFinder、BestKeeper、Delta-CT)对候选内参基因进行排序。基于每个项目的排名,它为单个基因分配适当的权重,并计算其权重的几何平均值,以进行总体最终排名[35]。
1.2.6 选定内参基因的稳定性验证 选择Beat基因评估内参基因。使用表2中的引物Beat-F、Beat-R 扩增Beat基因全长,克隆到pMD18-T载体(TaKaRa,D101A),测序,再确认并提交给GenBank(OM275425)。在各种组织中测量基因表达,并通过最佳内参基因(Ef1a、Act-1)和最不稳定内参基因(Acx4、Gapdh)进行标准化。qRT-PCR数据使用2-ΔΔCT方法[36]。
2 结果与分析
2.1 总RNA质量
提取不同基因型枸杞不同发育阶段和不同组织(茎、叶、花、果)的RNA,用1%琼脂糖凝胶电泳检测RNA完整性,用超微量紫外可见分光光度计检测RNA的浓度和纯度。各样品RNA在28S、18S、5S处有单一且明亮清晰的条带,可见RNA的完整性较好。超微量紫外可见分光光度计检测结果显示,各样品RNA的D260 nm/280 nm为1.8~2.1,说明各样品RNA纯度较高,满足后续试验要求。
2.2 候选内参基因引物特异性和扩增效率分析
PCR检测引物特异性,候选内参基因均在90~250 bp扩增出与预期一致的单一条带。经RT-qPCR检测,候选内参基因均能产生单一的熔解峰(图1)。用标准曲线法计算候选内参基因的扩增效率(E),各候选内参基因的E在91.27%~103.85%之间,线性相关系数r>0.99(表2)。结果表明所筛选的引物特异性及扩增效率均良好,可进行下一步的RT-qPCR试验。
2.3 候选内参基因CT值分析
CT值是PCR扩增过程中扩增产物的荧光信号达到设定阈值时经过的扩增周期数[33]。CT值可反映候选内参基因的表达丰度,CT值越小,基因表达丰度越高,反之亦然。从9个候选内参基因在不同基因型枸杞的不同組织、不同发育阶段、宁夏枸杞、非宁夏枸杞及总样本中的CT值箱线图(图2)可知:Act-1、Ef1a、H3b、Tub的CT值较小,Gapdh-1、Acx4的CT值较大。从分布范围上来看,Act-1、Ef1a、H3b、Tub分布较集中,Gapdh-1、Acx4分布较分散;从表达水平来看,Act-1、Ef1a、H3b、Tub的表达水平波动范围窄,Gapdh-1、Acx4波动范围宽。因此可初步判断Act-1、Ef1a、H3b、Tub的表达水平较其他基因更稳定,可作为候选内参基因。
2.4 候选内参基因表达稳定性分析
2.4.1 比较Delta CT Delta CT分析结果显示,候选内参基因在不同基因型枸杞不同组织(图3-A)和不同发育阶段(图3-B)中表达稳定的基因分别为Ef1a、Act-1,不稳定的基因分别为Acx4、Gapdh。在宁夏枸杞中基因表达稳定性有所不同,即Rh37最为稳定,其次为Ef1a;Gapdh稳定性最差(图3-C)。在非宁夏枸杞中表达最稳定的基因为Ef1a,其次为H3b;Acx4稳定性最差,其次为Gapdh(图3-D)。
2.4.2 geNorm分析 利用geNorm程序,计算基因的表达稳定值(M),并依据M值对基因的表达稳定性进行排序,结果表明,各候选基因稳定性在不同基因型枸杞的不同组织(图3-E)、不同发育阶段(图3-F)以及宁夏、非宁夏枸杞(图3-G、图3-H)中,Ef1a基因表达稳定性均表现最优,而表达稳定性最差的基因分别为Gapdh、Axc4。
2.4.3 NormFinder分析 NormFinder根据表达稳定值(expression stability value,M)衡量基因表达稳定性,M值越小,基因的表达稳定性越好。NormFinder分析结果表明,各候选基因稳定性在不同基因型枸杞的不同组织(图3-I)、果实不同发育阶段(图3-J)以及非宁夏枸杞(图3-K)中,表达稳定性最好的基因分别为Ef1a、Act-1。表达稳定性最差的基因分别为Gapdh、Axc4。而在宁夏枸杞中表达最稳定的基因为Rh37,其次为H3b;Gapdh稳定性最差(图3-L)。
2.4.4 BestKeeper分析 采用BestKeeper软件分析内参基因CT的标准偏差(SD),且SD值越小,内参基因表达稳定性越好,结果见表3。不同基因型枸杞不同发育时期和不同组织中,内参基因Act-3、Gapdh-1、Acx4、Samc的SD值变动大(SD>1),而内参基因Act-1、Ef1a、H3b、Pp2a、Rh37、Tub的SD值均小于1,且Rh37、Ef1a的SD值较小,说明这2个基因的稳定性较好。
2.4.5 RefFinder内参基因稳定性综合排名分析 RefFinder分析结果如表4所示,对于不同基因型枸杞不同组织和非宁夏枸杞而言,Ef1a、Act-1的综合排名为第一、第二。而在宁夏枸杞中,综合排名第一的是Rh37,Ef1a次之,表明内参基因Rh37、Ef1a对于宁夏枸杞而言是最合适的。在枸杞果实的不同发育阶段,综合排名第一的是Ef1a,Rh37次之。说明对于不同基因型枸杞,枸杞的不同组织及枸杞果实的不同发育时期,稳定表达的内参基因并不相同。
2.5 内参基因稳定性验证
以Beat为目的基因,分别选取2个稳定内参基因Ef1a、Act-1,2个不稳定的基因Acx4、Gapdh,进行荧光定量试验。以Ef1a、Act-1作为内参时,Beat基因在不同基因型枸杞不同组织中的表达量如图4-A、B所示。Beat在枸杞的花和叶中表达量较高,在果实中的表达量最低,且在宁夏枸杞中的表达量显著高于在非宁夏枸杞中的表达量,非宁夏枸杞样品内部之间也存在显著差异(P<0.05)。以Acx4作为内参时(图4-C),宁夏枸杞和非宁夏枸杞之间仍然具有显著性差异(P<0.05),但是非宁夏枸杞内部中国、昌吉、黑果之间的差异未到达显著水平。以Gapdh作为内参时(图4-D),宁夏枸杞花中表达量最高,但是非宁夏枸杞组织中的表达变化趋势变化不一,且发现宁夏枸杞和非宁夏枸杞之间没达到显著差异。
以Ef1a、Act-1作为内参时,计算Beat基因在不同基因型枸杞不同发育阶段的表达量。Beat基因在不同发育阶段表达变化模式较为相似(图5-A、图5-B), 在FS1中表达呈最高,FS2表达量相对较低,FS3~FS5之间表达量没有明显差异且表达量最低,不同基因型枸杞间在相同发育阶段内存在明显差异。当以Acx4作为内参时(图5-C),不同发育阶段表达变化模式不同于稳定性较高的Ef1a、Act-1 作为内参的表达量,材料间差异性明显降低。当以Gapdh作为内参时(图5-D),不同发育阶段的差异显著水平同样也降低,且在FS3~FS5阶段,宁夏枸杞的表达量明显低于非宁夏枸杞的表达量。可见,以稳定性较高的基因作内参基因,目的基因变化趋势基本一致或偏差较小;反之,以稳定性较低的基因作内参基因,会造成目的基因表达水平存在较大差异或偏差。进一步验证了筛选出的Ef1a、Act-1基因作为内参基因的稳定性。
3 結果与讨论
随着RT-qPCR技术的广泛应用,内参基因的稳定性已成为定量试验结果准确性的关键影响因子[31,37],选择合适的内参基因来减少RT-qPCR试验中误差造成的影响是非常有必要的。内参基因稳定性评价常用的软件有geNorm、NormFinder、BestKeeper、RefFinder综合分析等[38-39],能够快速系统地分析评价内参基因的稳定性。
本研究对比分析了Act、Ef1a、Gapdh、H3b、Acx4、Pp2a、Rh37、Samc、Tub等9个常用的内参基因在不同基因型枸杞不同发育阶段、不同组织中的表达水平。其中Act基因使用了2种不同的荧光定量引物。事实上,笔者所在课题组参考已发表枸杞内参基因文献[16-18]设计了所有的可用内参基因引物作为候选,但并非所有内参基因在不同基因型枸杞的不同组织部位中均能获得比较好的扩增条带,最终只选取了本研究所述的10对引物进行候选基因的扩增。另外,使用Wang等设计的HSP80引物[17]扩增后,扩增序列比对结果为Acx4,因此笔者所在课题组对其引物及PCR产物进行了重新命名。
本研究以9个不同基因型的枸杞果实不同发育阶段和不同组织为材料,选用9个候选内参基因,利用geNorm、NormFinder、BestKeeper、RefFinder 软件分析这9个基因在不同发育时期和不同组织中的表达稳定性。利用上述4种软件筛选出枸杞植物中稳定表达的内参基因Ef1a、Act-1,不稳定表达的内参基因Gapdh、Acx4。肌动蛋白Actin是高度保守的蛋白质,参与各种类型的细胞运动,并在所有真核细胞中广泛表达,在细胞形态建成、生长发育中起着重要作用[40]。Actin基因在绿豆的不同品种和部位中是最合适的内参基因之一[32],在显齿蛇葡萄的不同组织中表达稳定性较好的内参基因也是Actin[41],这与本研究的结果一致。Ef1a在蛋白质生物合成过程中促进氨基酰基tRNA与核糖体A位点的GTP依赖性结合。Gapdh参与光合还原戊糖磷酸途径(Calvin-Benson循环),催化NADPH还原 1,3-二磷酸甘油酯[33]。Ef1a基因在花椰菜的不同组织处理下表达最为稳定,Ef1a基因在甜瓜不同组织器官及不同胁迫条件下均可稳定表达,也是较为合适的内参基因[42],这也与本试验的结果一致。齐香玉等以茉莉花的5种组织和4个发育阶段的花为试验材料,选择较常见的8个候选内参基因进行引物特异性分析,发现不同发育期花的最适内参基因为Actin、Ef1α[43],这与本研究结果相同。此外,本研究发现针对所有样本最稳定的内参基因是Ef1a、Act-1;但是单独对宁夏枸杞内参基因稳定性进行分析时,得到最稳定的内参基因为Rh37,其次为Ef1a。这就说明对于不同基因型枸杞,内参基因表达也有一定的差异。
虽然利用基因稳定性分析软件筛选获得了稳定表达的内参基因,但不能确保所筛选出的内参基因的稳定性,还需利用目的基因对内参基因的表达稳定性进行验证,才能得出可靠的试验结果。因此,通过Beat目的基因进一步验证了基因的稳定性。
本研究结果还表明,内参基因的选择会影响试验结论。选择不适合的内参基因可能会导致错误的结果,最终导致错误的目的基因表达模式。当选取稳定或不稳定的内参基因进行试验时,Beat基因在各种组织中表现出不一致的表达模式。综上所述,本研究拟为不同基因型枸杞中基因表达的定量分析提供稳定的内参基因,拟为不同基因型枸杞功能基因组学的研究提供强有力的技术支撑。
参考文献:
[1]惠红霞,许 兴,李前荣. NaCl胁迫对枸杞叶片甜菜碱、叶绿素荧光及叶绿素含量的影响[J]. 干旱地区农业研究,2004,22(3):109-114.
[2]Chang R C C,So K F. Use of anti-aging herbal medicine,Lycium barbarum,against aging-associated diseases.what do we know so far?[J]. Cellular and Molecular Neurobiology,2008,28(5):643-652.
[3]Zhao J H,Li H X,Zhang C Z,et al. Physiological response of four wolfberry (Lycium Linn.) species under drought stress[J]. Journal of Integrative Agriculture,2018,17(3):603-612.
[4]王益民,张宝琳. 我国枸杞属物种资源及发展对策[J]. 世界林业研究,2021,34(3):107-111.
[5]安 巍,赵建华,尹 跃,等. 枸杞种质资源研究现状及发展方向[J]. 宁夏农林科技,2019,60(9):49-50,99.
[6]国家药典委员会. 中华人民共和国药典-四部[M]. 2015版. 北京:中国医药科技出版社,2015.
[7]Potterat O. Goji (Lycium barbarum and L. chinense):phytochemistry,pharmacology and safety in the perspective of traditional uses and recent popularity[J]. Planta Medica,2010,76(1):7-19.
[8]Zhou Z Q,Fan H X,He R R,et al. Lycibarbarspermidines A-O,new dicaffeoylspermidine derivatives from wolfberry,with activities against alzheimers disease and oxidation[J]. Journal of Agricultural and Food Chemistry,2016,64(11):2223-2237.
[9]Gao Y J,Wei Y F,Wang Y Q,et al. Lycium barbarum:a traditional Chinese herb and a promising anti-aging agent[J]. Aging and Disease,2017,8(6):778-791.
[10]Gao K,Ma D W,Cheng Y,et al. Three new dimers and two monomers of phenolic amides from the fruits of Lycium barbarum and their antioxidant activities[J]. Journal of Agricultural and Food Chemistry,2015,63(4):1067-1075.
[11]Ho Y S,So K F,Chang R C C. Anti-aging herbal medicine-how and why can they be used in aging-associated neurodegenerative diseases?[J]. Ageing Research Reviews,2010,9(3):354-362.
[12]Yu M S,Lai C S W,Ho Y S,et al. Characterization of the effects of anti-aging medicine Fructus lycii on beta-amyloid peptide neurotoxicity[J]. International Journal of Molecular Medicine,2007,20(2):261-268.
[13]杨云峰,王光明,侯祥英,等. 我国枸杞育种与栽培研究进展[J]. 农业科技通讯,2019(8):72-74.
[14]Hu J,Hu X K,Zhang H W,et al. Moderate NaCl alleviates osmotic stress in Lycium ruthenicum[J]. Plant Growth Regulation,2022,96(1):25-35.
[15]Lin S,Zeng S H,Biao A,et al. Integrative analysis of transcriptome and metabolome reveals salt stress orchestrating the accumulation of specialized metabolites in Lycium barbarum L.fruit[J]. International Journal of Molecular Sciences,2021,22(9):4414.
[16]Gong L,Yang Y J,Chen Y C,et al. LbCML38 and LbRH52,two reference genes derived from RNA-Seq data suitable for assessing gene expression in Lycium barbarum L.[J]. Scientific Reports,2016,6:37031.
[17]Wang L J,Wang Y C,Zhou P. Validation of reference genes for quantitative real-time PCR during Chinese wolfberry fruit development[J]. Plant Physiology and Biochemistry,2013,70:304-310.
[18]Zeng S H,Liu Y L,Wu M,et al. Identification and validation of reference genes for quantitative real-time PCR normalization and its applications in lycium[J]. PLoS One,2014,9(5):e97039.
[19]陳 旭,齐凤坤,康立功,等. 实时荧光定量PCR技术研究进展及其应用[J]. 东北农业大学学报,2010,41(8):148-155.
[20]Garson J A,Grant P R,Ayliffe U,et al. Real-time PCR quantitation of hepatitis B virus DNA using automated sample preparation and murine cytomegalovirus internal control[J]. Journal of Virological Methods,2005,126(1/2):207-213.
[21]Ginzinger D G. Gene quantification using real-time quantitative PCR:an emerging technology hits the mainstream[J]. Experimental Hematology,2002,30(6):503-512.
[22]Taylor S C,Nadeau K,Abbasi M,et al. The ultimate qPCR experiment:producing publication quality,reproducible data the first time[J]. Trends in Biotechnology,2019,37(7):761-774.
[23]袁 伟,万红建,杨悦俭. 植物实时荧光定量PCR内参基因的特点及选择[J]. 植物学报,2012,47(4):427-436.
[24]Long X Y,Wang J R,Ouellet T,et al. Genome-wide identification and evaluation of novel internal control genes for Q-PCR based transcript normalization in wheat[J]. Plant Molecular Biology,2010,74(3):307-311.
[25]Mascia T,Santovito E,Gallitelli D,et al. Evaluation of reference genes for quantitative reverse-transcription polymerase chain reaction normalization in infected tomato plants[J]. Molecular Plant Pathology,2010,11(6):805-816.
[26]赵艺蕊,黄春颖,王克涛,等. 山核桃实时荧光定量PCR分析中内参基因的筛选与验证[J]. 果树学报,2022,39(1):10-21.
[27]张芷睿,张耀华,王秋实,等. 大豆实时荧光定量PCR内参基因的筛选与验证[J]. 植物生理学报,2020,56(9):1963-1973.
[28]周 琳,张永春,蔡友铭,等. 彩色马蹄莲不同品种和组织qRT-PCR内参基因筛选[J]. 分子植物育种,2020,18(12):3971-3979.
[29]杨 阳,叶碧欢,宋其岩,等. 多花黄精块茎发育和胁迫条件下qPCR内参基因的筛选与验证[J]. 中国中药杂志,2020,45(24):5967-5975.
[30]张 瑜. 蜡梅花香相关基因BEAT的克隆和功能初步探究[D]. 武汉:华中农业大学,2018.
[31]Vandesompele J,de Preter K,Pattyn F,et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology,2002,3(7):RESEARCH0034.
[32]Andersen C L,Jensen J L,rntoft T F. Normalization of real-time quantitative reverse transcription-PCR data:a model-based variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer data sets[J]. Cancer Research,2004,64(15):5245-5250.
[33]Pfaffl M W,Tichopad A,Prgomet C,et al. Determination of stable housekeeping genes,differentially regulated target genes and sample integrity:BestKeeper-Excel-based tool using pair-wise correlations[J]. Biotechnology Letters,2004,26(6):509-515.
[34]Silver N,Best S,Jiang J,et al. Selection of housekeeping genes for gene expression studies in human reticulocytes using real-time PCR[J]. BMC Molecular Biology,2006,7(1):1-9.
[35]Xie F L,Xiao P,Chen D L,et al. miRDeepFinder:a miRNA analysis tool for deep sequencing of plant small RNAs[J]. Plant Molecular Biology,2012,80(1):75-84.
[36]Schmittgen T D,Livak K J. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols,2008,3(6):1101-1108.
[37]Citri A,Pang Z P,Südhof T C,et al. Comprehensive qPCR profiling of gene expression in single neuronal cells[J]. Nature Protocols,2012,7(1):118-127.
[38]Zhang Y,Yang J P,Dai R H,et al. Stability evaluation of candidate reference genes for RT-qPCR normalization in Lasioderma serricorne (F.)[J]. Journal of Stored Products Research,2021,94:101877.
[39]Liu Y P,Zhang Y,Liu F,et al. Establishment of reference (Housekeeping) Genes Via Quantitative Real-time PCR for Investigation of the Genomic Basis of Abiotic Stress Resistance in Psammochloa Villosa (Poaceae)[J]. Journal of Plant Physiology,2022,268:153575.
[40]錢 猛,杨 娜,朱昌华,等. 绿豆实时荧光定量PCR内参基因的筛选与验证[J]. 植物生理学报,2021,57(11):2203-2212.
[41]许 明,伊恒杰,赵 帅,等. 显齿蛇葡萄实时荧光定量PCR内参基因的筛选与验证[J]. 中草药,2017,48(6):1192-1198.
[42]章丽珍,韩晓云,吴菁华,等. 甜瓜实时荧光定量PCR分析中内参基因的筛选[J]. 福建农业学报,2020,35(11):1179-1187.
[43]齐香玉,陈双双,冯 景,等. 茉莉花实时荧光定量PCR内参基因的筛选与验证[J]. 华北农学报,2020,35(6):22-30.

