外源褪黑素对UV-B辐射下马铃薯苗期叶片抗氧化物和过氧化氢的影响
刘莹 万丽墙 海梅荣
摘要:UV-B辐射会对植物造成伤害,降低作物的产量和品质,褪黑素可以增强植物的抗逆性。为明确褪黑素在UV-B辐射下对马铃薯的影响,试验共设置4个辐射强度[太阳光自然照射及2.5、5.0、7.5 kJ/(m2·d),分别记为CK、B1、B2、B3]以及6个褪黑素浓度(0、25、50、100、150、200 μmol/L),选用马铃薯品种合作88,进行为期15 d的处理。研究发现:UV-B辐射增强后,马铃薯植株高度降低,进行褪黑素处理后有所提高,提高幅度最大为7.65%,即B3条件下,施加100 μmol/L的褪黑素。施加褪黑素后可以在一定范围内进一步升高抗坏血酸(AsA)的含量,升高幅度最大约为成倍增加,即在B1条件下施加25 μmol/L褪黑素。施加褪黑素后也可以在一定范围内进一步升高谷胱甘肽(GSH)的含量,升高程度可达30.43%,即在B1条件下,施加50 μmol/L褪黑素。随着辐射的增强,类黄酮含量呈上升趋势,在B3条件下,类黄酮含量最高,与在CK条件下各褪黑素浓度相比分别增加61.41%、63.44%、64.86%、64.86%、65.78%、65.78%。在一定范围内,褪黑素能使脯氨酸(Pro)含量进一步升高,升高程度可达13.93%,即在B3条件下,施加100 μmol/L褪黑素。施加褪黑素,在一定的范围内可以使H2O2含量降低,降低的最大幅度为18.06%,即在B2条件下施加50 μmol/L的褪黑素。褪黑素可促进抗坏血酸、谷胱甘肽和类黄酮等抗氧化物质含量增加,说明褪黑素可以保护细胞膜免受损伤,提高马铃薯植株的抗氧化能力,同时外源褪黑素可以增加内源褪黑素的含量。
关键词:马铃薯;UV-B辐射;褪黑素;抗氧化物;过氧化氢
中图分类号:S532.01 文献标志码:A 文章编号:1002-1302(2023)09-0060-08
基金项目:科研发展基金(编号:KX900078000)。
作者简介:刘 莹(1999—),女,新疆喀什人,硕士研究生,主要从事作物生理生态与产量品质形成研究。E-mail:1430441802@qq.com。
通信作者:海梅荣,博士,教授,硕士生导师,主要从事作物生产生理研究。E-mail:2250029499@qq.com 。
褪黑素(N-乙酰基-5-甲氧基色胺,melatonin)是一种吲哚胺类激素,具有使用量少且高效的特点。它同时也是一种潜在的自由基清除剂和抗氧化剂,能够消除植物体内的活性氧。通过级联反应,每一个褪黑素分子可以消除约10个自由基,而传统的抗氧化物质,比如维生素C、维生素E、谷胱甘肽等,通常只能清除1个自由基[1]。因此,和传统的抗氧化物质相比,褪黑素作为抗氧化剂具有更强的抗氧化能力[2]。研究发现,褪黑素能够提高植株对UV-B辐射的耐受性。王英利等通过对UV-B辐射下的绿豆添加一定浓度的外源褪黑素,发现其降低了绿豆的氧化应激反应,可见褪黑素是植株中的一种保护性抗氧化剂[3]。马征通过拟南芥褪黑素响应UV-B胁迫的试验发现,拟南芥体内褪黑素含量的增加可以提高植株对UV-B辐射的感知,并提高植株对UV-B辐射的抗性[4]。张来军等利用单细胞凝胶电泳的方法,检测了UV-B輻射后添加外源褪黑素的秦艽原生质体,结果表明褪黑素可降低由 UV-B 辐射诱导的植物原生质体的 DNA 损伤程度,并促进DNA损伤的修复,对植物原生质体有明显的保护作用[5]。此外,褪黑素还可以调节植物器官的生长发育,对下胚轴的伸长[6]、侧根及不定根的形成[7]、腋芽及不定芽的形成[8-9]、调控开花[10-11]、种子萌发等抗逆过程都起着重要作用[12]。
自1984年南极臭氧空洞的发现震撼了全球开始,有关UV-B辐射变化及其对全球生物的作用就开始受到重视,而根据最近数十年的观测资料分析,由于工业生产的发展以及人类的活动所造成的氟氯烃、氮氧化物等臭氧耗损物质,不断渗入地球平流层从而造成环境中臭氧下降,使到达地球地表的UV-B辐射更多[13]。据预测,未来70年,全球大气臭氧浓度将会不断减少,减少程度在2%~10%,而到达地球表面的UV-B辐射则会不断上升,增加量为4%~20%[14]。研究表明,UV-B辐射会对植物的核酸、蛋白质、表型、光合作用、生理代谢产生直接或间接的危害[15],会使植株叶面积减少、蒸腾作用下降致使光合受阻,进而导致植株矮化、发育迟缓从而影响生长,最终使植物产量减少、作物品质下降,严重危害整个植株的生态系统[16-19],从而造成生产上严重的经济损失。
目前,更多的人开始认识到褪黑素的积极影响,在植株发育、种子萌发、蔬菜成熟与老化、生态胁迫以及非生物胁迫等领域都有广泛应用,但在马铃薯的实际应用上则大多是关于晚疫病的研究,有学者认为褪黑素能有效控制马铃薯晚疫病的产生,其最主要原因就是由于褪黑素使马铃薯晚疫病病菌丝的增殖过程遭到了抑制,使细菌的超微管结构被改变,削弱了细菌的抗逆功能,进而明显降低了马铃薯晚疫病的发生[20-21]。但是,褪黑素对 UV-B 辐射下马铃薯生长发育及叶片抗氧化物的影响却鲜有报道。因此,本研究采用不同浓度的褪黑素对不同UV-B辐射下马铃薯幼苗进行处理,并测定植株高度、抗坏血酸(AsA)、谷胱甘肽(GSH)、脯氨酸(Pro)、类黄酮、过氧化氢(H2O2)以及内源褪黑素含量的变化规律,拟探究UV-B辐射下褪黑素对马铃薯的作用机制,为UV-B辐射下褪黑素增强马铃薯植株耐受性提供科学依据。
1 材料与方法
1.1 试验地及试验品种
试验于2020年5—9月进行。在云南省昆明市云南农业大学后山大棚(102°45′E、25°08′N)进行盆栽试验,该地海拔1 966 m,平均温度15.1 ℃,年平均蒸发量为175.1 mm。在西南生物多样性实验室(云南省昆明市盘龙区茨坝青松路19号)进行相关生理指标测定。试验材料为马铃薯品种:合作88。
1.2 试验设计
待马铃薯幼苗生长至15 cm左右进行处理。试验共设置6个褪黑素浓度(0、25、50、100、150、200 μmol/L)、4个辐射强度[太阳光自然照射及2.5、5.0、7.5 kJ/(m2·d),分别记为CK、B1、B2、B3],UV-B辐射选用波长范围为290~320 nm的紫外灯,辐射剂量由VLX-3W紫外辐射计测量,标准带宽为295~395 nm,中心波长为312 nm。试验共24个处理,每个处理3个重复。为确保在全部辐射期间维持同样的辐射剂量,及时调整灯管距离植株的高度以及定时旋转花盆角度。对照组的植株上部设置一个空灯架,以保证非辐射期间对照组和处理组之间所接受的自然光照相同。除阴雨天不进行辐射处理外,其余时间每天10:00—15:00进行5 h处理。处理15 d后取马铃薯幼苗倒三叶进行相关指标的测定。
1.3 测定指标及方法
1.3.1 株高的测定 使用长卷尺测量马铃薯植株底部至冠层高度,每个处理测量6次,取平均值。
1.3.2 抗氧化物质、胁迫性物质含量测定 测定指标包括抗坏血酸(AsA)、谷胱甘肽(GSH)、类黄酮、脯氨酸(Pro)、过氧化氢(H2O2)含量。上述指标均使用苏州格锐思生物技术有限公司的试剂盒,利用紫外光度法进行测定。
1.3.3 内源褪黑素含量的测定 将不同处理的马铃薯挑选倒三叶进行采样,每个处理3次重复,用灭菌后的剪刀进行采摘。采摘后的叶片迅速装入贴好标签的无菌离心管放入液氮中,而后放在-80 ℃冰箱中储存。送样时将样品放在充满干冰的泡沫盒中送往苏州格瑞斯生物科技有限公司进行检测。
1.4 数据统计与分析
试验中所得数据采用SPSS 19.0软件进行统计学分析,用单因素方差分析法(one-way ANOVA)分析不同处理间的显著差异(α=0.05)。用Excel 2016软件作图。
2 结果与分析
2.1 外源褪黑素对UV-B辐射下马铃薯生长发育的影响
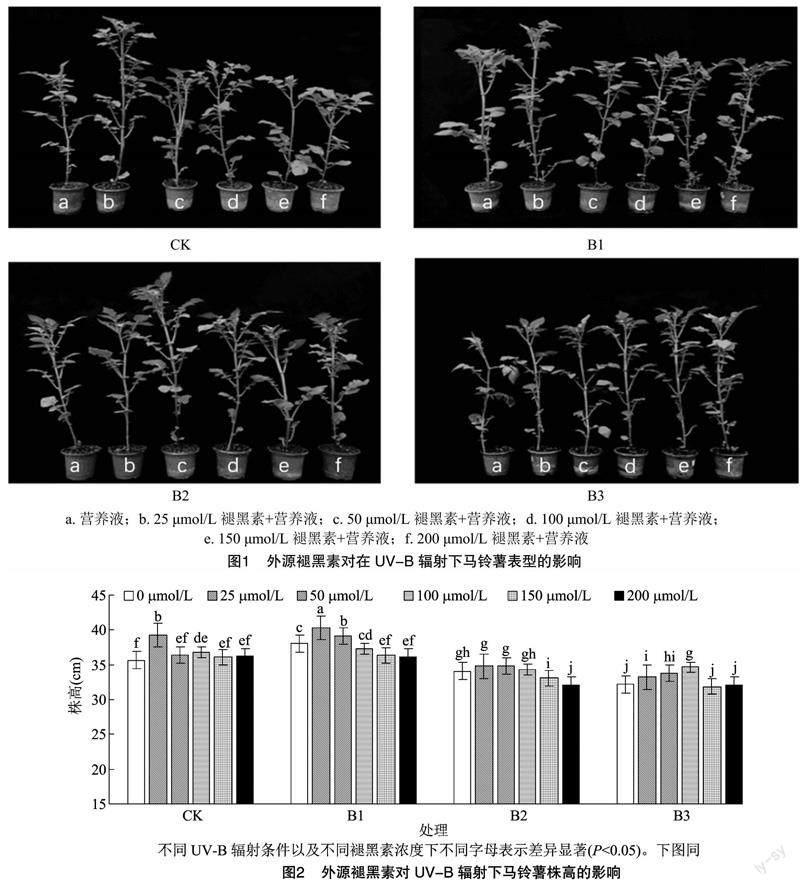
由图1可知,在CK和B1条件下施加褪黑素对马铃薯表型的影响主要体现在株高上,B2和B3条件下未施加褪黑素的马铃薯植株其茎发生了一定程度上的弯曲,这可能是为了减少UV-B辐射而采取的适应性行为,B3条件下所有的马铃薯植株叶片相较于其他3个处理都出现了一定程度的卷缩,且叶片较小。
由图2可知,UV-B辐射增强后,马铃薯植株高度整体先升高后降低,进行褪黑素处理后又进一步提高,提高幅度最大为7.65%,即B3条件下,施加 100 μmol/L 的褪黑素处理;在B1条件下,当施加 25 μmol/L 褪黑素时,马铃薯株高最高,在同等条件下较不施加褪黑素处理增加5.97%;B2条件
下,施加50 μmol/L褪黑素处理株高最高,较不施加褪黑素处理相比增加2.05%;而B1条件下,0、25、50、100、150 μmol/L褪黑素浓度处理下的株高均高于其余条件下相同褪黑素处理的马铃薯植株,较B3条件下褪黑素浓度0、25、50、150 μmol/L以及B2条件下褪黑素浓度100 μmol/L处理下的株高依次提高18.22%、21.39%、15.87%、14.12%、8.75%。在没有UV-B辐射的CK条件下,施用褪黑素也可使马铃薯的株高提升,施加25 μmol/L褪黑素处理马铃薯株高最高,在同等条件下较不施加褪黑素增加10.22%。
2.2 外源褪黑素對UV-B辐射下马铃薯抗氧化物质含量的影响
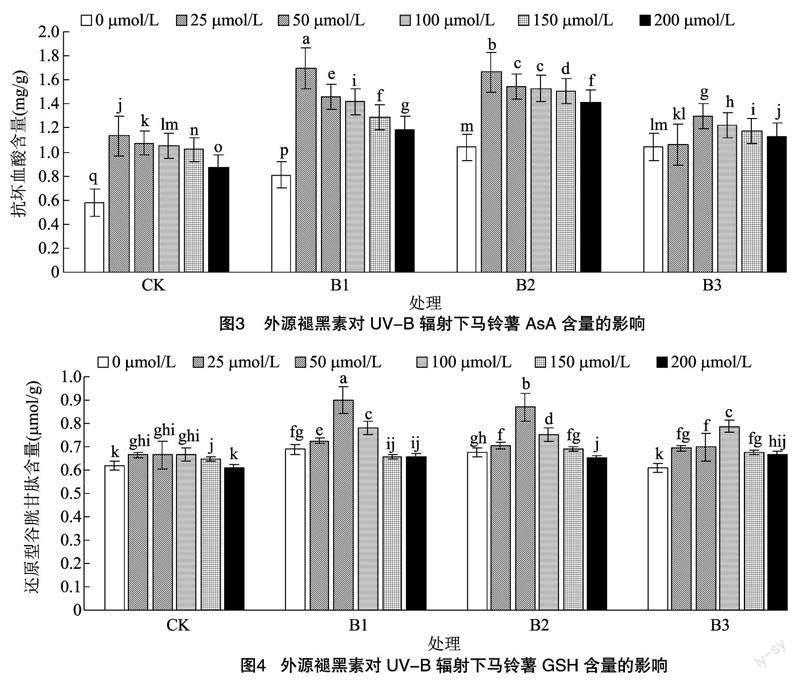
由图3可知,UV-B辐射可使马铃薯植株中抗坏血酸含量先升高后降低,施加褪黑素后可以进一步升高抗坏血酸含量,但过高的褪黑素浓度处理也会起到反作用。在相同UV-B辐射不同褪黑素浓度条件处理下的结果显示:在CK、B1和B2条件下,施加25 μmol/L褪黑素处理时AsA含量最高,CK、B2条件下与不施加褪黑素相比分别增加94.83%、59.62%,B1条件下则约成倍增加;在B3条件下施加50 μmol/L褪黑素处理AsA含量最高,较不施加褪黑素处理增加25.00%。
由图4可以看出,马铃薯在受到UV-B辐射后,其叶片中的还原型谷胱甘肽含量与抗坏血酸含量表现相同,整体呈先上升后下降趋势,在施加相应浓度的褪黑素后可以使其含量进一步上升。在同样的UV-B辐射条件和不同的褪黑素浓度下进行分析:在CK条件下,25、50、100 μmol/L褪黑素处理GSH含量最高,三者之间没有显著差异;B1和B2条件下,施用褪黑素的最优浓度均为 50 μmol/L,在同等条件下较不施加褪黑素处理分别提高30.43%、27.94%;在B3条件下,施用褪黑素的最优浓度为100 μmol/L,同等条件下较不施加褪黑素处理增加29.51%。在相同褪黑素浓度但 UV-B 辐射不同的情况下进行分析则发现:不施加褪黑素、施加25、50 μmol/L褪黑素处理,均是B1条件下的GSH含量最高;在施加100、200 μmol/L褪黑素时,均为B3条件下的GSH含量最高;在施加150 μmol/L褪黑素时,B2条件下的GSH含量最高;综合2种处理条件,在B1条件下,施加50 μmol/L褪黑素时,马铃薯叶片中的GSH含量最高。
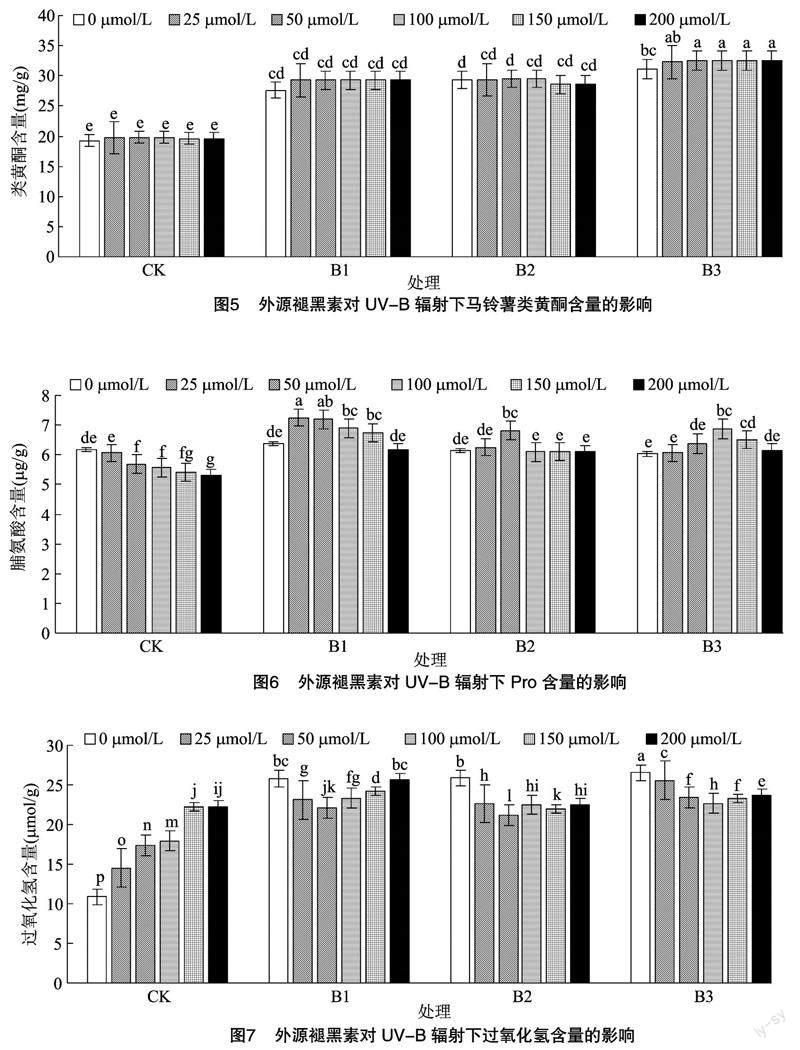
由图5可知,随着UV-B辐射强度的增加,类黄酮含量呈上升趋势。在B3条件下,类黄酮含量最高,与在CK条件各褪黑素处理相比分别增加61.41%、63.44%、64.86%、64.86%、65.78%、65.78%,不同浓度褪黑素处理对其影响差异不明显。
由图6可知,UV-B辐射会使马铃薯中脯氨酸含量整体先升高后降低,施加褪黑素后能使其含量进一步升高,但过高的褪黑素浓度也会使脯氨酸含量降低。在CK条件下,不施加褪黑素时Pro含量最大;在B1条件下,施加褪黑素的最优浓度为 25 μmol/L,同等条件下较不施加褪黑素处理提高13.81%;在B2条件下,施用褪黑素的最优浓度为50 μmol/L,同等条件下较不施加褪黑素处理提高11.07%;在B3条件下,施用褪黑素的最优浓度为100 μmol/L,同等条件下较不施加褪黑素处理提高13.93%。在相同褪黑素浓度不同UV-B辐射处理下的结果显示,B1辐射条件无论哪个褪黑素浓度马铃薯叶片中Pro含量均最高,较CK处理分别增加3.41%、19.44%、26.36%、23.88%、25.00%、16.23%。
2.3 外源褪黑素对UV-B辐射下马铃薯胁迫性物质含量的影响
由图7可知,UV-B辐射会使马铃薯植株的过氧化氢含量升高,而应用褪黑素后可以降低其含量,但过高的褪黑素浓度也会增加过氧化氢的含量。在同样的UV-B辐射但褪黑素浓度不相同的条件下结果显示:在B1和B2条件下,施用褪黑素的最优浓度为50 μmol/L,同等条件下较不施加褪黑素处理分别降低14.15%、18.06%;在B3条件下,施用褪黑素的最优浓度为100 μmol/L,同等条件下较不施加褪黑素处理降低14.65%。而在相同褪黑素含量不同UV-B辐射条件下,5个褪黑素浓度下(0、25、50、100、200 μmol/L)都是CK条件下的马铃薯叶片中的H2O2含量低于其他UV-B辐射条件下的H2O2含量。
2.4 外源施加褪黑素对UV-B辐射下内源褪黑素含量的影响
由图8可知,随着UV-B辐射的增强会使马铃薯叶片中内源褪黑素浓度先升高后下降,而在 UV-B 辐射下施加外源褪黑素,则会在一定范围内
使内源褪黑素含量升高,超过此范围后过高的外源褪黑素浓度会对其起到抑制作用。在相同的 UV-B 輻射不同褪黑素浓度处理下进行分析:在CK、B1、B2条件下,施加50 μmol/L外源褪黑素时内源褪黑素含量最高,同等条件下较不施加褪黑素分别提高38.79%、41.73%、51.82%;在B3条件下施加100 μmol/L外源褪黑素浓度时内源褪黑素含量最大,在同等条件下与不施加褪黑素相比提高40.19%。在相同褪黑素浓度和不同UV-B辐射处理条件下进行分析:不施加外源褪黑素时,B1条件下马铃薯叶片中的内源褪黑素含量要大于其他 UV-B 辐射条件下的含量;在施加25、50、100、150 μmol/L 外源褪黑素的情况下,均是B1条件下的内源褪黑素含量最高,与CK条件下各对应褪黑素浓度相比分别提高43.90%、11.80%、16.23%、7.35%;在施加200 μmol/L外源褪黑素的情况下,B2条件下的内源褪黑素含量最大,较CK条件增加5.22%。综合2种处理条件,在B1条件下,施加 50 μmol/L 褪黑素浓度时,马铃薯叶片中的内源褪黑素含量最高。
3 讨论
3.1 外源褪黑素对UV-B辐射下马铃薯生长发育的影响
植物会调节自身的适应性保护机制去应对各种胁迫。植物在表型上应对增强UV-B辐射的保护机制体现在缩短节间、降低株高、卷曲叶片、减小叶面积等,研究表明,长时间强烈的UV-B辐射会抑制植物的株高[22-23]。本试验研究发现,在不施用外源褪黑素的情况下,和正常光照组相比,B2、B3处理组的UV-B辐射会使马铃薯植株高度显著下降,无论有无UV-B辐射在对马铃薯施加不同浓度的褪黑素后,植株高度均呈现先升高后下降的趋势。这就意味着,在UV-B辐射的情况下施加适量褪黑素可以增加植株的高度,但是高浓度的褪黑素也会使马铃薯株高下降,本试验中在2.5 kJ/(m2·d)的UV-B辐射下施加25 μmol/L褪黑素时马铃薯植株最高。试验发现在5.0、7.5 kJ/(m2·d)的 UV-B 辐射下马铃薯植株的叶片发生了一定程度的卷缩,且叶片较小,茎也发生了一定程度的弯曲,这可能是马铃薯植株为减少UV-B辐射所产生的形态上的变化。
3.2 外源褪黑素对UV-B辐射下马铃薯抗氧化物质、胁迫物质和内源褪黑素含量的影响
UV-B辐射不但能使植物的表型产生变化,而且还会使植株自身形成过多的自由基,这些自由基会攻击植株的DNA、核酸、蛋白质等,从而造成植株光合速率降低,损伤细胞膜结构[24],使作物品质和产量受到严重影响,严重时导致作物的死亡。针对UV-B辐射,植株主要采取防护和修复2个方法实施自我保护,防护主要是指植物的表皮细胞、表皮毛、蜡质体等对UV-B辐射进行阻挡、吸附和反射[25],修复主要指通过酶和非酶系统清除自由基。
非酶反应的防护系统大多为较低分子量的抗氧化物,如抗坏血酸、谷胱甘肽、类黄酮等。抗坏血酸可以直接与羟基自由基、超氧化物和单价氧反应,可以保护质膜免于氧化损伤,并触发分子响应机制,有研究表明,当进行UV-B辐射时植物的抗坏血酸含量会增加[16]。谷胱甘肽是含硫化合物,其在植物防御氧化伤害中起着一定的作用。同时,植物在受到UV-B辐射诱导时,由于在类黄酮化合物结构的3位点处有一个羟基基团能够和金属螯合,可以有效控制活性氧自由基产生累积,此时类黄酮的合成基因会在叶绿素、细胞壁、腺体等部位积累,从而使植物有效地吸收并且清除自由基[26];虽然类黄酮能够清除自由基,但不同植物、不同品种和UV-B不同辐射强度均会使类黄酮的清除能力有所不同,同时清除能力不以相同速率和比例增加[27]。脯氨酸也是植物机体内重要的渗透调节物质,它除了能通过提高细胞的渗透势来维持细胞的水分平衡外,还具有维持生物膜、稳定蛋白质结构、碳和氮储存以及平衡胁迫下植物氧化与还原状态的功能[28],从而改善植株对逆境的抵抗能力。前人的研究已经证实,对植物叶片施用脯氨酸会减少叶片中MDA和H2O2的含量,从而提高抗氧化酶活力,增加植物叶片中光合色素含量和叶片相对含水量,从而提高植物的抗逆性[29]。
在本试验中抗坏血酸、谷胱甘肽和类黄酮在一定范围内随着UV-B辐射的增强其含量都有所升高,说明增强UV-B辐射会激起马铃薯植株合成抗氧化物质进行自我保护,在施加外源褪黑素后,抗坏血酸和谷胱甘肽的含量进一步增加,说明褪黑素有利于提高马铃薯植株的抗氧化能力,而类黄酮在施加外源褪黑素后变化不显著,表明类黄酮主要受UV-B辐射的影响。当在CK、B1、B2条件下褪黑素浓度超过25 μmol/L,B3条件下褪黑素浓度超过50 μmol/L时抗坏血酸含量开始下降;在B1、B2条件下褪黑素浓度超过50 μmol/L,CK、B3条件下褪黑素浓度超过100 μmol/L时谷胱甘肽含量开始降低。脯氨酸在无UV-B辐射条件下施加褪黑素后其含量降低,在UV-B辐射下施加褪黑素后脯氨酸含量先上升后下降,在B1条件下超过25 μmol/L、B2条件下褪黑素浓度超过50 μmol/L、在B3条件下褪黑素浓度大于100 μmol/L时脯氨酸含量降低。表明在UV-B辐射条件下褪黑素可以通过提高抗氧化物质的含量来提高马铃薯植株的抗性,但高浓度的褪黑素也会对马铃薯植株带来胁迫。
过氧化氢是植株在正常生理代谢中形成的主要副产物,它参与植株的一般生长发育过程,是植株胁迫应答中的关键信号分子,高浓度的过氧化氢会对细胞产生损伤[30]。在本试验中,过氧化氢含量在CK条件下施加褪黑素后升高了,这可能说明褪黑素对没有UV-B辐射的植物有一定的胁迫作用;在UV-B辐射下施用褪黑素,过氧化氢含量先降低后升高,在B2条件下施加50 μmol/L褪黑素浓度时马铃薯叶片中的过氧化氢含量最低。上述结果表明,在UV-B辐射下施加适量浓度的外源褪黑素可以减轻马铃薯幼苗细胞膜系统所受到的破坏。
褪黑素是植物体内很强大的抗氧化剂,其抗氧化功能明显优于抗坏血酸、生育酚、谷胱甘肽等抗氧化剂,它不但有助于消除羰基自由基、羟基自由基等活性氧自由基,而且有助于激活植物抗氧化酶的活性及其生物合成能力,进而实现增强植物细胞抗氧化的目的,以减少环境胁迫及生物胁迫对高等植物所造成的损伤,从而提高植物的抗逆性[31-32]。研究表明,外源褪黑素可在一定程度上增加马铃薯植株内源褪黑素的含量,产生这一变化的原因可能是马铃薯幼苗吸收了外源褪黑素,也有可能是外源褪黑素刺激了内源褪黑素的合成。
4 结论
4.1 外源褪黑素对UV-B辐射下马铃薯生长发育的影响
褪黑素可以减轻UV-B辐射对马铃薯的伤害,但其浓度过高时也会造成损伤,因此施加褪黑素应该适量。适量施加褪黑素有利于提高植株的高度,本试验中在2.5 kJ/(m2·d)的UV-B辐射下施加25 μmol/L褪黑素浓度时马铃薯植株最高,试验中还发现马铃薯植株自身会通过弯曲茎秆等形态上的变化来减少UV-B辐射对其自身的伤害。
4.2 外源褪黑素对UV-B辐射下马铃薯抗氧化物质、胁迫物质和内源褪黑素含量的影响
试验中发现在UV-B辐射的胁迫下马铃薯过氧化氢含量升高,通过施加外源褪黑素后能使其含量降低,这表明褪黑素在保护细胞膜免受损伤方面发挥作用;抗坏血酸、谷胱甘肽、类黄酮等抗氧化物质含量的升高说明施加外源褪黑素有利于马铃薯合成抗氧化物质进行自我保护;本试验还发现施加外源褪黑素也会使内源褪黑素含量在一定程度上升高。
參考文献:
[1]Galano A,Tan D X,Reiter R J. Melatonin as a natural ally against oxidative stress:a physicochemical examination[J]. Journal of Pineal Research,2011,51(1):1-16.
[2]Negi G,Kumar A,Sharma S S. Melatonin modulates neuroinflammation and oxidative stress in experimental diabetic neuropathy:effects on NF-κB and Nrf2 cascades[J]. Journal of Pineal Research,2011,50(2):124-131.
[3]王英利,王英娟,郝建国,等. 褪黑素对绿豆在增强UV-B辐射下的防护作用[J]. 光子学报,2009,38(10):2629-2633.
[4]马 征. 拟南芥褪黑素响应UV-B胁迫的功能和其合成酶表达研究[D]. 西安:西北大学,2019.
[5]张来军,贾敬芬,梅 康,等. 褪黑素对秦艽原生质体抗UV-B环境胁迫的作用[J]. 核农学报,2015,29(5):830-835.
[6]Hernández-Ruiz J,Cano A,Arnao M B.Melatonin:a growth-stimulating compound present in lupin tissues[J]. Planta,2004,220(1):140-144.
[7]Pelagio-Flores R,Muoz-Parra E,Ortiz-Castro R,et al. Melatonin regulates Arabidopsis root system architecture likely acting independently of auxin signaling[J]. Journal of Pineal Research,2012,53(3):279-288.
[8]Murch S J,Campbell S S B,Saxena P K.The role of serotonin and melatonin in plant morphogenesis:regulation of auxin-induced root organogenesis in in vitro-cultured explants of st.Johns Wort (Hypericum perforatum L.)[J]. In Vitro Cellular & Developmental Biology-Plant,2001,37(6):786-793.
[9]Litwińczuk W,Wadas-Boroń M.Development of highbush blueberry (Vaccinium corymbosum) in vitro shoot cultures under the influence of melatonin[J]. Acta Scientiarum Polonorum-Hortorum Cultus,2009,8:3-12.
[10]Kolá rˇ J,Johnson C H,Machá cˇková I. Exogenously applied melatonin (N-acetyl-5-methoxytryptamine) affects flowering of the short-day plant Chenopodium rubrum[J]. Physiologia Plantarum,2003,118(4):605-612.
[11]Wolf K,Kolá rˇ J A N,Witters E,et al. Daily profile of melatonin levels in Chenopodium rubrum L. depends on photoperiod[J]. Journal of Plant Physiology,2001,158(11):1491-1493.
[12]Lei Q,Wang L,Tan D X,et al. Identification of genes for melatonin synthetic enzymes in ‘Red Fuji apple (Malus domestica Borkh.cv.Red) and their expression and melatonin production during fruit development[J]. Journal of Pineal Research,2013,55(4):443-451.
[13]韓 艳. UV-B增强下施钾对花生生长、产量和品质影响及模拟[D]. 南京:南京信息工程大学,2018.
[14]Caldwell M M. Solar UV irradiation and the growth and development of higher plants[M]//Photophysiology.Amsterdam:Elsevier,1971:131-177.
[15]周 璇. 增强UV-B辐射对两种沙棘幼苗抗氧化及光合特性的影响[D]. 兰州:西北师范大学,2019.
[16]褚 润,陈年来,韩国君,等. 三种UV-B辐射强度下香蒲的生长和抗氧化状况[J]. 湿地科学,2020,18(1):32-39.
[17]刘 英,于雪莹,于莉莉,等. UV-B辐射下不同树龄杜仲叶片光合及部分生理特性的变化[J]. 东北林业大学学报,2020,48(6):42-46,50.
[18]涂 云,杨正聪,权佳锋,等. UV-B辐射强度对烟苗生长及抗氧化酶的影响[J]. 贵州农业科学,2019,47(4):13-18.
[19]娄运生,张 震,武 君. UV-B增强对作物生产影响的研究回顾与展望[J]. 农业环境科学学报,2020,39(4):812-821.
[20]Zhang S M,Zheng X Z,Reiter R J,et al. Melatonin attenuates potato late blight by disrupting cell growth,stress tolerance,fungicide susceptibility and homeostasis of gene expression in Phytophthora infestans[J]. Frontiers in Plant Science,2017,8:1993.
[21]张蜀敏. 新型致病疫霉抑菌剂的筛选及抑菌机制研究[D]. 重庆:重庆大学,2018.
[22]吕志伟,冯 青,吕艳伟,等. 140个冬小麦品种(系)对UV-B辐射的响应[J]. 麦类作物学报,2017,37(6):841-845.
[23]Lv Z W,Zhang X S,Liu L K,et al. Comparing intraspecific responses of 12 winter wheat cultivars to different doses of ultraviolet-B radiation[J]. Journal of Photochemistry and Photobiology B:Biology,2013,119:1-8.
[24]Pereira D T,Pereira B,Fonseca A,et al. Effects of ultraviolet radiation (UV-A+UV-B) on the antioxidant metabolism of the red macroalga species Acanthophora spicifera (rhodophyta,ceramiales) from different salinity and nutrient conditions[J]. Photochemistry and Photobiology,2019,95(4):999-1009.
[25]Takahama U,Oniki T. Flavonoids and some other phenolics as substrates of peroxidase:physiological significance of the redox reactions[J]. Journal of Plant Research,2000,113(3):301-309.
[26]Huarancca Reyes T,Scartazza A,Castagna A,et al. Physiological effects of short acute UVB treatments in Chenopodium quinoa Willd[J]. Scientific Reports,2018,8(1):371.
[27]刘建新,欧晓彬,王金成,等. 镉胁迫下裸燕麦幼苗对外源H2O2的生理响应[J]. 草业学报,2020,29(1):125-134.
[28]Liu C C,Liu Y G,Guo K,et al. Effect of drought on pigments,osmotic adjustment and antioxidant enzymes in six woody plant species in Karst habitats of southwestern China[J]. Environmental and Experimental Botany,2011,71(2):174-183.
[29]Ghaffari H,Tadayon M R,Nadeem M,et al. Proline-mediated changes in antioxidant enzymatic activities and the physiology of sugar beet under drought stress[J]. Acta Physiologiae Plantarum,2019,41(2):23.
[30]Maach M,Baghour M,Akodad M,et al. Overexpression of LeNHX4 improved yield,fruit quality and salt tolerance in tomato plants (Solanum lycopersicum L.)[J]. Molecular Biology Reports,2020,47(6):4145-4153.
[31]郭爱华. 外源褪黑素对盐胁迫下苦菜幼苗生长的影响[J]. 江苏农业科学,2022,50(13):153-157.
[32]刘 珂,张嘉欣,杜清洁,等. 外源褪黑素对盐胁迫下香椿种子萌发及幼苗生长的影响[J]. 中国瓜菜,2020,33(5):53-58.

