嗜酸性肉芽肿性多血管炎肾受累的临床分析
李 杰 张 隽 王 晶 华 琳 张黎明*
(1.首都医科大学附属北京朝阳医院-北京市呼吸病研究所 呼吸与危重症医学科,北京 100043;2.首都医科大学生物医学工程学院智能医学工程学学系,北京 100069)
嗜酸性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis, EGPA)是一种少见的系统性坏死性血管炎,病变主要累及中小血管,疾病具有潜在的致命风险。30%~40%的EGPA患者抗中性粒细胞胞质抗体(antineutrophil cytoplasmic antibody, ANCA)阳性,以核周型抗中性粒细胞胞质抗体(perinuclear-ANCA,p-ANCA)和髓过氧化酶抗中性粒细胞抗体(myeloperoxidase-ANCA,MPO-ANCA)为主。EGPA与肉芽肿性血管炎(granulomatosis with polyangiitis, GPA)、显微镜下多血管炎(microscopic polyangiitis, MPA)一同被归为ANCA相关性血管炎(ANCA-associated vasculitis, AAV)[1]。与GPA和MPA相比,EGPA的临床特征是以成人起病的难治性哮喘、周围神经病变和显著的外周血嗜酸性粒细胞增多为主,肾受累并不是EGPA患者的主要表现[2],因此,EGPA的肾受累常常被临床医生所忽视[3]。另外,慢性肾病(chronic kidney disease, CKD)由于患病率高、知晓率低、预后差和医疗费用高等特点,已成为除心脑血管疾病、糖尿病和恶性肿瘤外,又一严重危害人类健康的疾病[4],因此,针对EGPA患者这一CKD高危人群进行肾病筛查具有重要意义。本文回顾性分析了2005年5月至2021年12月在首都医科大学附属北京朝阳医院收治的EGPA住院患者的临床资料,总结患者肾受累的临床特征及其预后。
1 对象与方法
1.1 研究对象
纳入2005年5月至2021年12月首都医科大学附属北京朝阳医院收治的104例确诊EGPA患者为研究对象。纳入标准:所有入选患者均符合1990年美国风湿病学会(American College of Rheumatology, ACR)制定的EGPA诊断标准[5]。排除标准:①真菌致敏引起的严重哮喘及变应性支气管肺曲霉菌病;②合并类风湿关节炎、干燥综合征及系统性红斑狼疮等结缔组织病;③合并寄生虫、真菌、结核菌、人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染及病毒性肝炎;病历资料不全的患者。本研究得到全部研究对象及家属知情同意。本研究利用的研究信息不含有使受试者的身份被直接识别或通过与其相关的识别物识别的信息,免除伦理审查。
1.2 资料收集
收集EGPA患者基本信息、病史、症状、体征、血嗜酸性粒细胞计数、尿沉渣检测、ANCA检测、肾受累相关检验结果:包括蛋白尿、镜下血尿、肾功能等,以及肾病并发症可能会出现的贫血等资料,其中ANCA检测同时采用间接免疫荧光法和酶联免疫吸附法两种方法测定。
1.3 肾受累定义
根据指南[4]标准:①蛋白尿:每日尿蛋白量>150 mg。②镜下血尿:每高倍镜视野>3个红细胞。③利用慢性肾病流行病学合作研究公式(chronic kidney disease epidemiology collaboration,CKD-EPI)计算肾小球滤过率(estimated glomerular filtration rate,eGFR)[6],肾小球滤过率下降:eGFR <80 mL/(min·1.73 m2);CKD:eGFR <60 mL/(min·1.73 m2),持续3个月以上。
1.4 统计学方法

2 结果
2.1 EGPA患者临床特征
符合入选标准的共有104例患者,其中男性55例,女性49例,确诊时中位年龄为56(46,65)岁,42例(40.4%)患者年龄≥60岁,27例(26.0%)患者年龄≥65岁。随访91例患者,平均随访中位时间41(19,59)个月。104例EGPA患者中,27例(26.0%)患者有高血压病、7例(6.7%)患者有糖尿病。99例(95.2%)有哮喘症状,74例(60.5%)有周围神经病变,28例(26.9%)有皮肤病变,27例(26.0%)有消化道受累,50例(48.1%)患者有心脏受累。
104例患者中,20例患者(19.2%)ANCA阳性。ANCA阳性组患者出现全身症状、咯血、周围神经病变、中枢神经病变、血尿、肾功能不全的比例明显高于ANCA阴性组,两组间差异有统计学意义(P<0.05)。104例患者的平均eGFR为(91.06±29.44) mL/(min·1.73 m2),ANCA阳性组eGFR为(74.78±39.33)mL/(min·1.73 m2),ANCA阴性组eGFR为94.94±25.34 mL/(min·1.73 m2),两组之间比较统计学差异显著(χ2=2.847,P=0.005)。59例(56.7%)患者有肾受累,30例(28.8%)患者尿潜血阳性,11例(10.6%)患者有蛋白尿,38例(36.5%)患者eGFR<80 mL/(min·1.73 m2),11例(10.6%)患者eGFR<60 mL/(min·1.73 m2)(表1)。
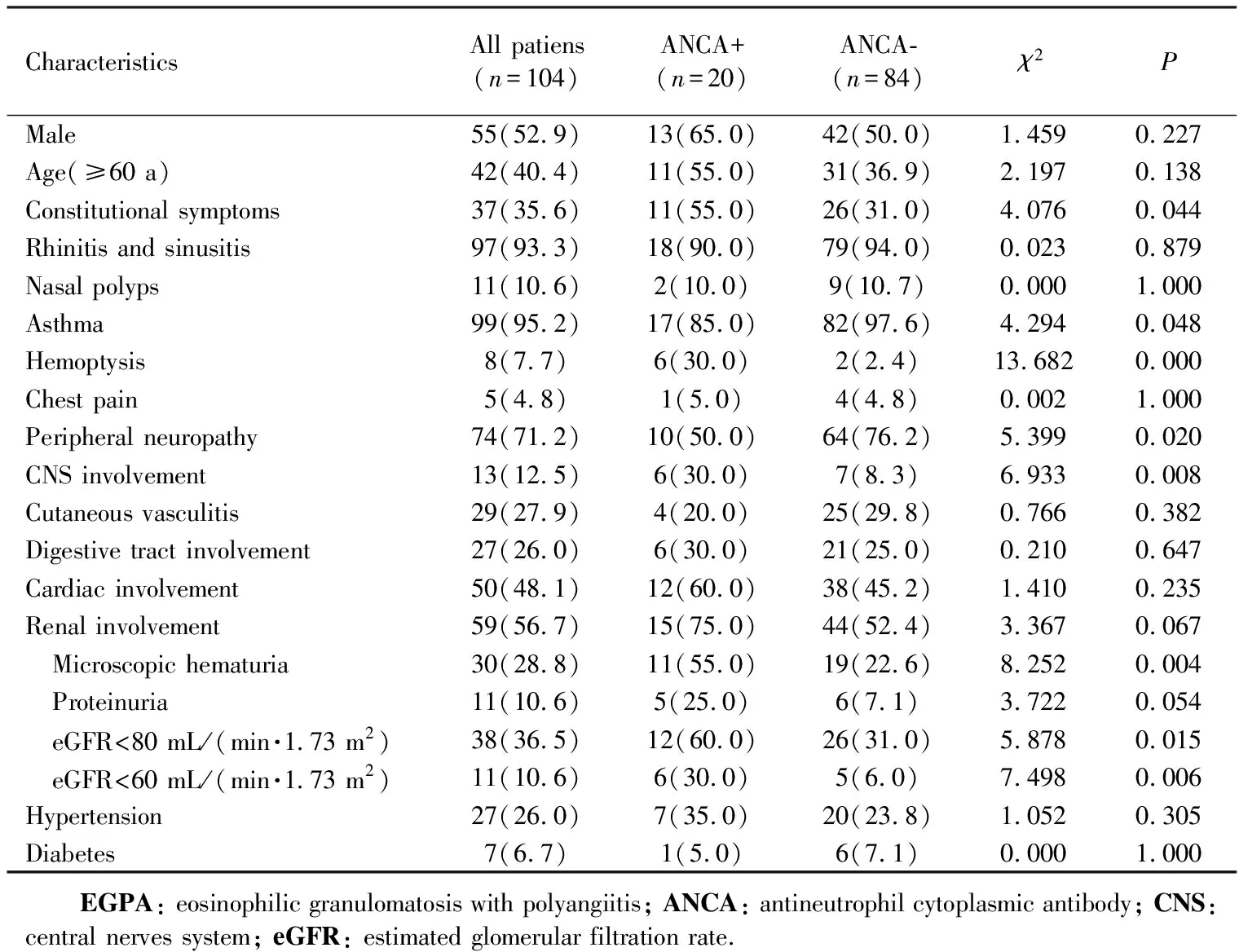
表1 EGPA患者的基本临床特征Tab.1 Baseline characteristics of patients with EGPA n(%)
2.2 EGPA合并CKD组的临床特征
将eGFR<60 mL/(min·1.73 m2)并持续3个月以上定义为合并CKD组,eGFR≥60 mL/(min·1.73 m2)为对照组,分析两组之间差异。发现合并CKD组中,平均年龄、ANCA阳性率、贫血、心脏受累及病死率显著高于对照组,差异有统计学意义(P<0.05)(表2)。

表2 EGPA CKD组与对照组的比较Tab.2 Comparison of baseline features of EGPA patients between CKD group and control group [M(P25,P75),n(%)]
2.3 EGPA合并CKD的危险因素
以是否EGPA合并CKD为因变量(是=1,否=0),纳入患者年龄、高血压病、糖尿病、嗜酸性粒细胞浓度及ANCA状态为自变量,进行多因素Logistic回归分析,发现年龄和ANCA阳性是合并CKD的独立危险因素(P<0.05)(表3)。
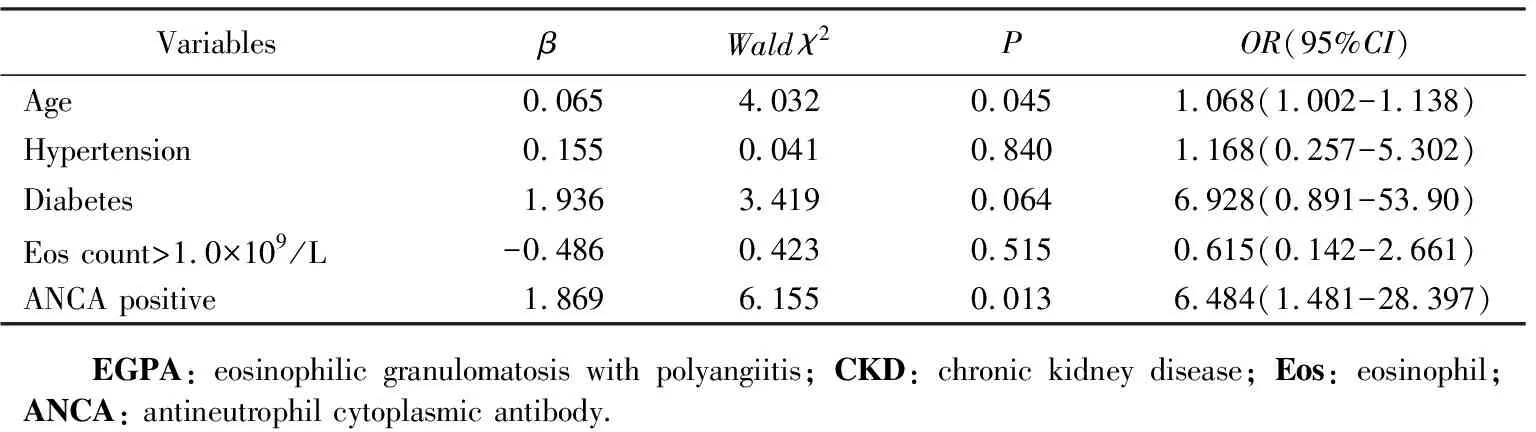
表3 EGPA CKD危险因素的多因素Logistic回归分析Tab.3 Risk factors associated with CKD among EGPA patients by multivariate Logistic regression analysis
2.4 治疗及预后
EGPA合并CKD患者的治疗遵循指南推荐原则,应用糖皮质激素联合环磷酰胺治疗。对91例患者进行随访,平均随访中位时间41(19,59)个月,6例患者死亡,其中3例患者伴有CKD。CKD患者病死率(27.3%)明显高于对照组(3.2%)(P=0.011)。
3 讨论
EGPA于1951年由Churg和Strauss发现并报道[7],曾命名Churg-Strauss综合征或变应性肉芽肿性血管炎。2012年Chapel Hill会议根据其临床及实验室特点将其改名为EGPA[8]。EGPA是一种较少见的临床疾病,病变主要累及中小血管,与其他小血管炎比较,其最显著不同表现为哮喘、外周血及组织中嗜酸性粒细胞增多。国外报道的总患病率为(10.7~13.0)/100万,年发病率为(0.5~6.8)/100万[9]。支气管哮喘人群中EGPA的发病率为(0~67)/100万[10],年发病率则高达64.4/100万,远高于总人群中EGPA的发病率[11]。我国尚缺乏EGPA的流行病学资料。
EGPA的发病机制尚未完全明确,虽属于AAV,但ANCA阳性率显著低于GPA和MPA。这提示除ANCA外,更多患者的发病与嗜酸性粒细胞相关。本研究中ANCA阳性率为19.2%,低于文献报道,考虑与本研究纳入的患者主要来自呼吸系统疾病中心,患者多以哮喘伴嗜酸性粒细胞增多为主要临床表现有关。
EGPA患者临床病程分为三期,这三期常有重叠[12]:①前驱期:表现为关节痛、肌痛、心悸、发热及体质量减轻等全身症状,哮喘是前驱期的重要特征。②嗜酸性粒细胞增多期:这一期表现为外周血嗜酸性粒细胞增多,伴有器官受累,特征性表现为肺、心脏及胃肠道受累。③血管炎期:外周神经受累是这一期最重要表现,病变可累及中枢神经系统、皮肤、肾及全身多个系统。EGPA临床表现缺乏特异性,多数患者直到出现明显的血管炎病变时才能确诊。
肾受累是ANCA相关血管炎最突出的临床特征之一。在GPA患者中70%表现出肾受累的征象,在MPA患者中占比更高至95%,而肾受累并不是EGPA的主要临床特征。然而,潜在的肾损伤在EGPA患者中并不少见。据报道,25%~45%的EGPA患者合并有肾疾病[13-14],在ANCA阳性患者中肾受累的发生率较高[3,14-15]。本中心早期研究[16]报道的EGPA肾受累情况基本与上述文献结果一致。EGPA肾受累患者表现多样,大多数患者表现为尿检异常,但一部分患者可迅速从单纯尿检异常发展为急性进展性肾小球肾炎,甚至需要透析治疗[14,17]。有些患者确诊时即出现慢性肾衰竭[18]。本研究显示,高龄及ANCA阳性是肾受累的独立危险因素,与既往报道一致。
特发性嗜酸性粒细胞增多症可合并多器官受累,包括肾受累[19]。嗜酸性粒细胞升高的水平及时机往往和器官受累的严重程度及发病时机并不一致[20]。在EGPA中,嗜酸性粒细胞也参与肾受累的发生[14]。本研究中,嗜酸性粒细胞计数水平与肾受累之间无相关性,可能与样本量小等因素有关。根据文献[21]报道,尿嗜酸性粒细胞检测对急性间质性肾炎具有诊断价值,后续我们将进一步完善相关研究。
EGPA病理表现包括三个方面:坏死性血管炎、嗜酸性粒细胞组织浸润及血管外肉芽肿[7,22]。这三种病理改变中,血管炎及嗜酸性粒细胞组织浸润较为多见,可达60%左右,而肉芽肿仅见于不到1/3的组织标本[22-23]。EGPA患者病理阳性率受多种因素影响,包括疾病所处临床分期、活检前是否应用糖皮质激素及免疫抑制剂治疗以及活检部位等[24]。尸检病理中阳性率高[7],活检病理结果中极少能见到三种病理特点共存[22]。EGPA肾受累病理结果中,寡免疫复合物局灶性、节段性、坏死性伴或不伴新月体形成的肾小球肾炎是最具特征性的病理表现[18]。“寡免疫”的特征可区别于Goodpasture综合征、系统性红斑狼疮、过敏性紫癜等疾病。肾病理偶见嗜酸性粒细胞明显浸润的肾小管间质性肾炎,部分患者出现系膜增生性肾小球肾炎或局灶性、节段性肾小球硬化[25]。肾活检中报道有间质嗜酸性粒细胞性肉芽肿病变的较少[26]。ANCA阳性EGPA患者中最常见的肾受累表现是寡免疫复合物肾小球肾炎,ANCA阴性患者常伴有非典型性表现,如膜性肾病[27]。本研究患者来源以呼吸科就诊患者为主,伴随明显肾功能不全临床特征的患者例数并不多,同时考虑肾活检存在风险,以及肾活检在EGPA诊断中的价值有限,本研究未对患者进行肾活检。针对病因不明或者快速进展的肾功能不全患者,有条件的可进行活检明确诊断。
EGPA的治疗方案是按照5因子危险因素评分(five-factors score, FFS)制定的[28],FFS=0分患者推荐糖皮质激素单药治疗[29],FFS≥1分患者推荐糖皮质激素联合免疫抑制剂治疗[30],环磷酰胺是首选的免疫抑制剂,利妥昔单抗可做为替代药物。疾病缓解后可应用甲氨蝶呤片、硫唑嘌呤维持治疗。针对EGPA的靶向治疗有美泊利单抗、奥马珠单抗等药物。其他治疗包括静脉注射免疫球蛋白、血浆置换等[17]。肾功能受损,血清肌酐值>150 μmol/L是FFS中的一项,首选的治疗方案是激素联合免疫抑制剂。对于CKD患者,需引导患者调整生活方式,优质蛋白饮食,控制血糖血压,减少肾毒性药物的应用[4]。对于肾衰竭患者,可选择血液透析治疗及肾移植[27]。
肾病指南[4,31]提示,CKD往往起病隐匿,患者长期处于无症状阶段。当疾病发展至G3期[eGFR<60 mL/(min·1.73 m2)]时,患者发生并发症风险和进展至终末期肾病的风险显著增高。CKD如能得到早期诊断及治疗,病情可得到良好控制,甚至可以逆转,所以筛查CKD意义重大,而EGPA患者显然是CKD的高风险人群。
本研究显示,EGPA CKD患者中,合并贫血及心脏受累的发生率显著高于对照组。针对贫血患者,需评估有无造血原料缺乏,酌情补充铁剂及应用红细胞生成刺激剂[4]。CKD患者中,心血管疾病风险增加,两者相互影响。由于EGPA患者本身就存在心脏受累风险,因此针对这一人群,建议同时进行心脏疾病的早期筛查,包括心脏磁共振成像检查等[32-33]。
据报道,EGPA的长期肾生存率是可变的。大多数研究报道肾功能一般保持稳定,而一些研究[26-27]报道部分患者进展为终末期肾病。肾功能不全是EGPA预后不良的危险因素之一[28]。本研究发现CKD组病死率明显高于对照组,但由于本研究样本量相对小,失访人数较多,导致疾病死亡的混杂因素也较多,因此未能对死亡原因进行多因素分析。
小结:EGPA患者肾受累主要表现为镜下血尿和蛋白尿,伴有肌酐清除率下降的患者比例较高,临床工作中不容忽视。肾受累患者同时伴有贫血和心脏受累的发生率增高。高龄及ANCA阳性是肾损害的独立危险因素。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明李杰:提出研究思路,设计研究方案,撰写论文;张隽、王晶:指导设计研究方案,对论文进行审阅;华琳:采集、分析数据;张黎明:总体把关,审定论文。

