辣椒根腐病菌对咯菌腈的敏感性及其抗性突变体的生物学性状

刘 翔1, 姜兴印1*, 王雪婷1, 朱文亚1, 姚向峰2, 王金花2, 张风文
摘要
为明确辣椒根腐病致病菌腐皮镰孢Fusarium solani对咯菌腈的抗性风险,采用菌丝生长速率法测定了采自未使用过咯菌腈的5个省份的102株腐皮镰孢对咯菌腈的敏感性。结果表明:咯菌腈对102株腐皮镰孢的EC50范围为0.029 0~0.183 4 mg/L,平均EC50为(0.106 2±0.031 5)mg/L,敏感性频率分布为连续单峰曲线,所以可将其作为供试5个省份腐皮镰孢对咯菌腈的敏感基线。通过药剂驯化和紫外诱导并结合抗性遗传稳定性最终共获得4株腐皮镰孢抗咯菌腈突变体,抗性水平在6.94~32.43倍之间,突变频率分别为3.51×10-4(SDWF1914Y336和SDWF1914Y017)和7.41×10-9(SDWF1914ZR717和JSXZ1906ZR496)。腐皮鐮孢抗咯菌腈突变体生物学性状的研究表明,抗性突变体在菌丝生长速率、产孢量与致病力方面与亲本菌株不存在显著差异。交互抗性测定结果显示,腐皮镰孢对咯菌腈与嘧菌酯、醚菌酯、多菌灵和福美双均无交互抗性。结果表明,供试腐皮镰孢对咯菌腈较为敏感,对咯菌腈的室内抗药性风险等级为低至中等,可作为防治辣椒根腐病的理想药剂,建议在生产中将咯菌腈与不同作用机制的杀菌剂混用或交替使用。
关键词
腐皮镰孢; 咯菌腈; 敏感性; 抗性突变体; 生物学性状
中图分类号:
S 481.4; S 482.2
文献标识码: A
DOI: 10.16688/j.zwbh.2022063
Sensitivity of Fusarium solani to fludioxonil and the biological characteristics of its resistant mutants
LIU Xiang1, JIANG Xingyin1*, WANG Xueting1, ZHU Wenya1, YAO Xiangfeng2,WANG Jinhua2, ZHANG Fengwen3
(1. College of Plant Protection, Shandong Agricultural University, Taian 271018, China; 2. College of
Resources and Environment, Shandong Agricultural University, Taian 271018, China; 3. Institute of
Tobacco Research, Chinese Academy of Agricultural Sciences, Qingdao 266101, China)
Abstract
The mycelial growth rate method was used to determine the sensitivity of 102 isolates of Fusarium solani to fludioxonil from five provinces where fludioxonil had not been used, aiming to clarify the resistance risk of F.solani to fludioxonil. The results indicated that the EC50 values of these isolates to fludioxonil ranged from 0.029 0 mg/L to 0.183 4 mg/L, with a mean EC50 value of (0.106 2±0.031 5)mg/L. The frequency distribution of susceptibility was a continuous unimodal curve, which could be used as the susceptibility baseline of the tested F.solani isolates to fludioxonil in five provinces. Four fludioxonilresistant isolates of F.solani were obtained through medicament domestication and ultraviolet induction combined with a resistance genetic stability test. The resistance level was between 6.94 and 32.43fold, with a mutation frequency of 3.51×10-4(SDWF1914Y336 and SDWF1914Y017) and 7.41×10-9 (SDWF1914ZR717 and JSXZ1906ZR496), respectively. The biological characteristics of the fludioxonilresistant mutants of F.solani exhibited no significant difference from the parental isolates in terms of hyphal growth rate, sporulation, and pathogenicity. In addition, no crossresistance was observed in F.solani isolates between fludioxonil and azoxystrobin, kresoximmethyl, carbendazim, and thiram. The results suggested that the tested F.solani isolates were relatively sensitive to fludioxonil, and showed low to moderate resistance. In summary, fludioxonil is an ideal agent for controlling pepper root rot, but should be mixed or alternately used with other fungicides with various mechanisms of action in agricultural production.
Key words
Fusarium solani; fludioxonil; sensitivity; resistant mutant; biological characteristics
辣椒是我国重要的经济作物,但生产中常因严重的病害问题导致经济损失。
腐皮镰孢Fusarium solani引起的辣椒根腐病[12]是影响田间辣椒生产最严重的病害之一。
土壤中的病原菌厚垣孢子、菌核或菌丝体通常为侵染源[3],土壤中的病菌翌年萌发产生的分生孢子也可以侵染致病。腐皮镰孢可从辣椒根和茎上的伤口处侵入维管束内,使植株发育不良,严重时会导致植株根系腐烂进而造成枯死现象[4]。由于该病原菌在土壤中存活时间较长,加上长期连作,导致土壤质量不断下降,土壤中有益微生物的数量随病原菌积累而锐减[56],在这种土壤中生长的辣椒更易得辣椒根腐病[78]。因此,田间辣椒根腐病的发生不断加重。
目前辣椒根腐病的防治以化学防治为主,但在本研究启动时我国登记用于防治辣椒根腐病的化学药剂仅有2种,分别为二氯异氰尿酸钠(sodium dichloroisocyanurate)以及福美双(thiram)和多菌灵(carbendazim)组成的混剂。由于药剂种类稀少且连年用药,导致防治效果不断下降。
多菌灵和福美双在田间防效下降甚至失败的案例已有发生,例如
由镰孢菌引起的小麦赤霉病对多菌灵的抗性水平上升较快[9]。多菌灵对绿豆根腐病有较好的防治作用, 但田间连续使用后病菌已经产生抗药性[10];因为抗性问题,福美双对绿豆根腐病的防治效果也显著下降[10]。因此,为延缓抗药性发生,避免对辣椒根腐病防治效果下降,亟须不同种类杀菌剂控制田间辣椒根腐病的发生。咯菌腈(fludioxonil)是一种低毒、高效的苯基吡咯类非内吸性广谱杀菌剂[1112],既可作为种子处理剂防治多种作物的土传和种传病害,亦可叶面喷施防治叶部病害,据报道
对灰葡萄孢Botrytis cinerea有特效[13]。已有研究表明,25 g/L咯菌腈悬浮种衣剂可有效防治由多种镰孢菌引起的大豆根腐病和花生根腐病[14];在筛选防治拟枝孢镰孢F.sporotrichioides引起的苜蓿根腐病的药剂试验中,50%咯菌腈可湿性粉剂有效剂量250 g/hm2时防效最好[15]。可见,咯菌腈对镰孢菌引起的作物根腐病普遍有较好的防治效果。
刘禹含等[16]通过药剂驯化获得水稻恶苗病菌F.fujikuroi高抗咯菌腈的突变体,生物学测定结果表明,抗性突变体的适合度极高;纪军建等[17]经过紫外诱导得到多株引起番茄灰霉病的灰葡萄孢B.cinerea咯菌腈抗性突变体,并且室内紫外诱导获得的抗咯菌腈突变体抗性可稳定遗传。由于病原菌自身特性、生长环境和防治药剂存在差异,因此,研究不同辣椒产区辣椒根腐病菌对咯菌腈的抗性风险具有重要意义。本研究通过菌丝生长速率法,測定了来自全国5个省份的102株辣椒根腐病菌对咯菌腈的敏感性,尝试建立其敏感基线,探究辣椒根腐病菌对咯菌腈产生抗性突变的可能性及所获抗药性突变体的生物学性状,旨在为咯菌腈防治辣椒病害提供科学合理的理论依据。
1 材料与方法
1.1 供试材料
1.1.1 菌株
2019年在山东潍坊(SDWF)、湖南岳阳(HNYY)、河北廊坊(HBLF)、江苏徐州(JSXZ)及四川成都(SCCD) 5个辣椒产区采集辣椒根腐病发病维管束、病根,经分离纯化获得102株辣椒根腐病病原菌,转接于马铃薯葡萄糖琼脂(PDA) 培养基上,于4℃冰箱中保存,备用。
1.1.2 试验药剂
98%咯菌腈原药和95%醚菌酯(kresoximmethyl)原药,江苏耕耘化学有限公司;96.5%嘧菌酯(azoxystrobin)原药,江苏中旗科技股份有限公司;98%多菌灵原药,江苏龙灯化学有限公司;95%福美双原药,河北冠龙农化有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂粉16~20 g,去离子水1 L; 121℃高压灭菌30 min。
绿豆培养基:绿豆20 g, 蔗糖20 g, 磷酸二氢钾1.0 g,去离子水1 L; 121℃高压灭菌30 min。
水琼脂培养基(WA):琼脂粉10 g,去离子水1 L。
1.1.4 供试辣椒品种
‘辣帝1号,寿光欣欣然园艺有限公司。
1.2 试验方法
1.2.1 病原菌分子鉴定
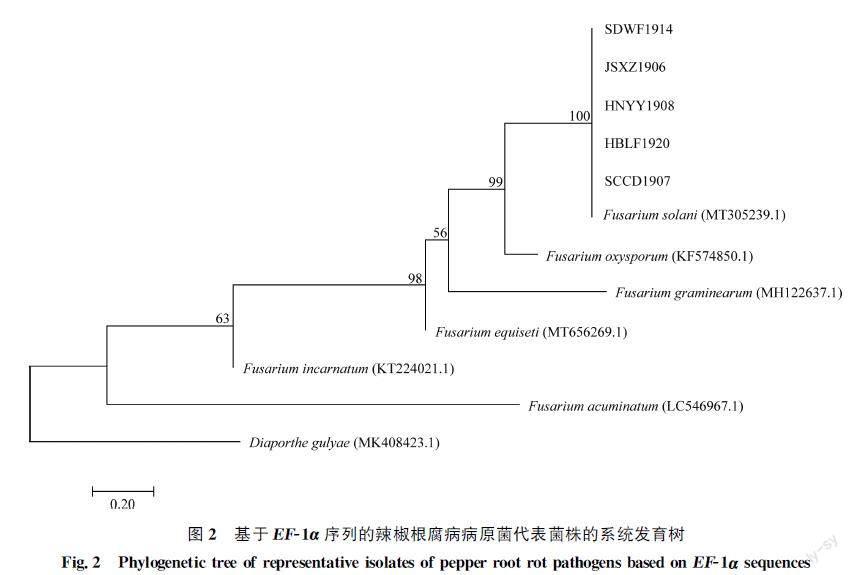
随机选取5株采集、分离自不同地区的代表菌株SDWF1914、JSXZ1906、HNYY1908、HBLF1920、SCCD1907,刮取其在PDA培养基上正常生长的菌丝,利用真菌DNA提取试剂盒提取病原菌DNA,用ITS通用引物ITS1(5′TCCGTAGGTGAACCTGCGG3′)和ITS4(5′TCCTCCGCTTATTGATATGC3′)以及延伸因子EF1α引物EF1[5′ATGGGTAAGGA(A/G)GACAAGAC3′]和EF2[5′GGA(G/A)GTACCAGT(G/C)ATCATGTT3′]进行PCR扩增。
对纯化后的PCR扩增产物进行双向测序,所得序列拼接后在GenBank中搜索与测试菌株相应序列相似度较高的序列及邻近种属序列,并用MEGA 7.0软件以邻接法构建系统发育树。
1.2.2 腐皮镰孢对咯菌腈敏感基线的建立
采用菌丝生长速率法测定102株腐皮镰孢对咯菌腈的敏感性,建立敏感基线。将咯菌腈溶于丙酮,在预试验的基础上,用含0.1%吐温 80(V/V)的无菌去离子水稀释配制成咯菌腈质量浓度分别为0.016、0.04、0.1、0.25、0.625 mg/L的含药PDA平板,以加入同体积含0.1%吐温 80 的无菌去离子水的PDA平板为对照。在已活化且菌丝生长至3/4皿的腐皮镰孢菌落边缘打取直径5 mm的菌饼,菌丝面朝下接种至上述PDA平板,每处理3次重复,于25℃黑暗条件恒温培养7 d,采用十字交叉法测量菌落直径,计算菌丝生长抑制率,建立毒力回归方程,计算得到有效抑制中浓度(EC50)。
1.2.3 腐皮镰孢抗咯菌腈突变体的获得
1.2.3.1 药剂驯化法
随机选取对咯菌腈敏感的腐皮镰孢菌株SDWF1914、HBLF1911、JSXZ1906,活化后转接于含EC50浓度咯菌腈的PDA平板上,每代选取菌丝生长较快的菌落并于菌落边缘打取菌饼进行转接,比较抗性变化,逐步提高PDA平板中咯菌腈含量,直至能在含0.5 mg/L(最低抑制浓度,MIC)咯菌腈的PDA平板上较好生长为止。每次试验打取100个菌饼,每皿接种1个菌饼,观察抗咯菌腈腐皮镰孢突变体抗性变化,计算抗性水平和抗性突变频率[18]。
RL=EC50(R)/EC50(S)×100%;
RMF=RN/TN×100%;
式中:RL为抗性水平(%);EC50为抑制中浓度;R表示抗性突变体;S代表亲本敏感菌株;RMF为抗性突变频率;RN为抗性突变体菌株数;TN为抗性筛选试验中供试病原菌的菌饼总数。
1.2.3.2 紫外诱导法
参考Lu等[19]和Bruin等[20]的方法并加以改进,选取对咯菌腈敏感的腐皮镰孢
菌株SDWF1914、HBLF1911和JSXZ1906,挑取菌丝放入绿豆培养基中于25℃黑暗条件下培养5 d,双层纱布过滤,用无菌水稀释成1×105个/mL的孢子悬浮液,取1 mL孢子悬浮液涂布于PDA平板,置于已预热 15 min 的紫外灯(20 W, 254 nm) 下20 cm处分别照射40、60、80、100、120、140 s和160 s,以未进行紫外灯照射的亲本菌株为对照。25℃黑暗条件下培养3 d后,调查不同紫外照射时间下菌株的死亡率(显微镜视野中未萌发孢子数占视野中孢子总数的百分比)
,获得紫外照射致使95%菌落死亡(即95%孢子不能正常萌发)的时间。取1 mL孢子悬浮液涂布于含EC50浓度咯菌腈的PDA平板上,每个菌株一次试验涂布100个平板,按使95%菌落死亡所需时间进行紫外照射后,25℃黑暗条件恒温培养5 d,观察菌丝生长情况。将平板上长出的不规则扇形角突变菌落转移到WA培养基上,显微镜下挑取单细胞菌丝进行菌株纯化。将纯化后的菌丝转接到含0.5 mg/L(最低抑制浓度,MIC)咯菌腈的PDA平板上,可正常生长的菌落为疑似抗性突变体,利用菌丝生长速率法测定其EC50,以未经紫外照射的亲本菌株作为对照,计算抗性突变体的抗性水平和抗性突变频率。
RMF=AN/TN×100%。
式中:AN为抗性突变体菌株数,TN为抗性筛选试验中供试病原菌的总孢子数。
1.2.4 抗性突变体的主要生物学性状研究
1.2.4.1 抗性遗传稳定性
在药剂驯化和紫外诱变获得的抗药性突变体及其亲本菌株的菌落边缘打取菌饼,将菌饼转接到不含药的PDA培养基平板上,25℃黑暗条件下培养,每7 d转接1次,连续转接培养12代后,以菌丝生长速率法分别测定第1代和第12代菌株对咯菌腈的敏感性。
1.2.4.2 适宜生长温度测定
打取抗性突变体及其亲本菌株菌饼,转接到不含药的PDA培养基平板上,25℃黑暗条件下培养7 d后,打取直径为5 mm的菌饼转接到不含药的PDA培养基平板中央,分别置于15、25、35℃黑暗条件下培养7 d,十字交叉法测量菌落直径。每处理3次重复。测定温度对抗性突变体及其亲本菌株菌丝生长的影响。
1.2.4.3 产孢能力测定
打取抗性突变体及其亲本菌株菌饼,接种于不含药的PDA培养基平板上
25℃黑暗条件下培养7 d,再次转接后在相同条件下
培养10 d,加入10 mL无菌水,收集孢子,用血球计数板计算孢子浓度,比较亲本敏感菌株与抗性突变体产孢能力。每个处理设3个重复。
1.2.4.4 致病力测定
采用麦粒接种的方法。供试菌株在PDA培养基平板上活化培养7 d后,打取直径5 mm的菌饼,放入盛有
麦粒(提前浸泡并高压灭菌)的100 mL锥形瓶中,每瓶放入10个菌饼。25℃黑暗条件下培养7 d,以盆栽辣椒苗为接种对象,待辣椒苗定植后,将带菌麦粒倒入根际周围土壤,以不带腐皮镰孢的麦粒为空白对照。接种后辣椒放置于温度25℃,相对湿度90%,光周期L∥D=16 h∥8 h条件下培养7 d,分别测量发病植株病斑面积,取平均值,比较亲本敏感菌株與抗性突变体致病力差异。每处理设3个重复,每重复10株辣椒。
1.2.4.5 交互抗药性测定
采用菌丝生长速率法分别测定抗性突变体及其亲本菌株对其他常规杀菌剂和田间主要使用药剂嘧菌酯、醚菌酯、多菌灵及福美双的敏感性。根据皮尔逊相关系数r和P值来判断2种杀菌剂之间是否存在交互抗性[2122]。
1.3 数据处理
利用SPSS 26.0对数据进行统计分析。采用单因素方差分析检验腐皮镰孢抗咯菌腈突变体在菌丝生长速率、产孢量及致病力方面与亲本菌株是否存在显著性差异,若存在,则进一步进行Duncan氏多重比较。
2 结果与分析
2.1 代表菌株的rDNAITS和EF1α序列分析
将供试菌株测序结果在GenBank数据库中进行BLAST比对,结果(图1,图2)显示采集、分离自不同地区的5株代表菌株与腐皮镰孢F.solani的rDNAITS和EF1α序列相似性均在99%以上。用MEGA 7.0软件,采用邻接法构建系统发育树显示,供试菌株皆与腐皮镰孢F.solani聚在同一分支,支持率均达到100%,因此将引起辣椒根腐病的病原菌鉴定为腐皮镰孢F.solani。
2.2 腐皮镰孢对咯菌腈敏感基线的建立
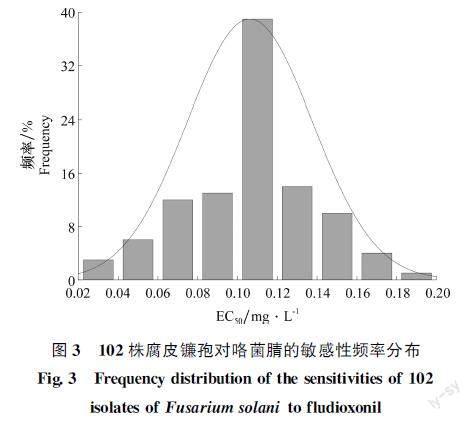
测定结果显示:供试102株腐皮镰孢对咯菌腈具有较高敏感性,EC50范围为0.029 0~0.183 4 mg/L,平均EC50为(0.106 2±0.031 5)mg/L,ShapiroWilk检验结果表明:P=0.126 4>0.05,符合连续偏正态分布,且其敏感性频率分布呈连续单峰曲线(图3)。因此可以将其作为试验地区腐皮镰孢对咯菌腈的敏感基线。
2.3 腐皮镰孢抗咯菌腈突变体的获得
通过药剂驯化对随机选取的3个菌株进行19代抗药性选育后仅有菌株SDWF1914获得2个抗咯菌腈突变体:SDWF1914Y336和SDWF1914Y017,抗性倍数分别为8.35和6.94(表1),抗性突变频率为3.51×10-4。通过紫外诱导对随机选取的3个菌株进行9次紫外诱变后,SDWF1914和JSXZ1906分别获得9个、13个疑似抗药性突变体,经连续12代抗药稳定性测定后,SDWF1914诱导的SDWF1914ZR717和JSXZ1906诱导的JSXZ1906ZR496,可以稳定遗传,抗性倍数分别为9.78和32.43(表1),抗性突变频率为7.41×10-9。表明腐皮镰孢亲本菌株经药剂驯化和紫外诱导后产生不同抗性水平的抗咯菌腈突变体。
2.4 腐皮镰孢抗咯菌腈突变体的主要生物学性状
2.4.1 抗性遗传稳定性
腐皮镰孢抗咯菌腈突变体及其亲本菌株在无药PDA培养基平板上转接12代后,抗性突变体对咯菌腈的抗性倍数均降低(表2),但变化不明显,抗性水平均未发生改变,说明抗性突变体具有较为稳定的抗性遗传性。
2.4.2 适宜生长温度
由表3可知:腐皮镰孢抗咯菌腈突变体及其亲本菌株在15~35℃条件下均能生长,同一菌株在不同温度下生长速率不同。在同一温度下,抗性突变体菌丝生长速率略低于其亲本菌株,但差异性不显著。因此,可以认为在不同试验温度下抗性突变体与其亲本菌株的菌丝生长速率差别较小。
2.4.3 产孢能力和致病力
产孢能力和致病力测定结果(表4)表明:抗性突变体产孢量与其亲本菌株无显著差异,说明抗性突变体在PDA平板上正常生长时具有与亲本菌株相当的产孢能力。抗性突变体侵染活体辣椒后产生的病斑面积与其亲本菌株不存在显著差异,表明抗性突变体具有类似于亲本菌株的致病能力。
2.4.4 对咯菌腈与其他杀菌剂的交互抗性
供试药剂的EC50(表5)测定结果表明:腐皮镰孢抗咯菌腈突变体及其亲本菌株对4种杀菌剂的敏感性由高到低依次为多菌灵>嘧菌酯>醚菌酯>福美双。交互抗性测定(表6)结果显示:咯菌腈EC50对数值与4种杀菌剂EC50对数值之间的相关系数分别为0.005 9、0.387 7、0.148 2、0.453 8,P>0.05,表明腐皮镰孢对咯菌腈与嘧菌酯、醚菌酯、多菌灵、福美双之间不存在交互抗性。
3 结论与讨论
镰孢属分布广泛,属内不仅种类繁多,并且种间差异微小,仅凭菌丝、孢子的形状、大小等传统形态特征鉴定方法很难准确区分种类[2325],rDNAITS、EF1α延伸因子等主效位點基因序列分析可为镰孢菌种、亚种等级的分类鉴定提供依据[26]。因此本研究采用ITS和EF1α基因序列进行分子鉴定,构建系统发育树,明确采集、分离菌株为腐皮镰孢F.solani。目前国内登记的苯基吡咯类杀菌剂仅有咯菌腈,其作用机制可能为抑制葡萄糖磷酰化有关的转移进而抑制菌丝生长[27];另有研究表明,咯菌腈在菌体内作用靶标是Ⅲ型组氨酸激酶,咯菌腈可导致病原菌HOGMAPK途径持续激活,合成并积累大量甘油,从而导致病原菌死亡[2829]。已有研究表明,2%咯菌腈颗粒剂对于田间辣椒根腐病具有较好的防治作用,有效成分用量为150 g/hm2时防效可达84.85%[30]。但目前关于腐皮镰孢对咯菌腈的敏感性分布以及腐皮镰孢抗咯菌腈突变体的获得及其生物学性状尚未见报道。因此,本研究采用菌丝生长速率法测定了供试地区102株腐皮镰孢对咯菌腈的敏感性,发现供试菌株对咯菌腈具有较高的敏感性,其EC50分布范围为0.029 0~0.183 4 mg/L,平均EC50为(0.106 2±0.031 5)mg/L,敏感性频率分布为连续单峰曲线,所以可将其作为供试地区腐皮镰孢对咯菌腈的敏感基线。
杀菌剂抗性行动委员会(FRAC)评定苯基吡咯类杀菌剂固有抗药性风险为低至中等,有关该类杀菌剂的抗性亦有报道:弥勒市采集到对咯菌腈产生低抗药性的葡萄灰霉病菌菌株[31],四川省部分地区的草莓灰霉病菌已对咯菌腈产生抗性[32]。目前对咯菌腈产生抗性的田间镰孢属真菌鲜有发现。本研究通过药剂驯化获得2株腐皮镰孢抗咯菌腈突变体,紫外诱导获得多个抗咯菌腈突变体,但仅有2株耐药性可稳定遗传。杀菌剂抗性行动委员会(FRAC)评定镰孢属Fusarium spp.病原菌固有抗药性风险为低等,结合咯菌腈固有抗药性风险以及农事操作抗药性风险,将腐皮镰孢对咯菌腈的室内抗药性风险等级评估为低至中等。本研究中腐皮镰孢抗咯菌腈突变体获得频率较低,评估结果亦得到佐证。腐皮镰孢抗咯菌腈突变体生物学性状与亲本敏感菌株相差较小。这与贾娇等[33]报道禾谷镰孢抗咯菌腈突变体对温度、pH等敏感性与亲本菌株相似的结论一致。但灰葡萄孢高抗咯菌腈突变体与敏感菌株在生物学特性方面存在显著差异[34]。推测造成差异的可能原因有:病原菌本身种间特性不同以及抗性突变体的抗性水平不等所造成。桑程巍[35]认为并非所有抗性菌株生物学特征都相似,王秋月等[36]认为不同的驯化或诱导方法以及不同地区菌株遗传背景的差异会导致抗性突变体与其亲本菌株部分生物学性状出现差异。二者的观点都为上述推测提供了理论依据。
管磊等[37]报道咯菌腈对引起花生根腐病的腐皮镰孢F.solani具有较高的室内毒力,本研究表明供试102株腐皮镰孢对咯菌腈具有较高的敏感性,与此研究结果一致。由于咯菌腈作用機制特殊,国内尚未有登记的同类药剂防治田间辣椒病害,因此交互抗性研究中选用目前已登记防治辣椒根腐病的多菌灵和福美双,以及甲氧基丙烯酸酯类杀菌剂嘧菌酯和醚菌酯作为供试药剂,结果表明腐皮镰孢对咯菌腈与供试药剂之间均无交互抗性。前人[16,38]研究也发现,镰孢属小麦赤霉病菌F.graminearum对咯菌腈的敏感性与其对多菌灵、戊唑醇的敏感性之间无明显相关性;藤仓镰孢F.fujikuroi对咯菌腈与咪鲜胺和戊唑醇之间不存在交互抗性。因此建议咯菌腈在防治辣椒根腐病时可与不同作用机制的杀菌剂混用或交替使用,从而保证防治效果并减缓抗药性的发生。韩絮[39]研究发现,玉米小斑病病菌Bipolaris maydis对咯菌腈产生抗药性与Ⅲ型双组分组氨酸激酶的突变相关。相对本研究中的抗性突变体而言,抗性的产生是否与上述突变相关还有待研究。由于本研究所获得的抗性突变体是在室内条件下产生的,在田间腐皮镰孢能否产生抗咯菌腈突变体以及抗性突变体的生物学性状与室内获得的突变体的生物学性状是否会不同,还需要进一步验证。
参考文献
[1] JABER L R, ALANANBEH K M. Fungal entomopathogens as endophytes reduce several species of Fusarium causing crown and root rot in sweet pepper (Capsicum annuum L.) [J]. Biological Control, 2018, 126: 117126.
[2] 马骁. 棚栽辣椒根腐病发生与综合防控[J]. 西北园艺(综合), 2020(1): 4243.
[3] 黄金花, 邱传明. 茂名辣椒种植的主要病害及防治[J]. 农业技术与装备, 2020(6): 146147.
[4] 殷福芝. 辣椒根腐病的症状识别与综合防治[J]. 上海蔬菜, 2019(5): 55.
[5] 贾晨波, 郭洋, 马成莲, 等. 宁杞1号枸杞健康株与根腐病患病株的土壤微生物群落和功能差异[J]. 生态环境学报, 2021, 30(9): 18311841.
[6] 苗翠苹. 三七根际土壤微生物的群落特征[D]. 昆明: 云南大学, 2015.
[7] CAO Yun, CHANG Zhizhou, WANG Jidong, et al. Potential use of anaerobically digested manure slurry to suppress Phytophthora root rot of chilli pepper [J]. Scientia Horticulturae, 2014, 168(26): 124131.
[8] SUN Ruibo, ZHANG Xuexian, GUO Xisheng, et al. Bacterial diversity in soils subjected to longterm chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw [J]. Soil Biology & Biochemistry, 2015, 88: 918.
[9] 賁秀兰, 赵海红, 苏兴海. 小麦赤霉病不同药剂试验简报[J]. 上海农业科技, 2012(6): 128129.
[10]刘佳. 25%多福克不同配比对绿豆根腐病菌联合毒力的测定[J]. 安徽农学通报, 2011, 17(9): 134135.
[11]闫潇敏, 宁斌科, 王列平, 等. 新型杀菌剂氟咯菌腈及其研究开发进展[J]. 世界农药, 2010, 32(3): 3638.
[12]AMIRI A, MULVANEY K A, PANDIT L K. First report of Penicillium expansum isolates with low levels of resistance to fludioxonil from commercial apple packinghouses in Washington State [J]. Plant Disease, 2017, 101(5): 835.
[13]杨亚兰. 灰葡萄孢菌(Botrytis cinerea)中与咯菌腈作用机理相关基因BcSln1和BcSho1的生物学功能研究[D]. 南京: 南京农业大学, 2017.
[14]娄天成, 左杨, 张心宁, 等. 杀菌剂咯菌腈对根腐病的室内毒力测定和田间防治效果[J]. 江苏农业科学, 2021, 49(11): 8084.
[15]潘龙其, 张丽, 袁庆华, 等. 不同杀菌剂对拟枝孢镰刀菌的毒力测定及田间防效[J]. 中国农业大学学报, 2016, 21(1): 8796.
[16]刘禹含, 邹佳营, 何博, 等. 吉林省水稻恶苗病菌对咯菌腈的敏感性及抗药性风险评估[J/OL]. 吉林农业大学学报. (20200916)[20211011]. https:∥doi.org/10.13327/j.jjlau.2020.5228.
[17]纪军建, 张小风, 王文桥. 番茄灰霉病菌对咯菌腈的抗性诱变及抗药突变体的生物学特性[J]. 农药学学报, 2012, 14(5): 497502.
[18]赵卫松, 韩秀英, 齐永志, 等. 辣椒疫霉对双炔酰菌胺的敏感性测定及其抗药突变体生物学性状研究[J]. 农药学学报, 2011, 13(1): 2127.
[19]LU Xiaohong, HAUSBECK M K, LIU Xili, et al. Wild type sensitivity and mutation analysis for resistance risk to fluopicolide in Phytophthora capsici [J]. Plant Disease, 2011, 95(12): 15351541.
[20]BRUIN G C A, EDGINGTON L V. Induction of fungal resistance to metalaxyl by ultraviolet irradiation [J]. Phytopathology, 1982, 72(5): 476480.
[21]LU Xiaohong, ZHU Shusheng, BI Yang, et al. Baseline sensitivity and resistancerisk assessment of Phytophthora capsici to iprovalicarb [J]. Phytopathology, 2010, 100(11): 11621168.
[22]ZHOU Yuxin, CHEN Lei, HU Jian, et al. Baseline sensitivity of natural population and resistance risk of Peronophythora litchii to four novel QoI fungicides [J]. European Journal of Plant Pathology, 2016, 146: 7183.
[23]朱孟烽, 吴伟怀, 贺春萍, 等. 咖啡腐皮镰孢黑果病病原鉴定及其生物学特性测定[J]. 热带作物学报, 2021, 42(3): 822829.
[24]SUMMERELL B A, SALLEH B, LESLIE J F. A utilitarian approach to Fusarium identification [J]. Plant Disease, 2003, 87(2): 117128.
[25]呂国忠, 赵志慧, 孙晓东, 等. 串珠镰孢菌种名的废弃及其与腾仓赤霉复合种的关系[J]. 菌物学报, 2010, 29(1): 143151.
[26]柳凤, 詹儒林, 韦继光, 等. 现代生物技术在镰刀菌分类学中的应用[J]. 中国农学通报, 2012, 28(30): 166170.
[27]刘长令. 农用杀菌剂开发的新进展[J]. 农药科学与管理, 2000(3): 2026.
[28]HAGIWARA D, MATSUBAYASHI Y, MARUI J, et al. Characterization of the NikA histidine kinase implicated in the phosphorelay signal transduction of Aspergillus nidulans, with special reference to fungicide responses [J]. Bioscience Biotechnology & Biochemistry, 2007, 71(3): 844847.

