施万细胞条件敲除SEMA3B 通过AKT/GSK3β 信号通路抑制神经损伤后的华勒变性
徐元涛,许逸舟,许淑怡,马心蕊,王祥海,朱立新,郭家松
1.南方医科大学珠江医院脊柱外科,广州 510510;2.南方医科大学基础医学院组织胚胎学教研室,广州510515
Semaphorin 3B(SEMA3B)是Semaphorin 家族成员,过去认为它主要表达于中枢神经系统,能在中枢神经系统发育时引导神经突起的生长[1,2],也能对中枢神经损伤后的轴突再生发挥抑制作用[3]。过表达SEMA3B 可减轻神经元凋亡并且增加突触相关蛋白的表达,从而改善小鼠的抑郁行为[4]。随着研究的深入,人们发现它还可以参与调节血管或淋巴管生成以及肿瘤进展等生物学功能[5,6]。然而SEMA3B 在周围神经损伤后华勒变性过程中的作用以及对施万细胞去分化的影响尚未有人报道。
周围神经损伤后,受损神经远端的轴突和髓鞘出现崩解和清除,这一过程被称为华勒变性,这可为随后的神经再生提供有利微环境。而施万细胞在这过程中扮演着非常重要角色,周围神经的髓鞘由施万细胞形成,随着髓鞘崩解,施万细胞开始去分化。去分化的施万细胞能够分泌因子募集巨噬细胞,其本身也能够协助巨噬细胞共同清理轴突和髓鞘碎片。文献显示SEMA3B 在不同细胞的不同生物学活动中可能通过不同的信号分子发挥作用[5,7~9]。在分析已知的SEMA3B 下游信号分子时,我们发现其中AKT、ERK和JNK 等与施万细胞分化或去分化有着密切关系[10~13],这提示SEMA3B 可能通过调控施万细胞去分化而影响神经损伤后华勒变性过程。为了验证我们的假设,本研究采用施万细胞条件敲除小鼠,通过体内外模型检测SEMA3B 基因敲除对施万细胞去分化及华勒变性的影响并探讨了其中的机制。
1 材料和方法
1.1 动物及模型建立
本实验使用的施万细胞条件敲除SEMA3B 小鼠基因型为dhh-Cre+/SEMA3Bflox/flox(cKO,来自Jackson 实验室),其同窝的dhh-Cre+(Cre)小鼠用作对照组。小鼠采用常规PCR 方法进行鉴定,8 周龄时用于建立体内外华勒变性模型:小鼠经三溴乙醇(180 mg/kg)麻醉后,对坐骨神经进行钝性分离,于坐骨切迹外侧0.5 cm 将神经完全横断,术后5 d 取材,将横断远端神经用于免疫荧光或蛋白免疫印迹检测。另外,由于体内模型中巨噬细胞对华勒变性的影响巨大,为了更加清晰显示施万细胞本身对华勒变性的影响,我们还建立了能排除巨噬细胞募集的体外模型,即将坐骨神经分离后取出并裁剪为5 mm 长的小段,然后用含10%血清的DMEM/F12 培养液在体外培养5 d,然后也进行免疫荧光或蛋白免疫印迹检测。
1.2 冰冻切片制作
体内模型动物术后5 d 按常规方法经心脏使用4%多聚甲醛灌注固定后取横断伤处远端坐骨神经并进行24 h 后固定。体外模型的神经培养5 d 后直接用4%多聚甲醛固定24 h。固定后的标本经30%蔗糖脱水24 h、OCT 包埋后进行冰冻切片,制成厚度为10μm的横切片,然后进行常规免疫荧光染色。
1.3 免疫荧光染色
用PBS 清洗神经组织冰冻切片3 次,每次10 min。用0.1%Triton X-100 透膜30 min,5 % Gelatin 封闭1 h。加入以下一抗:NF (1:400,Sigma-Aldrich)、MBP (1: 400,Merck Millipore)、c-Jun(1: 200,BD Biosciences)、MAG(1:200,Abcam),4℃孵 育24h 后PBS 漂洗3 次,Alexa 488 或568 荧光标记二抗(1:800)室温避光孵育2 h,最后使用封片剂封片。
1.4 蛋白免疫印迹
体内模型动物术后5 d 再次麻醉动物,取出横断远端神经(1.0 cm),体外模型则在第5 天直接取出培养的神经。组织经PBS 清洗后用RIPA 裂解液常规技术提取总蛋白。蛋白质样本在10%十二烷基硫酸钠盐-聚丙烯酰胺凝胶电泳凝胶上分离,并转移至聚偏二氟乙烯膜上。然后,用5%脱脂牛奶封闭1 h、与一抗孵育过夜、二抗孵育2 h。最后,使用ECL 化学发光剂进行显影。所使用的抗体如下:NF (1:800,Sigma-Aldrich)、MBP (1:1000,Merck Millipore)、c-Jun(1:800,BD Biosciences)、MAG(1:800,Abcam)、AKT(1:1000,Abclonal)、P-AKT(1:1000,Abclonal)、GSK3β(1:1500,Cell signaling)、p-GSK3β(1:1500,Cell signaling)、JNK(1:1000,Abclonal)、p-JNK(1:1500,Abclonal)、ERK(1:1000,Abclonal)、p-ERK(1:1500,Abclonal)。
1.5 逆转验证实验
按上述方法建立体外华勒变性模型,然后在培养液中加入浓度为79 μmol/L 的SC79 (SF2730,碧云天),对照组不做加药处理,培养5 d 后按上述方法进行免疫荧光或蛋白免疫印迹检测。
1.6 统计分析
本研究使用SPSS 20.0 软件(IBM)进行统计分析。用于t检验来比较两组之间数值差异。方差分析(one-way ANOVA,Bonferroni post hoc comparison)比较多组间差异,P<0.05 被认为具有统计学差异。所有数据均以平均值±标准差(Mean±SEM)展示,用Photoshop CS5(Adobe)软件处理荧光图片以及论文作图,用GraphPad Prism (GraphPad Software)软件进行统计作图。
2 结果
2.1 施万细胞敲除SEMA3B 增加了华勒变性过程中轴突及髓鞘的残留
以往的报道以及我们的研究均显示损伤远端神经中的NF 和MBP 的蛋白表达水平随着华勒变性进程而逐渐减低,且NF 和MBP 阳性的轴突或髓鞘逐渐减少[14,15]。所以本研究通过蛋白免疫印迹和免疫荧光比较了体内和体外模型中NF 和MBP 的蛋白表达水平和NF 阳性轴突和MBP 阳性髓鞘残留在cKO 和Cre组之间的差异。蛋白免疫印迹结果显示,不论是体内模型还是体外模型,cKO 组的NF 和MBP 蛋白水平均显著高于Cre 组(图1A-C,G-I)。免疫荧光则显示体内和体外模型中轴突和髓鞘结构均呈现不同程度的肿胀、松散及崩解状态,但是它们的残留量均是cKO组大于Cre 组(图1D-F,J-M)。
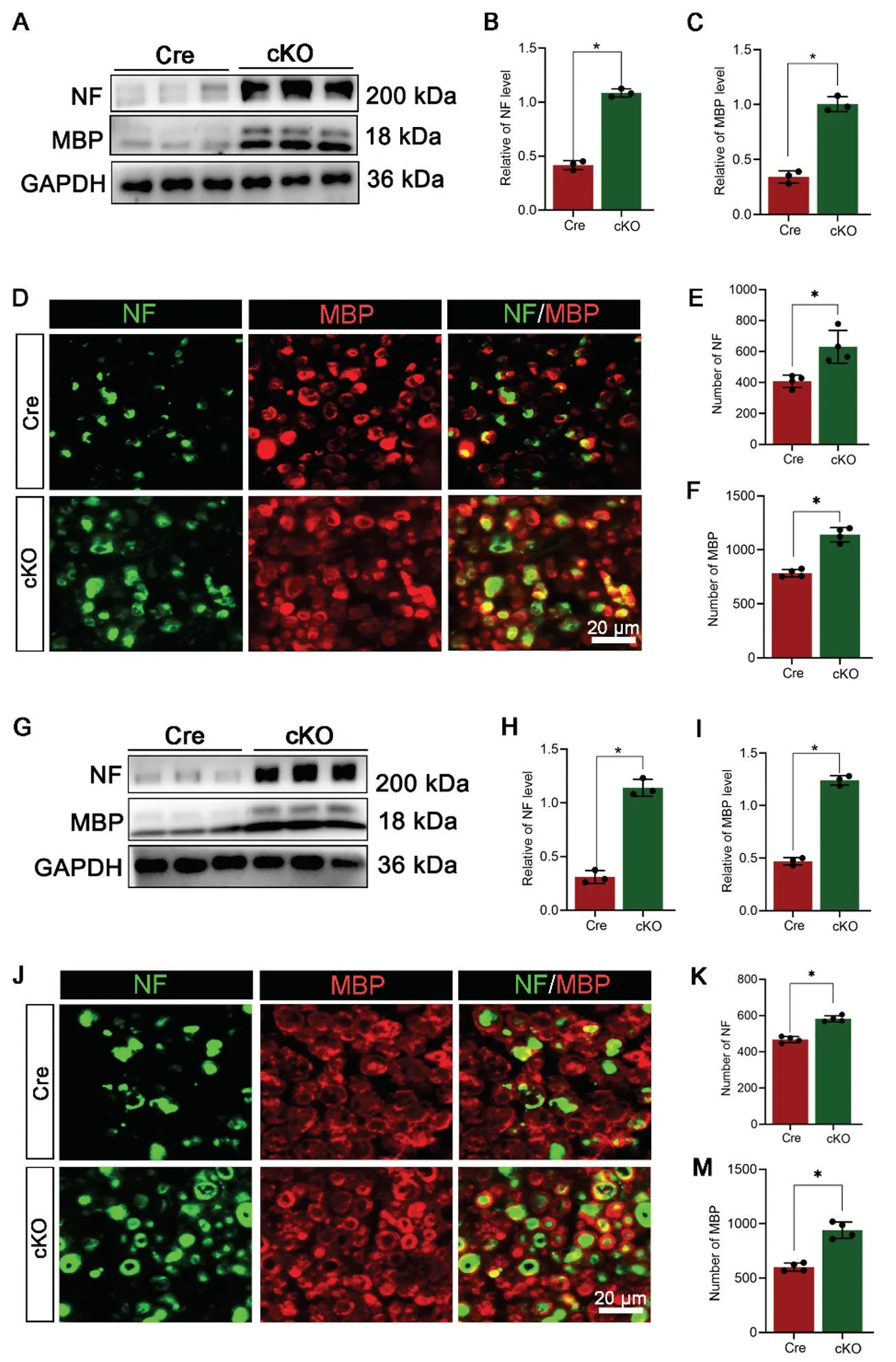
图1 施万细胞敲除SEMA3B 可增加华勒变性过程中轴突及髓鞘的残留A-C:蛋白质印迹显示损伤后5d 的NF 和MBP 水平,n=3 D-F:免疫荧光染色显示受损神经中残留的轴突和髓鞘,n=4 G-I:体外外植块培养5d 蛋白质印迹,n=3 J-M:体外免疫荧光染色结果, n=4 *P<0.05Fig.1 Schwann cellspecific knockout of SEMA3B increased the residual axon and myelin during Wallerian degeneration.A-C: Western blotting showed that the levels of NF and MBP after 5 days of injury (dpi),n=3; D-F:Immunofluoresence showed that the NF positive axons and MBP positive myelin in the injured nerve, n=4; G-I: Western blotting results of the in vitro model at 5 days,n=3; J-M:Immunofluorescence results of the in vitro model, n=4;*P<0.05
2.2 敲除SEMA3B 可抑制施万细胞去分化
在正常神经中成熟分化的施万细胞中高表达MAG、MBP 和P0 等标志性蛋白,而幼稚或去分化状态的施万细胞则表达c-Jun、p75 等蛋白[16]。所以本研究选择c-Jun 和MAG 分别作为施万细胞去分化和分化程度的标志物在体外模型评判SEMA3B 敲除对施万细胞去分化的影响。蛋白免疫印迹结果显示,cKO组c-Jun 水平低于Cre 组,而cKO 组MAG 水平明显升高(图2A-C)。免疫荧光结果同样显示cKO 组的c-Jun阳性荧光强度明显低于Cre 组,而MAG 荧光强度明显高于Cre 组(图2D-F)。这些数据表明SEMA3B 缺失延缓了损伤神经中的施万细胞去分化。
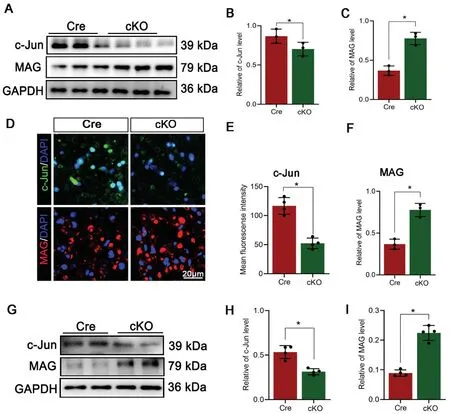
图2 特异性敲除SEMA3B 可抑制施万细胞去分化A-C:体外植块培养5 d 后检测c-Jun 和MAG 蛋白质水平表达, n=3 D-F:免疫荧光染色检测c-Jun 和MAG 结果, n=4 *P<0.05Fig.2 Specific SEMA3B knockout inhibited Schwann cells dedifferentiationA-C: Western blotting showed the protein levels of c-Jun and MAG in the nerve explants, n=3; D-F: Immunofluorescence showed the c-Jun and MAG expression in the cross sections of the nerve explants, n=4;*P<0.05
2.3 SEMA3B 通过AKT/GSK3β 影响华勒变性
如前所述,文献显示SEMA3B 可以影响AKT、GSK3β、ERK、JNK 等信号分子的表达,且这些分子与施万细胞分化和去分化有密切关系,所以我们通过蛋白免疫印迹检测了这几个分子的总蛋白及其磷酸化水平。结果显示,Cre 组与cKO 组之间ERK 和JNK的总蛋白和磷酸化水平均无显著差异。而cKO 组的AKT 和GSK3β 的磷酸化水平(p-AKT/AKT、p-GSK3β/GSK3β)均显著低于Cre 组(图3)。
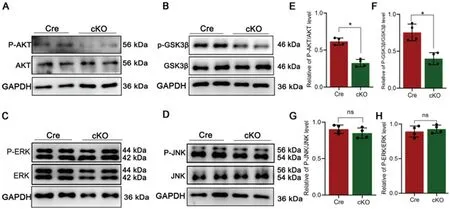
图3 Western blotting 显示AKT、GSK3β、ERK、JNK 总蛋白及其磷酸化水平的差异, n=4,*P<0.05Fig.3 Western blotting showed the expression level of AKT,GSK3β,ERK,JNK and their phosphorylation levels, n=4,*P<0.05
为了进一步确认SEMA3B 敲除是否因为AKT 通路活性下降导致华勒变性的进展减慢,我们在cKO组体外模型中添加AKT 激动剂(SC79)。免疫荧光染色结果显示,与不加激动剂的cKO 组相比,加入SC79的cKO 组中NF 阳性轴突和MBP 阳性髓鞘的数量明显减少,比较接近Cre 组的水平(图4A-C)。蛋白免疫印迹结果显示NF 及MBP 的蛋白的变化也呈现类似的变化趋势(图4D-F)。这些结果提示,激活AKT 信号通路可逆转SEMA3B 条件敲除对华勒变性的抑制作用。
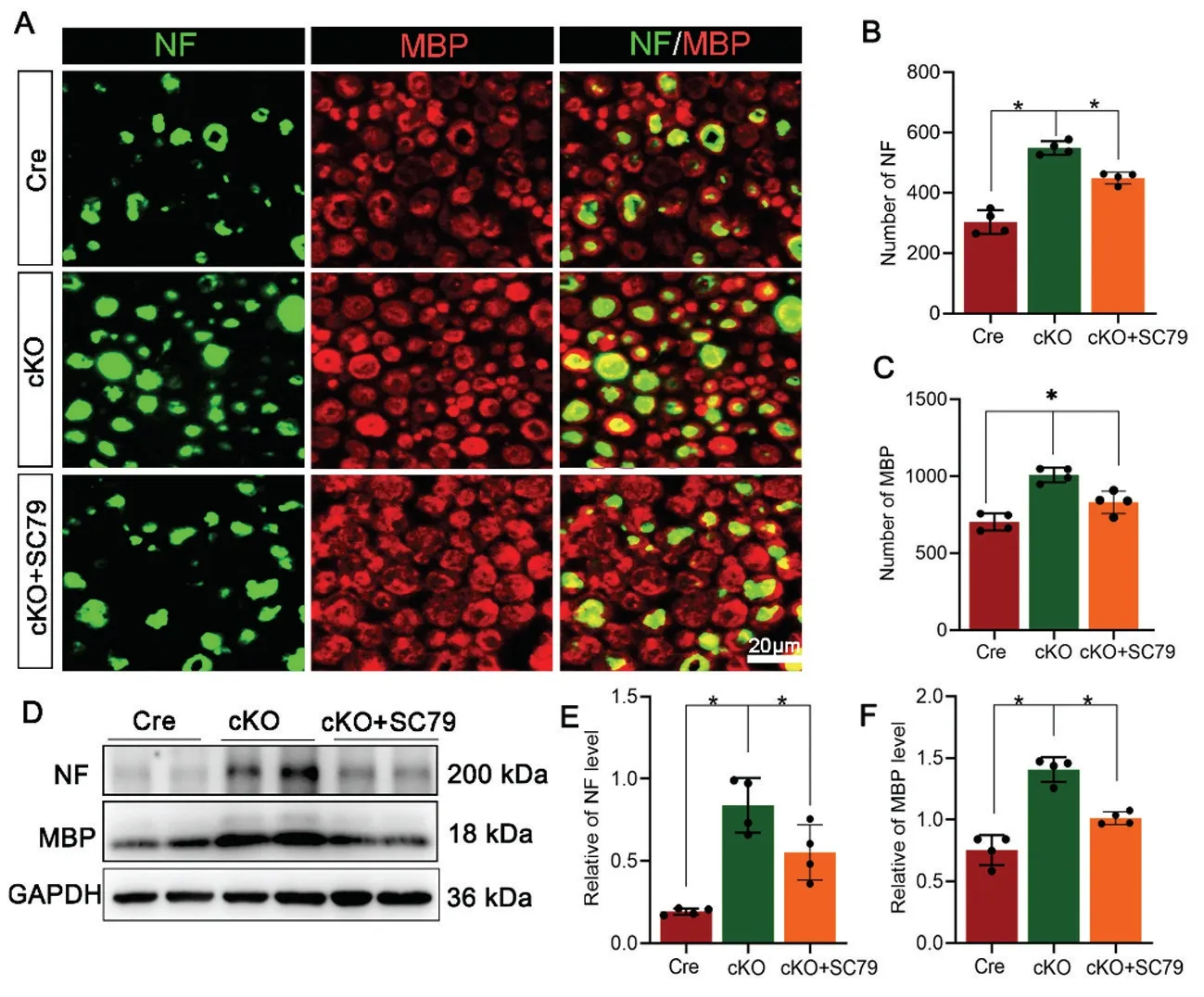
图4 SC79 处理对NF 和MBP 表达的影响A-C:免疫荧光显示体外模型中的NF 阳性轴突残余和MBP 阳性的髓鞘残余,n=4 D-F:蛋白质印迹显示NF 及MBP 的蛋白水平, n=4 *P<0.05Fig.4 Effects of SC79 treatment on the NF and MBP expressionA-C: Immunofluoresence showed that the NF positive axons and MBP positive myelin in vitro model, n=4; D-F:Western blotting results of the in vitro model, n=4;*P<0.05
3 讨论
Semaphorin 家族是一类能够具有轴突指导作用的家族,而SEMA3B 属于其中的第3 类,主要在轴突指导、血管生成、免疫调节以及肿瘤抑制方面起到十分重要的作用[1,5,8]。研究发现SEMA3B 在神经系统中能够起到调节轴突伸长的作用[17],但在周围神经损伤华勒变性过程作用却未见人报道。现在越来越多的证据显示加速华勒变性在神经再生中的作用非常重要[18]。华勒变性主要表现在受损神经远端的轴突和髓鞘溃变、崩解和被清除[19]。施万细胞去分化在上述过程发挥主要的作用,而文献提示SEMA3B 已知的下游信号分子中AKT、ERK 和JNK 能够调控施万细胞去分化,于是我们推测SEMA3B 可能通过影响施万细胞去分化从而影响华勒变性。
本研究发现施万细胞敲除SEMA3B 小鼠的损伤神经中华勒变性减慢,主要表现为残留的轴突和髓鞘增多。由于周围神经损伤后会有大量巨噬细胞被募集到损伤处参与轴突和髓鞘碎片的吞噬和清除。所以仅凭体内实验很难判断施万细胞本身清除轴突和髓鞘碎片的能力如何,因此我们又建立了体外华勒变性模型,这个模型可以排除巨噬细胞的募集,轴突和髓鞘碎片的清除主要是依靠施万细胞。结果显示体外模型得到了与体内模型一致的结果,这就能非常明确提示SEMA3B 在施万细胞参加华勒变性过程中发挥重要的调控作用。
接下来本研究检测了施万细胞的去分化。因为在周围神经损伤后的华勒变性过程中,施万细胞发生去分化、增殖、迁移和分泌等活动进而影响华勒变性和神经再生[20]。然而,这些功能都必须是在完成去分化的前提下,所以施万细胞去分化的意义重大。本研究的蛋白质印迹以及免疫荧光染色结果均显示敲除SEMA3B 会导致c-Jun 表达下调而MAG 表达升高,提示施万细胞的去分化程度减慢。随后对可能信号分子的检测显示SEMA3B 敲除并不影响ERK 和JNK 的表达水平和磷酸化水平,但是降低了p-AKT/AKT 和p-GSK3β/GSK3β 的比值,这些结果表明SEMA3B 敲除可抑制AKT 和GSK3β 的活化。已知AKT 可以通过GSK3β 对施万细胞的多项生物学功能发挥重要的调控作用,这提示我们SEMA3B 很有可能是通过AKT/GSK3β发挥了对华勒变性的影响。因 为SEMA3B 敲除会降低AKT 的活性,于是我们使用AKT 的激动剂进行验证实验,结果显示它确实能逆转SEMA3B 敲除导致的华勒变性减慢。综合本研究所有的实验结果,我们可以得出结论,施万细胞敲除SEMA3B 后延缓了华勒变性过程,这可能是SEMA3B施万细胞去分化减慢导致的结果。