安徽省5株新型鹅星状病毒的分离鉴定与遗传进化分析
贾北平, 吕 炫, 杨 庆, 王一楠, 李皖萧, 解新迪, 朱英奇, 王 蓓, 殷冬冬,张云凯, 王 晴, 王桂军,*
(1.安徽农业大学 动物科技学院,安徽 合肥 230036; 2.安徽省农业科学院 畜牧兽医研究所,安徽 合肥 230001; 3.合肥华盟生物技术有限公司,安徽 合肥 231131)
近年来,在我国安徽、山东、河南和福建等省均爆发了雏鹅痛风病。该病的病原为新型鹅星状病毒(GAstV)[1-2],以内脏、关节中的尿酸盐沉积为主要表现特征[3-4],会导致雏鹅生长迟缓、瘫痪,甚至死亡,严重影响养鹅产业的健康发展。
GAstV属于星状病毒科禽星状病毒属,是一种二十面体的无囊膜的单股正链RNA病毒[5-6]。禽星状病毒的基因组全长一般在6.9~7.9 kb[7-8],主要由5′非编码区(5′UTR)、3个开放阅读框(ORF)(分别为ORF1a、ORF1b和ORF2)、3′非编码区(3′UTR)和1个多聚A尾组成[9-10]。其中,ORF2编码衣壳蛋白(capsid),是病毒的结构蛋白,也是主要毒力蛋白[11-12]。GAstV的体外分离培养比较困难,目前主要在原代鹅胚肾细胞(GEK)[13]、鸡肝癌细胞(LMH)[14-15]和9~11日龄的鹅胚[16-17]中进行分离和培养。
由GAstV引起的雏鹅痛风病主要侵害3周龄以内的雏鹅[18],患病雏鹅生长缓慢、瘫痪,甚至死亡[19-20]。对发病雏鹅解剖可见,肝、肾、心脏等器官,及腿关节有明显的尿酸盐沉积[21]。本研究对2018—2021年采集的患病雏鹅的病料进行逆转录聚合酶链反应(RT-PCR)鉴定,通过分离培养获得多株GAstV毒株,开展全基因组测序,分析其ORF1a、ORF1b、ORF2基因与其他毒株的同源性,及与以往年份毒株氨基酸变异位点的差异,同时构建系统发育树,分析各毒株的遗传进化关系,旨在为鹅星状病毒的深入研究奠定基础,同时也可为安徽省鹅星状病毒的诊断与防控提供技术支持。
1 材料与方法
1.1 主要材料与试剂
2018—2021年于安徽省内多个养殖场采集疑似GAstV感染病料,保存于-80 ℃冰箱。健康鹅胚购自南京竹顺生物技术有限公司。
RNAeasyTM动物RNA抽提试剂盒、BeyoRTTMII cDNA第一链合成试剂盒,购自上海碧云天生物技术有限公司;2×TaqPlus Master Mix Ⅱ购自南京诺唯赞生物科技股份有限公司;pMD19-T载体、大肠埃希菌感受态细胞DH-5α,购自宝日医生物技术(北京)有限公司;StarPrep快速DNA胶回收试剂盒购自北京康润诚业生物科技有限公司;质粒提取试剂盒购自天根生化科技(北京)有限公司。
1.2 病例背景
2018年5月—2021年10月,安徽省多个鹅场先后爆发有雏鹅痛风症状的传染病,死亡雏鹅剖检可见明显的尿酸盐沉积等病理变化。本研究采集到多份病例(表1),发病鹅的品种包括朗德鹅、泰州白鹅、皖西白鹅,系10~40日龄的雏鹅,在临床上表现出采食量下降或废绝、排白色稀便、瘫痪等症状,死亡率在5.0%~77.8%。剖检病变情况如下:病料1,肾肿大发白,肝表面有白色尿酸盐沉积,胆囊呈绿色;病料2,肾出血肿大、有尿酸盐沉积,肝表面出血,胆汁发黄有颗粒物;病料3,输尿管尿酸盐沉积,脑膜出血;病料4,肾发白,输尿管尿酸盐沉积,心、肝表面白色尿酸盐沉积,脑出血;病料5,肾肿大,花斑肾,输尿管有尿酸盐沉积,肝表面可见尿酸盐沉积。
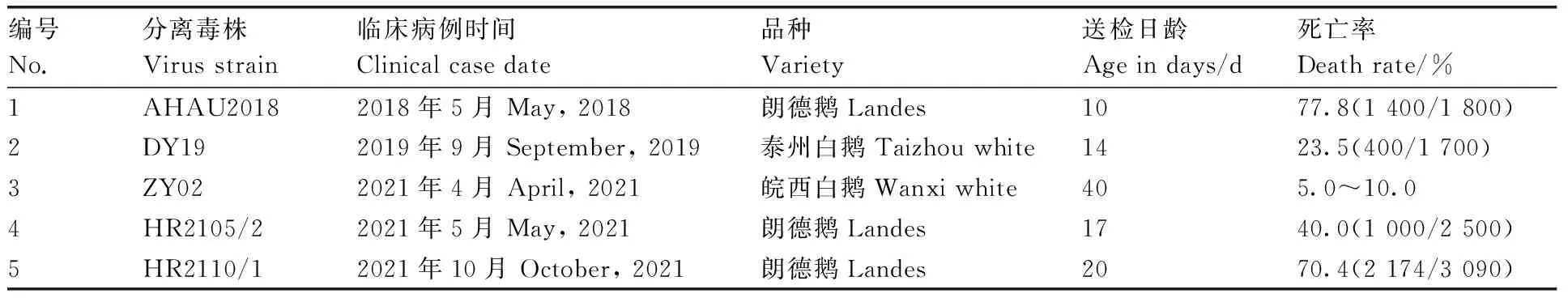
表1 雏鹅病例的基本情况Table 1 Basic information of gosling cases
1.3 病料的采集与处理
剖检雏鹅后,采集尿酸盐沉积明显的雏鹅心、肾、肝组织,分别取各组织的2/3保存于-80 ℃冰箱,用于后续检测;另外1/3室温保存于4%多聚甲醛溶液中,用于组织病理学观察。
从-80 ℃冰箱取出冻存的病料组织,用充分消毒的剪刀取等量雏鹅的心、肝、肾组织共1 g于研钵中,加入5 mL无菌PBS缓冲液充分研磨。收集病料研磨液,加入青霉素与链霉素,-80 ℃冷冻20 min后,室温解冻,反复冻融3次后,将研磨液在4 ℃、12 000×g条件下离心10 min,吸取上清,经0.22 μm滤器过滤后保存于-80 ℃冰箱,用于后续试验。
1.4 RT-PCR检测
取上述处理好的病毒液,用RNAeasyTM动物RNA抽提试剂盒提取RNA,用BeyoRTTMII cDNA第一链合成试剂盒进行反转录,将得到的cDNA产物置于-20 ℃冰箱备用。针对GAstV设计、合成PCR检测引物[引物序列(5′→3′)分别为AGAAGGTGCGGAAGAGTGGTATGA、GCGAAGAGTGCGTAAGAGGTTGT],用上述制备的cDNA作为模板,对病料进行RT-PCR检测(退火温度55 ℃,目的片断大小为300 bp)。同时,用针对鸭坦布苏病毒(DTMUV)、禽流感(AIV)、禽腺病毒(FAdV)、鸭乙型肝炎病毒(DHBV)、鸭呼肠孤病毒(DRV)和鹅细小病毒(GPV)等设计的特异性引物对病料进行RT-PCR检测,判定病料中是否存在其他常见的外源性病毒。取PCR产物进行琼脂糖凝胶电泳,观察结果。
1.5 GAstV的分离鉴定
取健康鹅胚在孵化箱内孵化至9日龄,通过绒毛尿囊膜途径分别接种各组阳性样品的病毒液(每组接种3枚,每枚胚的接种剂量为200 μL),并设立使用PBS缓冲液的阴性对照组。接种完成后,将鹅胚放入孵化箱中继续生长,每12 h照胚检查一次,观察并记录鹅胚的存活情况。弃去接种后24 h之内死亡的鹅胚。将1~7 d死亡的鹅胚及时取出。病毒接种7 d后收取其余鹅胚,放入4 ℃冰箱处死。
确定调度系统出现异常后,对操作人员进行告警。报警处理分两种方式,一种是事故报警,另一种是预告报警。前者包括非操作引起的断路器跳闸和保护装置动作信号。后者包括状态异常信息、模拟量越限/复限、计算机站控系统部件以及间隔层单元的状态异常等。
于无菌条件下打开鹅胚,收集尿囊液与胚体,观察病变。取胚体肝,研磨,离心,收取上清液,反复冻融。将上清液与尿囊液过滤除菌后继续接种于下一代鹅胚中,按此方法传3~5代。
将上述处理好的尿囊液与胚体研磨上清液一起提取RNA并进行RT-PCR检测,检测引物同1.4节。
1.6 GAstV的全基因组测序
根据GenBank收录的GAstV全基因组序列(来源于SD01株,GenBank登录号:MF772821),设计7对引物(表2),包含病毒的全基因组且相互重叠。引物委托南京擎科生物科技有限公司合成。

表2 GAstV全基因测序引物的基本信息Table 2 Basic information of primers for genome sequencing of GAstV
取上述分离到的GAstV各毒株的F3代病毒液进行RNA提取与反转录,其中,反转录引物使用各段测序引物的下游引物。利用设计的引物对各毒株的全基因组序列分段扩增,取PCR产物经凝胶回收后连接T载体,委托南京擎科生物科技有限公司测序。
1.7 GAstV的遗传进化分析
利用MegAlign软件对本研究分离到的毒株与其他人分离得到的毒株的ORF1a、ORF1b、ORF2基因进行核苷酸同源性分析。用到的其他毒株具体包括:JSHA(分离于2016年),GenBank登录号为MK125058;SD01(分离于2017年),GenBank登录号为MF772821;GD(分离于2017年),GenBank登录号为MK125058;SDPY(分离于2017年),GenBank登录号为MH052598;GXZ(分离于2018年),GenBank登录号为MH807626;GTF-04(分离于2018年),GenBank登录号为MN068023;GTF-07(分离于2018年),GenBank登录号为MN068024;AHAU1(分离于2018年),GenBank登录号为MN428641;AHAU4(分离于2018年),GenBank登录号为MN428644;XX(分离于2018年),GenBank登录号为MN337323;SDXT(分离于2019年),GenBank登录号为MN399857;HBXG(分离于2019年),GenBank登录号为MN894548;HNKF-1(分离于2020年),GenBank登录号为MW592377;HNSQ-6(分离于2020年),GenBank登录号为MW592378;HR2105/1(分离于2021年),GenBank登录号为OM066892;ZM(分离于2021年),GenBank登录号为MZ648231。
利用MEGA 7软件,基于本研究分离到的毒株与其他毒株的ORF2基因的核苷酸序列和编码的氨基酸序列构建系统进化树,分析其遗传进化关系。同时,利用MEGA 7软件,选取不同种属的星状病毒(包括哺乳动物星状病毒和禽星状病毒),根据其全基因组构建系统进化树,分析GAstV与其他星状病毒的亲缘关系。
2 结果与分析
2.1 患病雏鹅的临床观察与剖检
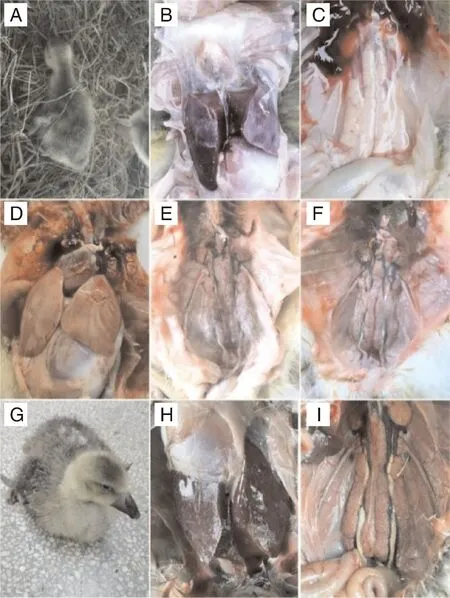
A~C,病例1的临床观察和剖检变化;D~F,病例2的剖检变化;G~I,病例3的临床观察和剖检变化。A-C, Clinical observation and autopsy changes of case No. 1; D-F, Changes in autopsy of case No. 2; G-I, Clinical observation and autopsy changes of case No. 3.图1 临床发病雏鹅的临床观察与解剖变化Fig.1 Clinical observation and anatomical changes of diseased goslings
2.2 临床病料的RT-PCR检测结果
RT-PCR检测结果显示,5例病例均系GAstV阳性,扩增片段的大小符合预期(图2),并且无外源性病毒感染,可确诊为GAstV感染。
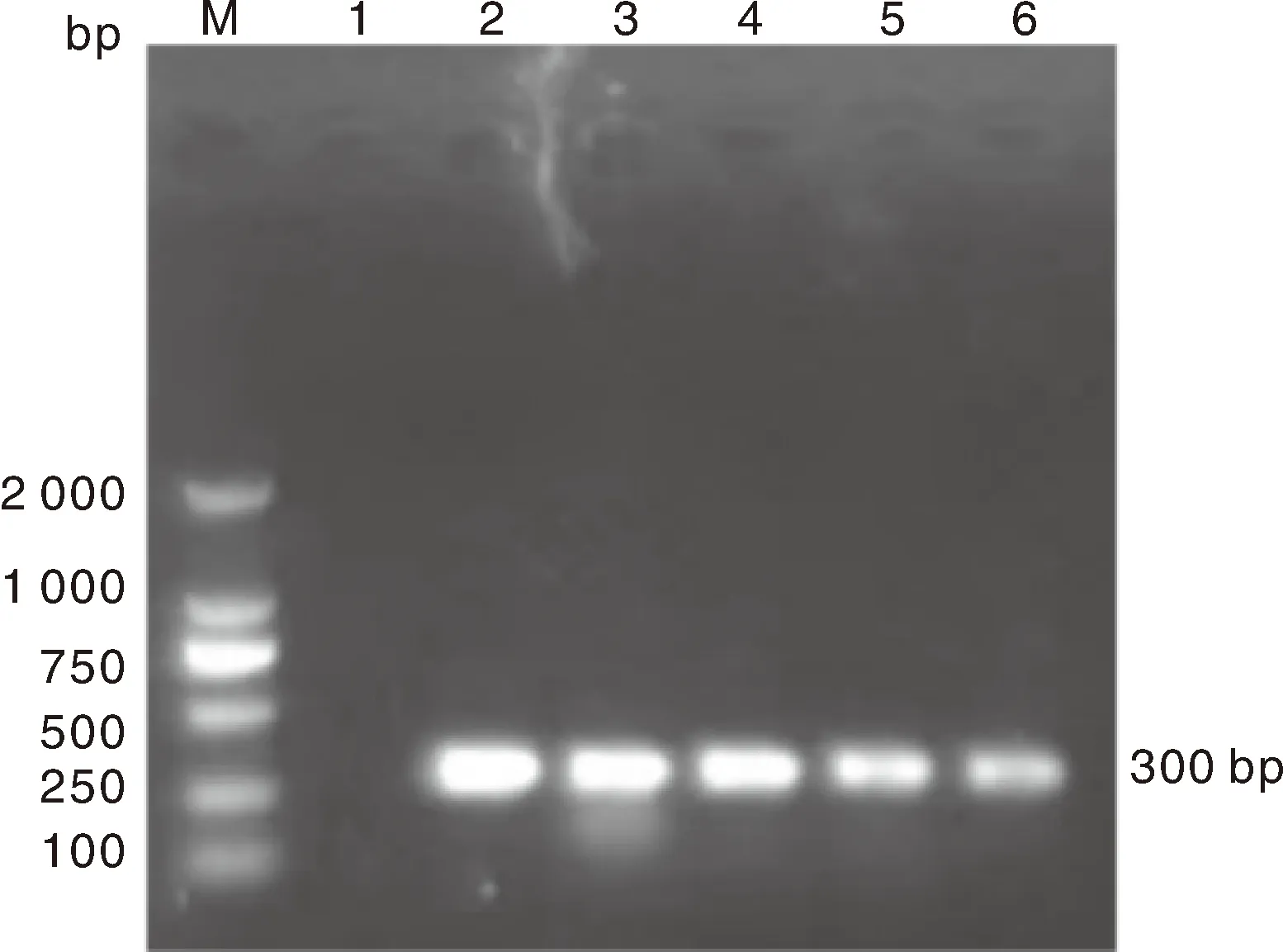
M,DL2000 DNA分子量标记;1,阴性对照;2~6依次对应于病例1~病例5。M, DL 2000 DNA marker; 1, Negative control; 2-6, Case 1-5, correspondingly.图2 临床病例的RT-PCR检测结果Fig.2 RT-PCR results of clinical cases
2.3 GAstV的分离鉴定
采集GAstV阳性雏鹅的肾和肝,研磨过滤除菌后接种于9~11日龄健康鹅胚中,盲传3代,分离得到5株新型鹅星状病毒,分别命名为AHAU2018株、DY-19株、ZY02株、HR2105/2株、HR2110/1株。结果显示,阴性对照组鹅胚未出现病变或死亡,未检测到GAstV。各毒株各代次的鹅胚病变基本一致,胚体均表现出全身出血的病变,且随着代次增加,胚体腹腔可见白色尿酸盐沉积病变,部分毒株高代次时鹅胚出现绒毛尿囊膜上蓄积白色尿酸盐的变化。前期低代次的毒株感染鹅胚并未导致鹅胚死亡,但随着代次增加,逐渐有鹅胚死亡,死亡率在20%~30%,死亡时间集中在60~120 h。其中,HR2105/2株可见胚体严重出血(图3),ZY02株可见胚体出血,解剖可见腹腔有白色尿酸盐沉积。RT-PCR检测结果显示,各组F3代尿囊液均系GAstV阳性(图4)。综上,分离得到的各毒株均可在鹅胚上稳定增殖传代,并能引起鹅胚胚体广泛性出血、胚体腹腔有白色尿酸盐沉积等稳定病变,可致鹅胚死亡。
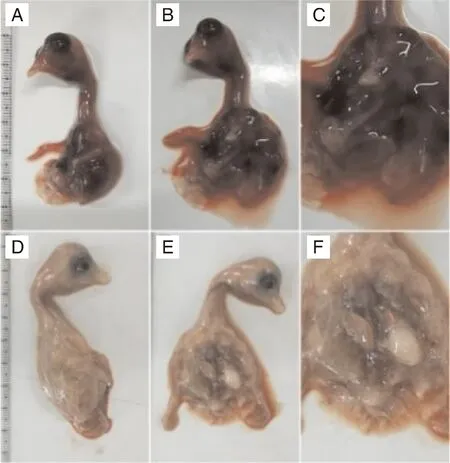
图3 HR2105/2株(A~C)和ZY02株(D~F)GAstV接种鹅胚的病变图Fig.3 Pathological changes of goose embryos inoculated with HR2105/2 strain (A-C) and ZY02 strain (D-F) of GAstV
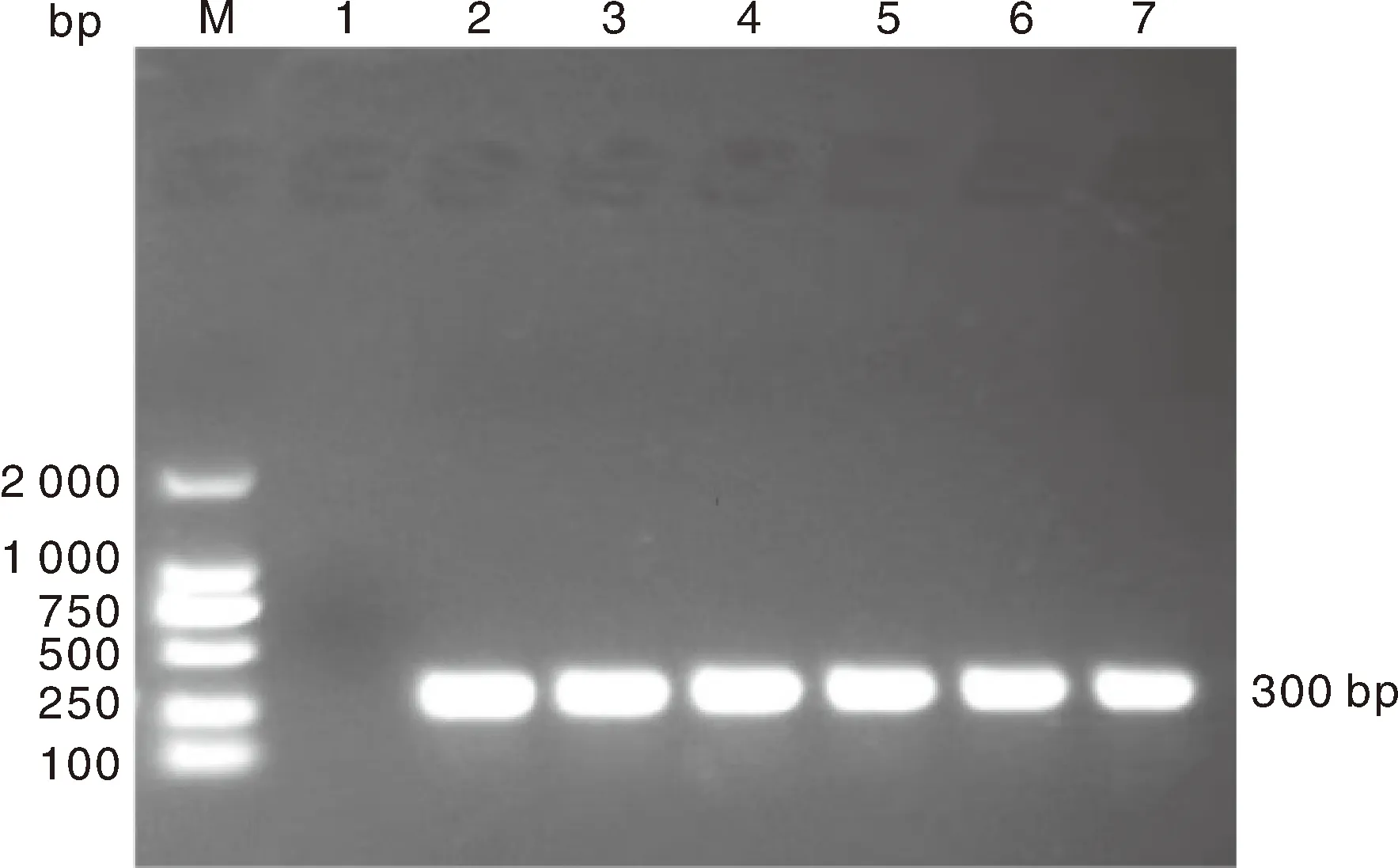
M,DL2000 DNA分子量标记;1,阴性对照;2,阳性对照;3,AHAU2018株;4,DY-19株;5,ZY02株;6,HR2105/2株;7,HR2110/1株。M, DL2000 DNA Marker;1, Negative control; 2, Positive control; 3, AHAU2018 strain; 4, DY-19 strain; 5, ZY02 strain; 6, HR2105/2 strain; 7, HR2110/1 strain.图4 F3代鹅胚尿囊液的RT-PCR检测结果Fig.4 RT-PCR detection results of allantoic fluid from F3 generation goose embryos
2.4 GAstV毒株的全基因组测序结果
全基因组测序结果表明,本研究分离的5株毒株的全长均为7 175 nt,包括10 nt的5′UTR和236 nt的3′UTR,以及3个ORF(分别编码ORF1a、ORF1b和ORF2蛋白)(图5)。ORF1a长3 255 nt,ORF1b长1 551 nt,两者编码鹅星状病毒的非结构蛋白,包含跨膜域、丝氨酸蛋白酶、卷曲螺旋、病毒基因组连接蛋白、核定位信号和RNA依赖性RNA聚合酶;ORF2长2 115 nt,编码病毒衣壳蛋白。
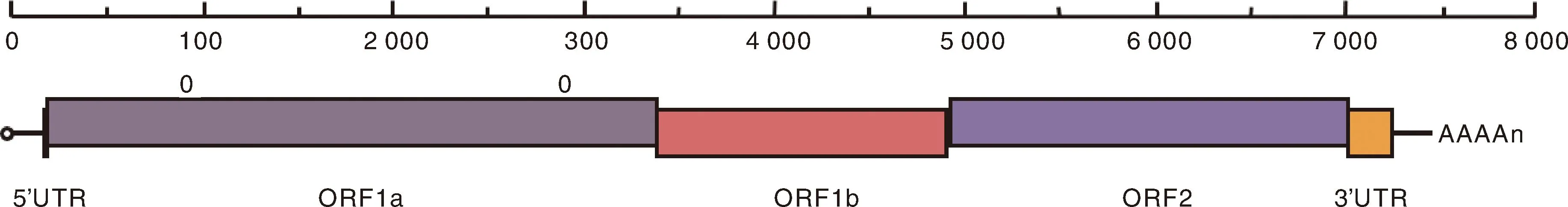
图5 GAstV分离株的基因组结构Fig.5 Genome structure of GAstV strain
将AHAU2018、DY-19、ZY02、HR2105/2、HR2110/2株GAstV的全长序列提交至GenBank数据库,登录号分别为ON205965、MT701902、OM066895、OM066893、OM066894。
2.5 GAstV毒株的遗传进化分析
对分离毒株核苷酸的同源性进行分析(表3),结果显示,AHAU2018株(分离于2018年)与分离于2018年前后的毒株的同源性高于与2019年以后分离毒株的同源性;而HR2105/2、HR2110/1、ZY02株(均分离于2021年)与2021年前后分离株的同源性高于与2016—2019年分离毒株的同源性。上述结果表明,GAstV在我国已发生变异。
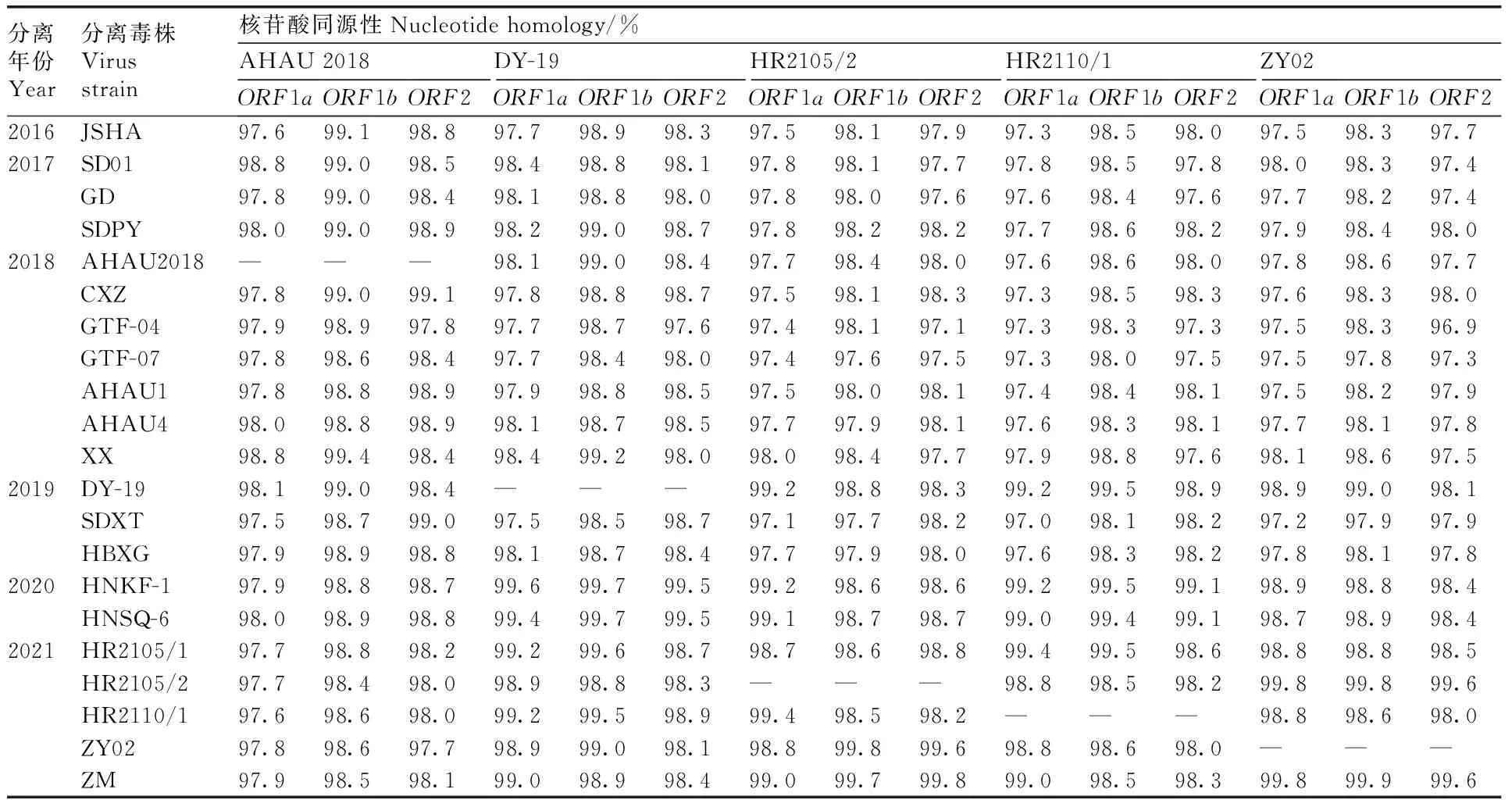
表3 分离毒株ORF1a、ORF1b和ORF2基因的同源性Table 3 Homology analysis of ORF1a, ORF1b and ORF2 genes of GAstV strains
为了探究不同年份GAstV分离毒株之间的差异,本研究选取ORF2基因作为研究对象,构建系统进化树(图6)。结果显示,2019年以前分离的毒株(包括AHAU2018)处于同一个进化亚分支,而2019年以后分离的毒株处于另一个进化亚分支。
将分离到的5株GAstV与已发表的哺乳动物星状病毒和禽星状病毒进行全基因组的核苷酸比对,并构建系统进化树(图7)。结果显示,5株分离毒株均属于目前流行的导致雏鹅痛风的GAstV,其中,AHAU2018株与其他4株分离毒株,以及本实验室2021年分离得到的ZM株(GenBank登录号:MZ648231)和HR2105/1株(GenBank登录号:OM066892)处于同一进化分支的不同进化亚分支上,与上文结果一致。所分离的这5株毒株均不属于TAstV-1、DAstV-2进化分支,与以往分离得到的鹅星状病毒FLX株和AHDY株处于同一进化分支的不同进化亚分支,与哺乳动物星状病毒处于不同的进化分支。
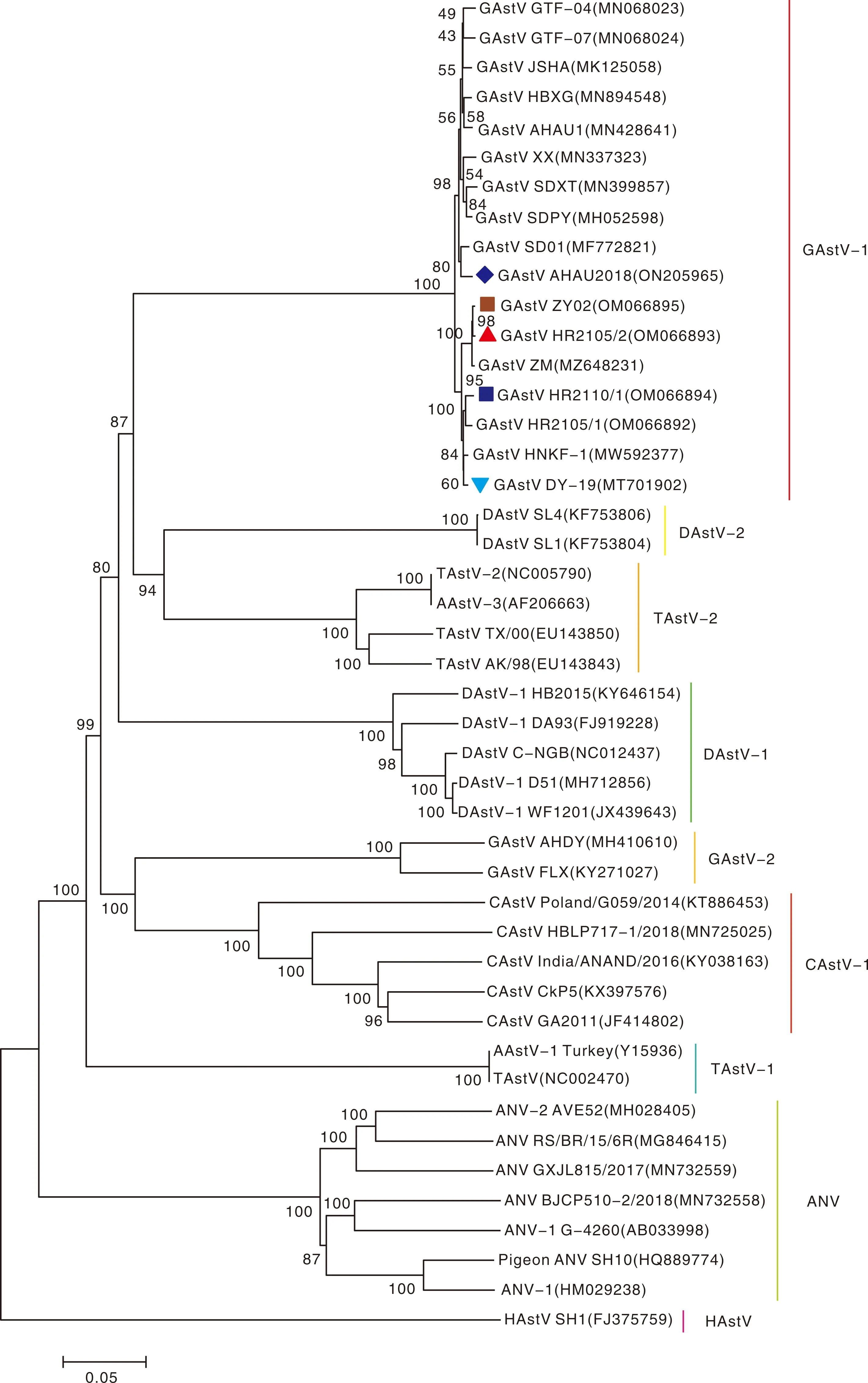
图7 基于星状病毒全基因组的遗传进化分析Fig.7 Genetic evolution analysis based on whole genome of astrovirus
3 讨论
近几年,GAstV感染引起的雏鹅痛风病已经成为制约安徽养鹅产业健康发展的问题之一[22]。该病以雏鹅关节、内脏等产生尿酸盐沉积为典型特征[23-24],可致雏鹅生长迟缓、瘫痪,甚至死亡。本研究于2018—2021年在安徽省内主要养鹅地区采集疑似感染GAstV的病料,并对其进行鉴定、病毒培养、基因组测序和遗传进化分析,以期为深入了解安徽省乃至我国GAstV的流行情况和病原特征提供参考。结果显示,共分离到5株新的鹅星状病毒毒株,经鉴定,均系GAstV,分别将其命名为AHAU2018株、DY-19株、ZY02株、HR2105/2株、HR2110/1株。
因缺少合适的细胞系,星状病毒的体外培养存在一定困难。有研究表明,鹅星状病毒可在LMH细胞中增殖,但不引起LMH细胞出现病变。Wei等[25]利用LMH细胞成功地从发病雏鹅的肝和肾中分离得到GAstV。Wei等[26]还利用LMH细胞成功分离到鸭源的GAstV。孙永林[27]研究发现,GAstV可以通过制备的鸡胚肝细胞进行分离,且可以产生细胞病变。张玉杰等[28]研究发现,GAstV-2 SCCD株可以在鹅胚上稳定增殖,但是GAstV-1 SDPD株不能在鹅胚和SPF鸡胚上稳定增殖。本研究分离的不同年份的毒株均可以通过绒毛尿囊膜接种的方式在鹅胚上稳定增殖,并可引起鹅胚胚体出血、腹腔尿酸盐沉积等病变,但关于其在LMH细胞上的增殖特性还有待进一步研究。
星状病毒作为单链RNA病毒,易发生不同毒株之间的同源重组。目前,在禽类和哺乳动物类星状病毒中均发现了变异毒株。Niu等[29]从制备的原代鹅胚肾细胞中分离得到一株新型鹅星状病毒SDPY株,发现其ORF1a、ORF1b和ORF2基因与已发表的禽星状病毒株的相似性很低,最高不超过69%。Fei等[30]研究表明,GAstV中的Ⅱ-c型目前已经成为山东省的优势基因型,同时发现了GAstV存在自然重组的证据。徐梦璐等[31]研究发现,GAstV的JSSQ株与GD AHAU2株和AHAU4株发生了重组。卢秀娴等[32]从山东省患病雏鹅中分离出1株鹅星状病毒,与章丽娇等[33]于2018年在安徽得到的分离株AHQJ18的亲缘关系较近。Wei等[26]研究发现,安徽地区分离毒株与分离自山东地区的SDPY株的亲缘关系较近,江苏地区分离毒株的重组位点可能来自安徽和山东分离株,同时存在安徽不同毒株间的重组。星状病毒ORF2基因编码的结构蛋白是星状病毒分型的主要依据。本研究通过分析GAstV不同分离株ORF2基因核苷酸和其编码的氨基酸序列发现,2019年前后分离的GAstV处于不同的进化亚分支上,表明GAstV在我国已发生变异,但其优势基因型是否发生变化还有待进一步研究证实。本研究分离的AHAU2018、DY-19、ZY02、HR2105/2、HR2110/1株均属于目前在我国流行的导致雏鹅痛风的GAstV,但AHAU2018株与作者团队于2019年后获得的其他分离株处于不同的进化亚分支上。

