聚苯乙烯纳米塑料与铅胁迫对菠菜种子萌发和幼苗生长的影响*
郭琳琳,俎敬美,王晶晶,谌柄旭
(1.沧州师范学院生命科学系 沧州 061001;2.大连大学生命健康学院 大连 116622;3.沧州环创环保技术服务有限公司 沧州 061001)
2020 年全球塑料产量3.67 亿t,预计到2050 年将会达11 亿t[1]。由于塑料制品在自然环境中难以降解,其对生态环境所造成的影响已成为研究的热点问题。塑料在生物体、风力、水流、紫外线等外力条件的作用下能够被降解为<5 mm 的塑料碎片,被称为微塑料(microplastics,MPs),而粒径小于1 μm的微塑料称为纳米塑料(nanoplastics,NPs)[2]。现今,对于MPs 污染的研究大多集中于海洋生态系统,而其对于陆地生态系统的影响研究还相对较少。但是,相关研究表明,陆地作为塑料生产的源头和汇集区,每年释放到土壤的MPs 大概是海洋的4~23 倍[3]。因此,MPs 很可能是首先与陆地系统中的生物群相互作用,并对陆地生态系统造成影响[4]。土壤是陆地生态系统的重要组成部分,近年来有关土壤MPs 的污染问题已成为生态环境领域的研究热点。土壤中的MPs 主要由人类活动产生,来源于农业用膜的降解、垃圾填埋、污水排放、废水灌溉等,同时排放到环境中的MPs,又可经过大气沉降与地表径流等方式重新进入到土壤中[5]。进入土壤中的MPs 不但可以释放出有害物质,还可以从环境中吸附污染物,从而对土壤环境及生物体产生影响。MPs 可能通过胞吞作用、离子通道、载体蛋白或水通道蛋白、土壤碳或根系分泌物介导等途径进入植物体,从而在食物链中累积,对人体产生不利影响[4,6]。
目前,仅有少数报道是围绕MPs/NPs 对植物的影响进行研究的。例如,在对植物种子萌发和生长特征等的研究中,Pignattelli 等[7]发现,不同类型的MPs (聚丙烯、聚乙烯、聚氯乙烯等)暴露均会抑制独行菜(Lepidium sativum)种子的萌发;粒径20 nm的聚苯乙烯微球能够抑制水稻(Oryza sativa)的根伸长,降低根的干重[8];而对伊乐藻(Elodeasp.)的研究发现,粒径为50~190 nm 的聚苯乙烯微粒会增加其根和芽的生物量[9]。也有部分研究人员对MPs 作用下植物的氧化防御体系进行了研究,Jiang 等[10]的研究发现,粒径5 μm 的聚苯乙烯MPs 胁迫会引起蚕豆(Vicia faba)幼苗体内SOD 活性的升高,而1 μm 聚苯乙烯MPs 胁迫对狸藻体(Utricularia vulgaris)内的SOD 活性无显著影响,却降低POD 的活性[11]。可见,粒径、聚合物组成、受试植物等因素均会影响MPs对植物体的作用。
除MPs 污染之外,重金属污染也是影响我国土壤环境的重要因素之一。我国耕地中Pb、Hg 等重金属污染面积约2000 万hm2,大致占据耕地总面积的1/5[12]。已有研究发现,土壤中提取的MPs 中含有不同浓度的Pb、Cd、Cu 等重金属[10]。已有研究发现,MPs 能够促进螃蟹体内Pb 的生物累积以及脂质代谢酶的活性,并加重肝损伤,表明MPs 可以作为Pb 的潜在载体进入生物体内[13-14]。刘玲等[15]的研究发现,低浓度的MPs 能够缓解Pb 对水稻幼苗根系的氧化胁迫,而高浓度的MPs 加剧了Pb 对水稻根系的氧化损伤。MPs 和Cd 共同暴露,会改变玉米(Zea mays)对Cd 的吸收,改变植物体的生理指标以及土壤的性质[16]。由此可见,MPs 可以改变重金属在生物体内的毒理学效应。
菠菜(Spinacia oleracea)是苋菜科(Amaranthaceae)的一种可食用开花植物[17],是在我国普遍种植并广泛食用的蔬菜作物。已有报道指出菠菜可以用于Pb和As 污染土壤的修复[18]。截至目前,有关Pb 与MPs/NPs 共同作用对菠菜的毒理学效应尚不明确。本研究以菠菜为研究对象,研究单一MPs/Pb 或二者复合污染条件下对菠菜种子萌发和幼苗生长的影响,并探讨MPs 与Pb 可能的作用机理,以期为陆地生态系统中MPs 的生态风险评估以及蔬菜作物的栽培提供一定的理论依据。
1 材料与方法
1.1 供试材料
供试菠菜种子购于沧州市某农贸市场。Pb 溶液由Pb(NO3)2配制。单分散聚苯乙烯微球(PSNPs)购于无锡瑞格生物技术有限责任公司,粒径为(100±10) nm。
1.2 试验设计
选取颗粒饱满、大小均匀、状态良好的种子清水浸泡12 h。将种子取出并沥干后放置托盘中,用镊子将种子外壳剥掉,剥壳后的种子采用1% H2O2溶液浸泡消毒30 min,再用蒸馏水冲洗多次,用滤纸将种子表面的水分吸干后放入已洗净消毒并铺有两层纱布的培养皿(直径为9 cm)中,在每个培养皿中加入2 mL 蒸馏水以及2 mL Hoagland 营养液(按照硝酸钙945 mg·L-1,硝酸钾607 mg·L-1,磷酸铵115 mg·L-1,硫酸镁493 mg·L-1,铁盐溶液2.5 ml·L-1,微量元素5 mL·L-1的浓度进行配制,并调整营养液pH=6),待种子萌发后置于人工气候培养箱(RYQH-250F,上海姚氏仪器设备厂)内培养(25 ℃恒温、光照14 h),培养过程中及时观察种子萌发情况并补充适量的蒸馏水。待菠菜幼苗第2 片真叶展开之前,将幼苗移栽到装有25 mL Hoagland 营养液的100 mL 三角瓶中,放入人工气候培养箱中继续培养,光暗周期为12 h∶12 h,温度23 ℃,湿度60%,每3 d 更换一次培养液,在菠菜第3 片真叶展开后,选取长势较好、一致的幼苗分别移栽到装有Hoagland 营养液和不同处理液的三角瓶中,继续培养,并每天更换培养液,继续培养14 d 后进行各项生理指标的测定[19]。试验设置以下不同处理组,所有处理组均设置3 个重复。单一PSNPs 胁迫组: 在上述培养皿/三角瓶中分别加入2 mL 浓度为200 mg·L-1、400 mg·L-1、800 mg·L-1和1600 mg·L-1的PSNPs 悬浮液;单一重金属Pb 胁迫组: 在上述培养皿/三角瓶中分别加入2 mL 浓度为5 mg·L-1、25 mg·L-1、50 mg·L-1和100 mg·L-1的Pb 溶液;PSNPs-Pb 复合污染组: 在上述培养皿/三角瓶中分别加入2 mL PSNPs (低浓度200 mg·L-1和高浓度800 mg·L-1)及Pb (低浓度5 mg·L-1和高浓度50 mg·L-1)的复合溶液(两种溶液配比为1∶1);对照组: 加入2 mL蒸馏水。
1.3 测定方法
1.3.1 生长指标测定
在第7 天统计计算各生长指标,用直尺测定根长、芽长,其余各项生长指标的计算公式如下[20]:
式中:Gt为t天内的发芽数,Dt为对应的发芽天数。
1.3.2 幼苗生理指标测定
对幼苗进行暴露培养14 d 后,称取新鲜健康的整株菠菜幼苗,低温研磨,经离心提取后,分别采用氮蓝四唑法测定SOD 活性,采用愈创木酚法测定POD 活性,采用考马斯亮蓝G-250 染色法测定可溶性蛋白的含量[21]。
1.4 数据处理
使用SPSS 23.0 软件对数据进行统计分析,采用单因素方差分析法(ANOVA)对不同处理组和对照组的数据进行分析比较(P<0.05)。
2 结果与分析
2.1 PSNPs 与Pb 胁迫对菠菜种子萌发的影响
2.1.1 PSNPs 或Pb 单独胁迫对菠菜种子萌发的影响
发芽率、发芽势、发芽指数是表征种子成活度、发芽速度和整齐度以及种子活力的重要指标。由表1 可知,与对照组相比,单一PSNPs 胁迫下,随着PS 浓度的升高,中高浓度(400 mg·L-1、800 mg·L-1、1600 mg·L-1)胁迫下菠菜种子的发芽率、发芽势、发芽指数均显著低于对照组(P<0.05),而低浓度PSNPs (200 mg·L-1)胁迫对菠菜种子的活力无显著影响。由此可知,单一PSNPs 胁迫(≥400 mg·L-1)对菠菜种子的萌发具有抑制作用。单一重金属Pb 胁迫(≥25 mg·L-1)显著降低菠菜种子的发芽率、发芽指数(P<0.05),而低浓度5 mg·L-1Pb 暴露对菠菜种子的发芽势有轻微促进作用,但无显著性差异。
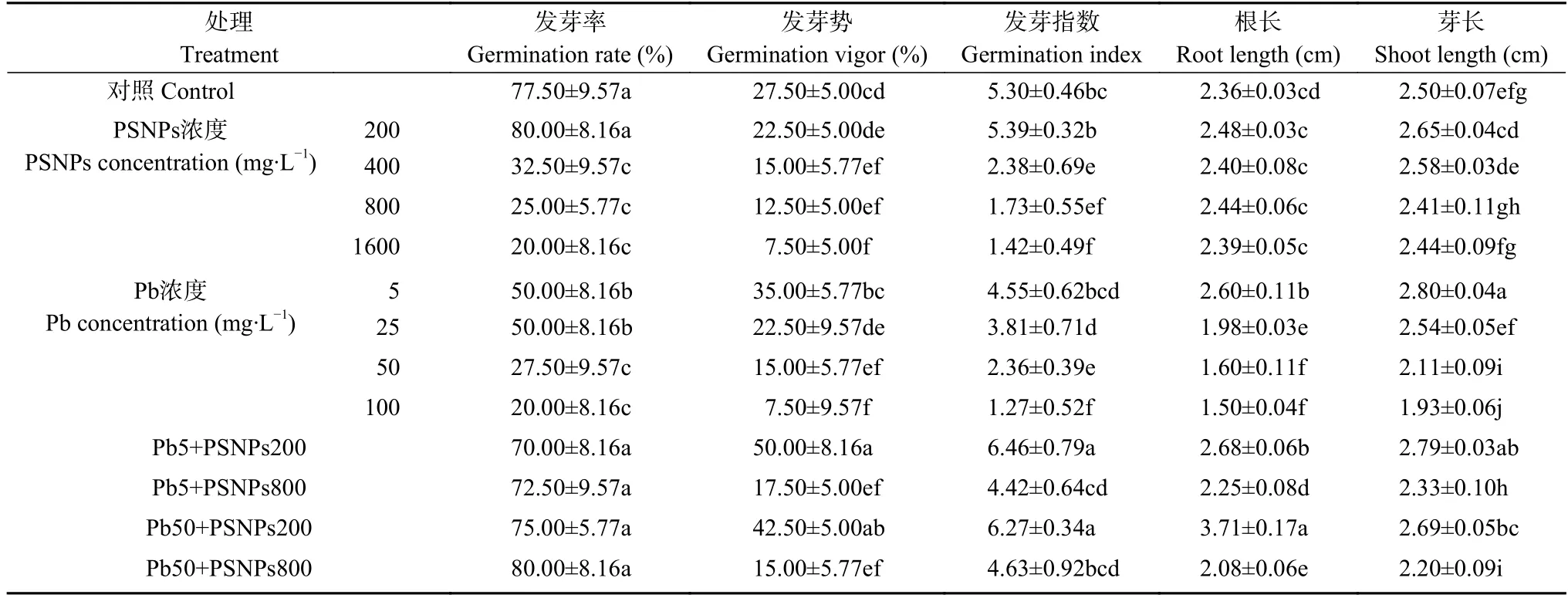
表1 聚苯乙烯纳米塑料(PSNPs)、Pb 单独胁迫或复合污染对菠菜种子萌发及根长和芽长的影响Table 1 Effects of single or combined pollution of polystyrene nanoplastics (PSNPs) and Pb on seed germination,seedling root and shoot lengthes of spinach
低浓度200 mg·L-1PSNPs 胁迫对菠菜种子芽的伸长有显著促进作用(P<0.05),而其余浓度PSNPs 单独胁迫对根长和芽长无显著影响(表1)。5 mg·L-1低浓度Pb 暴露组的根长和芽长显著(P<0.05)高于对照组,而随着Pb 浓度的增加(25 mg·L-1、50 mg·L-1、100 mg·L-1),菠菜种子的根和芽的生长受到抑制,除25 mg·L-1Pb 胁迫下芽长无显著变化外,其余浓度组的根长和芽长均显著低于对照组(P<0.05)。由此可知,单一Pb 胁迫对菠菜种子的根和芽的伸长表现为“低促高抑”的作用规律。
2.1.2 PSNPs 与Pb 复合污染对菠菜种子萌发的影响
由表1 可知,相比于对照组,复合污染组对菠菜种子的发芽率无显著影响,而低浓度200 mg·L-1PSNPs 与不同浓度Pb 复合胁迫显著增加种子的发芽势和发芽指数(P<0.05),并促进根和芽的伸长;而高浓度800 mg·L-1PSNPs 与不同浓度Pb 复合胁迫则显著降低种子的发芽势(P<0.05),降低发芽指数,并抑制根和芽的生长。
与单一Pb 胁迫相比,不同浓度的PSNPs 与Pb复合显著提高菠菜种子的发芽率和发芽指数(P<0.05)。低浓度(200 mg·L-1) PSNPs 与不同浓度Pb复合胁迫能够提高种子的发芽势,而高浓度(800 mg·L-1) PSNPs 与Pb 复合胁迫会降低种子的发芽势或无显著影响。不同浓度PSNPs 与低浓度(5 mg·L-1)Pb 复合胁迫,会减弱低浓度Pb 的促进作用,而抑制菠菜种子根和芽的生长;不同浓度PSNPs 与高浓度(50 mg·L-1) Pb 复合,会缓解Pb 对根和芽生长的抑制作用。综上可知,PSNPs-Pb 复合在影响菠菜种子萌发以及根、芽的生长时,总体表现为拮抗作用。
2.2 PSNPs 与Pb 胁迫对菠菜幼苗生理指标的影响
2.2.1 PSNPs 或Pb 单独胁迫对菠菜幼苗SOD 和POD 活性的影响
SOD 和POD 是构成植物抗氧化系统的主要酶,其活性水平能反映植物受外界逆境影响的程度。由表2 可知,相比于对照组,不同浓度PSNPs 胁迫下SOD 活性均降低,在中高浓度组(800 mg·L-1、1600 mg·L-1) SOD 活性受到显著抑制(P<0.05)。POD 活性在200 mg·L-1、400 mg·L-1、800 mg·L-1PSNPs 处理组均显著高于对照组(P<0.05);而在1600 mg·L-1PSNPs 处理POD 活性达最低,且显著低于其他处理(P<0.05)。不同浓度Pb 胁迫导致菠菜幼苗的SOD 活性呈剂量效应降低(P<0.05),而POD 活性相比于对照组均显著升高(P<0.05)。

表2 聚苯乙烯纳米塑料(PSNPs)、Pb 单独胁迫或复合污染对菠菜幼苗生理指标的影响Table 2 Effects of single or combined pollution of polystyrene nanoplastics (PSNPs) and Pb on physiological indexes of spinach seedlings
2.2.2 PSNPs 或Pb 单独胁迫对菠菜幼苗可溶性蛋白含量的影响
可溶性蛋白是植物体必备的营养物质,也是其进行生理代谢的重要调控物质。由表2 可知,不同浓度PSNPs 胁迫下菠菜幼苗可溶性蛋白含量均有一定程度的增加,且表现为先升高后降低的趋势,但仅在400 mg·L-1和800 mg·L-1处理组显著高于对照组(P<0.05)。随着Pb 浓度的升高,菠菜幼苗的可溶性蛋白含量先减少后增加,且在5 mg·L-1低浓度组略低于对照组,在25 mg·L-1、50 mg·L-1和100 mg·L-1组显著高于对照组(P<0.05)。
2.2.3 PSNPs 与Pb 复合污染对菠菜幼苗生理指标的影响
由表2 可知,PSNPs 与Pb 复合作用下,菠菜幼苗的SOD 活性均显著低于对照组(P<0.05)。相比于单一低浓度5 mg·L-1Pb 胁迫,PSNPs 与Pb 复合暴露显著降低SOD 活性(P<0.05),表明PSNPs 能够加强Pb对SOD 活性的抑制作用,二者表现为协同作用。
与单一Pb 胁迫相 比,低浓度200 mg·L-1PSNPs 与Pb 复合胁迫显著提高POD 活性(P<0.05),二者表现为协同作用;而高浓度800 mg·L-1PSNPs 与Pb复合胁迫显著抑制POD 活性(P<0.05),说明高浓度PSNPs 能够减弱Pb 对POD 活性的诱导作用,二者表现为拮抗作用。
与单一Pb 胁迫相 比,低浓度200 mg·L-1PSNPs 与Pb 复合对菠菜幼苗的可溶性蛋白含量无显著影响,而高浓度(800 mg·L-1) PSNPs 与低浓度(5 mg·L-1) Pb 复合胁迫显著增加可溶性蛋白含量(P<0.05),表明PSNPs 可减弱5 mg·L-1Pb 对可溶性蛋白的抑制作用;而高浓度(800 mg·L-1) PSNPs 与高浓度(50 mg·L-1) Pb 复合胁迫显著降低可溶性蛋白的含量(P<0.05),PSNPs 会减弱50 mg·L-1Pb 对可溶性蛋白的促进作用。
综上可知,PSNPs-Pb 复合对菠菜幼苗的影响主要是: 低浓度PSNPs 与Pb 主要表现为协同作用,而高浓度的PSNPs 与Pb 主要表现为拮抗作用。
3 讨论
3.1 PSNPs 和Pb 污染对种子萌发的影响
本研究表明,单一PSNPs 胁迫显著降低菠菜种子的发芽率、发芽势和发芽指数,能够对种子萌发起到抑制作用。已有研究发现,不同粒径的MPs 暴露均会显著降低水芹种子(Lepidium sativum)的发芽率[22-23]。而不同类型、不同粒径的MPs 对小麦(Triticum aestivum)种子的发芽率、发芽势、发芽指数均起到抑制作用[24-25]。这些结果均与本研究结果相一致。MPs 抑制种子萌发的主要原因可能是MPs 颗粒堵塞种子囊中的孔隙,从而对种子萌发产生不利影响[22]。而在本研究中,低浓度(200 mg·L-1)的PSNPs 可以促进菠菜种子根和芽的伸长,而中高浓度(≥400 mg·L-1)的PSNPs 对种子根和芽的伸长无显著影响。研究发现,低浓度PSNPs 能够促进大豆(Glycine max)种子的根和芽的伸长[26]。Bosker 等[22]研究发现低浓度下50 nm、500 nm NPs 能够促进水芹种子根的伸长,这可能是由于低浓度的NPs 更易被植物体所吸收,并诱导α-淀粉酶活性,为根和芽的生长提供更多的能量[27]。但是,也有一些研究发现,MPs 的暴露会抑制种子根和芽的生长[28-30]。本研究中采用的PSNPs 为粒径小于1 μm 的NPs,相比于MPs,NPs 的粒径更小、流动性更强,更加容易穿透生物体表面,引起植物体内更为复杂的毒理学效应[31]。因此,与以往研究相比,MPs 对根长和芽长的不同影响可能与MPs 的聚合物组成、MPs 的质量浓度、供试植物的种类等因素有关[32]。
本研究发现,单一重金属Pb 胁迫能够抑制菠菜种子的萌发,这与前人的研究结果一致[33-36]。而本研究中,单一Pb 胁迫对菠菜种子根和芽生长的影响表现为“低促高抑”的规律。杨文玲等[35]的研究发现,低浓度Pb 对早熟禾(Poa annua)和狗牙根(Cynodon dactylon)种子根长和出苗率也具有低促高抑的作用规律;张雅莉等[37]在研究Pb 对硬粒小麦种子根和芽的影响时也发现了相同的规律,这些均与本研究结果一致。分析原因,低浓度的重金属胁迫可能会诱发植物体内的某些生理代谢途径,并提高某些酶的活性,从而对种子根、芽的伸长起到一定促进作用;而高浓度的重金属会阻碍植物细胞分裂和生长,抑制蛋白酶和淀粉酶的活性,从而影响代谢,抑制种子的萌发[35,37]。但也有研究发现,不同浓度的Pb 胁迫均会对植物种子的根和芽的伸长起抑制作用[38-40]。分析原因,可能主要与Pb 的胁迫浓度以及受试植物的品种有关。
在复合污染对菠菜种子的萌发影响研究中,不同浓度MPs 与不同浓度Pb 复合均会减弱Pb 单独作用下的抑制/促进作用,MPs-Pb 整体表现为拮抗作用。分析原因,可能是在菠菜种子萌发的过程中,MPs 颗粒堵塞种子囊中的孔隙[22],进而阻碍了Pb 的吸附,从而二者表现出拮抗作用。王泽正等[20]的研究发现MPs 与重金属镉复合对水稻种子生长特性、根长和芽长的影响总体表现出一定的拮抗作用,这与本文的研究结果一致。
3.2 PSNPs 和Pb 污染对幼苗生长的影响
本研究发现,PSNPs 单独胁迫下,SOD 活性在中高浓度组(800 mg·L-1、1600 mg·L-1)受到显著抑制;而POD 活性在中低浓度(200 mg·L-1、400 mg·L-1、800 mg·L-1)处理组升高,而在最高处理组1600 mg·L-1受到显著抑制。中低浓度下POD 活性的上升,可能是低浓度的PSNPs 增强了活性氧(ROS)刺激酶编码基因的表达,从而提高了抗氧化酶POD 的活性,而高浓度下PSNPs 可能会破坏抗氧化防御系统,从而抑制SOD 和POD 的活性[32]。廖苑辰等[41]研究发现,粒径100 nm PSNPs 处理小麦后,SOD 活性始终低于对照组,POD 活性在中低浓度组极显著高于对照组;黄献培等[42]发现当MPs 浓度高于750 mg·L-1时菜心(Brassica campestris)幼苗中SOD 活性均显著低于对照组,浓度低于750 mg·L-1时无显著影响;也有研究[21,43]发现,中低浓度的聚乙烯MPs 能显著提高蚕豆幼苗和花生(Arachis hypogaea)幼苗的POD 活性,这些研究与本研究结果一致。但是,也有研究[44]发现,低浓度的MPs 对小麦幼苗的SOD、POD 活性无显著影响,中高浓度能提高SOD、POD 的活性,这与本研究的结果不同,分析原因可能是由于MPs 粒径、质量浓度以及受试植物的不同造成的。另外,本研究发现,单一Pb 胁迫抑制菠菜幼苗的SOD 活性,而诱导POD 活性升高。林琳等[45]的研究发现,不同浓度、不同暴露时间的Pb 显著抑制生菜(Lactuca sativa)幼苗的SOD 活性,而诱导POD 的活性,这与本研究的结果一致,即Pb 胁迫引起POD 活性上升,诱发机体的调节反应,而抑制SOD 酶的活性,造成损伤。
在对可溶性蛋白的研究中发现,PSNPs 单独胁迫引起可溶性蛋白含量先升高后降低。已有研究发现,粒径80 nm 的PSNPs 对两种外生菌根真菌彩色豆马勃(Pisolithus tinctorius)和松乳菇(Lactarius delicious)可溶性蛋白的影响,也表现为相同的规律[46]。但是,也有研究发现粒径70 nm PSNPs 胁迫会引起菜心幼苗可溶性蛋白含量先升高后降低,而粒径20 μm聚苯乙烯微球胁迫导致可溶性蛋白含量始终低于对照组[42];100~400 nm PSNPs 和10~15 μm 聚苯乙烯微球均会引起生菜幼苗的可溶性蛋白含量降低[47],这与本研究的结果不一致。分析原因,可能是受试植物暴露时间不同,生菜幼苗是在暴露培养28 d 后进行可溶性蛋白的测定,而菜心幼苗的暴露则是在种子出芽试验结束后即停止并进行测定,而本研究的菠菜幼苗是在第三片真叶展开后暴露14 d 后进行测定,暴露时间的不同会导致外源物质在植物体内的影响不同;另一方面,可能是MPs 的粒径不同造成的,本研究采用的是100 nm 的PSNPs,粒径更小,比表面积更大,更易引起植物体内更为复杂的生理效应。本研究中,单一Pb 胁迫引起菠菜幼苗中可溶性蛋白含量先降低后升高,且在中高浓度(25 mg·L-1、50 mg·L-1、100 mg·L-1)组显著高于对照组。王芳洲等[48]对秋茄(Kandelia obovata)幼苗处理14 d 后,发现可溶性蛋白含量随PbCl2浓度升高呈现先降后升的趋势;也有研究发现,Pb 胁迫下,金丝草(Pogonatherum crinitum)根系可溶性蛋白含量则先减后增[49],这些结果与本研究的一致。以上结果表明,单一的PSNPs 或Pb 胁迫,能够使菠菜幼苗体内的可溶性蛋白含量处于较高水平,间接平衡了细胞的渗透势,维持正常的代谢水平。
本研究中,相比于Pb 单独胁迫,低浓度PSNPs 与Pb 复合污染抑制SOD 活性,而提高POD 活性,对可溶性蛋白含量无显著影响;而高浓度的PSNPs 与Pb 复合抑制SOD、POD 的活性,对可溶性蛋白的影响表现为与Pb 单独胁迫相反的影响(即Pb 5 mg·L-1+PSNPs 800 mg·L-1增加菠菜幼苗的可溶性蛋白含量,缓解了5 mg·L-1Pb 单独胁迫下对可溶性蛋白含量的抑制;而Pb 50 mg·L-1+PSNPs 800 mg·L-1降低了菠菜幼苗的可溶性蛋白含量,抑制了50 mg·L-1Pb 单独作用下可溶性蛋白含量的升高)。刘玲等[15]的研究发现,与Pb 处理组相比,低浓度PSNPs 与Pb复合降低了水稻幼苗的SOD 活性,提高了POD 的活性,而高浓度PSNPs 与Pb 复合对水稻幼苗造成更大毒害,主要表现为抗氧化酶活性的下降;WANG 等[50]的研究也表明较低质量浓度(1 mg·L-1)的PSNPs 与Pb 复合对微囊藻(Microcystis aeruginosa)的生长表现为协同作用,上述研究的结果与本研究基本一致。分析原因,可能是低浓度的PSNPs 吸附Pb2+后,作为其载体穿过细胞壁的孔洞、幼苗侧根的缝隙或者通过内吞作用进入植物体内,二者发挥协同效应,从而增加Pb 的毒性;而高浓度的PSNPs 会发生团聚效应[32],导致游离态的PSNPs 减少,降低对Pb 的吸附;另一方面团聚体的形成会阻碍菠菜幼苗对Pb2+的吸收,从而使二者表现为拮抗作用。
4 结论
1) PSNPs (≥400 mg·L-1)与Pb 单独胁迫均会对菠菜种子的发芽率、发芽势、发芽指数等起抑制作用,低浓度PSNPs (200 mg·L-1)胁迫对菠菜种子根和芽的伸长起促进作用,而单一Pb 胁迫对菠菜种子的根和芽的伸长表现为“低促高抑”的作用规律。
2) PSNPs 单独胁迫抑制菠菜幼苗的SOD 活性,对POD 活性表现为“低促高抑”的作用规律;单一Pb胁迫抑制菠菜幼苗的SOD 活性,而诱导POD 活性;高浓度的PSNPs (200 mg·L-1)-Pb (50 mg·L-1、100 mg·L-1)胁迫均会显著提高菠菜幼苗中的可溶性蛋白的含量。
3)相比于单独Pb 胁迫,PSNPs-Pb 复合污染会缓解Pb 对菠菜种子萌发以及种子根、芽生长的抑制作用,二者表现为拮抗作用;PSNPs-Pb 复合污染对菠菜幼苗的影响是低浓度(200 mg·L-1) PSNPs-Pb 复合效应主要表现为协同作用,而高浓度(800 mg·L-1)PSNPs 与Pb 复合污染会进一步加强Pb 对菠菜幼苗的毒害作用。

