2023年高考化学模拟试题A 卷
■河南省焦作市第一中学 赵 敏 ■河南省郑州市回民高级中学 王凤伟
可能用到的相对原子质量:H 1 N 14 O 16 S 32 Ca 40 Ti 48 Mn 55
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.化学使科技进步,使生活更美好。下列相关说法错误的是( )。
A.北京冬奥会制作“飞扬火炬”的碳纤维复合材料、速滑竞赛服采用的聚氨酯材料都属于有机高分子材料
B.“神舟十五号”返回舱座椅缓冲器使用的铝合金具有较高的强度、韧性和抗腐蚀性等优点
C.中科院攻克“液态阳光燃料”合成技术,利用太阳能、水和二氧化碳催化合成甲醇,符合 “碳达峰、碳中和”的发展理念
D.“天问一号”祝融火星车使用的热控材料是新型保温材料纳米气凝胶,纳米气凝胶具有丁达尔效应
D.漂白粉、Fe2(SO4)3、KI
4.实验证据推理是化学研究的常用方法,下列实验操作、现象及结论都正确的是( )。

选项 实验操作 实验现象 结论____两 支 试 管 各 盛4mL 加 入 2 mL 0.1 mol·L-1 高锰酸钾溶液,分别加入2mL 0.2 A 0.1 mol·L-1 的草酸溶液和2mL0.2反应物浓度越大,反应速率越快mol·L-1 的______草酸溶液mol·L-1草酸溶液的试管中,高锰酸钾溶液完全褪色时间更短__________________mol·L-1 KI溶液,滴加5~6 滴0.1取5mL0.1 B mol·L-1 FeCl3 溶液,充分反应后,再滴加______少量的K________________________________________SCN_溶液溶液变红KI与FeCl3的反应是可逆反应C将乙醇蒸气通过炽热的铜粉,接着通入酸性______KMnO4 溶液酸性 KMnO4溶液褪色乙醇被催化氧化成乙醛D淀粉完全水解向淀粉溶液中加入少量稀硫酸,加热,充分反应后,向溶液中加入NaOH溶液至溶液呈碱性,再将溶液分成两份,一份滴加碘水,另一份加入新制______Cu(OH)2 悬浊液滴加碘水,溶液不变蓝;加入新制Cu(OH)2 悬浊液,加热至沸腾,生成砖红色沉淀
下列说法正确的是( )。
A.X、Y 中含氧官能团相同
B.X 分子中所有碳原子处于同一平面
C.X 和Y 互为同分异构体,且Y 能与脯氨酸发生取代反应
D.1 mol Y与足量的钠反应产生2g氢气
3.某黄色固体样品X,可能含有漂白粉、FeSO4、Fe2(SO4)3、CuCl2、KI中的几种或全部。将X 与足量的水作用,得到深棕色固体混合物Y 和无色碱性溶液Z。该样品中确定存在的是( )。
A.漂白粉、FeSO4、Fe2(SO4)3
B.漂白粉、Fe2(SO4)3、CuCl2
C.Fe2(SO4)3、CuCl2、KI
5.某种电化学的电解液的组成如下所示。X、Y、Z、Q、W 为原子序数依次增大的短周期元素,下列说法正确的是( )。
A.基态Z原子核外电子的运动状态有3种
B.Z的氢化物沸点一定比Y 的氢化物沸点高
C.W 的含氧酸均为强酸
D.该化合物中五元环上的5个原子的杂化方式不都相同。

图1
A.a电极的电势比b电极高。
B.m 为阳离子交换膜,n为阴离子交换膜
C.电解过程中,图中两处Na2SO4溶液物质的量浓度均不变
D.b极区产生22.4 L(标准状况)气体,理论上产生1 mol 1,5-戊二胺
7.SO2易溶于水,光谱研究表明,SO2的水溶液中存在下列平衡:

A.SO2在水中的溶解度(以物质的量浓度表示)为c,c>K1p(SO2)
B.当SO2的平衡压强为p时,测得c(SO2-3)=amol·L-1,则溶液中c(H+)=

D.向该溶液中加入足量的酸都能放出SO2气体
二、非选择题:共58 分。第8~10 题为必考题,每个试题考生都必须作答。第11~12题为选考题,考生依据要求作答。
(一)必做题:共43分。
8.(16分)硫酸锰铵[(NH4)2Mn(SO4)2]是一种浅粉色固体,可溶于水,工业上可用于加工木材防火剂。用软锰矿(主要含MnO2,还含有FeO、Fe2O3、CuO、MgO、SiO2等)制备硫酸锰铵的工艺流程如下。

已知:①MgSO4和MnSO4的溶解度如表1所示。

表1
②常温下,Ksp(MnS)=2.5×10-13,Ksp(CuS)=1.3×10-36。
回答下列问题:
(1)“酸浸”时,H2C2O4的作用是____。
(2)“沉铜”反应的平衡常数K=____(结果保留2位有效数字)。
(3)“氧化”时,反应的离子方程式为____。
(4)加 MnCO3调节溶液的pH 可将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为_____。
(5)“系列操作”包括____、___、洗涤。
(6)通过实验测定产品硫酸锰铵中锰元素的含量:准确称取所得产品wg溶于水配成溶液,滴加氨水调pH 至7~8,加人过量的c1mol·L-1KMnO4溶液V1mL,充分反应后,过滤掉MnO2,将滤液与洗涤液合并配制成100 mL 溶液,取20 mL 用c2mol·L-1FeSO 酸性标准液滴定,重复实验3 次,平均消耗标准液V2mL。滴定终点的判断依据是____,产品硫酸锰铵中锰元素的质量分数为____(用相应字母表示)。
9.(13分)连二亚硫酸钠(Na2S2O4)俗称保险粉,是无机精细化学品,在造纸、印染等行业应用广泛。某科研小组通过以下方案制备Na2S2O4。
已知:①Na2S2O4在空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定。
②低于52 ℃时Na2S2O4在水溶液中以Na2S2O4·2H2O 形 态 结 晶,高 于52 ℃时Na2S2O4·2H2O在碱性溶液中脱水成无水盐。
③Zn(OH)2开始沉淀的pH 为8.0,沉淀完全pH 为11.1。
Na2S2O4的制备过程如下。
步骤1:安装好整套装置(如图2,夹持装置省略),并检查装置的气密性。
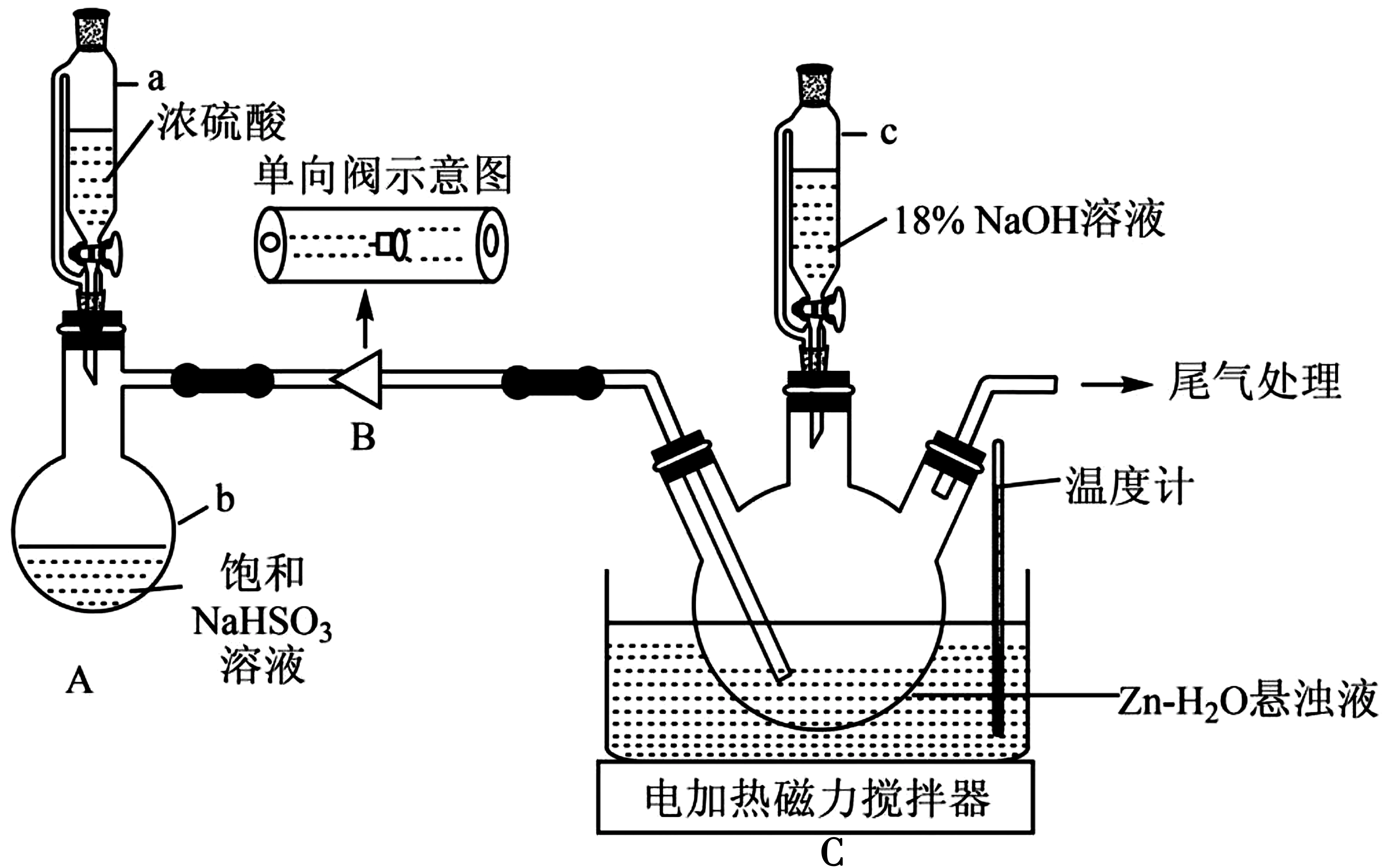
图2
步骤2:在三颈烧瓶中依次加入Zn粉和水,电磁搅拌形成悬浊液。
步骤3:打开仪器a的活塞,向装置C 中先通入一段时间SO2。
步骤4:打开仪器c的活塞滴加稍过量NaOH 溶 液,使 装 置C 中 溶 液 的pH 在8.2~10.5之间。
步骤5:过滤,将滤液经“一系列操作”可获得Na2S2O4。
请回答下列问题:
(1)仪器a的名称是_____。
(2)装置B(单向阀)的作用是_____。
(3)在实验开始之前,向装置通入一段时间氮气的目的是____。
(4)步骤3 中生成物为ZnS2O4,滴加氢氧化钠后,装置C 中发生反应的化学方程式为____。此步骤需控制溶液的pH 在8.2~10.5之间,其原因是_____。
(5)“一系列操作”包括:加入细食盐粉使其结晶,加热至60 ℃,趁热过滤,用____洗涤,干燥。
(6)若 选 择 图3 所示装置进行尾气处理,可选用的试剂是____。

图3
10.(14 分)Ⅰ.以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下。

(1)反应1、2和3的ΔG(自由能变化)随温度的变化关系如图4所示。图中对应反应2的线条是_____。
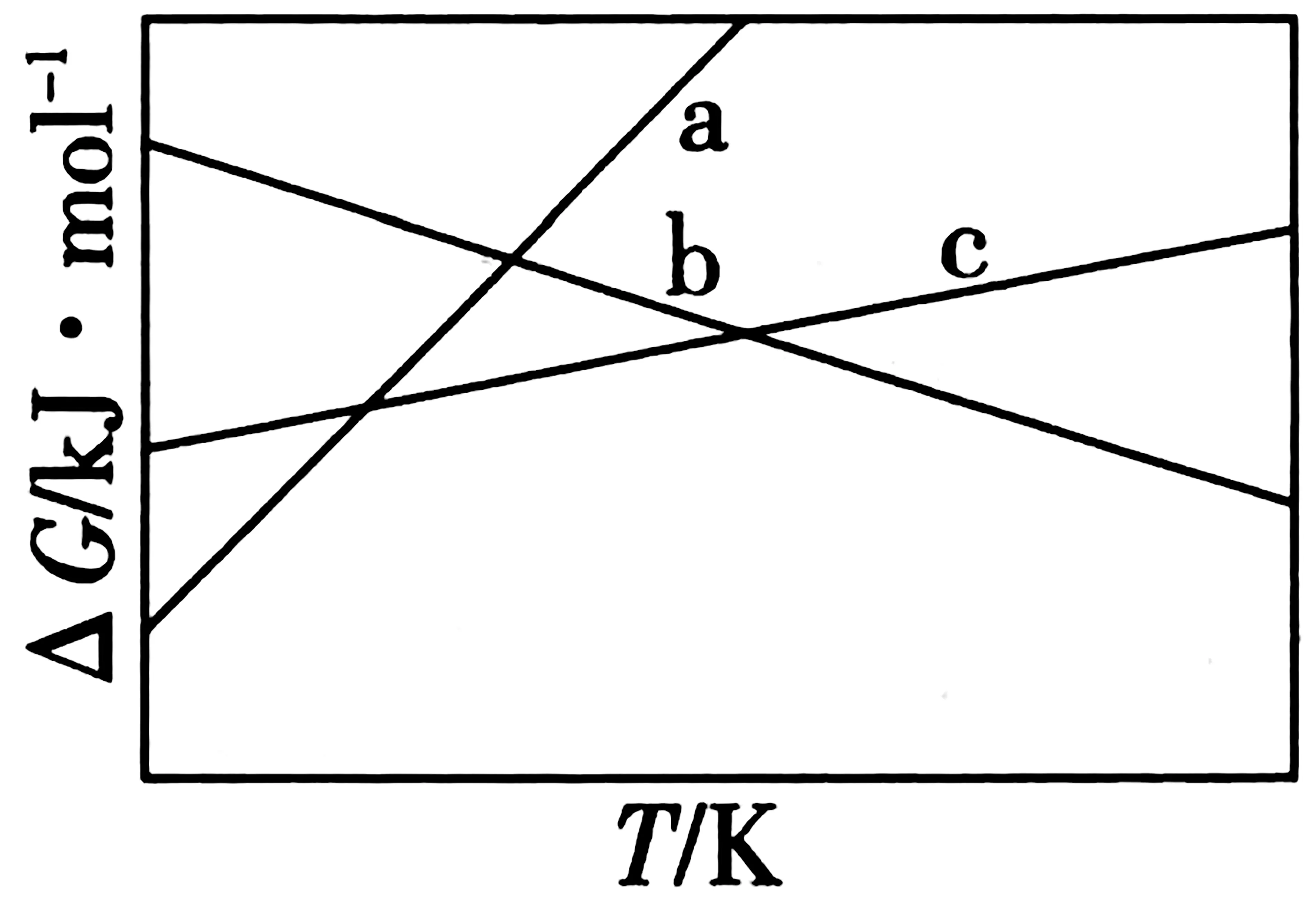
图4
(2)在相同条件下,反应3分别在恒温恒容容器中和绝热恒容容器中,两者均达到平衡时,c(CO2)绝热____c(CO2)恒温(填“>”“<”或“=”)。
(3)一定条件下,恒容容器中,充入原料气3 mol NH3和1 mol CO2,平衡时CO2的转化率为0.5,容器内总压强为pkPa,已知反应2的Kp=ap,则上述反应3的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)以惰性电极电解尿素CO(NH2)2的碱性溶液,阳极有N2产生,写出阳极的电极反应方程式:___。
Ⅱ.CO2和H2在一定条件下可以合成甲醇,该反应存在副反应2。

(1)向VL 密闭容器中充入1 mol CO2和3 mol H2,在催化剂存在的条件下进行反应,测得温度与CO2转化率、产物选择性的关系如图5所示。CO2的转化随着温度升高而增大的原因可能是______。

图5
(3)有利于提高CH3OH 选择性反应条件是____(填标号)。
A.高温高压
B.低温高压
C.分离出水蒸气
D.在原料气中加入适量的CO
(二)选考题:共15分。请考生从2道化学题中任选一题作答,如果多做,则按所做的第一题计分。
11.[选修3:物质结构与性质](15分)
元素周期表中第四周期过渡元素在工业及生活方面有重要应用,请回答下列问题:
(1)CrO5中 有1 个-2 价 的O,1 mol CrO5中含有σ键数目为_____。
(2)基态锰原子的px原子轨道上的电子个数为____,与锰同周期的第ⅡB 族和ⅢA族两种元素中第一电离能较大的是____(写元素符号)。
(3)富马酸亚铁FeC4H2O4是一种补铁剂。富马酸分子的结构模型如图6所示,富马酸亚铁中各元素的电负性由大到小的顺序为_____;富马酸分子中碳原子的杂化类型为_____。
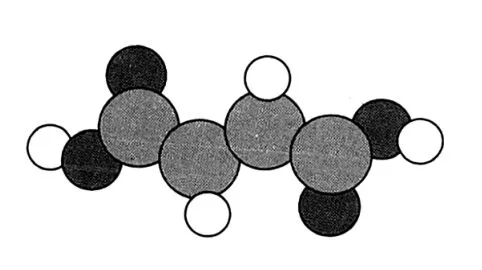
图6
(4)[Cu(NH3)4]2+中H—N—H 键角____(填“大于”“小于”或“等于”)气态NH3分子中H—N—H 键角,原因是____。写出一个与CN-互为等电子体的离子:___。
(5)CaTiO3的晶胞如图7 所示,该晶体的晶胞还可以有另一种画法,将Ti4+置于立方体的顶点,则Ca2+的位置在立方体的_____。若该晶胞密度为ρg·cm-3,用NA表示阿伏加德罗常数,则以Ti4+为中心,O2-构成的正八面体的体积为cm3。

图7
12.[选修5:有机化学基础](15分)
化合物H 是制备药物洛索洛芬钠的关键中间体,其一种合成路线如下。

(1)有机物A中含氧官能团名称为_____。
(2)C→D 的反应类型为____。
(3)有机物G 的结构简式为_____。F→G的反应也可以在SOCl2的作用下进行,且在SOCl2作用下进行时产率更高,用化学方程式解释选择SOCl2产率更高的原因:____。
(5)在E 的同分异构体中,同时满足下列条件的有_____种。
a.核磁共振氢谱显示4组峰且峰面积为6∶3∶2∶1。
b.分子中含有苯环和甲基。
c.碱性条件下完全水解生成两种产物。


