不同光质对愈合期黄瓜嫁接苗质量的影响
刘新颖 杨其长 郑胤建 刘高峰 李清明 许亚良
摘 要:为筛选黄瓜嫁接苗愈合期间的适宜光质条件,利用LED光源调制不同光质比例,以白光(W)为对照,探究了嫁接愈合期间红光(R)、蓝光(B)和红蓝混合光(RB,红光光照度∶蓝光光照度=7∶3)对黄瓜嫁接苗生长及生理生化特性的影响。结果表明,B处理可显著促进茎秆及叶柄伸长,叶片伸展,增加嫁接苗全株鲜质量、干质量及可溶性蛋白含量;RB处理有利于嫁接苗单位叶面积的叶片干质量(LMA)及迪克森质量指数(DQI)等幼苗质量评估指标的提高;W及RB处理下嫁接苗总叶绿素含量与R、B处理相比显著提高,可溶性糖含量显著降低。此外,黄瓜第1朵雌花开放节位以及10、15、20节以内雌花数也受到不同光质处理的影响。RB处理下第1朵雌花开放节位最低,R处理不利于黄瓜嫁接苗雌花的分化。综合来看,红蓝混合光最利于嫁接苗壮苗的培育,提升后期高产潜力,宜作为嫁接苗愈合光质。
关键词:黄瓜;嫁接苗;LED光源;幼苗质量
中图分类号:S642.2 文献标志码:A 文章编号:1673-2871(2023)06-106-08
Effect of LED light on the quality of cucumber grafted seedlings
LIU Xinying, YANG Qichang, ZHENG Yinjian, LIU Gaofeng, LI Qingming, XU Yaliang
(National Agricultural Science & Technology Center/Institute of Urban Agriculture, Chinese Academy of Agricultural Sciences, Chengdu 610000, Sichuan, China)
Abstract: In order to screen out the suitable light quality conditions during the healing of cucumber grafted seedlings, three treatments were designed with red light(R), blue light(B), and the complex light of red and blue(RB, Red light intensity∶Blue light intensity=7∶3), compared to the treatment of white light(W). B treatment could significantly promote stem and petiole elongation, leaf extension, and increase fresh weight, dry weight and soluble protein accumulation of grafted seedlings. In addition, there were higher leaf mass per area(LMA)and Dicksons quality index under RB treatment than under other treatments. The total chlorophyll content of grafting seedlings in combination light treatment(W, RB)was significantly higher than monochrome light treatment(R, B). The highest accumulation of soluble sugar was observed in R and B treatment and B-exposed seedlings showed the highest soluble protein content. Furthermore, light quality affected the first female flower of cucumber grafting seedlings and the number of female flowers within 10, 15, and 20. Among them, the first female flower was the lowest in the RB treatment, and the number of female flowers was the lest in the R treatment. In conclusion, the RB treatment can enhance the production of high-quality grafted cucumber seedlings.
Key words: Cucumber; Grafting; LED light; Seedling quality
黄瓜(Cucumis sativus L.)在蔬菜的生产和供应中具有重要地位。中国是全球黄瓜生产面积最大、产量最高的国家[1]。温室黄瓜生产是我国黄瓜栽培的重要形式,与一般的露地黄瓜生产相比,温室生产的黄瓜不仅产量高、品质好,而且能更高效地利用农业资源[2]。然而在黄瓜种植过程中,轮作倒茬困难、连作频繁等问题导致土传病害发生率大大提高[3],特别是枯萎病这类真菌性土传病害,具有暴发性强、破坏力大、防控性难的特征,一般可致黄瓜减产15%~25%,严重时在50%以上[4-5]。嫁接技术已成为提高现代蔬菜栽培效率的一项极具潜力的绿色技术,旨在增强蔬菜在不同生物与非生物胁迫条件下的适应性和耐受性,提升产量和品质[6],目前已广泛应用于黄瓜幼苗的大规模高效生产中[7]。在设施蔬菜生产规模不断擴大的情况下,实现优质黄瓜嫁接苗大规模高效培育已成为黄瓜产业可持续发展的重要保障。
光照是植物生長发育和产量品质形成的必需环境要素。在嫁接苗栽培领域,光照不仅是促进嫁接苗愈合期间维管束重新连接所必需的[8-9],还在嫁接苗光形态建成方面发挥着非常重要的作用[10-12]。随着光电技术的发展,高光效低能耗的LED光源可实现植物生理有效辐射单色光质和组合光质的精准调制,为探究适用于不同蔬菜嫁接愈合的理想光源提供关键技术支持[13]。目前,关于光质对嫁接苗影响的研究主要集中在辣椒[14]、番茄[15]、西瓜[16]嫁接苗成活率及嫁接苗质量方面。Nguyen等[17]研究表明,愈合期间辣椒嫁接苗在红光、红蓝混合光处理下成活率最高(100%),黑暗处理下成活率最低,红光处理可以通过促进嫁接苗地上部分生长,改善根系形态,进而提高嫁接苗整体质量。Vu等[18]研究发现,番茄嫁接苗在红光处理下成活率可达100%,与黑暗、蓝光及远红光处理相比,红光处理更有利于番茄嫁接苗维管束的重新连接,促进嫁接愈合和幼苗生长。Bantis等[19]证明,在红光中加入12%~24%的蓝光可以改善叶片形态,促进双断根嫁接苗根系重新生长,提高西瓜嫁接苗的质量。Moosavi-Nezhad等[20]指出,白光和单色蓝光对西瓜嫁接苗生长、光合色素积累和光合效率提升均有促进作用,可作为嫁接苗愈合的适宜光质,而单色红光照射的幼苗叶绿素含量降低,限制了嫁接苗定植后的生长潜力,应避免使用。由此可见,合理选择嫁接苗愈合过程中的光质是提高嫁接成活率、加快愈合进程、提升幼苗质量的关键。目前,关于黄瓜嫁接苗愈合期间最优光质却鲜有报道,此外,迄今未见愈合期间光质处理对嫁接苗定植后的开花习性影响的相关研究报道。
笔者采用不同波长的LED光源,对嫁接后的黄瓜嫁接苗进行光质处理,主要研究了不同LED光源对黄瓜嫁接苗生长形态及各项生理指标的影响,进一步揭示光质在黄瓜嫁接苗愈合期间发挥的作用。此外,还探究了愈合期间不同光质处理对嫁接苗定植后开花习性的影响,为工厂化黄瓜嫁接苗愈合光环境精准调控提供理论依据和数据参考。
1 材料与方法
1.1 材料
供试材料购于成都金田种苗有限公司,黄瓜接穗品种为燕白黄瓜美多脆,南瓜砧木品种为金妈妈图霸613,接穗与砧木均为嫁接生产常用品种,具有一定的代表性。
1.2 方法
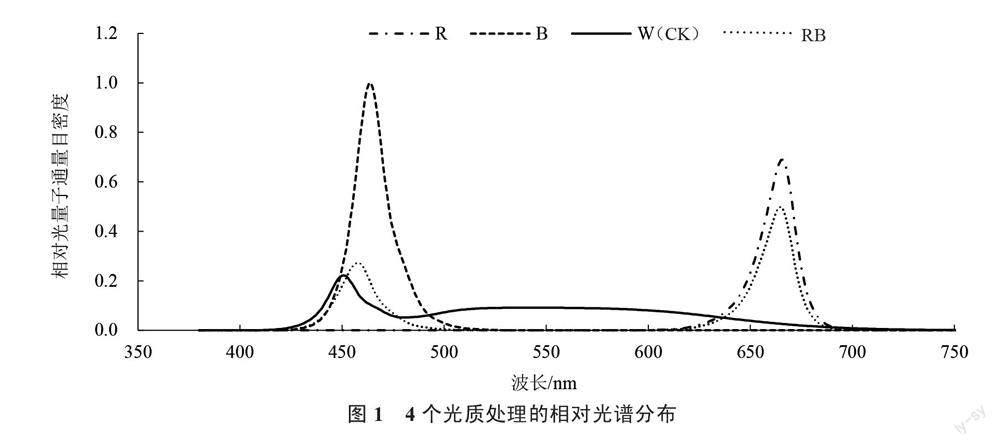
试验于2022年5月中旬在成都市农林科学院人工气候室内进行。试验分为4个阶段。第一阶段:催芽育苗,选取饱满、整齐一致的黄瓜、南瓜种子,55~60 ℃温汤浸种10 h后置于28 ℃恒温培养箱催芽,南瓜、黄瓜种子露白后,将其分别播于50孔(盘体长54 cm、宽28 cm、穴深50 mm)、200孔(盘体长54 cm、宽28 cm、穴深43 mm)硬塑料穴盘中,间隔播种,接穗早于砧木1.5 d播种。第二阶段:嫁接,待黄瓜幼苗子叶展平,南瓜幼苗出现第1片真叶时进行嫁接操作,选取健壮育苗,采用贴接法嫁接,在砧木子叶和第1片真叶之间斜切1刀,保证切口平整,叶基部生长点完全切除。接穗下胚轴斜切1刀,长度控制在1 cm左右。将砧木、接穗伤口贴合,快速用嫁接套管固定住结合部位。第三阶段:以LED白光为对照(W),共设置4个处理(图1):LED红光(R)、LED蓝光(B)、LED白光、红蓝混合光(RB,红光光强∶蓝光光强=7∶3),在全人工光植物生长培养室内,将嫁接苗放置在不同LED光源下处理10 d,嫁接愈合其他环境条件为光照度(100±6)μmol·m-2·s-1;昼夜温度(28±2) ℃/(19±2) ℃,光周期为光照/黑暗=12 h/12 h,嫁接后1~3 d、4~6 d、7~10 d,湿度分别为95%±5%、85%±5%、75%±5%。第四阶段:嫁接后11 d,选取具有代表性的植株移至温室大棚内进行常规管理,每隔3 d施肥1次,每次每盘施质量浓度为1500 mg·L-1的黄瓜水溶肥1 L。定植后15 d,苗长至4叶1心时,进行吊蔓。吊蔓后每隔1 d观察第1朵雌花开花时间和节位,以及单株嫁接苗1~20节内各节位的雌花数量和位置。
1.3 形态指标测定
光质处理10 d后,每个处理随机选取嫁接苗进行形态指标的测定,试验设置3次重复,随机区组分布,每次重复选取10株嫁接苗取平均值。选用BK-302数显游标卡尺分别测量接穗高度(嫁接结合部至接穗生长点、砧木高度(茎基部至嫁接结合部)、茎粗(接穗茎粗为结合部上方0.5 cm处),砧木茎粗为结合部下方1.5 cm处以及接穗第1片真叶叶柄长度。将完全展开的接穗真叶、子叶部分采下,放置在发光板上拍照,使用Image J软件对黄瓜嫁接苗叶片面积进行分析。用精确0.001 g的电子天平称量接穗鲜质量、砧木鲜质量、接穗叶片鲜质量、根系鲜质量,然后将嫁接苗的接穗、砧木和根系部分别用牛皮纸包住放入烘箱,105 ℃烘干箱内杀青30 min后,调至75 ℃烘至恒质量取出,再用电子天平称量相关部位干物质质量。
接穗茎叶比=(接穗干质量-接穗叶片干质量)/接穗叶片干质量; (1)
全株干质量=接穗干质量+砧木干质量+根系干质量; (2)
根冠比=根系干质量/(接穗干质量+砧木干质量); (3)
单位面积叶片干质量(LMA)=接穗叶片干质量/接穗叶片面积; (4)
迪克森质量指数(DQI)=全株干质量/[(株高/接穗茎粗)+(接穗干质量+砧木干质量)/根系干质量]。 (5)
1.4 生理指标测定
光照处理10 d,并于光期结束时(20:00),每个处理随机取15株嫁接苗的真叶部分用于生理生化指标测定,每5株为一个样品,3次重复。采用乙醇浸提法[21]测定叶绿素的含量;采用蒽酮比色法[22]测定可溶性糖含量;采用考马斯亮蓝法[23]测定可溶性蛋白含量。
1.5 统计分析
采用Excel 2019进行图表绘制,采用SPSS 26.0对试验数据进行统计学分析,使用Duncan新复极差法进行差异显著性检验。
2 结果与分析
2.1 不同光质对黄瓜嫁接苗形态指标的影响
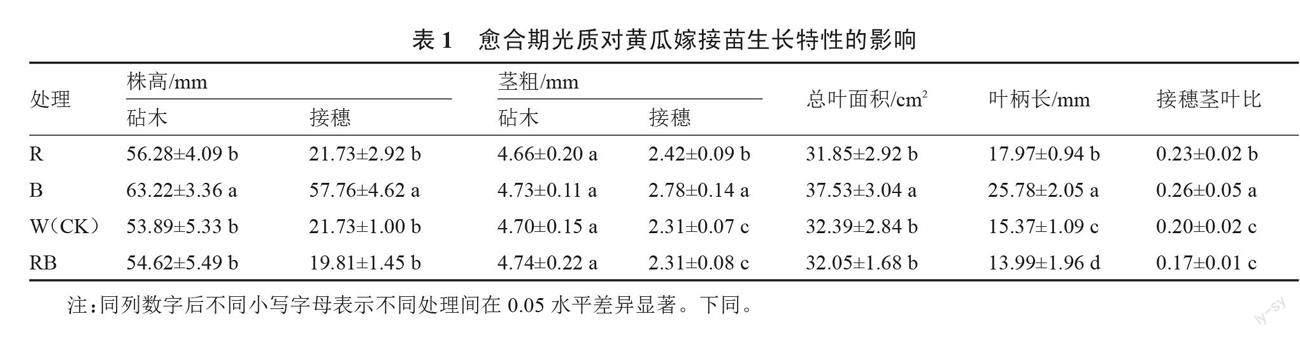
2.1.1 不同光质对黄瓜嫁接苗地上部分形态指标的影响 由表1可知,不同光质处理对黄瓜嫁接苗地上部分形态指标的影响有一定差异。B处理对嫁接苗茎秆伸长生长具有一定的促进作用,经B处理的嫁接苗砧木株高、接穗株高均显著高于其他处理。各处理间嫁接苗接穗茎粗的变化趋势为B>R>RB=W,其中以B处理最大,比W处理显著增加20.35%,但各处理间砧木茎粗无显著差异。B处理下黄瓜嫁接苗的总叶面积、叶柄长、接穗茎叶比均显著高于其他处理。R、W及RB处理下总叶面积无显著差异,叶柄长、接穗茎叶比变化趋势均为R>W>RB,其中各处理间叶柄长差异显著,R处理下接穗茎叶比显著高于W、RB处理。
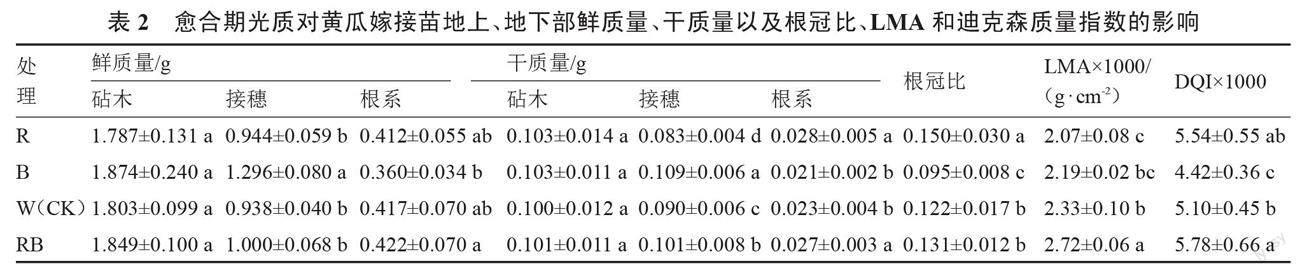
2.1.2 不同光质对黄瓜嫁接苗形态综合指标的影响 由表2、图2可知,B处理下嫁接苗的接穗鲜质量、干质量均显著高于W处理。R、RB处理与W处理相比,接穗鲜质量无显著差异,但R处理接穗干质量与W处理相比显著降低7.78%,RB处理接穗干质量显著增加了12.22%。各光质处理下砧木鲜质量、干质量无显著差异。
R、RB处理还有利于嫁接苗根系干物质积累,根系干质量显著高于W处理。由此可见,B处理及RB处理均可促进嫁接苗干物质积累,B处理对接穗干物质的积累作用效果显著,但不利于根系干物质积累。嫁接苗根冠比、单位面积叶片干质量(LMA)及迪克森质量指数(DQI)也受愈合期间光质的影响,R处理下黄瓜嫁接苗根冠比最大,比W处理显著增加22.95%;B处理下根冠比最小,比W处理显著降低22.13%。B处理下LMA略低于W处理,但无显著差异;R处理下LMA显著低于W处理;RB处理下LMA显著高于W处理。不同光质处理下,DQI也发生不同的变化,其大小依次是RB>R>W>B,RB和B处理均与W处理存在显著差异,R处理与W处理差异不显著。
2.2 不同光质对黄瓜嫁接苗生理指标的影响
2.2.1 不同光质对黄瓜嫁接苗叶绿素含量的影响 由表3可知,R、B处理下叶绿素a、总叶绿素含量均显著低于W处理,其中叶绿素a含量分别比W处理低13.53%、8.82%,总叶绿素含量分别比W处理低9.72%,9.43%。RB处理叶绿素a、叶绿素b及总叶绿素含量均略低于W处理,但差异不显著。R处理有利于叶绿素b的积累,叶绿素b含量显著高于B处理,但与W、RB处理相比无显著差异。黄瓜嫁接苗经过不同光质处理后,叶绿素(a/b)值发生变化,B处理下比值最高,但与W处理无显著差异,R处理下比值最低,显著低于其他处理。
2.2.2 不同光質对黄瓜嫁接苗可溶性糖、可溶性蛋白含量的影响 由图3可知,不同光质处理对黄瓜嫁接苗叶片可溶性糖、可溶性蛋白含量的影响有所不同。R、B处理的黄瓜嫁接苗可溶性糖含量均显著高于W处理,与W处理相比分别增加了68.14%、56.45%。RB处理下的可溶性糖含量略高于W处理,但二者之间差异不显著。B处理下可溶性蛋白含量最高,与W处理相比显著增加了42.00%,R处理、RB处理可溶性蛋白含量均显著低于W处理,但二者之间可溶性蛋白含量无显著差异。
2.3 不同光质对黄瓜嫁接苗定植后开花习性的影响
由表4、图4可以看出,黄瓜嫁接苗愈合期间经过不同光质处理后,第1朵雌花开放节位以及10节、15节、20节以内的雌花数有所不同。与R、B、W处理相比,RB处理下黄瓜嫁接苗第1朵雌花开放的节位显著降低。各处理间黄瓜嫁接苗第10节以内雌花数变化趋势为B>RB>W>R,第15节、20节以内雌花数变化趋势均为B>W>RB>R,其中R处理雌花数最少,显著低于其他处理,B、RB处理雌花数与W处理相比均无显著差异。
3 讨论与结论
光照是调控植物形态建成与产量品质形成的有效环境因子,利用LED照明技术对光环境进行精准调控是提高设施蔬菜生产综合效益的一项关键技术手段[24]。茎秆伸长是植物响应红光、蓝光的重要指标之一。笔者的研究结果显示,单色B处理下,嫁接苗接穗及砧木株高均显著高于其他处理,此类现象也同样发生在芸薹属植物中,如芝麻菜、芥菜、卷心菜和羽衣甘蓝[25-26],以及矮牵牛、天竺葵、大角菊和万寿菊等花坛植物中[27],Hernández等[28]及Liang等[29]在探究红蓝光质对黄瓜幼苗形态建成的影响时也得到相同结果。前人[30]研究表明,特定的蓝光受体隐花色素与感受红光、远红光信号的光敏色素存在共享信号通路,协同参与由光介导的茎秆伸长反应[31-32]。蓝光对植株茎秆伸长的促进作用可能与较低的光敏色素稳态值(PPS)有关,当PPS值降低到0.6以下时,光敏色素无法激活[33],失活的光敏色素可作为诱导避阴反应的信号,最大限度地促进茎秆伸长生长,导致株高显著高于其他處理[34]。同时蓝光所诱导的避阴反应还可以最大限度地促进叶柄伸长,刺激叶片扩张,提高生物量向支撑结构(如主茎)的分配比例,以增加黄瓜嫁接苗的光截获能力,促进光合产物积累[35],这也部分解释了为何B处理下嫁接苗叶柄长、总叶面积、接穗茎叶比、全株鲜质量及干质量均高于其他处理。
笔者研究中,B处理下的干质量最高,R处理下的干质量最低,这与Hernández等[28]在黄瓜幼苗以及Liu等[36]在樱桃番茄上的研究结果相类似。弱光条件下(100 μmol·m-2·s-1),蓝光为光合机构高效运行所必需[37],R处理下较低的鲜质量、干质量可能与“红光综合症”有关,即长时间生长在纯红光下,植物会表现出光合作用失调、PSII原初光能转化效率(Fv/Fm)降低以及气孔响应紊乱的症状[38],影响黄瓜嫁接苗光合产物积累。Hogewoning等[39]指出在纯红光中加入7%的蓝光便可缓解“红光综合症”引起的生理障碍。一些研究结果也表明,至少需要30 μmol·m-2·s-1的蓝光才能满足某些植株正常生长发育的需求[40-41]。
在评价种苗质量时,苗圃人员需要一种客观指标来预测种苗定植后的生长状况。单位叶面积的叶片干质量(LMA)可以被理解为叶片层面的光截获成本,是植物生长的关键指标之一[42]。笔者研究发现,RB处理下LMA显著高于其他处理。DQI也被认为是一种很有前途的幼苗质量指标[43]。作为一个综合了总生物量、健壮程度和茎粗与株高之比的参数,DQI阐明了植物定植后在田间生存和生长的整体潜力。笔者研究发现,不同光质处理下,DQI具有明显的变化,RB>R>W>B。因此,从嫁接苗形态指标及干物质积累量综合来看,蓝光是嫁接苗正常生长所必需的,红蓝混合光(RB)最利于嫁接苗壮苗的培育,宜作为嫁接苗愈合光质。
叶绿素含量体现了植物对光能的利用和调节能力,是评价植物生长发育状况的一项基础指标,含量高低与植物光合能力有直接关系。笔者的研究结果表明,W处理下黄瓜嫁接苗叶片中总叶绿素含量均显著高于R、B处理,与唐大为等[44]、储钟稀等[45]的研究结果一致,RB处理下总叶绿素含量也高于R、B处理,说明在黄瓜嫁接苗光合色素合成方面,混合光处理较单一红、蓝光具有更为明显的优势。可溶性蛋白、可溶性糖含量是衡量幼苗品质的重要指标。笔者研究发现,R处理提高了黄瓜嫁接苗叶片的可溶性糖含量,这与在黄瓜[44]、番茄[46]和萝卜[47]幼苗中的研究结果一致,可见红光提高植物体内可溶性糖含量是普遍现象。笔者还发现,B处理下,黄瓜嫁接苗叶片中可溶性糖含量略低于R处理,但无显著差异,这可能与B处理下有较多的光合产物生成有关,王爱民等[48]对缕丝花试管苗的研究也得出相同结论,即红光下可溶性糖含量最高,然后依次是蓝光、白光。蛋白质是组成有机体的重要成分,是生物体的主要物质基础。大量研究结果表明,红光和蓝光对高等植物的蛋白质代谢有重要的调节作用,蓝光处理下多种植物叶片蛋白质含量高于红光处理[49-51],笔者的研究结果也得出相同结论。B处理下可溶性蛋白含量分别比R、W、RB处理高132.55%、42.00%、100.02%。这可能是因为蓝光能促进叶片线粒体的暗呼吸,暗呼吸产生的有机酸含量可为氨基酸的合成提供碳架,促进了蛋白质的合成[52],同时蓝光可诱导抗氧化酶基因的表达并提高其活性,缓解植物可溶性蛋白质含量的降解[53]。
第1朵雌花节位与雌花率是预测单株黄瓜果实数量及整体黄瓜产量的重要指标[54-56]。黄瓜花性分化是一个高度复杂的生理生化和形态发生的过程,受基因、激素和环境因素等共同调控[57],光质在此过程中起到至关重要的作用。笔者研究发现,黄瓜嫁接苗愈合期间不同光质处理影响黄瓜第1朵雌花开放节位以及10节、15节、20节以内雌花数。其中RB处理下第1朵雌花节位最低,比W处理显著降低了1.5个节位,但10节、20节以内雌花数与W处理无显著差异。R处理下,10节、15节、20节以内雌花数显著低于其他处理,说明R处理不利于黄瓜嫁接苗雌花的分化。植物性别分化与内源激素密切相关,如乙烯促进雌花发育,GA则主要促进植物雄蕊的发育[58]。宋佳丽[59]指出较高比例蓝光可以通过调控使赤霉素钝化的基因CsGA2ox2的表达降低活性GA的水平,进而调控黄瓜苗期雌花的形成。苗妍秀等[60]研究也表明,蓝光和红蓝光组合照射下黄瓜前20节雌花数增加,与本研究结果基本一致。
RB处理有利于嫁接苗总叶绿素含量的提升,提高LMA及DQI等幼苗质量评估指标,促进黄瓜嫁接苗的愈合和生长,还能降低第1朵雌花开放节位。综上所述,在工厂化黄瓜嫁接苗愈合期间,提供红蓝混合光的光质条件最为适宜。
参考文献
[1] 董涛.基于专利分析的我国黄瓜产业技术发展研究[J].农业与技术,2016,36(22):233-234.
[2] 徐传.温室黄瓜生产存在问题及应对策略[J].中国果菜,2020,40(6):122-124.
[3] 任锡存,张青艳.节能日光温室黄瓜栽培技术[J].现代农业科技,2011(10):125-126.
[4] 杨侃侃,刘晓虹,陈宸,等.黄瓜枯萎病研究进展[J].湖南农业科学,2019,31(6):121-124.
[5] 隋继超,李晓丽,宋晓飞,等.黄瓜抗枯萎病研究进展[J].中国瓜菜,2023,36(1):1-5.
[6] NOOR R S,WANG Z,UMAIR M,et al.Interactive effects of grafting techniques and scion-rootstocks combinations on vegetative growth,yield and quality of cucumber(Cucumis sativus L.)[J].Agronomy-Basel,2019,9(6):288.
[7] BIE Z L,NAWAZ M A,HUANG Y,et al.Introduction to vegetable grafting[M].COLLA G,PEREZ-ALFOCEA T,SCHWARZ D.Vegetable grafting,Principles and Practices.England:CABI Publishing.2017:1-21.
[8] MUNEER S,KO C H,SOUNDARARAJAN P,et al.Proteomic study related to vascular connections in watermelon scions grafted onto bottle-gourd rootstock under different light intensities[J].PLoS One,2015,10(3):e0120899.
[9] LI F H,LI Y,LI S L,et al.Green light promotes healing and root regeneration in double-root-cutting grafted tomato seedlings[J].Scientia Horticulturae,2021,289:110503.
[10] WEI H,WANG M Z,JEONG B R.Effect of supplementary lighting duration on growth and activity of antioxidant enzymes in grafted watermelon seedlings[J].Agronomy-Basel,2020,10(3):337.
[11] WEI H,ZHAO J,HU J T,et al.Effect of supplementary light intensity on quality of grafted tomato seedlings and expression of two photosynthetic genes and proteins[J].Agronomy-Basel,2019,9(6):339.
[12] 劉方园,黄远,黎煊,等.愈合期不同温度和光照处理对甜瓜嫁接苗质量的影响[J].中国瓜菜,2019,32(3):18-21.
[13] 刘文科.LED植物工厂光质生物学研究与应用现状[J].中国农业科技导报,2018,20(10):9-14.
[14] JANG Y,MUN B,SEO T,et al.Effects of light quality and intensity on the carbon dioxide exchange rate,growth,and morphogenesis of grafted pepper transplants during healing and acclimatization[J].Korean Journal of Horticultural Science & Technology,2013,31(1):14-23.
[15] VU N T,KIM Y S,KANG H M,et al.Effect of red LEDs during healing and acclimatization process on the survival rate and quality of grafted tomato seedlings[J].Protected Horticulture and Plant Factory,2014,23(1):43-49.
[16] BANTIS F,DANGITSIS C,KOUKOUNARAS A.Influence of light spectra from LEDs and scion×rootstock genotype combinations on the quality of grafted watermelon seedlings[J].Plants,2021,10(2):353.
[17] NGUYEN T H,PHAM T D,DONG H G,et al.Effect of light-emitting diode irradiation during healing and acclimatization period on the survival rate and seedlings quality of grafted pepper[J].Journal of Agricultural,Life and Environ Scientia,2014,26(3):39-47.
[18] VU N,KIM Y,KANG H,et al.Influence of short-term irradiation during pre-and post-grafting period on the graft-take ratio and quality of tomato seedlings[J].Horticulture,Environment,and Biotechnology,2014,55(1):27-35.
[19] BANTIS F,KOUKOUNARAS A,SIOMOS A S,et al.Bichromatic red and blue LEDs during healing enhance the vegetative growth and quality of grafted watermelon seedlings[J].Scientia Horticulturae,2019,261:109000.
[20] MOOSAVI-NEZHAD M,SALEHI R,ALINIAEIFARD S,et al.Blue light improves photosynthetic performance during healing and acclimatization of grafted watermelon seedlings[J].International Journal of Molecular Sciences,2021,22(15):8043.
[21] 李合生,孫群,赵世杰.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[22] LIU H,FU Y M,HU D W,et al.Effect of green,yellow and purple radiation on biomass,photosynthesis,morphology and soluble sugar content of leafy lettuce via spectral wavebands“knock out”[J].Scientia Horticulturae,2018,236:10-17.
[23] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.
[24] HE J,QIN L,CHOW W S.Impacts of LED spectral quality on leafy vegetables:productivity closely linked to photosynthetic performance or associated with leaf traits[J].International Journal of Agricultural and Biological Engineering,2019,12(6):16-25.
[25] KONG Y,SCHIESTEL K,ZHENG Y B.Pure blue light effects on growth and morphology are slightly changed by adding low-level UVA or far-red light:a comparison with red light in four microgreen species[J].Environmental and Experimental Botany,2019,157:58-68.
[26] JOHNSON R E,KONG Y,ZHENG Y B.Elongation growth mediated by blue light varies with light intensities and plant species:a comparison with red light in arugula and mustard seedlings[J].Environmental and Experimental Botany,2020,169:103898.
[27] KONG Y,STASIAK M,DIXON M A,et al.Blue light associated with low phytochrome activity can promote elongation growth as shade-avoidance response:a comparison with red light in four bedding plant species[J].Environmental and Experimental Botany,2018,155:345-359.
[28] HERNANDEZ R,KUBOTA C.Physiological responses of cucumber seedlings under different blue and red photon flux ratios using LEDs[J].Environmental and Experimental Botany,2016,121(S1):66-74.
[29] LIANG Y,KANG C Q,KAISER E,et al.Red/blue light ratios induce morphology and physiology alterations differently in cucumber and tomato[J].Scientia Horticulturae,2021,281:109995.
[30] PEDMALE U V,HUANG S S C,ZANDER M,et al.Cryptochromes interact directly with PIFs to control plant growth in limiting blue light[J].Cell,2016,164(1/2):233-245.
[31] COSGROVE D J.Rapid suppression of growth by blue light:Occurrence,time course,and general characteristics[J].Plant Physiology,1981,67(3):584-590.
[32] HUCHE-THELIER L,CRESPEL L,LE GOURRIEREC J,et al.Light signaling and plant responses to blue and UV radiations-perspectives for applications in horticulture[J].Environmental and Experimental Botany,2016,121(S1):22-38.
[33] STUTTE G W.Light-emitting diodes for manipulating the phytochrome apparatus[J].HortScience,2009,44(2):231-234.
[34] KONG Y,SCHIESTEL K,ZHENG Y B.Maximum elongation growth promoted as a shade-avoidance response by blue light is related to deactivated phytochrome:a comparison with red light in four microgreen species[J].Canadian Journal of Plant Science,2020,100(3):314-326.
[35] LIN K H,HUANG M Y,HUANG W D,et al.The effects of red,blue,and white light-emitting diodes on the growth,development,and edible quality of hydroponically grown lettuce(Lactuca sativa L.var.capitata)[J].Scientia Horticulturae,2013,150:86-91.
[36] LIU X Y,CHANG T T,GUO S R,et al.Effect of different light quality of LED on growth and photosynthetic character in cherry tomato seedling[J].Acta Horticulturae,2011,907:325-330.
[37] 王曉艳.LED光质对弱光下黄瓜幼苗生长发育以及光合功能的影响[D].南京:南京农业大学,2014.
[38] TROUWBORST G,HOGEWONING S W,VAN KOOTEN O,et al.Plasticity of photosynthesis after the‘red light syndromein cucumber[J].Environmental and Experimental Botany,2016,121:75-82.
[39] HOGEWONING S W,TROUWBORST G,MALJAARS H,et al.Blue light dose-responses of leaf photosynthesis,morphology,and chemical composition of Cucumis sativus grown under different combinations of red and blue light[J].Journal of Experimental Botany,2010,61(11):3107-3117.
[40] WHEELER R M,MACKOWIAK C L,SAGER J C.Soybean stem growth under high-pressure sodium with supplemental blue lighting[J].Agronomy Journal,1991,83(5):903-906.
[41] YORIO N C,MACKOWIAK C L,WHEELER R M,et al.Vegetative growth of potato under high-pressure sodium,high-pressure sodium SON-Agro,and metal halide lamps[J].HortScience,1995,30(2):374-376.
[42] POORTER H,NIINEMETS U,POORTER L,et al.Causes and consequences of variation in leaf mass per area(LMA):A meta-analysis[J].New Phytologist,2009,183(4):1222.
[43] YUCEDAG C,BILIR N,OZEL H B.Phytohormone effect on seedling quality in Hungarian oak[J].Forest Systems,2019,28(2):e005.
[44] 唐大为,张国斌,张帆,等.LED光源不同光质对黄瓜幼苗生长及生理生化特性的影响[J].甘肃农业大学学报,2011,46(1):44-48.
[45] 储钟稀,童哲,冯丽洁,等.不同光质对黄瓜叶片光合特性的影响[J].植物学报,1999,41(8):867-870.
[46] WANG W,SU M H,LI H H,et al.Effects of supplemental lighting with different light qualities on growth and secondary metabolite content of Anoectochilus roxburghii[J].PeerJ,2018,6:e5274.
[47] 张欢,徐志刚,崔瑾,等.不同光质对萝卜芽苗菜生长和营养品质的影响[J].中国蔬菜,2009(10):28-32.
[48] 王爱民,肖炜,杜文雪,等.光质对缕丝花试管苗生长发育的影响[J].徐州师范大学学报(自然科学版),2001,19(4):56-58.
[49] 陈娴,刘世琦,孟凡鲁,等.不同光质对韭菜生长及光合特性的影响[J].中国蔬菜,2012(8):45-50.
[50] 张立伟,刘世琦,张自坤,等.光质对萝卜芽苗菜营养品质的影响[J].营养学报,2010,32(4):390-392.
[51] 秦永梅,韩凤英,杨慧,等.光质对苦瓜幼苗形态建成及碳氮代谢的影响[J].中国瓜菜,2020,33(7):24-27.
[52] KOWALLIK W.Blue light effects on respiration[J].Annual Review of Plant Physiology,1982,33(1):51-72.
[53] PAN R C,CHEN F G.Retardation of senescence in detached leaves of mung bean seedling by blue light[J].Botanical Journal of South China,1992(1):66-72.
[54] 管雪松,李洪岩,欧阳明安.累积嫁接对黄瓜雌雄花及花粉萌发的影响[J].江苏农业科学,2016,44(6):248-251.
[55] BU F J,CHEN H M,SHI Q X,et al.A major quantitative trait locus conferring subgynoecy in cucumber[J].Theoretical and Applied Genetics,2016,129(1):97-104.
[56] YUAN X J,PAN J S,CAI R,et al.Genetic mapping and QTL analysis of fruit and flower related traits in cucumber(Cucumis sativus L.)using recombinant inbred lines[J].Euphytica,2008,164(2):473-491.
[57] 馬刘峰,易海艳,易霞,等.不同光周期和温度处理对黄瓜花芽分化的影响[J].北方园艺,2012(21):25-26.
[58] 殷惠玲.黄瓜幼苗期性型分化的环境因素[J].现代农业,2012(5):34-34.
[59] 宋佳丽.光质调控黄瓜花性分化的转录组分析[D].广州:华南农业大学,2016.
[60] 苗妍秀,陈青云,曲梅,等.黄瓜红蓝光质育苗对其定植后生长、光合特性以及产量的影响[J].园艺学报,2019,46(7):1388-1398.

