番茄青枯病拮抗菌株B-6 的诱变选育
李甜爽,王潞伟,任潇妍,刘海霞,王美琴
(山西农业大学 植物保护学院,山西 太谷 030801)
番茄青枯病是由青枯劳尔氏菌(Ralstonia solanacearum)引起的细菌性维管束组织病害,是一种典型的毁灭性土传病害,其发病早期不易显症,中后期症状明显时,已错过关键防治期,严重时番茄植株青枯萎蔫,死棵现象明显,导致番茄产量和品质下降,给种植户带来极大经济损失[1-3]。近年来,随着温室番茄种植面积扩大和重茬连作等因素,导致这种病害日益严重[4]。生产上用来防治番茄青枯病主要有中生菌素、噻森铜、春雷霉素等化学药剂,但长期使用易造成病原菌抗药性、药剂残留、破坏生态平衡等负面影响[5-7]。近年来,在青枯病防治中登记使用的微生物农药种类相对较多,与化学农药登记的份额基本相同,主要集中在芽孢杆菌属和荧光假单胞菌两大类群。通过多途径筛选拮抗活性好的生防菌株在倡导保护环境、维护生态平衡、追求绿色食品的现代农业中,成为20 世纪以来农药界和植病界学者研究的热点[8-9]。
对于茄科蔬菜青枯病的防治,国内外学者主要集中在室内有益微生物的筛选,多从植株内或其根际土壤中分离,如无致病力青枯菌(Ralstonial solanacearumavirulent strain)、芽孢杆菌属(Bacillus)、链霉菌属(Streptomyces)、野野村菌属(Nonomuraea)、假单胞菌属(Pseudomonas)和节杆菌属(Arthrobacter)等[10-16]。目前,生产上登记的应用于青枯病防治的生防菌剂有芽孢杆菌和假单胞菌。从自然界分离野生型菌株往往耗时长、效率低、产量低,离生产应用还有一定距离,使用物理或化学等人工诱变方法处理微生物,可以增强拮抗作用,提高产量,获得满足工业生产需求的目的菌株[17-18]。人工诱变方法简便、收效大,常用的诱变方法有紫外线诱变、亚硝酸诱变、硫酸二乙酯诱变、常压室温等离子体诱变等。左勇等[19]对贝莱斯芽孢杆菌(Bacillus velezensis)进行紫外和亚硝酸复合诱变,酶活提高了205.8%。高兆建等[20]用紫外线-硫酸二乙酯复合诱变处理地衣芽孢杆菌(Bacillus licheniformis),得到抑菌活性显著提高的突变菌株。高荣等[21]用ARTP 诱变处理海藻类芽孢杆菌(Paenibacillus algicola),酶活明显提高。微生物诱变机制较复杂,采用复合诱变的方法可扩大基因突变范围,使诱变效果产生协同效应,提高突变效果和遗传稳定性,获得高效突变生防菌株[19]。
山西农业大学植物保护学院植物病害生物防治课题组前期从健康番茄植株的根际土壤中分离筛选出对Ralstonia solanacearum具有拮抗作用的铜绿假单胞菌(Pseudomonas aeruginosa)B-6[22]。本试验以菌株B-6 作为出发菌株,以番茄青枯病菌为指示菌,通过紫外和亚硝酸钠复合诱变处理,旨在筛选出对番茄青枯病菌拮抗性能更强且遗传稳定性良好的高效突变菌株,以期为铜绿假单胞菌诱变育种和番茄青枯病的生物防治以及生防菌剂的进一步开发应用提供依据。
1 材料和方法
1.1 材料
1.1.1 供试菌株 出发菌株Pseudomonas aeruginosaB-6、指示菌Ralstonia solanacearum,均由山西农业大学植物病理重点实验室分离保藏。
1.1.2 供试培养基 优化的NB 培养基:麦芽糖3%(30 g)、蛋白胨1%(10 g)、氯化钠1%(10 g),蒸馏水1 L,pH 值8.0。NA 培养基:牛肉浸膏3 g,蛋白胨5 g,蔗糖10 g,琼脂粉15 g,蒸馏水1 L,pH 值7.0 左右。
1.1.3 供试试剂 0.1 mol/L亚硝酸钠溶液;1 mol/L pH 值4.6 醋酸缓冲液;pH 值8.6 磷酸氢二钠溶液;pH 值7.2 磷酸缓冲液。
1.2 方法
1.2.1 菌种的活化 取管藏的Ralstonia solanacearum和Pseudomonas aeruginosaB-6 斜面,用划线的方法接种在NA 培养基平板上,在30 ℃培养箱中倒置培养2~3 d。
1.2.2 生长曲线的测定 从活化菌株的平板中挑取2 环接入100 mL(250 mL 锥形瓶)优化的NB 培养基中,30 ℃、180 r/min 振荡培养24 h 得种子液,再按照3%接种量接入新的优化NB 培养基中同条件振荡培养,每1 h 取样一次,以不接种子液的优化NB 培养基作为空白对照,用紫外分光光度计测定OD600。以OD600为纵坐标,培养时间(h)为横坐标绘制拮抗菌株B-6 的生长曲线图。
1.2.3 菌悬液的制备 同1.2.2 制备菌的发酵液,振荡培养18 h 后的发酵液,在7000 r/min、4 ℃离心20 min,弃上清液收集沉淀菌体,用0.1%磷酸缓冲液洗涤2 次,再重悬菌体即得菌悬液,调节菌体浓度为1.0×108cfu/mL。
1.2.4 紫外诱变
1.2.4.1 紫外辐射处理 在超净工作台中放置好磁力搅拌器,并将其与紫外灯(30 W)之间的距离固定为30 cm,紫外灯提前30 min 打开保证光波稳定。取4 mL 菌悬液加入带有转子的无菌培养皿中,放置在磁力搅拌器上,在黑暗条件下对菌悬液边搅拌边进行紫外线照射。本试验设置5 个紫外照射处理,时长分别为1、2、3、4、5 min,以不经紫外照射处理作为对照。
1.2.4.2 致死率 将各处理的菌悬液立即放入避光纸箱,在4 ℃冰箱保存2 h,以防止光复活。在暗环境下取出并进行稀释涂布,初始浓度视为1.0×108cfu/mL,对照浓度稀释至1.0×105、1.0×104、1.0×103cfu/mL,处理浓度稀释至1.0×106、1.0×105、1.0×104cfu/mL。取100 μL 涂布,每个稀释浓度3 个重复,在30 ℃培养箱中倒置培养2~3 d。
统计各处理平板的菌落数,选择菌落数为30~300 的浓度,通过十倍稀释法计算每毫升菌液中的活菌数,并按照公式(1)计算各紫外照射时长对菌体的致死率。
1.2.4.3 正(负)突变率 从不同处理平板中分别挑取30 个形态上有差异、生长速度快的单菌落与番茄青枯病菌进行平板对峙培养。挑取2 环番茄青枯病菌接入NB 培养基中,30 ℃、180 r/min 摇瓶培养24 h,取100 μL 发酵培养液涂布在NA 平板上,将挑取的单菌落点接在涂布平板上,每个平板均匀点接5 个,并以出发菌株作为对照,30 ℃黑暗培养3 d 后测量每个单菌落的抑菌圈直径,与对照的抑菌圈直径对比计算正(负)突变率,并进行初步筛选。由于点接细菌的菌量难以定量控制,所以,初筛以超过对照抑菌圈直径15%作为正突变菌株,低于对照15%为负突变菌株,二者之间的为未突变菌株,并按照公式(2)计算正(负)突变率[23]。
1.2.5 亚硝酸钠诱变 将1.2.3 所得沉淀菌体用磷酸缓冲液洗涤2 次。本试验设置5 个亚硝酸钠处理,浓度分别为:0.015、0.025、0.035、0.045、0.055 mol/L(即0.1 mol/L 亚硝酸钠溶液和pH 值4.6 醋酸缓冲液按照3∶17、5∶15、7∶13、9∶11、11∶9 的体积比配制成2 mL 溶液)。用上述溶液重悬菌体,在30 ℃下保存5 min,再加入pH 值8.6 的磷酸二氢钠溶液使pH值达到6.8 左右以终止反应,以不经亚硝酸钠处理的菌悬液作为对照。
同1.2.4 计算亚硝酸钠诱变处理对菌体的致死率和正(负)突变率。
1.2.6 亚硝酸钠和紫外复合诱变 选择上述试验正突变率较高的处理作为最佳诱变剂量进行复合诱变。同1.2.5 对沉淀菌体进行亚硝酸钠处理,处理完成后在4 ℃冰箱保存2 h,再同1.2.4 对亚硝酸钠处理后菌悬液进行最佳紫外照射时长处理。同1.2.4计算复合诱变处理对菌体的致死率和正(负)突变率。
1.2.7 正突变菌株的复筛 用琼脂扩散抑菌圈法进行复筛。对上述诱变处理所筛选出来的正突变菌株同1.2.3 进行摇瓶培养,离心所得上清液用0.22 μm 微孔滤膜过滤,所得无菌滤液与番茄青枯病菌进行平板对峙。倒平板后,涂布100 μL 番茄青枯病菌发酵液,晾干后打孔加入50 μL 无菌滤液,以出发菌株作为对照,在30 ℃培养箱中培养2~3 d。十字交叉法测量抑菌圈直径。
1.2.8 遗传稳定性测定 将筛选出来的高效突变菌株在NA 培养基上转接培养,2 d 为一代,连续转接10 代,同期发酵并同1.2.7 进行平板对峙试验,检测该菌株抑菌活性的变化,测定其遗传稳定性。
1.2.9 高效突变菌株与出发菌株的生长曲线对比 同1.2.2 测定高效突变菌株的生长曲线。
1.3 数据分析
采用Excle 2019 制作图表,采用IBM SPSS Statistics 25.0 进行数据处理,用Duncan 氏新复极差法进行差异显著分析(P<0.05)。
2 结果与分析
2.1 生长曲线
本研究通过分光光度法测定菌株B-6 的生长曲线,结果如图1 所示。
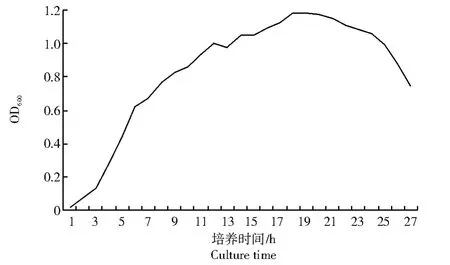
图1 拮抗菌株B-6 的生长曲线Fig.1 Growth curve of antagonistic bacterium strain B-6
从图1 可以看出,0~3 h 为延迟期,菌株适应环境;3~18 h 为对数生长期,菌株迅速繁殖,代谢旺盛,这一时期菌体生理状态同步,且对环境刺激比较敏感,有利于获得高效突变株,故在此时期进行诱变处理;18~20 h 为稳定期,OD600基本保持不变;20 h 以后进入衰亡期。
2.2 紫外诱变
拮抗菌株B-6 紫外诱变结果如图2 所示,照射时长为1 min 时,致死率为74.3%,随紫外照射时长增加,致死率也不断增加,照射时长为3 min 时,致死率达93.2%。紫外诱变处理后菌株的突变率比自然状态提高31.3%~50.0%,整体而言,正突变率随照射时长的增加呈先上升后下降趋势,照射时长为3 min 时正突变率最高,达31.3%,其次为照射2 min,达25.0%。为获得更多正突变株,选择2 min和3 min 作为后续复合诱变时的紫外照射时长。
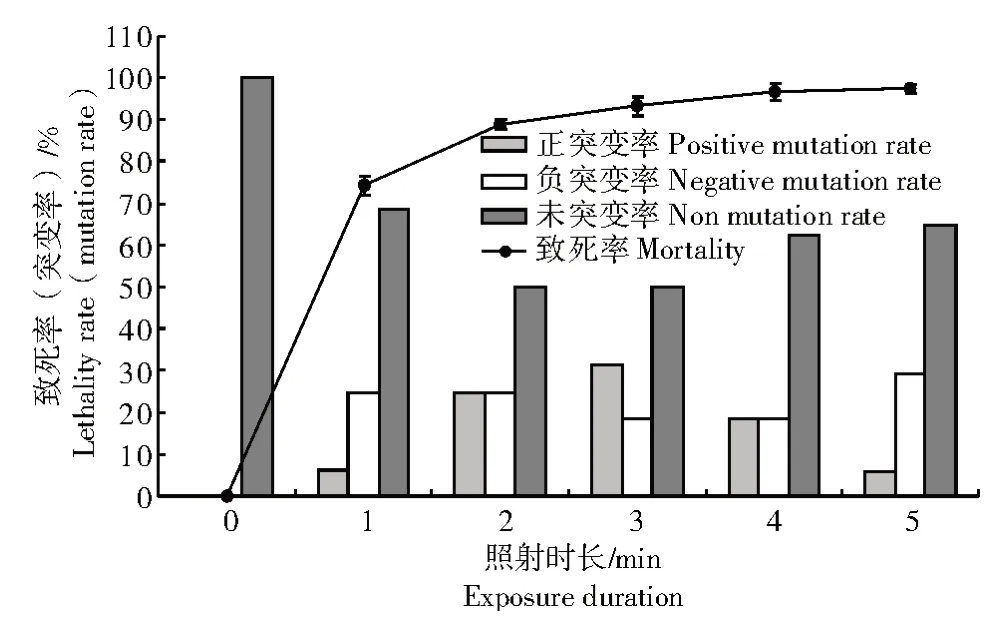
图2 紫外辐射处理对菌株B-6 致死率和突变率的影响Fig.2 Effect of UV on the lethality rate and mutation rate of B-6 strain
2.3 亚硝酸钠诱变
拮抗菌株B-6 亚硝酸钠诱变结果如图3 所示。

图3 亚硝酸钠处理对菌株B-6 致死率和突变率的影响Fig.3 Effect of sodium nitrite on the lethality rate and mutation rate of B-6 strain
由图3 可知,随亚硝酸钠浓度增加,致死率也不断增加,浓度为0.035 mol/L 时,致死率达到86.7%;浓度为0.055 mol/L 时,致死率达到95.6%。亚硝酸钠诱变后菌株的突变率比自然状态提高56.7%~86.7%,且负突变率高于正突变率,正突变率变化与亚硝酸钠浓度不同步,浓度为0.045 mol/L 时正突变率最高,达到25.0%,其次为0.035 mol/L 时,达到23.3%。为获得更多正突变株,选择0.035 mol/L和0.045 mol/L 作为后续复合诱变时亚硝酸钠浓度。
2.4 亚硝酸钠和紫外复合诱变
将上述所选最佳单一诱变剂量两两组合进行复合诱变处理,处理1 为3 min 和0.035 mol/L,处理2 为3 min 和0.045 mol/L,处理3 为2 min 和0.045 mol/L,处理4 为2 min 和0.035 mol/L,拮抗菌株B-6 亚硝酸钠和紫外复合诱变结果如图4 所示,处理4 致死率为89.9%,其余3 个处理均高于95.9%;处理2 即紫外照射时长为3 min 和亚硝酸钠浓度为0.045 mol/L 时正突变率最高,达到22.6%。
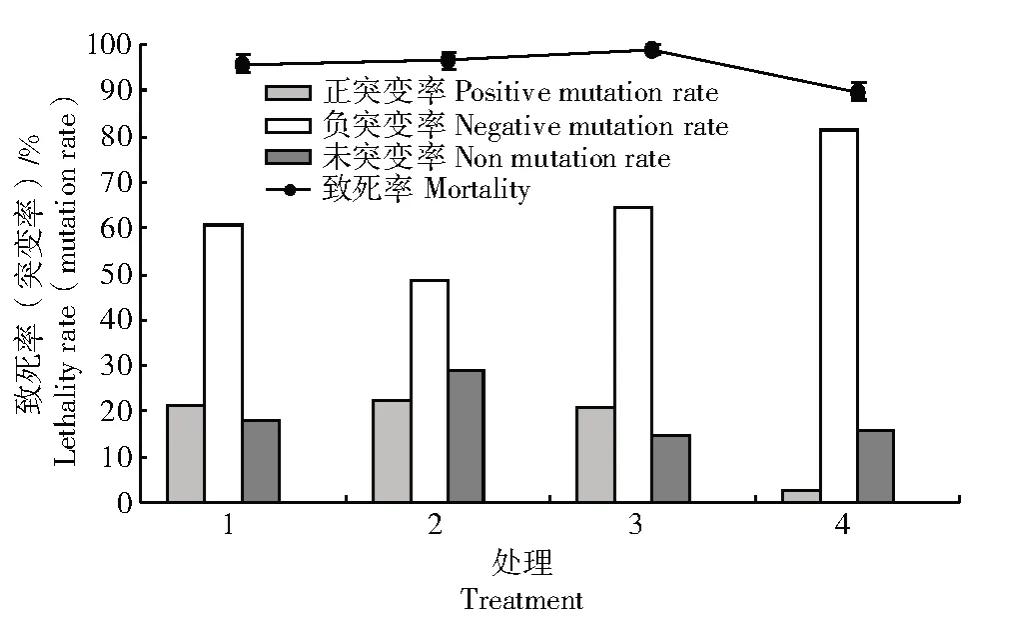
图4 紫外和亚硝酸钠复合处理对菌株B-6 致死率和突变率的影响Fig.4 Effect of compound treatment of UV and sodium nitrite on the lethality rate and mutation rate of B-6 strain
菌株B-6 复合诱变处理后共得到131 株诱变菌株,经平板对峙初筛,负突变菌株有85 株,未突变菌株有25 株,正突变菌株有21 株。另外,通过对比复合诱变和单一紫外或亚硝酸钠诱变的平板对峙初筛结果表明,紫外或亚硝酸钠单一诱变和二者复合诱变均可提高菌株的抑菌活性,与单一紫外诱变相比,复合诱变抑菌活性提高39.1%;与单一亚硝酸钠诱变相比,复合诱变抑菌活性提高25.4%,因此,复合诱变比单一诱变更能提高菌株B-6 的抑菌活性。
2.5 正突变菌株的复筛
将21 株正突变菌株分别编号为UH-1~UH-21,摇瓶发酵复筛结果如表1 所示,菌株UH-9 在处理2 即紫外照射时长为3.0 min 和亚硝酸钠浓度为0.045 mol/L 条件下获得,与其他20 株菌相比有显著性差异(P<0.05),抑菌圈直径可达28.6 mm,抑菌活性与出发菌株(15.3 mm)相比提高86.5%,平板对峙效果如图5所示,抑菌效果极显著提高。
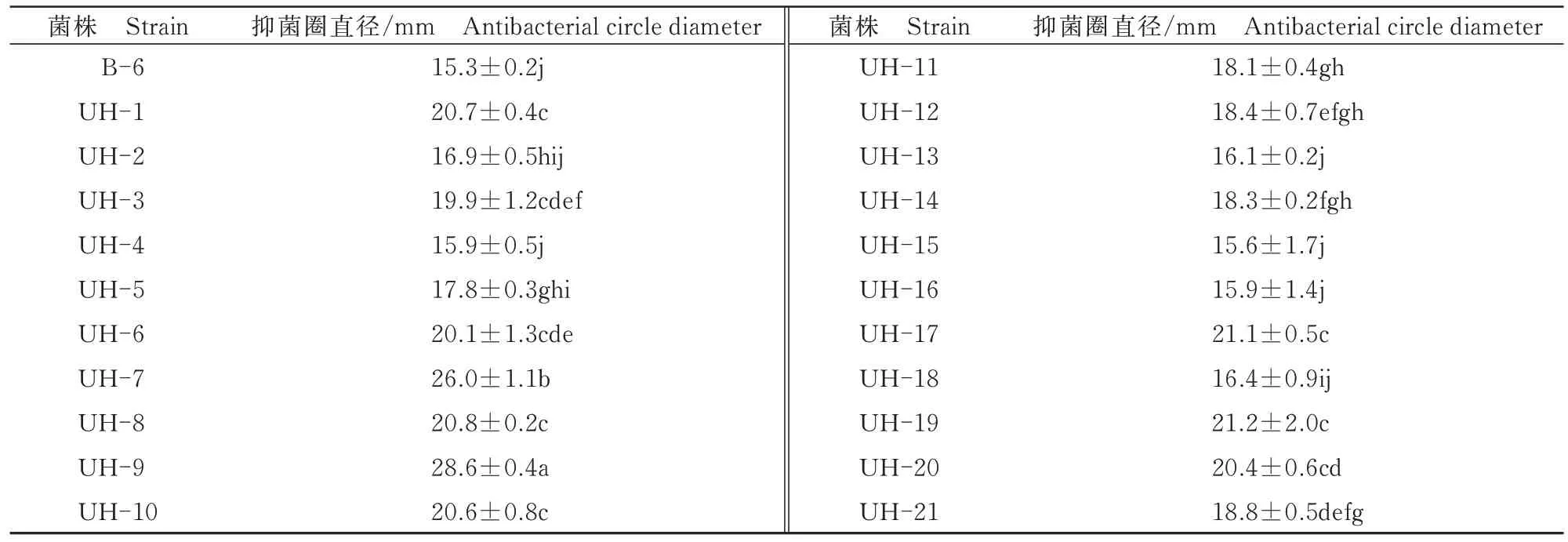
表1 正突变菌株对番茄青枯病菌的抑菌活性Tab.1 Antibacterial activity of positive mutant strains against Ralstonia solanacearum
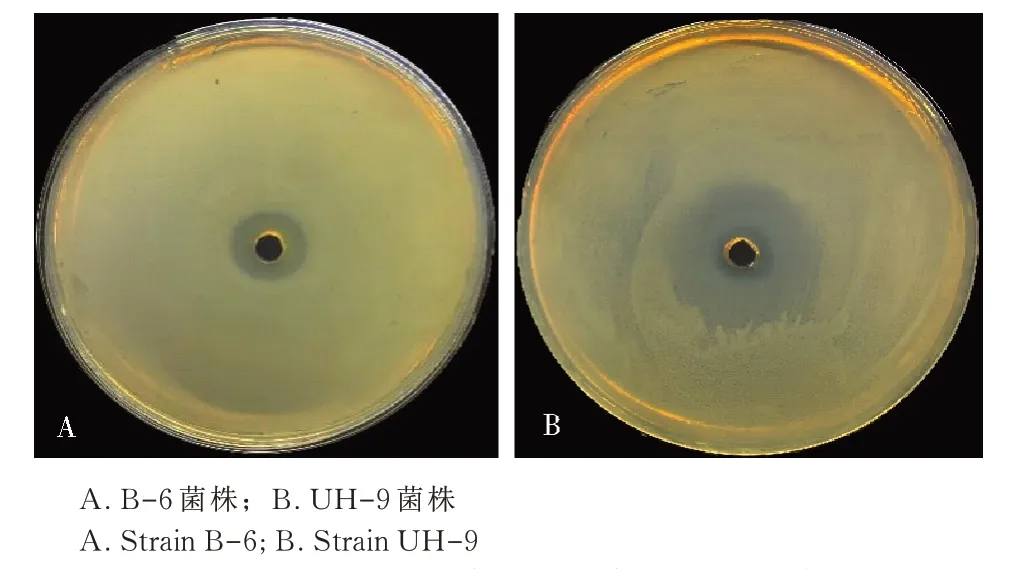
图5 拮抗菌株对番茄青枯病菌的抑菌效果Fig.5 Antibacterial effect of antagonistic strains against Ralstonia solanacearum
2.6 遗传稳定性测定
将UH-9 连续转接10 代后抑菌圈直径如图6所示。
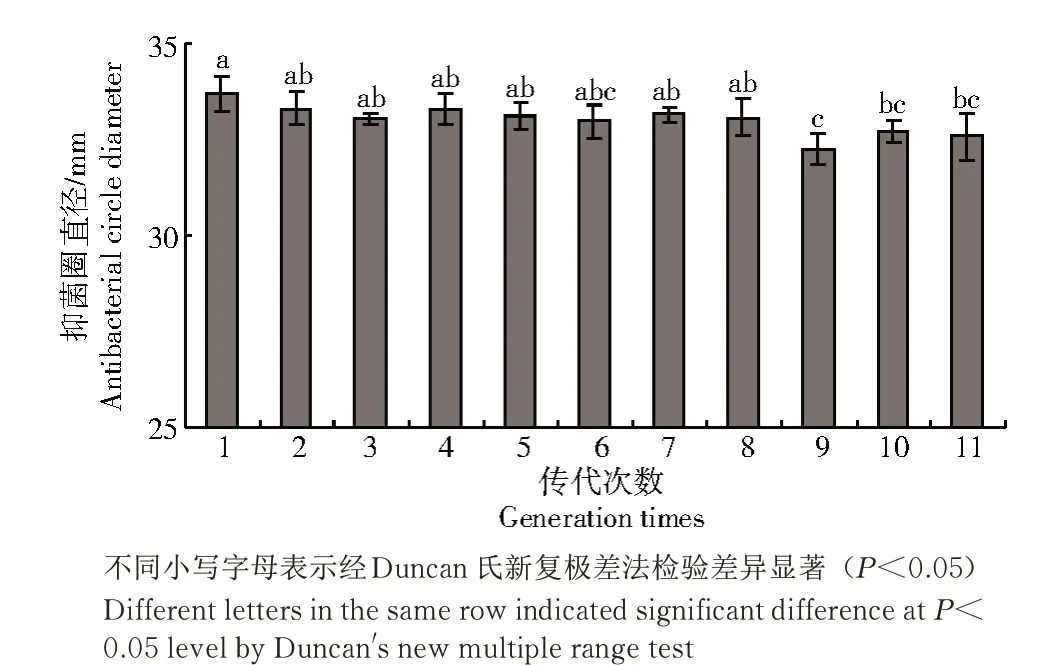
图6 UH-9 菌株的遗传稳定性Fig.6 Genetic stability of strain UH-9
由图6 可知,抑菌圈直径不严格随传代次数的增加而减少,而是有一定的波动,在7 代之内,菌株抑菌效果有所降低,但抑菌圈直径仍保持在27.9 mm以上,无显著差异;8 代之后抑菌圈直径有所下降,但维持在27.2 mm 以上。整体而言,连续传代10 次,与出发菌株相比抑菌活性提高率在77.4%以上,拮抗性能较稳定,具有良好的遗传稳定性。
2.7 高效突变菌株与出发菌株的生长曲线对比
突变菌株UH-9 和出发菌株B-6 生长曲线对比结果如图7 所示,菌株UH-9 相比B-6 抑菌活性增强,但2 个菌株生长曲线基本吻合,UH-9 菌株生长时期与B-6 相同,0~3 h 为延迟期,3~18 h 为对数生长期,18~20 h 为稳定期,20 h 以后进入衰亡期。但在13 h 之后,突变菌株OD600开始高于出发菌株B-6。
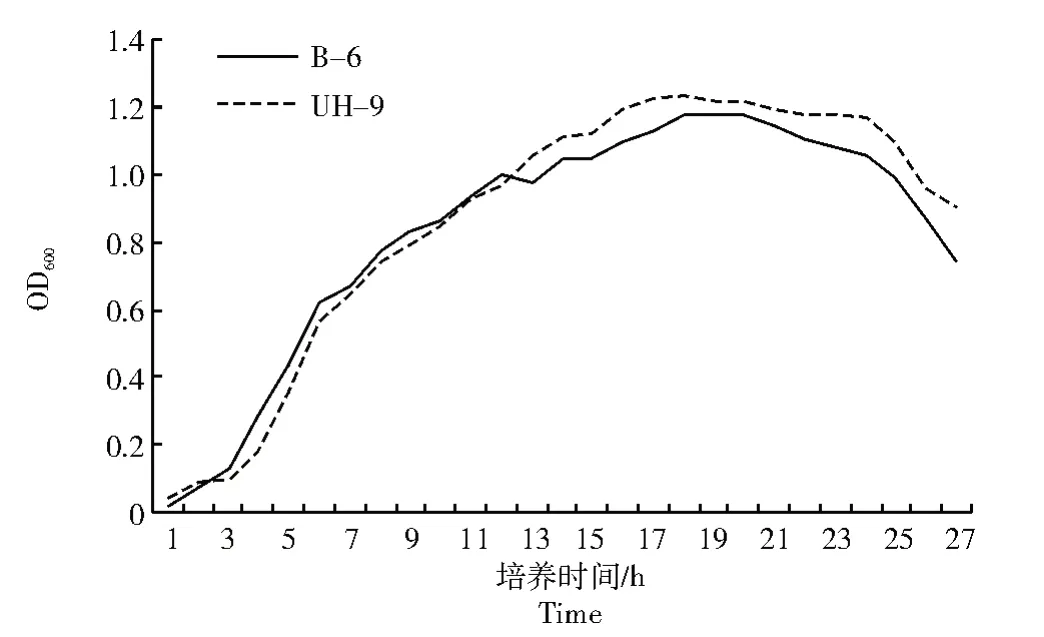
图7 菌株UH-9 与原菌株B-6 生长曲线对比Fig.7 Comparison of the growth curves of strain UH-9 and B-6
3 结论与讨论
青枯病在番茄种植区大面积发生且危害严重,但目前尚无高效的防治手段,因此,青枯病的防治在世界范围内都具有重要意义[24]。而生物防治更符合绿色发展理念,筛选具有高效生防作用的微生物是青枯病防控的重要手段之一[25]。生防假单胞菌繁殖能力强且广泛存在于根际土壤,可利用其次级代谢产物对烟草黑胫病、葡萄灰霉病、草莓炭疽病等多种病害起抑制作用[26-28]。本课题组前期从健康番茄植株的根际土壤中分离筛选出对番茄青枯病菌具有拮抗作用的P. aeruginosaB-6,大田防治效果达到60.3%,具有生防潜力[22]。通过人工诱变的方法可以改良菌种,提高抑菌活性。
微生物突变机制复杂,复合诱变是目前微生物育种的重要手段之一。杜婵娟等[29]用紫外线和亚硝酸复合诱变处理枯草芽孢杆菌Bs6602 菌株,抑菌活性提高83.8%。孙瑾[30]对铜绿假单胞菌进行单一诱变和多次复合诱变筛选,发现复合诱变所得菌株鼠李糖脂产量比单一诱变普遍增高。本试验以拮抗菌P. aeruginosaB-6 为出发菌株,经紫外或亚硝酸钠单一诱变选出最佳诱变剂量,再进行复合诱变处理,通过平板初筛和摇瓶发酵复筛,在紫外照射时长3 min 和亚硝酸钠浓度0.045 mol/L 复合处理条件下,获得1 株抑菌活性最强的高效突变菌株UH-9,其抑菌圈平均直径达28.6 mm,抑菌活性较出发菌株提高86.5%,连续传代培养7 次,抑菌活性无显著降低,具有遗传稳定性。同时,复合诱变比单一紫外或亚硝酸钠诱变抑菌活性分别提高39.1%和25.4%。
另外,通过对比突变菌株UH-9 和出发菌株B-6 的生长曲线,发现生长时期吻合,但在13 h 后,UH-9 的OD600高于B-6 菌株,推测可能在诱变过程中控制酶的相关基因发生突变,引起细胞生理生化变化,使得代谢物产量增多,进而导致抑菌活性提高。
本试验通过紫外和亚硝酸钠复合诱变处理所得高效突变菌株UH-9 抑菌活性有明显提高,为生防菌剂的进一步开发应用提供了依据,对番茄青枯病的生物防治具有重要意义。后续可通过基因序列比对或代谢产物定性定量分析研究突变菌株的代谢物变化。铜绿假单胞菌是一种条件性致病菌,从根际土壤分离的生防菌株相比临床分离的菌株毒性要低,但也存在一定毒性,可采用基因工程手段敲除致病相关基因[31]。其次,铜绿假单胞菌可产生多种次级代谢产物,对多种病原菌有抑制作用,在生防方面有很大应用前景,今后应注重抑菌代谢产物的研究,可用发酵罐的方法提高发酵效价[32]。

