肉鹅制品中松香酸和脱氢松香酸残留的高效液相色谱检测方法
李金玲 白昊鑫 马晶晶 刘裕 耿志明 李金平 王道营 徐为民


摘要:松香甘油酯是我国推荐使用的畜禽脱毛剂,研究表明,松香甘油酯在合成和使用过程中均能检出游离松香,这些残留的松香在脱毛过程中可能残留于畜禽胴体,而肉鹅制品中松香残留情况尚缺乏研究。在前期松香残留分析工作的基础上,以松香酸(AA)和脱氢松香酸(DHAA)作为松香的标志物,采用固相萃取对样品进行除杂和富集,高效液相二极管阵列检测器串联荧光检测器同时分析市场流通领域中肉鹅制品中2种目标化合物的含量。该方法具有重复性好、灵敏度高的特点,松香酸和脱氢松香酸的检出限分别为0.015 μg/g和0.003 μg/g。市场上流通的生、熟肉鹅制品中AA的阳性检出率均高达80%,AA含量分别在2.82~14.52 μg/g和0.64~9.6 μg/g范围,而生、熟肉鹅制品DHAA的阳性检出率分别为80%和60%,DHAA含量分别在1.62~10.06 μg/g和0.06~2.62 μg/g范围。研究结果表明,市场上流通领域的肉鹅制品中普遍检出松香残留,这些残留的松香进入消费者餐桌,存在食品安全隐患。
关键词:肉鹅制品;松香酸;脱氢枞酸;固相萃取;高效液相色谱法
中图分类号:TS207文献标志码:A文章编号:1002-1302(2023)11-0174-05
我国是世界肉鹅生产和消费大国,相比其他家禽,肉鹅羽毛具有分布更密集、毛层厚实、绒多且细长等特点[1],这些因素导致肉鹅宰后脱毛难度更大。脱毛是肉鹅屠宰加工过程中的重要环节,脱毛干净与否是制约肉鹅制品生产和销售的瓶颈问题之一[2]。传统的脱毛方法主要包括热烫、机械打毛、二次脱毛等步骤,热烫和机械脱毛可以去除大部分羽毛,二次脱毛主要采用黏附性较好的脱毛剂去除残留在头、颈、翅、臀等部位的细小微绒毛。
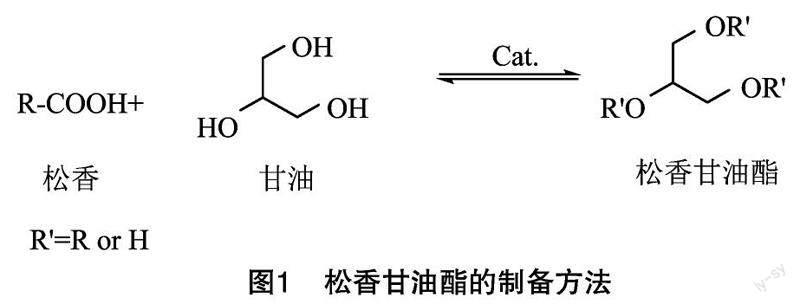
松香和松香甘油酯是2种常用的畜禽脱毛剂,二者在适当加热条件下可由固态转化成液态,此时较好的黏附性能,可以附着在畜禽胴体表面,遇冷凝固成膜,撕去膜的同時可达到除残毛的效果[3]。松香是一种天然的树脂固体晶体,具有来源广、价格低等优点,曾长期用于鸭、鹅、猪蹄、猪耳等的二次脱毛加工[4-5]。松香酸(Abietic acid,AA)和脱氢松香酸(Dehydroabietic acid,DHAA)是松香的标志性成分[6-11],研究表明,AA和DHAA均有一定的毒理学性质[12-14],在光、热、氧和金属离子等因素的诱导下,易发生氧化反应,生成的产物具有致敏性[15-16]。采用松香脱毛,易导致AA和DHAA残留在胴体表皮组织中,引发食品安全问题,因此,我国已禁止松香用于屠宰加工脱毛,推荐松香甘油酯作为替代产品[17]。松香甘油酯是松香的改性产物,松香中的羧酸类化合物和甘油在催化剂作用下发生酯化,生成一甘酯、二甘酯和三甘酯等产物(图1),相比松香,松香甘油酯具有稳定性好、酸值低等优点。但松香甘油酯作为脱毛剂,使用过程也存在一些问题:一是相比松香,松香甘油酯成分更加复杂,工业化生产偏重酸价和色度等指标来判断产物等级,而忽视了松香的真实酯化程度,此外,松香甘油酯的酯化程度、成分分析、含量分析等方面尚缺乏必要的研究,市场上流通的松香甘油酯品质难以鉴别和监控[18-19];二是松香甘油酯的工业合成存在酯化不完全现象,导致游离松香残留,采用松香甘油酯用于畜禽脱毛仍可导致松香残留的情况发生[20],这些残留的松香进入消费者的餐桌,同样会引发食品安全问题;三是松香甘油酯价格比松香高,实际生产过程中使用量大,无疑会增加企业的成本,在脱毛效果和利益的双重胁迫下,部分企业仍违规使用松香进行屠宰加工脱毛。笔者所在课题组前期研究表明,市场上流通领域的白条鸭胴体松香残留情况较普遍[21-23],残留的松香经水洗、烹饪加工不能完全消除,肉鸭熟制品仍有游离松香残留[6]。上述原因造成了市场上“松香产品”屡禁不止现象,这些残留的松香尚不能有效区分来源,而现阶段市场上流通的肉鹅制品中松香残留情况尚缺乏研究,因此,对市场上的肉鹅制品进行松香残留分析显得尤为必要。
笔者所在课题组前期建立了同时检测肉鸭制品中AA和DHAA方法,采用固相萃取净化、高效液相分析方法[22]。肉鹅表皮组织富含油脂、蛋白等成分,会干扰AA和DHAA的分析检测,本研究采用固相萃取对肉鹅表皮组织进行除杂和富集AA和DHAA。AA和DHAA这2种化合物的同时检测采用高效液相二极管阵列检测器(PDA)串联荧光检测器(FLR)来实现。由图2可见,AA和DHAA是一类三环二萜类的树脂酸,AA因结构中存在共轭的不饱和碳碳双键,在紫外区域有良好的吸收特性,可采用紫外或二极管阵列检测器对AA进行含量分析,而DHAA分子结构中含有苯环,兼具紫外和荧光特性,且在荧光检测器下表现出更高的灵敏度,能满足更低含量的检测要求,可采用荧光检测器对DHAA进行含量分析。因此,本研究采用固相萃取对采集的肉鹅制品进行净化和松香富集,二极管阵列串联荧光检测器的高效液相分析同时检测样品中AA和DHAA含量。该方法具有灵敏度高、操作便捷等优点。本研究以AA和DHAA为松香残留标志物,采用高效液相法分析生、熟肉鹅胴体中松香残留情况,为现阶段市场流通领域中的肉鹅制品中松香情况提供数据和分析方法,对于国家质量监管、保护消费者食品安全具有重要意义。
1材料与方法
1.1原料与试剂
肉鹅制品均购自南京孝陵卫农贸市场及附近苏果超市、北京华联超市,所有样品采样后,取不同部位的表皮、肌肉(胸肉和腿肉,去除筋膜),搅碎,混匀,置于密封袋中-20 ℃避光保存。
AA(标准试剂,HPLC纯度≥90%)和DHAA(标准试剂,HPLC纯度≥98%)上海源叶试剂有限公司;色谱纯乙腈,上海泰坦科技股份有限公司;色谱纯甲酸,上海麦克林生化科技股份有限公司;水由Millipore纯水仪制备;其他试剂均为分析纯;C18固相萃取(solid phase extraction,SPE,3 mL)小柱,美国Supelco公司。
1.2仪器与设备
高效液相色谱仪Waters e2695(配有PDA和FLR),美国Waters公司;固相萃取仪,美国Alltech科技有限公司;氮气浓缩仪N-Evap 112,美国 Organomation公司;Direct-Q3uv超纯水机,美国Millipore;电子分析天平PTX-FA210S,福州华志科学仪器;台式冷冻离心机Unicen MR,德国 Hero lab公司;HS2060A超声波振荡器,常州国华电器有限公司。
1.3方法
1.3.1标准溶液的配制分别称取适量AA和DHAA,用乙腈溶解,分别配制成1 mg/mL和 0.1 mg/mL 的储备液。取适量等体积上述储备液混匀,用乙腈梯度稀释,分别配制成AA系列濃度为0.1~20 μg/mL,DHAA系列浓度为0.01~2.00 μg/mL 的混合标准溶液。
1.3.2样品处理参照文献[14]的方法并略有改动:称取1 g(精确至0.001 g)混合均匀的样品置于10 mL离心管中,加入5 mL乙腈,充分混匀后超声水浴振荡10 min,室温离心(10 000 r/min,10 min)。另取洁净10 mL离心管,吸取4 mL上清液,加入等体积的去离子水混匀后作为固相萃取上样液,固相萃取小柱上样前依次用乙腈和去离子水各3 mL活化,上样后,用3 mL 40%乙腈溶液淋洗,最后用 2 mL 甲醇洗脱收集,收集液经氮气吹扫仪浓缩干燥后,用适量乙腈复溶,经0.22 μm有机滤膜过滤,置于-20 ℃保存,待HPLC分析。每个样品取3个平行,测试结果以平均值±标准差表示。
1.3.3色谱条件色谱柱:XBridge C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.1%甲酸水溶液(体积比84 ∶16);流速:1 mL/min;PDA检测波长:240 nm,FLR 激发和发射波长分别为 225 nm 和287 nm;柱温:30 ℃;进样量:10 μL。
1.4数据及图像分析
试验数据采用Excel 2016软件进行处理,数据结果以平均值±标准差表示;图像采用Chemdraw 16.0及Powerpoint 2016绘制。
2结果与分析
2.1色谱条件的优化
在笔者所在课题组前期研究[6]的基础上,对高效液相检测的色谱条件进行优化,主要对流动相试剂种类、流动相比例进行优化,固定0.1%甲酸水溶液作为水相,以乙腈代替甲醇作为有机流动相时,在不影响分离度的情况下,可以明显缩短AA和DHAA的保留时间,与此同时,DHAA的荧光吸收响应值要比甲醇作为流动相时高,可以满足更低浓度的检测。通过流动相比例优化,可以得出,随着水相比例的提高,可以延长AA和DHAA的出峰时间,当乙腈和水相体积比调为84 ∶16时,可使目标物和杂质分离开来,又能满足检测保留时间的需求。综合2种标志物分离度、峰形、保留性、响应值等方面的综合考虑,最终采用的流动相为乙腈-0.1%甲酸水溶液(体积比84 ∶16),流速为1 mL/min,AA和DHAA的保留时间分别为13.4 min和9.0 min(图3)。
2.2方法的线性范围、检测限和定量限
本试验采用外标法定量肉鹅制品中的AA和DHAA,以标准系列浓度作为横坐标x,相应的峰面积为纵坐标y,分别绘制AA和DHAA标准曲线,AA和DHAA的回归方程分别为y=11 596x-159.1和y=2 200 587.2x-6 715.3,线性相关系数均高于0.999,表明在选择的浓度范围内,2种化合物的浓度与相应峰面积呈良好的线性关系。按照3倍信噪比(S/N=3)计算方法的检出限,AA和DHAA的检出限分别为0.015 μg/g和0.003 μg/g,按照10倍信噪比(S/N=10)计算方法的定量限,两者的定量限分别为0.050 μg/g和0.010 μg/g(表1)。AA和DHAA的保留时间具有较高的重复性,日内和日间精密度以相对标准偏差(RSD)表示,结果均低于2.0%。
2.3实际样品分析
采用已经建立的固相萃取净化、高效液相同时分析AA和DHAA的方法,对市场上流通的肉鹅制品中松香残留进行分析。由表2可见,市场上的生、熟肉鹅制品(各10种)中松香的阳性检出率均高达80%,AA含量分别在2.82~14.52 μg/g和0.64~9.6 μg/g范围;生、熟肉鹅制品DHAA的阳性检出率分别为80%和60%,DHAA含量分别在1.62~10.06 μg/g 和0.06~2.62 μg/g范围。这2种物质的阳性检出率均比较高,表明市场流通领域的肉鹅制品普遍存在松香残留情况,AA和DHAA的范围变化比较大,可能与使用的脱毛剂中松香组成、含量分布、 脱毛工艺、加工方式等因素有关,与前期的研究结果基本一致。沈金灿等分别采用松香和松香甘油酯模拟肉鸭脱毛,结果表明这2种脱毛剂均可能导致肉鸭胴体残留松香[11]。目前市场上流通的肉鹅制品松香残留率较高,尚不能有效区分松香残留的来源究竟是松香还是松香甘油酯。因此,需要更深入研究松香残留的影响因素,确保脱毛效率的同时,减少或消除松香残留的发生。
3结论
本研究以AA和DHAA作为松香残留的标志物,采用固相萃取前处理、HPLC-PDA/FLR分析对市场上的肉鹅制品中松香残留情况进行普查。该方法可以实现AA和DHAA同时分析检测,具有操作简单、灵敏度高等优点。市场上流通的生、熟肉鹅制品中AA的阳性检出率均高达80%,AA含量分别在2.82~14.52 μg/g和0.64~9.6 μg/g范围,而生、熟肉鹅制品中DHAA的阳性检出率分别为80%和60%,DHAA含量分别在1.62~10.06 μg/g和0.06~2.62 μg/g范围。这些残留的松香最终被消费者摄入,具有潜在的食品安全隐患,应该引起更多的关注。
参考文献:
[1]陈丽园,张泰康,丁元飞,等. 日粮中添加维生素添加剂对皖西白鹅羽绒生长与品质的影响[J]. 粮食与饲料工业,2022(5):44-47.
[2]马晶晶,卞欢,王倩,等. 冷鲜鹅二次脱毛与减菌技术的研究[J]. 食品安全导刊,2021(22):80-84.
[3]刘恬,张 娜,段仁杰,等. 松香甘油酯在生猪产品脱毛过程中的应用[J]. 肉类工业,2010(12):11-12.
[4]王院华,刘军昌,甘泉,等. 屠宰过程中猪蹄、头脱毛技术的研究[J]. 中国畜牧兽医,2006,33(12):108-109.
[5]王院华,闵成军,甘泉,等. 屠宰过程中禽类脱毛技术的研究[J]. 肉类工业,2007(7):8-10.
[6]Zhu Y Z,Zhang S Z,Geng Z M,et al. Analysis of abietic acid and dehydroabieticacidresiduesinraw ducks and cooked ducks[J].Poultry Science,2014,93(10),2663-2667.
[7]张苏珍,耿志明,王道营,等. 固相萃取-高效液相色谱法检测肉鸭表皮组织中的松香酸[J]. 食品科学,2014,35(4):82-85.
[8]卞欢,仇新媛,李鹏鹏,等. 松香人工抗原的合成及多克隆抗体的制备[J]. 食品科学技术学报,2018,36(6):51-57.
[9]仇新媛,姚忠,耿志明,等. 酶联免疫吸附测定法检测白条鸭表皮组织中的脱氢松香酸[J]. 肉类研究,2019,33(12):45-49.
[10]Qiu X Y,Ma J J,Li P P,et al. Development of indirect competitive ELISA for determination of dehydroabietic acid in duck skin and comparison with the HPLC method[J]. Poultry Science,2020,S003257912030119X-.
[11]张苏珍,卞欢,王道营,等. 食品中松香残留检测方法的研究进展[J]. 江苏农业科学,2013,41(8):307-308.
[12]Smith P A,Gardner D R,Drown D B,et al. Detection of resin acid compounds in airborne particulate generated from rosin used as a soldering flux[J]. American Industrial Hygiene Association Journal,1997,58(12):868-875.
[13]Sderberg T A,Johansson A,Gref R. Toxic effects of some conifer resin acids and tea tree oil on human epithelial and fibroblast cells[J]. Toxicology,1996,107(2):99-109.
[14]Kamaya Y,Tokita N,Suzuki K. Effects of dehydroabietic acid and abietic acid on survival,reproduction,and growth of the crustacean Daphnia magna[J]. Ecotoxicology & Environmental Safety,2005,61(1):83-88.
[15]Ren F,Zheng Y F,Liu X M,et al. Thermal oxidation reaction process and oxidation kinetics of abietic acid[J]. RSC Advances,2015,5(22):17123-17130.
[16]Li Y L,Xu X L,Niu M M,et al. Thermal stability of abietic acid and its oxidation products[J]. Energy & Fuels,2019,33(11):11200-11209.
[17]陳炳旭. 松香甘油酯获准用于畜禽脱毛处理[J]. 肉类工业,2006(4):36.
[18]高宏,宋湛谦,王振洪,等. 高稳定浅色松香甘油酯的制备[J]. 林产化工通讯,2005,39(5):1-4.
[19]厚朋禄,刘仕伟,于世涛. 松香甘油酯的合成[J]. 化工科技,2018,26(1):7-10.
[20]沈金灿,肖陈贵,黄昌雄,等. 液相色谱-串联质谱法测定畜禽表皮中松香酸和脱氢松香酸[J]. 食品科学,2021,42(12):275-280.
[21]张苏珍,耿志明,王道营,等. 肉鸭表皮组织中脱氢枞酸残留的SPE-HPLC检测方法[J]. 食品科学,2014,35(16):101-104.
[22]Zhu Y Z,Zhang S Z,Geng Z M,et al. Simultaneous determination of abietic acid and dehydroabietic acid residues in duck meat by HPLC-PAD-FLD[J]. Food Analytical Methods,2014,7(8):1627-1633.
[23]张苏珍,卞欢,王道营,等. 肉鸭经松香脱毛后表皮松香残留的薄层色谱检测研究[J]. 江西农业学报,2013,25(5):117-119.

