白头翁汤通过调节T淋巴细胞平衡治疗溃疡性结肠炎小鼠的机制研究
潘思敏,黄梦芬,王春丽,张美玲,周若愚,王青,罗霞,周联,侯江涛,陈斌 (.广州中医药大学第一临床医学院,广东 广州 50405;.广州中医药大学中药学院,广东 广州 50006;.广州中医药大学第一附属医院脾胃病科,广东 广州 50405)
溃疡性结肠炎(Ulcerative colitis,UC)是一种原因不明的慢性非特异性肠道炎症性疾病,以肠黏膜的反复性炎症、肿胀、溃疡等为特征,临床上多以血性腹泻、腹痛、大便急迫为主要表现[1]。UC 炎症病变部位累及直肠和乙状结肠,从直肠黏膜开始,持续向结肠近端扩展,随着病情不断发展,严重影响患者的生活质量[2]。UC 发病机制主要受遗传易感性、上皮屏障缺陷、免疫反应失调和环境等多因素影响[3]。目前对UC 的治疗药物主要有氨基水杨酸制剂、糖皮质激素和免疫抑制剂等[4],但存在长期使用疗效欠佳及不良反应较多的问题。白头翁汤源自张仲景的《伤寒论》,具有清热解毒、祛湿、凉血止痢之功效,是清热祛湿法的代表方剂。研究[5-6]发现,白头翁汤具有抗炎、抗菌、抗肿瘤、免疫调节等多重药理作用。临床研究[7-8]也表明,白头翁汤对活动性UC 有较好的治疗作用。故本研究拟通过葡聚糖硫酸钠(DSS)诱导建立UC 小鼠模型,观察白头翁汤对其免疫平衡及肠上皮损伤的影响,探讨其治疗UC 的作用机制。
1 材料与方法
1.1 动物60 只雄性C57BL/6 小鼠,SPF 级,6~8 周龄,体质量(20±2)g,购自北京维通利华有限公司,实验动物生产许可证号:SCXK(京)2021-0006。动物饲养环境湿度保持在55%±2%,12 h/12 h 昼夜循环。本动物实验经过广州中医药大学中药学院实验动物伦理委员会审批,伦理编号:ZYD-2022-014。
1.2 药品及试剂白头翁汤组方:白头翁15 g(批号:2105125)、黄连6 g(批号:H3622111)、黄柏12 g(批号:210501)、秦皮12 g(批号:20210422),均购自广州中医药大学第一附属医院,药材符合《中华人民共和国药典》规定;美沙拉秦缓释颗粒(批号:210708),法国爱的发制药有限公司。DSS(分子量:36 000~50 000,批号:S5148),购自美国MP Biomedical 公司;肿瘤坏死因子α(TNF-α,批号:MM-0132M1)、白细胞介素1β(IL-1β,批号:MM-0040M1)、IL-6(批号:MM-0163M1)、γ 干扰素(IFN-γ,批号:MM-0182M1)、IL-17A(批号:MM-0759M1)、转化生长因子β(TGF-β,批号:MM-0689M1)检测试剂盒,均购自中国江苏酶免有限公司;一抗ZO-1(批号:21773-1-AP)、Occludin(批号:13409-1-AP)抗体,均购自美国Proteintech公司;Mouse-PE/cyanine7-anti-CD3 抗体(批号:100220)、Mouse- FITC- anti- CD4 抗体(批号:100509)、Mouse- APC- anti- CD25 抗体(批号:102011)、Mouse-APC-anti-IFN-γ 抗体(批号:505810)、Mouse- PE- anti- Foxp3 抗体(批号:126404)、Mouse-BV421-anti-IL-17A 抗体(批号:506926),均购自美国Biolegend 公司;FOXP3/ 转录因子染色缓冲液套件(批号:2313200),购自美国赛默飞公司。
1.3 主要仪器D3024R 微型高速冷冻离心机,美国Scilogex 公司;HT7800 型荧光显微镜,日本Olympus公司;Multiskan FC 酶标仪、Excelsior AS 组织脱水机、HistoStar 组织包埋机、HM 340E 组织切片机,美国Thermo Scientific 公司;BD LSR Fortessa 流式细胞仪,美国BD 公司。
1.4 分组、模型复制及给药将60 只小鼠适应性饲养1 周后,随机分为6 组:正常组、模型组、美沙拉秦组(500 mg·kg-1)及白头翁汤低、中、高剂量组(5、10、15 g·kg-1),每组10 只。除了正常组外,其他各组小鼠均采用自由饮用3% DSS 溶液,连续7 d,诱导建立UC 小鼠模型;正常组小鼠给予正常饮用水。参考《实验动物和动物实验技术》[9]中动物给药量计算方法设置给药组剂量。各组小鼠造模同时按上述剂量灌胃给药(20 mL·kg-1),每日1 次,连续给药10 d;正常组、模型组小鼠给予等体积蒸馏水灌胃。
1.5 一般情况观察实验期间每天观察小鼠状态、活动和精神状况,记录小鼠体质量变化。从造模第3 天开始收集小鼠粪便,观察粪便性状,检测并记录小鼠便血情况。进行疾病活动指数(DAI)评分[10],计算:DAI=(体质量下降分数+大便性状分数+便血分数)/3,评分标准见表1。

表1 疾病活动指数评分标准Table 1 Disease activity index score
1.6 取样实验第11 天,按照动物伦理相关要求对小鼠施行安乐死后,解剖并小心剥离脾脏、胸腺组织,称量并记录其湿质量,计算:脾脏(胸腺)指数=脾脏(胸腺)湿质量(mg)/体质量(g)× 10;分离小鼠肠系膜淋巴结、结肠组织,并测量结肠长度;取小鼠远端结肠约1 cm,用4%多聚甲醛溶液固定48 h。
1.7 小鼠结肠组织病理学观察取固定后结肠组织进行脱水、石蜡包埋、组织切片后,分别进行HE 染色和阿尔新蓝染色;在显微镜下观察结肠组织炎症及隐窝增生等情况,并进行病理学评分[11];分析杯状细胞黏蛋白(阿尔新蓝阳性细胞)的表达情况。
1.8 流式细胞术检测小鼠肠系膜淋巴结及脾脏中辅助性T 细胞1(Th1)、辅助性T 细胞17(Th17)及调节性T 细胞(Treg)的细胞比例收集新鲜的小鼠肠系膜淋巴结和脾脏组织,机械研磨,脾脏另外加入红细胞裂解液,制备得到细胞悬液;每管分别以106个细胞加入CD3(PE/CY7,每管1 μL),CD4(FITC,每管1 μL),CD25(APC,每管1 μL)抗体,另外准备阴性管和单染管,避光在室温下孵育30 min;孵育结束后用PBS 洗涤2 次,加入固定破膜工作液(每管900 μL),避光破膜30 min;破膜完成后,用固定清洗液洗涤细胞2 次,然后每管分别加入IFN-γ(APC,每管3 μL)、IL-17A(BV421,每管1 μL)和Foxp3(PE,每管3 μL)抗体,室温下避光孵育30 min;孵育完成后用PBS 洗涤2 次,加入300 μL PBS 重悬细胞,采用流式仪分析肠系膜淋巴结及脾脏组织中Th1、Th17、Treg 细胞占比。
1.9 ELISA 法检测小鼠结肠组织中炎性细胞因子的表达取小鼠结肠组织适量,加入生理盐水进行匀浆(60 Hz,120 s)后,以4 ℃、120 000×g离心10 min,收集匀浆上清;严格按照ELISA 试剂盒说明书步骤检测TNF-α、IL-1β、IL-6、IL-17A、TGF-β 和IFN-γ 的含量。
1.10 免疫荧光法检测结肠组织紧密连接蛋白ZO-1、Occludin 的表达取结肠石蜡切片,经过脱蜡后,把切片浸泡在枸橼酸钠抗原修复液内,微波炉加热煮沸,取出自然冷却;滴加0.3% TritonTMX-100,放在湿盒内透化30 min;然后用山羊血清封闭30 min,滴加山羊血清配制的一抗[ZO-1(1∶100)、Occludin(1∶100)],置于湿盒内于4 ℃冰箱过夜;次日经洗涤后,滴加荧光二抗(1∶200),室温下于湿盒内孵育1 h;洗涤后加入30 μL DAPI,避光孵育10 min,最后用荧光显微镜观察。
1.11 统计学处理方法使用SPSS 26.0 统计软件进行数据分析,应用GraphPad Prism 8.0 软件作图;计量资料以均数±标准差(±s)表示;符合正态分布与方差齐性的计量资料,多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD 检验,符合正态分布方差不齐的计量资料,则采用Dunnett’s T3检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 白头翁汤对UC 小鼠体质量及DAI 评分的影响结果见图1。与正常组比较,模型组小鼠的体质量显著降低(P<0.01),DAI 评分显著升高(P<0.01)。与模型组比较,白头翁汤低、中、高剂量组及美沙拉秦组小鼠的体质量显著增加(P<0.01),DAI 评分显著降低(P<0.01)。结果表明,白头翁汤可以改善DSS诱导的UC 小鼠的疾病症状。

图1 白头翁汤对溃疡性结肠炎小鼠体质量及疾病活动指数(DAI)评分的影响(±s,n=6)Figure 1 Effects of Baitouweng Decoction on body mass and disease activity index(DAI)score in ulcerative colitis mice(±s,n=6)
2.2 白头翁汤对UC 小鼠胸腺指数、脾脏指数及结肠长度的影响结果见表2。与正常组比较,模型组小鼠的脾脏指数显著上升(P<0.01),胸腺指数显著下降(P<0.01),结肠长度显著缩短(P<0.01)。与模型组比较,白头翁汤低、中、高剂量组及美沙拉秦组小鼠脾脏指数显著下降(P<0.05,P<0.01),胸腺指数显著上升(P<0.05,P<0.01),结肠长度显著延长(P<0.05,P<0.01)。
表2 白头翁汤对溃疡性结肠炎小鼠结肠长度、胸腺指数、脾脏指数及病理学评分的影响(±s,n=6)Table 2 Effects of Baitouweng Decoction on colon length,thymus index,spleen index and pathological score in ulcerative colitis mice(±s,n=6)

表2 白头翁汤对溃疡性结肠炎小鼠结肠长度、胸腺指数、脾脏指数及病理学评分的影响(±s,n=6)Table 2 Effects of Baitouweng Decoction on colon length,thymus index,spleen index and pathological score in ulcerative colitis mice(±s,n=6)
注:与正常组比较,**P<0.01,与模型组比较,#P<0.05,##P<0.01
病理学评分/分0.00±0.00 9.50±1.22**7.17±0.75##4.00±0.89##4.17±1.17##4.00±1.10##组别正常组模型组白头翁汤低剂量组白头翁汤中剂量组白头翁汤高剂量组美沙拉秦组剂量/(g·kg-1)--5 10 15 0.5结肠长度/cm 8.20±0.25 5.47±0.23**6.00±0.41#7.20±0.23##7.27±0.33##6.35±0.38##胸腺指数23.62±0.83 8.92±2.24**15.41±4.17##18.42±2.89##13.92±1.62#14.66±4.27##脾脏指数28.81±1.59 44.04±2.59**38.43±2.83#28.58±1.66##28.81±2.01##37.48±3.76##
2.3 白头翁汤对UC 小鼠结肠组织病理变化的影响结果见表2、图2。与正常组比较,模型组小鼠结肠组织出现明显溃疡,上皮细胞大量脱落,腺体排列紊乱,黏膜层和黏膜下层有大量炎性细胞浸润,病理组织评分显著升高(P<0.01)。与模型组比较,白头翁汤低、中、高剂量组及美沙拉秦组小鼠结肠上皮细胞和腺体排列较紧密,炎性细胞浸润减少,病理组织评分显著降低(P<0.01)。结果表明,白头翁汤能够有效改善DSS 诱导的UC 小鼠结肠组织的病理损伤。
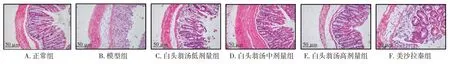
图2 白头翁汤对溃疡性结肠炎小鼠结肠组织病理形态的影响(HE 染色,×200)Figure 2 Effect of Baitouweng Decoction on the pathological injury of colon in colitis mice(HE staining,×200)
2.4 白头翁汤对UC 小鼠肠系膜淋巴结及脾脏组织中Th1、Th17、Treg 细胞的影响结果见图3、图4。与正常组比较,模型组小鼠肠系膜淋巴结及脾脏组织中CD4+IFN-γ+Th1、CD4+IL-17A+Th17 细胞占比显著升高(P<0.05,P<0.01),而CD25+FOXP3+Treg细胞占比显著降低(P<0.01)。与模型组比较,白头翁汤低、中、高剂量组及美沙拉秦组小鼠肠系膜淋巴结及脾脏组织中CD4+IFN-γ+Th1、CD4+IL-17A+Th17 细胞占比显著降低(P<0.05,P<0.01),CD25+FOXP3+Treg 细胞占比显著升高(P<0.05,P<0.01)。结果表明,白头翁汤可以在一定程度恢复UC 小鼠肠系膜淋巴结及脾脏组织中的T 细胞平衡。
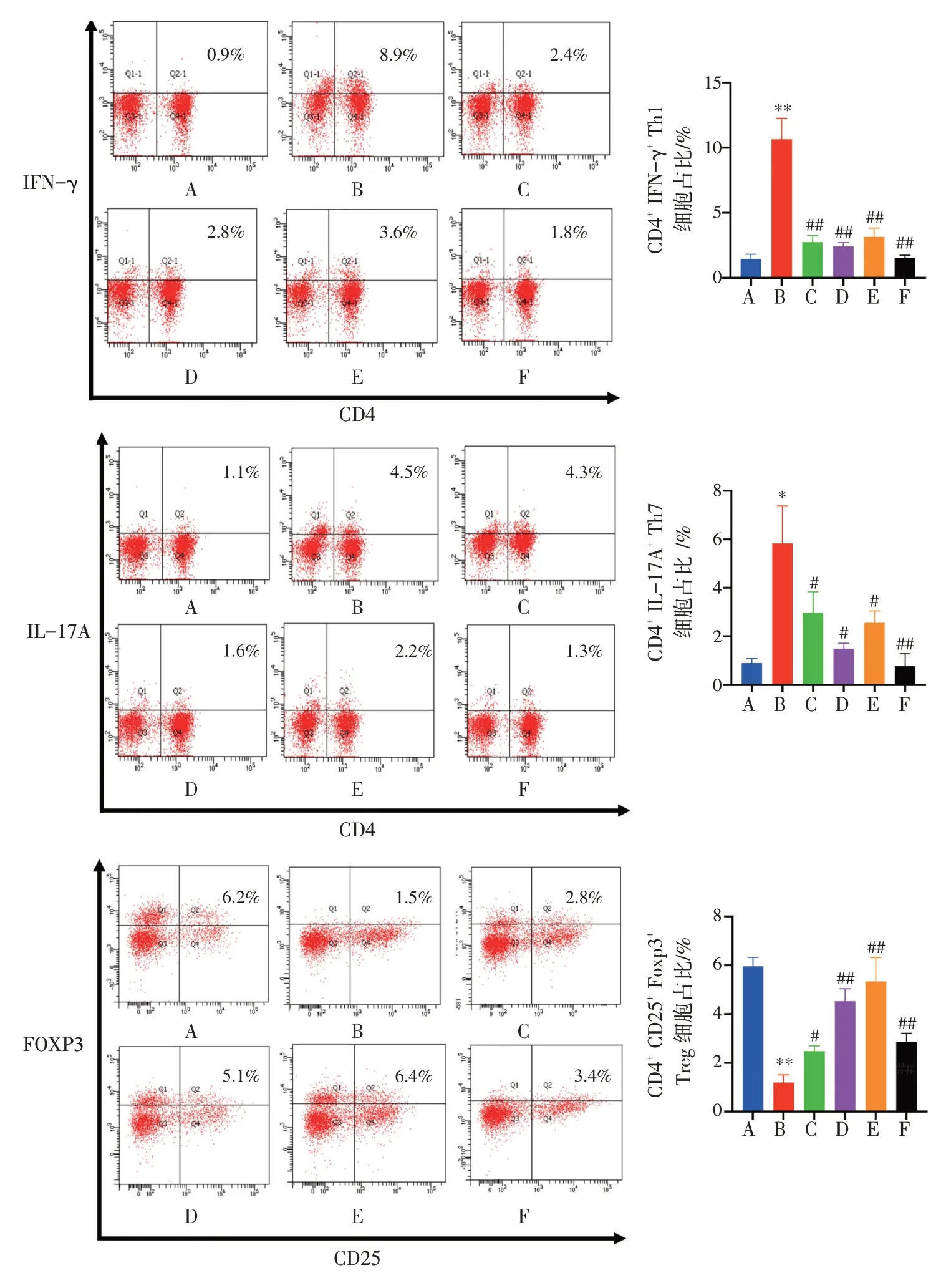
图3 白头翁汤对溃疡性结肠炎小鼠肠系膜淋巴结组织T 细胞平衡的影响(±s,n=5)Figure 3Effect of Baitouweng Decoction on mesenteric lymph node T cell balance in ulcerative colitis mice(±s,n=5)
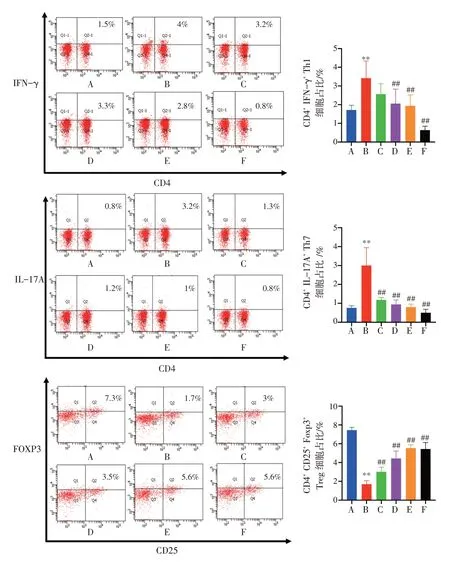
图4 白头翁汤对溃疡性结肠炎小鼠脾脏组织中T 细胞平衡的影响(±s,n=5)Figure 4 Effect of Baitouweng Decoction on spleen T cell balance in ulcerative colitis mice(±s,n=5)
2.5 白头翁汤对UC 小鼠结肠组织中炎性因子水平的影响结果见图5。与正常组比较,模型组小鼠结肠组织中TNF-α、IL-1β、IL-6、IL-17A 和IFN-γ 水平显著升高(P<0.01),TGF-β 水平显著降低(P<0.01)。与模型组比较,白头翁汤给药组小鼠结肠组织中的TNF-α、IL-1β、IL-6、IL-17A 和IFN-γ 水平明显降低(P<0.05,P<0.01),TGF-β 水平明显升高(P<0.05,P<0.01)。结果表明,白头翁汤能够抑制DSS 诱导的UC 小鼠结肠组织中促炎细胞因子TNF-α、IL-1β、IL-6、IL-17A 和IFN-γ 的分泌,增强抑炎因子TGF-β 的分泌。

图5 白头翁汤对溃疡性结肠炎小鼠结肠组织中TNF-α、IL-1β、IL-6、IL-17A、IFN-γ 及TGF-β 水平的影响(±s,n=6)Figure 5 Effects of Baitouweng Decoction on the levels of TNF-α,IL-1β,IL-6,IL-17A,IFN-γ and TGF-β in the colon tissue of ulcerative colitis mice(±s,n=6)
2.6 白头翁汤对UC 小鼠结肠组织上皮损伤的影响结果见图6。与正常组比较,模型组小鼠结肠组织中的黏蛋白含量及紧密连接蛋白ZO-1、Occludin 表达量显著降低(P<0.05,P<0.01)。与模型组比较,白头翁汤及美沙拉秦组小鼠结肠组织中杯状细胞分泌的黏蛋白含量及紧密连接蛋白ZO-1、Occludin 表达量显著增加(P<0.05,P<0.01)。结果表明,白头翁汤能够改善DSS 诱导的UC 小鼠结肠组织上皮损伤。

图6 白头翁汤对溃疡性结肠炎小鼠结肠组织上皮损伤的影响(±s,n=3)Figure 6 Effect of Baitouweng Decoction on intestinal barrier in ulcerative colitis mice(±s,n=3)
3 讨论
在本研究中,给予3% DSS 诱导后,溃疡性结肠炎(UC)模型小鼠体质量减轻,出现腹泻和直肠便血等症状,DAI 评分显著升高,结肠长度明显缩短;病理学观察显示,UC 小鼠结肠出现急性黏膜损伤,结肠组织黏膜层及黏膜下层受到炎性细胞浸润,中性粒细胞聚集使得隐窝破坏[12-13];此外,脾脏作为机体最重要的免疫器官,由于DSS 对机体免疫系统的影响,导致脾脏出现肿大,胸腺相对缩小[14-15]。给予白头翁汤干预后,能够明显减缓UC 小鼠体质量的减轻,降低DAI 评分,并改善结肠组织病理损伤,减少炎性细胞浸润,胸腺及脾脏指数趋向正常。结果表明,白头翁汤对UC 小鼠的症状、组织黏膜修复和机体免疫反应具有一定的治疗作用。
在UC 患者肠道中,免疫细胞异常反应使正常的共生菌群和饮食抗原进入固有层,宿主固有免疫系统被激活后,抗原呈递细胞(APC)诱导T0 细胞活化,导致CD4+T 细胞分化为Th1、Th17 细胞,产生更多促炎细胞因子,并使Treg 细胞分泌的抑炎因子减少[16-17]。Th 细胞功能的分化是APC 推动的,在APC 作用下产生IL-12 促使Th1 分化,Th1 细胞表达转录因子T-bet 和IFN-γ,IFN-γ 作用于CD4+T 细胞,激活转录因子1(STAT1)信号,并与TCR 下游信号通路共同促进T-bet 的大量表达,形成正反馈,协同促进IFN-γ 的表达[18]。另外,IFN-γ 会刺激炎症部位产生CCL3、CCL4、CCL5 等趋化因子,同时Th1表面也会表达CCR5、CXCR3 等趋化因子受体,与其配体结合后招募到炎症部位发挥作用,最终导致Th1/Th2 失衡[19]。Th17 细胞由在TGF-β 和IL-6 刺激下的CD4+T 细胞分化,主要由视黄酸相关孤儿受体(RORγT)的转录调节下介导[20]。Th17 细胞产生促炎细胞因子包括IL-17、IL-21、IL-22、IL-23 和IL-25等。IL-17 作为一个重要的促炎细胞因子,刺激TNF-α、IL-1β、IL-6、IFN-γ 等多种促炎因子分泌,此外IL-17 还能募集中性粒细胞释放和破坏肠上皮屏障,诱导肠道的炎症反应[21]。Treg 细胞通过分泌抗炎细胞因子IL-10 和TGF-β 维持肠道稳态。TGF-β作为CD4+T 细胞分化Treg 和Th17 细胞的必要条件,在促炎因子IL-6 的作用下,可以促进T 细胞向Th17 细胞分化,在缺乏IL-6 的情况下,T 细胞则会优先促进Treg 细胞的分化[22]。本研究结果表明,白头翁汤可以促进Treg 细胞的分化,并抑制Th1、Th17 细胞的分化,恢复UC 小鼠肠系膜淋巴结及脾脏组织中的T 细胞平衡。
TGF-β 作为一种抗炎细胞因子,可以通过调节免疫反应抑制疾病的发展,促进肠上皮修复[23]。IL-6是一种参与免疫调节和炎症的多效性细胞因子,可以促进Th1、Th2 和Th17 细胞分化,并诱导T 细胞亚群产生更多的促炎因子[24],此外IL-6 还可以通过激活结肠上皮细胞信号转导和转录激活因子3(STAT3),损伤肠黏膜屏障,加剧炎症的发展[25]。本研究显示,IL-6 的表达与Th17 细胞的趋势一致,Treg 相关细胞因子TGF-β 与Treg 细胞的趋势一致,与课题组前期实验[26-27]结果相符合。在UC 的发病过程中,TNF-α、IL-1β 是常见的促炎细胞因子,TNF-α 主要作用于肠壁,通过诱导上皮细胞凋亡和改变紧密连接功能来损害肠屏障[28];IL-1β 在肠道中能够吸引中性粒细胞,引起炎症介质的释放[29]。在本研究中,白头翁汤能够通过抑制促炎细胞因子TNF-α、IL-1β、IL-6、IL-17、IFN-γ 的分泌,促进抑炎细胞因子TGF-β 表达来发挥其对UC 的抗炎作用。
研究[30-31]发现,肠道抗原持续异常激活免疫系统,产生大量炎性细胞因子、炎症介质等通过损伤肠上皮细胞,诱导上皮细胞凋亡,进而影响上皮细胞间的紧密连接蛋白表达及分布,破坏上皮细胞间紧密连接,同时还能抑制黏蛋白的产生,破坏上皮细胞表面的黏液层,最终导致肠道黏膜屏障受损。肠上皮屏障主要由紧密连接、黏附连接、桥粒和缝隙连接组成,尤其是紧密连接最为重要[32]。紧密连接通过紧密连接蛋白(Occludin、Claudins、ZO)连接肠上皮细胞,可以阻止肠道内毒素和病原微生物进入肠腔,并调节细胞间通透性[33]。杯状细胞分泌的黏蛋白作为肠道黏膜屏障的重要防御线,可以防止肠道微生物直接作用于肠上皮细胞[34]。本研究显示,白头翁汤能够促进UC 小鼠肠道中ZO-1、Occludin 蛋白表达,增加黏蛋白分泌,促进肠上皮结构在很大程度上得到恢复。
综上所述,白头翁汤能够有效改善DSS 诱导的UC 小鼠的症状,可能是通过调节T 淋巴细胞平衡,增加抑炎因子的分泌,降低促炎因子的表达,从而减轻肠上皮损伤。然而,白头翁汤影响T 细胞分化的具体机制尚不明确,仍需要通过进一步的实验深入研究。

