雷公藤内酯三醇通过Nrf2/Keap1信号通路抑制氧化应激和炎症减轻雷公藤甲素诱导的肝损伤
郑碧丹,王晓婉,王思玉,杨祎琦,王凯,徐鹏,刘博,2,3(.广州中医药大学第二临床医学院,广东 广州 50006;2.广州市中药活性成分手性研究重点实验室,广东 广州 50006;3.省部共建中医湿证国家重点实验室,广东 广州 50006)
雷公藤甲素是雷公藤(TripterygiumwilfordiiHook F.,TwHF)的二萜类成分,具有多种药理活性,如抗肿瘤、抗炎、抗生育和免疫抑制作用等[1]。近年来,雷公藤被广泛应用于治疗肾病综合征、肿瘤和系统性红斑狼疮等疾病[2]。然而,雷公藤甲素在肝脏、肾脏和生殖系统等方面引起的严重器官损伤极大地限制了其应用和发展[3]。许多动物和细胞模型也已经证实肝脏是雷公藤甲素主要损伤的目标器官[4]。
氧化应激是雷公藤甲素诱导肝脏损伤最主要的机制,决定了肝脏损伤的严重程度[5-6]。其中活性氧(Reactive oxygen species,ROS)增加与细胞内丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽(Reduced glutathione,GSH)水平的变化密切相关[7]。过量的ROS 可以诱发肝脏组织的炎症,并导致促炎因子白细胞介素6(IL-6)和抗炎因子白细胞介素10(IL-10)发生变化[8-9],抗氧化是改善肝损伤的重要策略。
转录因子核因子-红细胞相关因子2(Nuclear factor-erythrocyte-related factor 2,Nrf2)是一个重要的抗氧化转录因子,在肝脏损伤中起着关键作用[10]。Nrf2 调节多种抗氧化酶以维持细胞的氧化还原平衡并监测氧化应激[11]。在正常情况下,Nrf2 通过与KELCH 样ECH 关联蛋白1(KELCH- like ECHassociated protein 1,Keap1)结合,在细胞质中保持低水平[12]。在氧化应激条件下,Keap1 发生构象变化而失活,解离的Nrf2 聚集在细胞核中,激活下游的抗氧化酶,如血红素氧合酶1(Heme oxygenase-1,HO- 1)、醌氧化还原酶1(NAD(P)H Quinone Dehydrogenase 1,NQO1),与超氧化物歧化酶(Superoxide dismutase ,SOD)一起促进谷胱甘肽(Reduced glutathione,GSH)的产生[13]。作为细胞保护的关键机制,Nrf2/Keap1 信号通路被认为是改善肝损伤的关键节点[14]。
雷公藤内酯三醇是一种从雷公藤中提取的二萜类活性单体,通过在肝细胞、足细胞、肾小管上皮细胞和肠上皮细胞中发挥保护作用,对肾病综合征和炎症性肠病显示出治疗效果[15-18]。我们前期的研究[18]发现,Nrf2/Keap1 信号通路与雷公藤内酯三醇的肝脏保护作用密切相关。然而,雷公藤内酯三醇对雷公藤甲素诱导肝脏损伤的保护作用以及Nrf2/Keap1 信号通路在其中的作用鲜有研究。考虑到雷公藤内酯三醇对肝脏损伤的治疗效果和安全性,以及减轻雷公藤甲素刺激的肝脏损伤作用,我们设想雷公藤内酯三醇可能通过调控Nrf2/Keap1 信号通路来减轻雷公藤甲素诱导的肝脏损伤。
因此,我们用雷公藤甲素复制Balb/c 小鼠肝脏损伤的动物模型,并用雷公藤内酯三醇进行了预先干预,探讨其对体内肝脏损伤的氧化应激和炎症的影响。同时采用小鼠正常肝细胞(Alpha Mouse Liver 12,AML12)探究雷公藤内酯三醇对雷公藤甲素诱导细胞损伤的保护作用,进一步探讨其作用机制。最后,用分子对接技术间接验证药物作用靶点,为雷公藤内酯三醇的减毒研究提供科学依据。
1 材料与方法
1.1 动物健康雄性Balb/c 小鼠,6~8 周龄,18~22 g,SPF 级,由广东省医学实验动物中心提供。动物质量合格证号:44825400001469;动物生产许可证编号:SYXK(粤)2018-0002。饲养温度(20±2)℃,湿度(50±10)%。实验经广东省中医院实验动物伦理委员会批准,动物实验伦理审查编号:2020004。
1.2 药物及试剂雷公藤内酯三醇(纯度>98%,CAS号137131-18-1)由刘博实验室(广东广州)提供,制备方法参考前期的研究[16]。雷公藤甲素,南京狄尔格医药科技有限公司,纯度>98%,CAS 号:137131-18-1,批号:D19071602;IL-6,美国abcam 公司,批号:GR-3409214-3;IL-10,美国abcam 公司,批号:GR-3296337-10;ROS,碧云天生物科技有限公司,批号:011521210621;MDA,普利莱生物技术有限公司,批号:E2019;GSH(批号:20211123)、SOD(批号:20210924),均来自南京建成生物技术有限公司;Nrf2,Keap1 和NQO1 抗体,美国Cell Signaling Technology 公司,CAS 号分别是:12721S 、8047S、3187S ;HO-1 抗体,美国Abcam 公司,批号:GR295624;GAPDH、LMNB1,博士德生物技术有限公司,批号分别是:5A21、2p2507BP07。
1.3 主要仪器BX61 型研究级电动显微镜,日本OLYMPUS 公司;EonC 酶标仪,美国BioTek 公司;ChemiDocTM Touch 凝胶成像系统,美国Bio-Rad 公司;5430R 高速台式冷冻离心机,美国Eppendorf 公司;Novo Quanteon 流式细胞仪,美国安捷伦公司。
1.4 分组、模型复制及给药方法将Balb/c 小鼠随机分为3 组,空白对照组、雷公藤甲素组(1 mg·kg-1)及雷公藤甲素+雷公藤内酯三醇组(1 mg·kg-1+28 mg·kg-1),每组6 只。适应性喂养3 d 后开始实验。根据前期研究[19]结果确定雷公藤内酯三醇的给药剂量。雷公藤甲素诱导的模型复制方法参照已发表报道[20]。雷公藤甲素+雷公藤内酯三醇组的小鼠连续7 d 灌胃雷公藤内酯三醇(28 mg·kg-1),其他12 只小鼠则给予相同体积的蒸馏水。灌胃第7 天,雷公藤甲素组和雷公藤甲素+雷公藤内酯三醇组的小鼠单次腹腔注射雷公藤甲素(1 mg·kg-1)复制肝脏损伤模型,空白对照组给予相同剂量的生理盐水。血清ALT、AST 明显升高,肝脏细胞出现明显损伤则提示模型复制成功。
1.5 取材Balb/c 小鼠在注射雷公藤甲素24 h 后,眼眶取血收集血样,4 ℃下放置1 h,以500×g离心15 min,血清在-80 ℃下保存以备后续检测。用1%戊巴比妥钠(50 mg·kg-1)腹腔注射麻醉Balb/c 小鼠,解剖取出肝脏,磷酸缓冲盐溶液冲洗,滤纸吸干水分。切取部分置于4%多聚甲醛固定24 h 后常规脱水,包埋进行组织病理学分析;其余部分肝脏组织置于液氮速冻,-80 ℃储存以备生物化学和蛋白质表达的分析。
1.6 肝功能ALT 和AST 水平测定ALT 和AST 水平以广东省中医院临床实验室的自动分析仪进行分析。
1.7 肝脏组织病理学观察取4%多聚甲醛固定48 h的肝脏标本,脱水包埋,切成3 μm 薄片,进行常规HE 染色,在全自动倒置显微镜中观察采集图像。根据肝脏损伤程度,随机挑选5 个视野进行评分。评分标准根据肝脏细胞坏死,肝细胞胞质空泡化,肝窦充血和脂滴分为0~4 分:0 分(无),1 分(肝脏损伤面积最小),2 分(小于30%),3 分(30%~60%),4 分(大于60%)[21]。
1.8 细胞培养与细胞活力测定AML12 细胞(ATCC来源),购于泰泽生物技术有限公司。培养于专用培养基中,置于37 ℃、5% CO2培养箱中。以每孔6×104个细胞接种于96 孔细胞培养板。培养12 h 后,用雷公藤甲素(5、10、20、40、80、160、320 和640 ng·mL-1)和雷公藤内酯三醇(12.5、25、50、100、200 和400 μg·mL-1)干预24 h,在450 nm 处检测吸光度。随后用雷公藤甲素(80 ng·mL-1)和雷公藤内酯三醇(12.5、25、50、100、200 和400 μg·mL-1)处理12 h 或24 h,CCK-8 法检测活力。最后,将AML 12 细胞种在6 孔板中,用雷公藤甲素(80 ng·mL-1)或雷公藤内酯三醇(200 μg·mL-1)进行干预24 h,显微镜观察细胞形态并拍照。
1.9 ELISA 法检测IL-6、IL-10 含量肝脏组织在裂解液中匀浆后,在4 ℃条件下以3 000×g离心15 min,取上清液备用。AML12 细胞用雷公藤甲素(80 ng·mL-1)或雷公藤内酯三醇(200 μg·mL-1)进行干预24 h 后,用裂解液裂解并收集上清备用。ELISA检测方法参照说明书。
1.10 检测肝脏及细胞中ROS、MDA、GSH、SOD含量收集肝脏组织细胞悬液并以每孔1×104个细胞的密度种于96 孔培养板。用DCFH-DA(10 μmoL·L-1)在37 ℃下孵育30 min,使用酶标仪检测荧光强度。对于AML12 细胞,在6 孔板中加入雷公藤甲素(80 ng·mL-1)和雷公藤内酯三醇(200 μg·mL-1)处理24 h,DCFH-DA(10 μmoL·L-1)孵育30 min,用流式细胞仪Novo Quanteon(Agilent ACEA)检测ROS 含量。对于MDA、GSH、SOD,肝脏组织匀浆后,取上清液备用。AML12 细胞用雷公藤甲素(80 ng·mL-1)或雷公藤内酯三醇(200 μg·mL-1)进行干预24 h 后,收集上清备用,检测方法按照说明书执行。
1.11 Western Blot 法检测肝脏及细胞中细胞核Nrf2、Keap1、HO-1、NQO1 蛋白表达水平使用组织总蛋白或核蛋白提取试剂盒提取蛋白质。裂解后的上清液采用BCA 蛋白定量测定蛋白浓度,100 ℃变性10 min。取等量蛋白缓冲液用SDS-PAEG凝胶电泳分离蛋白,并转移到PVDF 膜上。5%脱脂牛奶封闭2 h,加入一抗Nrf2(1∶1 000)、Keap1(1∶1 000)、NQO1(1∶1 000)、HO-1(1∶1 000)、LMNB1(1∶1 000)和GAPDH(1∶3 000)在4 ℃下孵育过夜,然后用辣根过氧化物酶连接的二抗在37 ℃下孵育2 h。ELC 显影,拍照。使用Image Lab 5.2.1 分析免疫印迹。全蛋白以GAPDH 为内参,细胞核蛋白以LMNB1 为内参对目的蛋白进行半定量分析。
1.12 分子对接Keap1 结构(PDB ID:4XMB)是从蛋白质数据库(PDB,http://www.rcsb.org)获得的,作为分子对接的受体,雷公藤内酯三醇和雷公藤甲素的二维化学结构从PubChem 获得(https://pubchem.ncbi.nlm.nih.gov)。通过AutoDock Vina(v1.1.2)软件进行分子对接,以确认雷公藤内酯三醇-Keap1 和雷公藤甲素-Keap1 的亲和力[22-23]。
1.13 统计学处理方法统计分析采用SPSS 17.0 软件,计量资料采用均数±标准差(±s)表示。组间比较通过单因素方差分析(ANOVA)进行,不符合方差齐性时采用Dunnett T3 检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 雷公藤内酯三醇可降低肝损伤小鼠肝脏ALT 和AST 水平并减轻肝脏病理损伤结果见图1。与空白对照组比较,雷公藤甲素组的肝组织的ALT(P<0.01)和AST(P<0.05)水平明显升高,表明雷公藤甲素诱发了小鼠肝损伤。雷公藤内酯三醇的干预明显抑制了雷公藤甲素诱导的肝脏中ALT(P<0.01)和AST(P<0.01)水平。小鼠的肝脏病理变化与血生化指标的结果一致。在光镜下,空白对照组肝脏显示肝细胞紧密排列,具备完整的肝脏结构。然而,雷公藤甲素组的肝脏出现明显的肝脏结构受损、水肿变性、肝窦出血和脂滴。而雷公藤内酯三醇组的肝脏病变程度明显减轻。图1 结果表明,雷公藤内酯三醇可以改善雷公藤甲素诱导的小鼠肝损伤。

图1 雷公藤内酯三醇对雷公藤甲素诱导的肝损伤小鼠肝脏ALT、AST 水平及肝脏病理损伤的影响(±s,n=6;HE 染色,×100)Figure 1 Effects of triptriolide on ALT,AST levels and pathological damage in mice with triptolide-induced liver(±s,n=6;HE staining,×100)
2.2 雷公藤内酯三醇可减少雷公藤甲素诱导的小鼠肝脏IL-6、ROS、MDA 含量并增加IL-10、GSH、SOD 含量结果见图2。与空白对照组比较,雷公藤甲素刺激后促炎细胞因子IL-6 的浓度(P<0.01),ROS(P<0.05)、MDA 水平(P<0.01)明显升高,GSH(P<0.01)和SOD(P<0.05)活性明显下降。雷公藤内酯三醇的干预可以明显抑制IL-6 水平(P<0.01),增加IL-10 的含量(P<0.01),同时明显抑制小鼠肝脏中ROS(P<0.05)和MDA(P<0.01)的含量,GSH(P<0.05)和SOD(P<0.01)的活性均有不同程度的提高。结果表明,雷公藤内酯三醇能够减少雷公藤甲素诱导小鼠肝脏促炎因子IL-6 分泌,促进抗炎因子IL-10 分泌,同时减轻氧化应激水平。
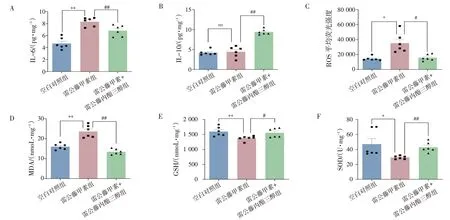
图2 雷公藤内酯三醇对雷公藤甲素诱导的肝损伤小鼠肝脏IL-6、IL-10、ROS、MDA、GSH、SOD 水平的影响(±s,n=6)Figure 2 Effects of triptriolide on liver IL-6,IL-10,ROS,MDA,GSH,SOD levels in mice with triptolide-induced liver(±s,n=6)
2.3 Nrf2/Keap1 信号通路参与了雷公藤内酯三醇拮抗雷公藤甲素引起的肝损伤过程结果见图3。Nrf2/Keap1 信号通路在抗氧化过程中起着重要的作用。雷公藤甲素组的小鼠肝脏中细胞核Nrf2 蛋白表达升高(P<0.05)。同时,与空白对照组比较,雷公藤甲素也提高了肝脏下游蛋白NQO1(P<0.01)和HO-1(P<0.05)的蛋白表达量。在雷公藤内酯三醇预先干预的小鼠肝脏中,细胞核Nrf2(P<0.01)、NQO1(P<0.01)和HO-1(P<0.01)的水平明显升高,差异具有统计学意义。此外,雷公藤内酯三醇组和雷公藤甲素组的Keap1 相对蛋白表达量没有明显变化。结果表明,雷公藤内酯三醇可能通过激活Nrf2/Keap1信号通路,改善雷公藤甲素诱导的小鼠肝脏损伤。

图3 雷公藤内酯三醇对雷公藤甲素诱导的肝损伤小鼠肝脏细胞核Nrf2、Keap1、NQO1 和HO-1 蛋白表达的影响(±s,n=3)Figure 3 Effects of triptriolide on the protein expressions of nuclear Nrf2,Keap1,NQO1,and HO-1 in mice with triptolide-induced liver(±s,n=3)
2.4 雷公藤内酯三醇可减轻雷公藤甲素诱导AML12细胞损伤结果见图4。10~640 ng·mL-1的雷公藤甲素剂量依赖性地降低了AML12 细胞的活性。6.25 ~400 μg·mL-1的雷公藤内酯三醇没有显示出细胞毒性。在100 ~400 μg·mL-1的浓度范围内,雷公藤内酯三醇可以明显提高雷公藤甲素(80 ng·mL-1)诱导的AML12 细胞活力(P<0.05,P<0.01)。此外,与空白对照组比较,雷公藤甲素(80 ng·mL-1)刺激的AML12 细胞形态出现收缩、减少和死亡现象,而雷公藤内酯三醇(200 μg·mL-1)处理可以改善这些变化。雷公藤内酯三醇(200 μg·mL-1)组中没有观察到明显的细胞损伤。结果表明,雷公藤内酯三醇可以减轻雷公藤甲素诱导AML12 细胞损伤,提高细胞活力,雷公藤内酯三醇没有明显的细胞毒性。

图4 雷公藤内酯三醇对雷公藤甲素诱导的AML12 细胞存活率和细胞形态的影响(±s,n=3;×100)Figure 4 Effects of triptriolide on triptolide-induced survival rate and cell morphology of AML12 cell(±s,n=3;×100)
2.5 雷公藤内酯三醇可减少雷公藤甲素诱导的AML12细胞IL-6、ROS、MDA 含量并增加IL-10、GSH和SOD 含量结果见图5。与空白对照组比较,雷公藤甲素(80 ng·mL-1)刺激后促炎细胞因子IL-6(P<0.01),ROS(P<0.01)、MDA(P<0.01)水平明显增加,IL-10(P<0.05)含量及GSH(P<0.01)和SOD(P<0.01)活性明显下降。雷公藤内酯三醇(200 μg·mL-1)的干预可以明显抑制IL-6 水平(P<0.01),增加IL-10 含量(P<0.05),同时明显抑制ROS(P<0.01)和MDA(P<0.05)的产生,GSH(P<0.05)和SOD(P<0.01)的活性均有不同程度的提高,差异有统计学意义。结果表明,雷公藤内酯三醇能够减少雷公藤甲素诱导的AML12 细胞炎症因子IL-6 分泌,增加促炎因子IL-10 分泌量,同时减轻氧化应激水平。

图5 雷公藤内酯三醇对雷公藤甲素诱导的AML12 细胞IL-6、IL-10、ROS、MDA、GSH、SOD 水平的影响(±s,n=3)Figure 5 Effects of triptriolide on triptolide-induced IL-6,IL-10,ROS,MDA,GSH,SOD levels in AML12 cell(±s,n=3)
2.6 Nrf2/Keap1 信号通路参与了雷公藤内酯三醇拮抗雷公藤甲素诱导的AML12 细胞损伤过程见图6。细胞实验的结果与动物实验一致。雷公藤甲素损伤的AML12 细胞中细胞核Nrf2 蛋白水平略有增加(P<0.05),其下游蛋白包括NQO1(P<0.05)和HO-1(P<0.05)表达量都有所升高。与雷公藤甲素组比,雷公藤内酯三醇干预后Nrf2(P<0.01)、NQO1(P<0.05)和HO-1(P<0.05)蛋白水平有所提高,差异具有统计学意义。同样,雷公藤甲素和雷公藤内酯三醇的干预并没有引起AML12 细胞中Keap1 蛋白表达的变化。结果表明,雷公藤内酯三醇通过激活Nrf2/Keap1信号通路,改善雷公藤甲素诱导的AML12 细胞损伤。
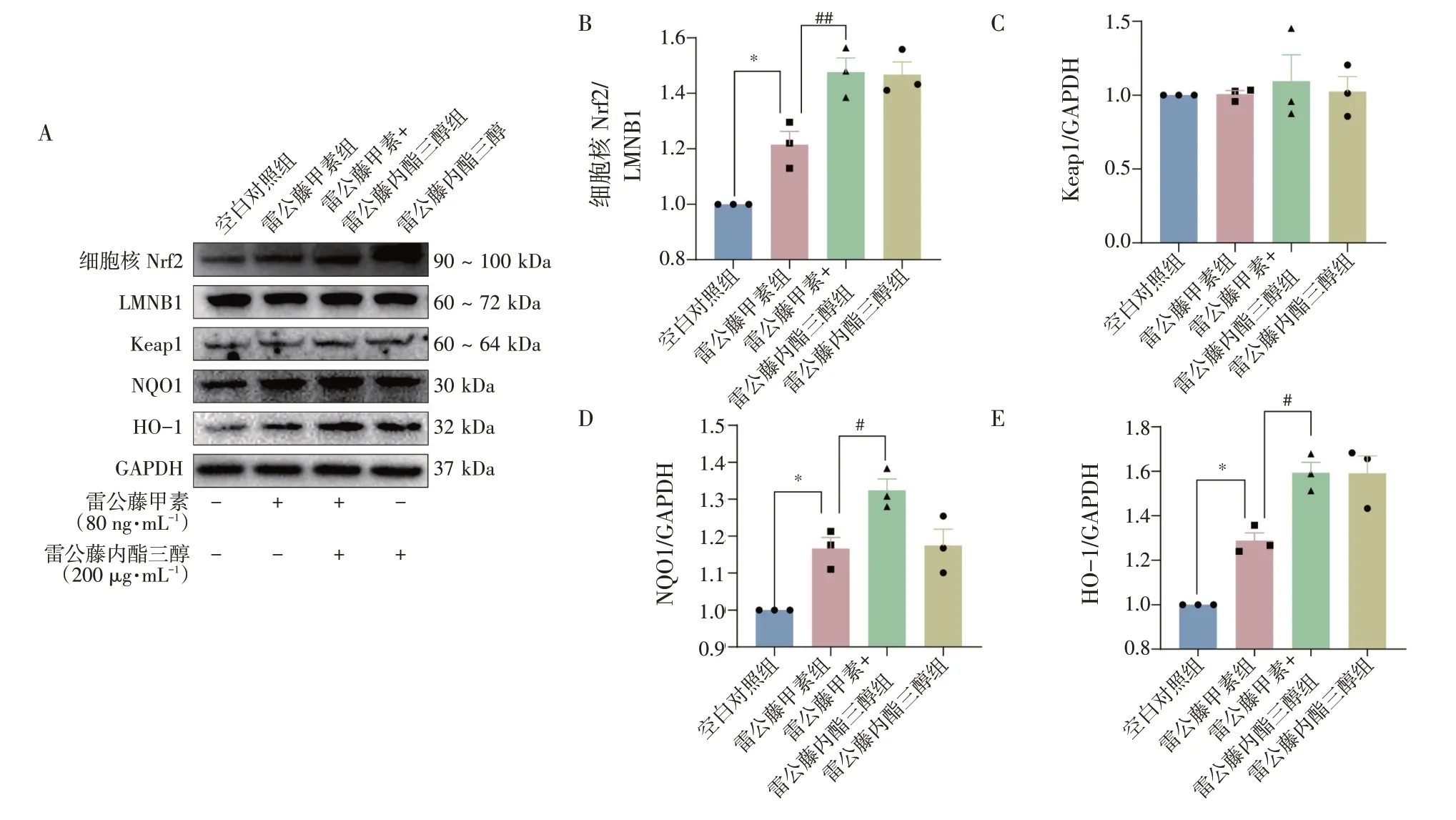
图6 雷公藤内酯三醇对雷公藤甲素诱导的AML12 细胞核Nrf2、Keap1、NQO1 和HO-1 蛋白表达的影响(±s,n=3)Figure 6 Effects of triptriolide on the protein expressions of nuclear Nrf2,Keap1,NQO1,and HO-1 in AML12 cell induced by triptolide(±s,n=3)
2.7 分子对接分析结果见图7。雷公藤内酯三醇-Keap1 和雷公藤甲素-Keap1 的最小结合能分别为-9.7 kJ·mol-1和-9.4 kJ·mol-1。具体来说,雷公藤甲素可以与Keap1 的VAL521 和ILE559 形成氢键作用,雷公藤内酯三醇可以与VAL463、VAL465 和ILE416 形成氢键作用。对接结果表明,雷公藤内酯三醇-Keap1 与雷公藤甲素-Keap1 具有相似的亲和力,雷公藤内酯三醇可能可以通过与Keap1 结合释放Nrf2 入核激活抗氧化信号通路。
3 讨论
雷公藤甲素作为一种有效的免疫抑制和抗癌的中药单体活性成分,具有临床应用的潜力[24,25]。然而,雷公藤甲素的多器官损伤作用,尤其是对肝脏功能的破坏,极大限制了其临床转化[26]。因此,寻找和验证新型的雷公藤甲素减毒药物,推进雷公藤甲素的研究和开发,对于治疗癌症和自身免疫性疾病等疾病是至关重要的。雷公藤内酯三醇是TwHF 中的一种微量二萜二环氧化物成分[27]。在先前的研究中,研究者很少关注雷公藤内酯三醇的药效学和生物学效应。本研究以雷公藤甲素诱导的肝损伤动物和细胞模型为研究对象,探讨雷公藤内酯三醇对雷公藤甲素的肝脏保护作用,并探究其内在机制。
首先,本研究结果显示雷公藤内酯三醇缓解了由雷公藤甲素诱导的肝功能损伤和组织病理学损伤。在细胞水平上,雷公藤内酯三醇可以提高雷公藤甲素诱导的AML12 细胞活性,改善细胞形态。据报道[28],雷公藤甲素会引起ROS 的升高,诱导正常细胞释放IL-6 和IL-10,这与肝损伤的病理变化有关。受刺激的机体产生ROS 同时刺激细胞膜磷脂受其攻击导致脂质过氧化生成大量MDA 来抑制抗氧化成分的活性,包括SOD,GSH[29-30]。过量的ROS 会损害蛋白质和细胞质膜,造成肝细胞损伤[31]。MDA 会影响线粒体功能,加剧细胞质膜损伤[32]。SOD 和GSH 的减少会导致超氧阴离子自由基的过度产生,从而加重氧化应激,诱发炎症引起肝细胞损伤[33]。在本研究中,雷公藤内酯三醇治疗减少了ROS,增强了抗氧化酶的活性,进而抑制了炎症反应,在减轻雷公藤甲素诱导的肝损伤方面发挥了重要的作用。
本研究通过Western Blot 法检测Nrf2/Keap1 通路上的关键蛋白,探究了雷公藤内酯三醇在保护雷公藤甲素诱导的肝损伤的基本机制。Nrf2 是细胞内抗氧化反应的重要激活剂,通过上调外源性代谢过程和细胞保护酶,在细胞的防御功能中扮演着重要的角色[34]。作为基于Cullin 3(CUL3)的E3 泛素连接酶蛋白的一个组成部分,Keap1 控制着Nrf2 的激活和稳定性[35]。一个Nrf2 和两个Keap1 分子形成一个三聚体,通过加速Nrf2 Neh2 结构域中赖氨酸残基的泛素化可导致Nrf2 蛋白体降解。在应激状态下,Keap1分解并诱导Nrf2 聚集到细胞核,并激活下游的抗氧化酶包括HO-1 和NQO1 的表达,以维持细胞内的平衡状态[36]。HO-1 是一种细胞保护性限速酶,其功能是清除有毒血红素并产生胆红素、铁离子和一氧化碳[37]。HO-1 通过抑制氧化应激损伤、调节炎症以及促进血管生成而发挥细胞保护作用[38]。NQO1 是一种受Nrf2 调控的细胞膜黄素酶,其启动子区域含有ARE 区域[39]。已发现NQO1 与其他Nrf2 刺激的解毒酶如HO-1,在抗氧化反应中一起被上调[40]。本研究数据显示,与雷公藤甲素组比较,雷公藤内酯三醇处理都能够在体内体外明显提高Nrf2 和下游蛋白酶表达,包括NQO1 和HO-1。
值得注意的是,雷公藤甲素刺激的Nrf2 以及NQO1 和HO-1 的蛋白表达水平比空白对照组的小鼠要高,原因可能是雷公藤甲素刺激的肝损伤的细胞防御反应导致Nrf2/Keap1 信号通路被激活。雷公藤甲素可以与Keap1 结合并释放Nrf2,这一结论可以通过分子对接分析得到支持,激活的Nrf2/Keap1 信号通路可以稍微缓解雷公藤甲素诱导的氧化应激损伤。但它无法彻底抵消雷公藤甲素的肝脏损伤,该结论与潜在机制和已发表的结果一致[41-43]。
此外,与细胞实验不同的是,雷公藤甲素干预Balb/c 小鼠24 h 后,IL-10 没有明显下降。雷公藤甲素组IL-10 没有明显下降的原因可能有以下几点:雷公藤甲素诱导的Nrf2 的激活对雷公藤甲素诱导的肝脏损伤起到了保护作用;动物内部条件复杂,影响实验结果;雷公藤甲素的干预时间短。除此之外,由于雷公藤内酯三醇的低毒性在前人研究中已有报道[44],本研究并未在动物实验中设置单独的雷公藤内酯三醇给药组。在后续实验中,我们将探讨雷公藤内酯三醇预处理对雷公藤甲素诱导的慢性肝损伤的保护作用及相关机制。
最后,我们采用分子对接技术,在分子水平上探讨了雷公藤内酯三醇和雷公藤甲素促进Nrf2 释放的方式。分子对接技术是将配体分子置于受体分子的活性位点,根据几何互补、能量互补和化学环境互补的原则,实时评估配体和受体之间的相互作用,从而找到两个分子之间的结合模式[45]。近年来,分子对接技术已经成为计算机辅助药物研究领域的一项重要技术[46]。本研究的分子对接结果显示,雷公藤内酯三醇和雷公藤甲素对Keap1 都有亲和力,与Keap1蛋白具有相近的最小结合能。基于上述结果,我们认为雷公藤甲素可能在诱导肝脏氧化应激和炎症损伤的同时,通过与Keap1 结合将Nrf2 释放到细胞核中,从而激活了防御反应,而低毒的雷公藤内酯三醇也可以与Keap1 结合,激活Nrf2/Keap1 信号通路,增强抗氧化效果。雷公藤甲素的环氧环能与人体内生物大分子中的电子基团进行亲电反应,形成共价键,使靶细胞中的生物大分子失去活性,但对正常细胞也有效[47]。因此,雷公藤甲素的环氧结构既是一个活性部位,又是一个毒性基团。优化雷公藤甲素的环氧基团结构,获得高活性、低毒性的雷公藤甲素衍生物是研究雷公藤甲素的主要目标。雷公藤甲素的三个环氧基团(C-12、C-7,8 和C-5,6)已被确定为其生物活性的关键结构[48]。其中,C-12,13 环氧基是最重要的修饰位点之一,因为它的立体阻碍最小,最有可能形成开环结构,从而降低毒性[2]。雷公藤内酯三醇是由雷公藤甲素的环氧基在磷酸盐缓冲液中开环得到的,它破坏了雷公藤甲素原有的毒性作用,保留了生物活性。在我们以前的研究中,雷公藤内酯三醇可以通过抗炎、抗氧化和抗凋亡的作用,有效地拮抗LPS 诱导的肝损伤和雷公藤甲素/嘌呤霉素诱导的肾损伤,而且毒性很低。而通过增加雷公藤内酯三醇在TwHF 制剂中的比例得到的新TwHF 制剂也可以对硫酸右旋糖酐钠诱导的炎症性肠病和阿霉素诱导的肾脏综合征起到持续作用和解毒作用。
综上所述,雷公藤内酯三醇可以改善雷公藤甲素诱导的肝脏损伤、氧化应激和炎症反应,其作用机制可能与结合Keap1 激活保护因子Nrf2 有关。在后续研究中,我们将重点关注Nrf2 的降解方式,进一步探讨雷公藤内酯三醇减轻雷公藤甲素细胞损伤的机制。

