基于PTEN/PI3K/Akt/mTOR 信号通路探讨淫羊藿苷联合地塞米松对阿霉素诱导足细胞损伤的保护作用及机制
吕娟,张云霞,白俊嫄,蒲晓薇,戴恩来(.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中医院,甘肃 兰州 730050)
肾小球足细胞作为终末分化的上皮细胞,覆盖于肾小球毛细血管外表面,与肾小球基底膜和肾小球内皮细胞一起形成肾小球滤过屏障。足细胞功能障碍或损伤引起肾小球滤过屏障功能受损,出现蛋白尿,是导致肾病综合征的重要原因[1-3]。
自噬机制已被确定为将受损蛋白质和细胞器输送到溶酶体以维持细胞稳态的主要途径,足细胞关键自噬蛋白缺失导致蛋白尿,诱导自噬是防止足细胞衰老和肾小球损伤的主要保护机制[4]。足细胞高水平的自噬可减轻足细胞损伤[5-6]。哺乳动物雷帕霉素靶蛋白(mammalian target ofrapamycin,mTOR)被认为是自噬和细胞代谢的关键调控因子[7]。mTOR 激活足细胞自噬,从而减少足细胞的凋亡[8]。研究[9-10]表明,PI3K/AKT/mTOR 信号通路在肾组织调节自噬中发挥着不可或缺的作用。同源性磷酸酶-张力蛋白(phosphatase and tensin homolog,PTEN)可通过激活脂质磷酸酶使磷脂酰肌醇三磷酸去磷酸化转变为磷脂酰肌醇二磷酸而失活,负性调控PI3K/Akt/mTOR信号通路,增强自噬[11-12]。
课题组前期体内研究[13]已证实,淫羊藿苷联合激素可以有效保护阿霉素肾病综合征足细胞的损伤,延缓病理进程。本研究旨在从细胞层面,基于PTEN/PI3K/Akt/mTOR 信号通路,探讨淫羊藿苷联合地塞米松对阿霉素诱导的足细胞损伤模型大鼠足细胞自噬水平的影响,以揭示其对足细胞的保护作用及机制。
1 材料与方法
1.1 细胞 大鼠肾足细胞株(Rat podocyte),编号:338697,购自北京北纳创联生物技术研究院。
1.2 药物及试剂 盐酸阿霉素(批号:427D022)、淫羊藿苷(批号:1128F021)、地塞米松(批号:320E056),均购自北京索莱宝科技有限公司;氯喹,批号:C843545,购自上海麦克林生化科技股份有限公司;synaptopodin 抗体(批号:224491)、LC3-Ⅱ抗体(批号:192890)、PETN 抗体(批号:32199)、mTOR 抗体(批号:32028)、PI3K 抗体(批号:151549)、p62抗体(批号:ab109012)、GAPDH 抗体(批号:37168)、山羊抗兔IgG(批号:150182),均购自英国Abcam 公司;Akt 抗体,批号:128414,美国GeneTex公司;HBAD-mRFP-GFP-LC3 腺病毒,货号:HB-AP210 0001,上海汉恒生物科技有限公司;胎牛血清,批号:504110916,上海元升生物科技有限公司;RIPA 裂解液,批号:20180913,北京索莱宝科技有限公司。
1.3 仪器 SW-CJ-1FD 型超净工作台,美国AIRTHCH 公司;FV1000 型共聚焦显微镜,日本Olympus 公司;ICX41 型倒置荧光显微镜,浙江舜宇光学股份有限公司;HT7700 型透射电镜,韩国COXEM 公司;DYCZ-40G 型转膜仪、DYCZ-25D 型电泳仪,均购自北京六一生物科技公司;5424R 型低温高速离心机,德国Eppendorf 公司。
1.4 模型的建立、分组及给药 将大鼠足细胞置于37 ℃,5% CO2培养箱中,观察足细胞生长情况,取分化成熟、对数生长期的细胞进行实验。根据前期预实验的结果,采用2 μmol·L-1阿霉素干预足细胞24 h 建立阿霉素足细胞损伤模型。地塞米松、淫羊藿苷、氯喹给药剂量均为10 μmol·L-1。将实验分为4 组:空白组、模型组(阿霉素2 μmol·L-1)、淫羊藿苷联合地塞米松组(阿霉素2 μmol·L-1+淫羊藿苷10 μmol·L-1+地塞米松10 μmol·L-1)、氯喹组(阿霉素2 μmol·L-1+淫羊藿苷10 μmol·L-1+地塞米松10 μmol·L-1+氯喹10 μmol·L-1)。氯喹组预先加入氯喹处理1 h,阿霉素与治疗药物(淫羊藿苷联合地塞米松)同时加入,作用24 h 后检测相关指标。
1.5 免疫荧光法检测synaptopodin 的表达 收集足细胞, PBS 漂洗,4%多聚甲醛固定,加synaptopodin一抗,过夜;PBS 洗涤3 次,加二抗,孵育1 h。加DAPI 染液,37 ℃孵育,防荧光淬灭剂封片,拍照分析处理。观察各组synaptopodin 的表达水平。
1.6 激光共聚焦显微镜观察足细胞的自噬流水平 将生长状态良好的大鼠足细胞接种到6 孔板,待细胞融合程度达到70%时,加入自噬双标腺病毒mRFPGFP-LC3;感染24 h, PBS 洗2~3 次;加4%多聚甲醛,固定30 min;PBS 漂洗3 次;DAPI 避光染色,室温静置15 min;PBS 漂洗3 次,封片、拍照分析。观察足细胞内GFP 和RFP 荧光信号,判断足细胞内自噬流水平的变化。
1.7 透射电镜观察足细胞内自噬体及自噬溶酶体变化 收集足细胞,加5%戊二醛室温固定3 h;加1%锇酸固定,PBS 洗涤3 次,依次用50%、70%、90%乙醇脱水各20 min,90%乙醇+90%丙酮(1∶1)脱水20 min,90%、100%丙酮脱水各20 min,丙酮脱水20 min,重复3 次;室温下依次采用纯丙酮+包埋液(2∶1)处理4 h,纯丙酮+包埋液(1∶1)过夜,纯包埋液37 ℃处理3 h;依次37 ℃烘箱内过夜,45 ℃烘箱内12 h,60 ℃烘箱内24 h;超薄切片机切片,每片厚度50 nm;透射电镜观察足细胞自噬体及自噬溶酶体并拍摄照片。
1.8 Western Blot 法检测LC3-Ⅱ、p62 和PTEN、p-PI3K、p-Akt、p-mTOR 的蛋白表达 收集足细胞,提取总蛋白,加入相应剂量RIPA 裂解液,以离心半径8 cm,12 000 r·min-1,4 ℃离心10 min,取上清液。根据BCA 试剂盒说明书,计算各组足细胞蛋白浓度。配置好浓缩胶及分离胶后,电泳转膜。封闭1 h,加入一抗,4 ℃孵育过夜。洗涤后放入二抗工作液中,置于摇床1 h。漂洗后加入发光液,成像仪曝光。采用ImageJ 软件分析灰度值,观察自噬相关蛋白表达水平。
1.9 统计学处理方法 采用SPSS 23.0 统计软件进行统计分析,计量资料结果以均数± 标准差(±s)表示。符合正态性要求采用单因素方差分析组间差异,方差齐时两两比较用LSD 法,方差不齐时则采用Grames-Howell 法进行两两比较。以P<0.05 为差异有统计学意义。
2 结果
2.1 对大鼠足细胞synaptopodin 表达的影响 见图 1、图2。与空白组比,模型组大鼠足细胞synaptopodin 的表达量下降(P<0.01);与模型组比,淫羊藿苷联合地塞米松组足细胞synaptopodin 的表达量增加(P<0.05);与淫羊藿苷联合地塞米松组比,氯喹组足细胞synaptopodin 的表达量下降(P<0.05)。
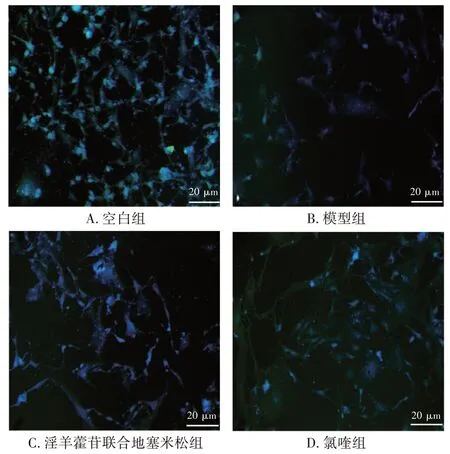
图1 大鼠足细胞synaptopodin 蛋白表达的免疫荧光染色图(×400)Figure 1 Immunofluorescence staining results of synaptophodin protein expression in rat podocytes(×400)

图2 大鼠足细胞synaptopodin 蛋白的相对表达量(±s,n=3)Figure 2 Relative expression of synaptophodin protein in rat podocytes(±s,n=3)
2.2 对腺病毒mRFP-GFP-LC3 转染足细胞自噬的影响 见图3、图4。自噬体与溶酶体结合后形成自噬溶酶体,自噬溶酶体由于溶酶体内部的酸性环境,可以导致pH 下降,GFP 淬灭。而mRFP 是稳定的荧光表达基团,不受外界影响。显微镜下成像后红色的斑点指示自噬溶酶体,红绿荧光Merge 后出现的黄色斑点即是自噬体。空白组足细胞中可见红色斑点和黄色斑点表达,自噬水平正常。与空白组比,模型组红色斑点和黄色斑点明显减少(P<0.01),自噬流减弱。与模型组比,淫羊藿苷联合地塞米松组红色斑点和黄色斑点明显增加(P<0.01),自噬流增强。与淫羊藿苷联合地塞米松组比,氯喹组红色斑点明显减少(P<0.01),黄色的斑点增加(P<0.05),自噬流被抑制。
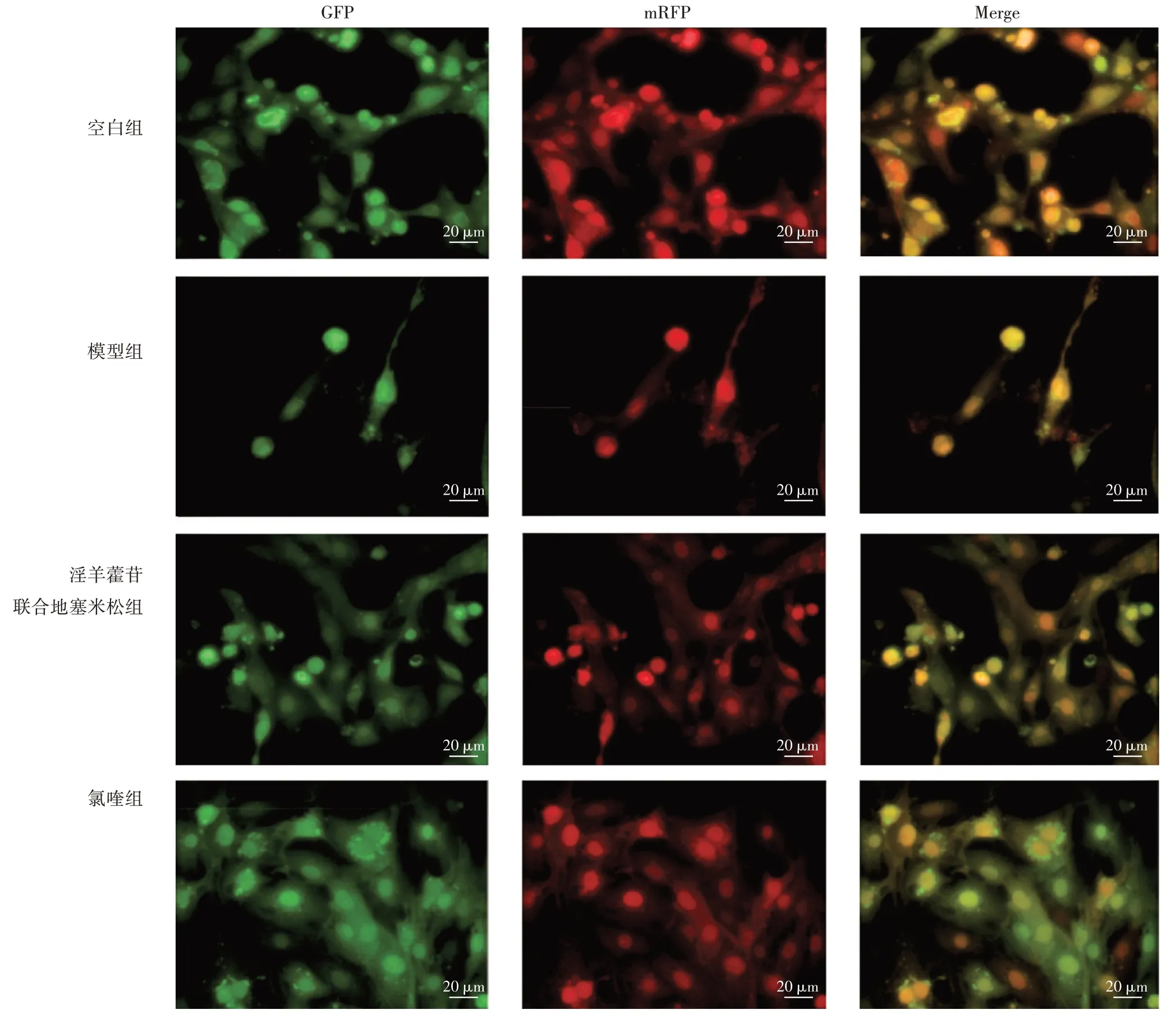
图3 大鼠足细胞中自噬流的变化(×400)Figure 3 Changes of autophagic flow in rat podocytes(×400)
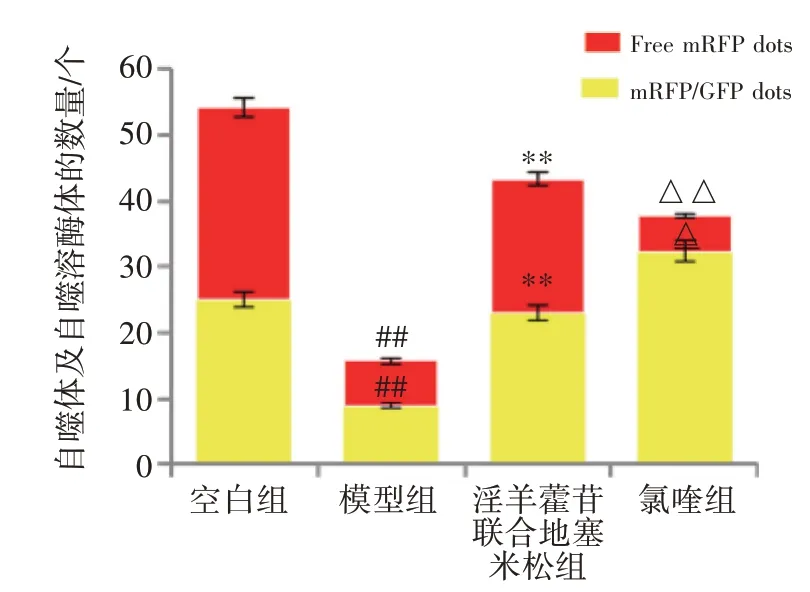
图4 共聚焦显微镜下大鼠足细胞中自噬体及自噬溶酶体的比较(±s,n=3)Figure 4 Comparison of autophagosomes and autophagic lysosomes in rat podocytes under confocal microscope(± s,n=3)
2.3 对足细胞中自噬体及自噬溶酶体数量的影响 见图5。透射电镜下吞噬泡形状为新月形或杯形,双层或多层膜,具有包绕胞浆中组织成分的趋势;自噬小体具有双层或多层膜的液泡状结构,其内含胞浆组织成分,如内质网、核糖体、线粒体等;自噬溶酶体为单层膜,液泡状结构内的胞浆细胞器成分已降解,其内结构模糊,轮廓不清晰。空白组见自噬体2 个,自噬溶酶体4 个;模型组只见1 个自噬溶酶体;淫羊藿苷联合地塞米松组见自噬体1 个,自噬溶酶体2 个;氯喹组见自噬体3 个,自噬溶酶体1 个。

图5 透射电镜下大鼠足细胞中自噬体及自噬溶酶体的变化(×15 000)Figure 5 Changes of autophagosome and autophagic lysosome in rat podocytes under transmission electron microscope(×15 000)
2.4 对LC3-Ⅱ、p62 和PTEN、p-PI3K、p-Akt、p-mTOR 蛋白表达的影响 见图6、图7。与空白组比,模型组LC3-Ⅱ、PTEN 的表达减少,p62、p-PI3K、p-Akt、p-mTOR 的表达增加(P<0.01)。与模型组比,淫羊藿苷联合地塞米松组LC3-Ⅱ、PTEN的表达量增加(P<0.01),p62、p-PI3K、p-Akt、p-mTOR 的表达减少(P<0.01)。与淫羊藿苷联合地塞米松组比,氯喹组LC3-Ⅱ和p62 的表达量均升高(P<0.05,P<0.01),PTEN、p-PI3K、p-Akt、pmTOR 的表达量均未见明显变化(P>0.05)。
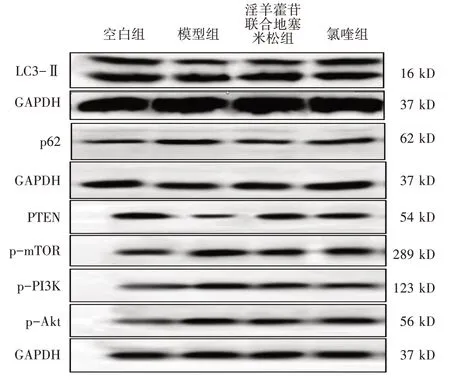
图6 Western Blot 法检测各组LC3-Ⅱ、p62、PTEN、p-mTOR、p-PI3K、p-Akt 的蛋白表达Figure 6 Protein expressions of LC3-Ⅱ,p62,PTEN,p-mTOR,p-PI3K,p-Akt detected by Western Blot
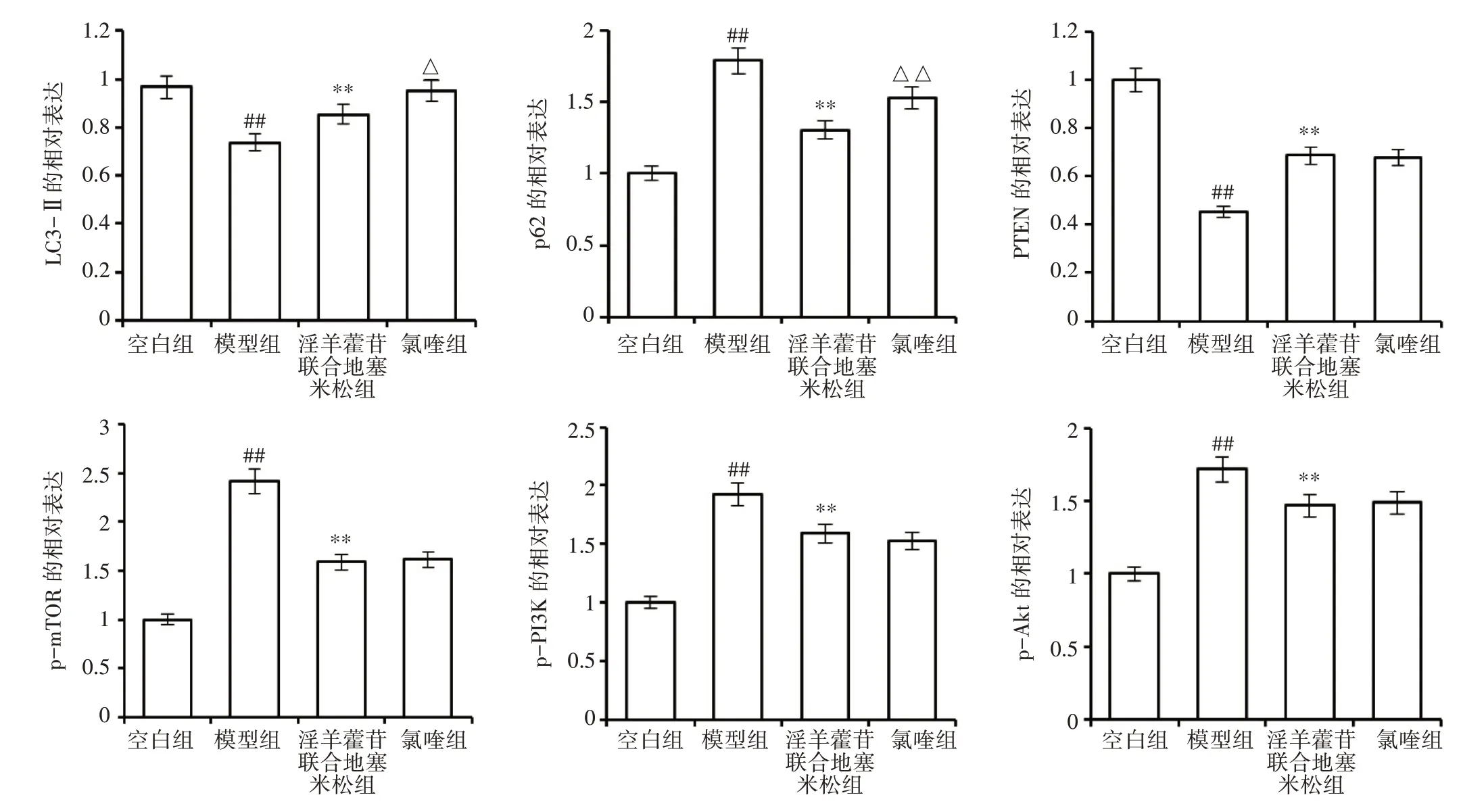
图7 各组LC3-Ⅱ、p62、PTEN、p-mTOR、p-PI3K、p-Akt 蛋白表达量的比较(±s,n=3)Figure 7 Comparison of the protein expressions of LC3-Ⅱ,p62,PTEN,p-mTOR,p-PI3K and p-Akt among each group(±s,n=3)
3 讨论
阿霉素是一种肾毒素,诱导的足细胞损伤表现为足细胞通透性增加,细胞骨架破坏,凋亡增加。阿霉素损伤导致的足细胞足突消失,代表了临床肾病综合征的特征[14-16]。地塞米松能够增加足细胞肌动蛋白丝的稳定性[17]。淫羊藿苷可降低足细胞凋亡、维持线粒体的结构和功能,在保护足细胞损伤中具有潜在的作用[18]。自噬激活对足细胞处理各种应激至关重要,可以保护细胞免受多种有害应激而引起的凋亡,维持足细胞内稳态[19]。课题组前期研究[20]已证实淫羊藿苷可以提高激素的敏感性,增加治疗阿霉素肾病综合征的有效性。动物实验也已证实淫羊藿苷联合激素使用效果优于单独使用[21],但其有效性的具体作用机制尚不明确。本研究进一步探讨了其联合使用的作用机制。
足细胞是肾小球基底膜最外层的上皮细胞,由胞体和足突组成,两相邻足突之间的裂隙称为裂孔,其上覆有一层拉链状蛋白结构——裂孔隔膜,为足细胞特有的细胞间连接,在维持肾小球滤过屏障的完整性方面起着关键作用[22]。Synaptopodin 是一种富含脯氨酸的肌动蛋白结合蛋白,存在于分化足细胞的足突中[23]。Synaptopodin 结构突变或表达缺失导致足细胞裂孔隔膜疏松、稳定性下降,蛋白尿发生[24-25]。
本研究结果表明,阿霉素可以降低足细胞synaptopodin 的表达,淫羊藿苷联合地塞米松可以有效地增加synaptopodin 的表达,发挥足细胞的保护作用;加入自噬抑制剂后,synaptopodin 的表达被明显地抑制。
自噬相关蛋白LC3 在自噬形成过程中发生聚集。无自噬时,LC3 融合蛋白弥散在胞浆中;自噬形成时,LC3 融合蛋白转位至自噬体膜。但是LC3 升高增多并不一定代表自噬活性增强,也有可能是自噬溶酶体降解途径受阻。因此为了鉴定真正自噬水平高低,可以进一步鉴定与LC3 相互作用的蛋白p62。p62 能调节自噬并与LC3 相互结合[26]。p62 和LC3 最终被自噬溶酶体内的溶酶体降解[27]。因此当自噬溶酶体降解途径受阻时,体内LC3、p62 均升高。氯喹作为经典的自噬抑制剂,通过改变溶酶体的酸性环境阻断自噬体与溶酶体的结合,使得大量的待降解蛋白在细胞中堆积。氯喹的亲溶酶体性使其进入细胞后特异性地作用于溶酶体,这导致溶酶体内pH 升高,丧失了与自噬体结合的能力,发挥对自噬的抑制作用[28]。
本文的激光共聚焦研究结果表明,阿霉素可以明显降低足细胞内自噬流水平,自噬体及自噬溶酶体均降低。淫羊藿苷联合地塞米松可增加足细胞自噬流水平,自噬体及自噬溶酶体均增加。氯喹可抑制自噬体与溶酶体的结合,使足细胞内自噬流水平降低,自噬溶酶体减少,但明显增加自噬体的数量。本文的透射电镜研究结果与此一致,进一步说明了淫羊藿苷联合地塞米松是通过调节足细胞自噬水平,从而发挥足细胞保护作用。
PI3K/Akt/mTOR 信号通路是调控细胞自噬的经典通路,PI3K 激活后能够产生磷脂酰肌醇三磷酸(PIP3),PIP3 使Akt 磷酸化从而使其活化,Akt 能够进一步激活mTOR 激酶[29-30]。mTOR 是自噬启动阶段的关键调节因子,mTOR 信号通路包括两种功能蛋白复合物,即mTOR 复合物1(mTORC1)和mTOR 复合物2(mTORC2),二者均参与自噬的调节。其中mTORC1 是蛋白质翻译和核糖体合成的重要调节因子,通过磷酸化作用抑制ULK1 的活性进而抑制自噬[31]。本研究的Western Blot 结果显示,阿霉素损伤足细胞后,LC3-Ⅱ、PTEN 的表达减少,p62、p-PI3K、p-Akt、p-mTOR 的表达增加,说明阿霉素损伤大鼠足细胞后,PTEN 活性被抑制,PI3K/Akt/mTOR 信号通路被激活,足细胞的自噬活性降低。淫羊藿苷联合地塞米松干预后,LC3-Ⅱ、PTEN 的表达量增加,p62、p-PI3K、p-Akt、p-mTOR 的表达减少。说明药物联合治疗后PTEN 的活性被抑制,激活了PI3K/Akt/mTOR 信号通路,上调了足细胞异常降低的自噬水平。加入自噬抑制剂氯喹后,发现LC3-Ⅱ和p62 的表达量同步升高,而PTEN、p-PI3K、p-Akt、p-mTOR 的表达量均未见明显变化。这是因为氯喹阻断自噬体与溶酶体的结合,导致LC3-Ⅱ病理性堆积,自噬系统受损,p62 也发生堆积。但是自噬信号通路相关蛋白的表达不受氯喹抑制。
淫羊藿又名仙灵脾,具有温补肾阳、强筋骨、祛风湿的功效,其主要活性化合物为淫羊藿苷,具有抑制肾纤维化、保护肾脏的功能[32],同样也具有温阳的效果[33]。黄贵华等[34]认为,自噬是对机体正虚邪实作出的一种自我调节方式。刘杰民等[35]认为自噬是机体在正气亏虚下的自救方式。本研究发现,淫羊藿苷协同地塞米松治疗增加了阿霉素足细胞中自噬活性。进一步阐明分子层面的细胞自噬现象仍然与中医阴阳理论相契合。
基于上述研究,提示淫羊藿苷联合地塞米松对阿霉素诱导的足细胞损伤具有保护作用,体现在上调足细胞骨架蛋白synaptopodin 的表达。通过激活PTEN,抑制PI3K/Akt/mTOR 信号通路,调节足细胞自噬水平可能是其足细胞保护作用的内在机制之一。
本实验主要为体外研究,通过阿霉素足细胞株模型探讨淫羊藿苷联合地塞米松的治疗效果及可能的机制。不足之处为未观察单独药物对自噬的影响,且体外研究有它的局限性,阿霉素足细胞株模型并不能完全代表阿霉素肾病综合征模型。今后有待从体内实验来进一步证实其机制。

