寒地苹果资源遗传多样性及群体结构的SSR 标记分析*
刘 畅,郭劲鹏,高 源,胡颖慧,杨 悦,宋宏伟,卜海东,于文全,王 昆,顾广军
(1 黑龙江省农业科学院牡丹江分院,寒地果树育种与栽培重点实验室, 157000)(2 黑龙江省林业科学院牡丹江分院)(3 中国农业科学院果树研究所,农业农村部园艺作物种质资源利用重点实验室)(4 吉林省农业科学院果树研究所)
东北属于寒地小苹果栽培区,以楸子、山定子、海棠及绵苹果等小苹果为主,通过引种并同当地野生种进行杂交育种,形成了北方寒地特有的苹果资源群落[1]。大量的苹果资源之间杂交使得群体间基因交流频繁,导致表型变异幅度增大,增加了种质资源的遗传背景和亲缘关系的鉴定难度。目前对于寒地苹果资源的鉴定大多从叶片、枝条、果实等形态指标进行[2-5],由于受环境影响较大而影响结果的准确性。
随着分子技术的发展,SSR 标记具有多态性高、重复性好以及准确性高等特点,已成为苹果资源遗传多样性研究的主要方法[6-7]。Gharghani 等[8]利用筛选出的9 对SSR 位点对159 份苹果资源进行遗传多样性分析,发现伊朗地方苹果品种与俄罗斯的东方海棠关系比其他海棠品种更近,来自世界不同地区的老苹果与西方苹果、东方苹果和伊朗苹果的遗传关系比其他野生品种更为密切;Gasia 等[9]利用10对SSR 引物对24 份波黑苹果品种和15 个国外品种进行遗传多样性分析,发现2 个传统的本国品种与国外品种紧密地聚类在一起,而其他品种形成了独立的聚类;Zhang 等[10]利用29 个SSR 引物对19 份克什米尔地区苹果材料遗传多样性进行分析,共扩增出218 个多态性等位基因,同时发现所有苹果品种主要分为2 个大类,存在更广泛的遗传多样性。
目前,针对中国北方寒地苹果资源群体多样性研究较少。本研究用筛选出多态性好的20 对荧光SSR 引物,对49 份寒地苹果种质资源进行SSR 多态性分析、聚类分析和群体结构分析,旨在揭示寒地苹果资源遗传多样性特征和群体遗传分化结构,为寒地苹果资源收集利用、亲缘关系分析和分子育种提供理论依据。
1 材料与方法
1.1 试验材料
供试49 份寒地苹果资源材料见表1,其中21份为在黑龙江野外对苹果资源收集考察时获得,6份为在俄罗斯远东地区考察时获得,13 份取自国家果树种质公主岭寒地果树圃,其余9 份取自黑龙江省农业科学院牡丹江分院苹果资源圃。
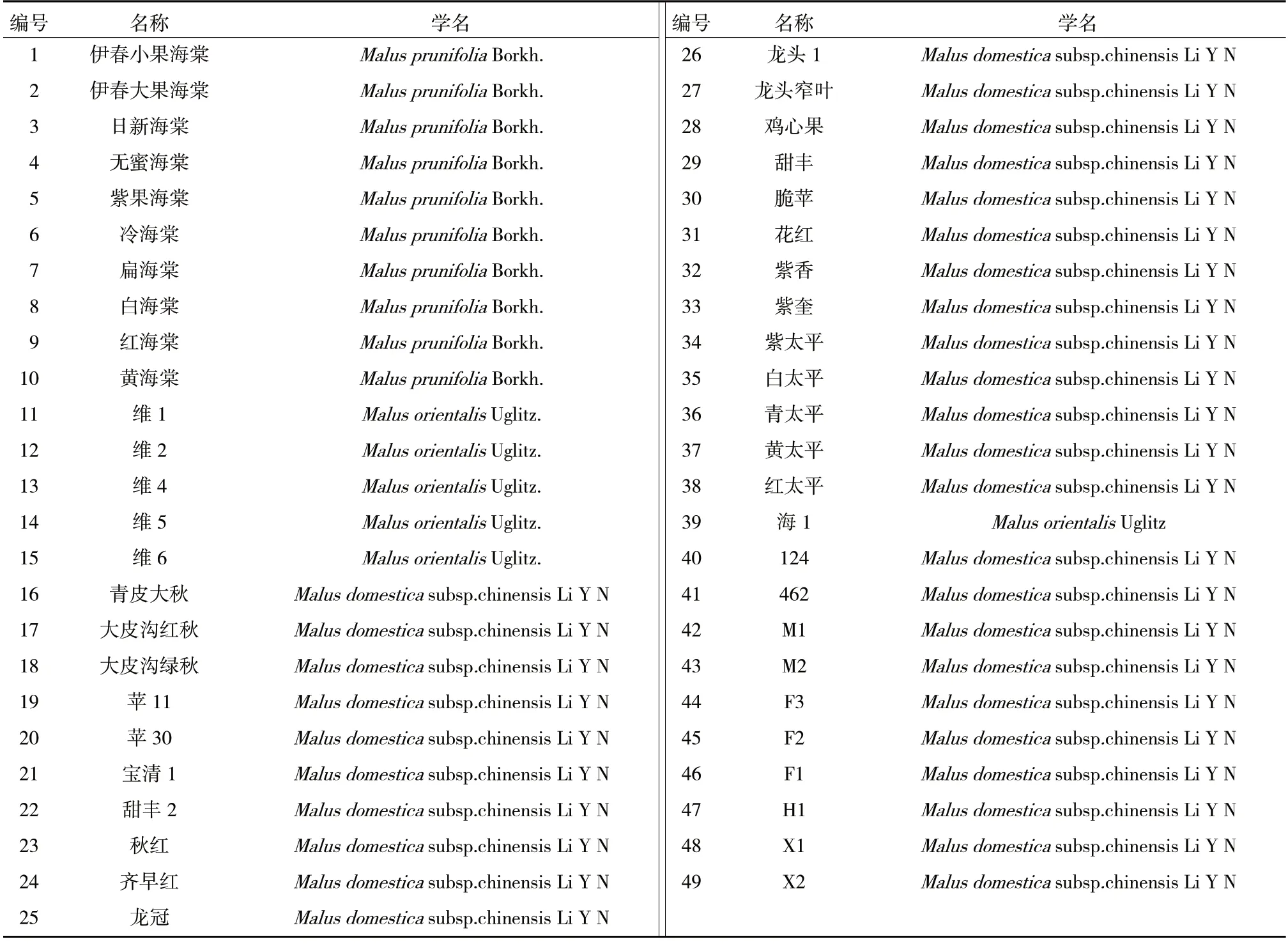
表1 49 份寒地苹果资源
1.2 试验方法
2020 年5 月采集幼嫩叶片,采用德国QIAGEN的DNeasy Plant Mini Kit 提取DNA,1%琼脂糖凝胶电泳检测DNA 完整性,用紫外分光光度计检测其浓度。从Hokanson 等[11]、Liebhard 等[12]、Yamamoto等[13]和Guiford 等[14]报道的序列中选取扩增产物片段长度在100~300 bp 并经检测具有高度多态性的SSR 引物20 对,引物相关信息见表2。SSR 反向引物和带有6FAMTM 荧光标记的SSR 正向引物均由上海生工有限公司合成。
PCR 体系参照Cao 等[15]的方法,扩增产物的纯化体系参照高源等[16]的方法。PCR 反应在Bio-Rad PTC-200 上进行。荧光SSR 的PCR 扩增产物经过纯化后在美国ABI-3730 基因测序仪上进行荧光检测,收集原始数据。
1.3 数据统计与分析
利用GeneMapper 3.0 软件对ABI-3730 收集数据进行分析,获得样品在每个SSR 位点的扩增片段长度,即指纹数据。利用遗传数据分析软件GenAlEx 6.501 计算多态性等位基因数(Na)、SSR 位点的有效等位基因数(Ne)、观察杂合度(Ho)、期望杂合度(He)、固定指数(F)及香农多样性指数(I)等遗传多样性指标,并分析种群间的分子变异(AMOVA)。基于SSR 不同位点,通过Excel 2017构建(0,1)矩阵,利用NTSYS 1.2 构建49 份寒地苹果材料的进化树,使用STRUCTURE 2.3.4 分析群体的遗传结构并确定最佳的群体分组。
2 结果与分析
2.1 SSR 扩增产物多态性分析
利用20 对多态性荧光SSR 引物对49 份寒地苹果资源基因组DNA 进行扩增,结果见表3,共扩增出278 个多态性等位基因(Na)。多态性等位基因数最少为3.000(GD147),最多为21.000(CH01f07a和CH01f02),平均多态性等位基因数为13.850,多态性位点百分率为100%。有效等位基因数(Ne)为1.353(NZ28f4)~12.637(CH01f07a),平均值为6.649。香农多样性指数(I)为0.646(NZ28f4)~2.745(CH01f07a),平均值为2.065。观察杂合度(Ho)为0.000(GD147)~0.776(GD15),平均值为0.569。期望杂合度(He)为0.261(NZ28f4)~0.921(CH01f07a),平均值为0.799。固定指数(F)为-0.026(GD15)~1.000(GD147),平均值为0.296,只有在GD15 中为负值,其余均为正值,说明供试寒地苹果资源群体内含有杂合子较少。
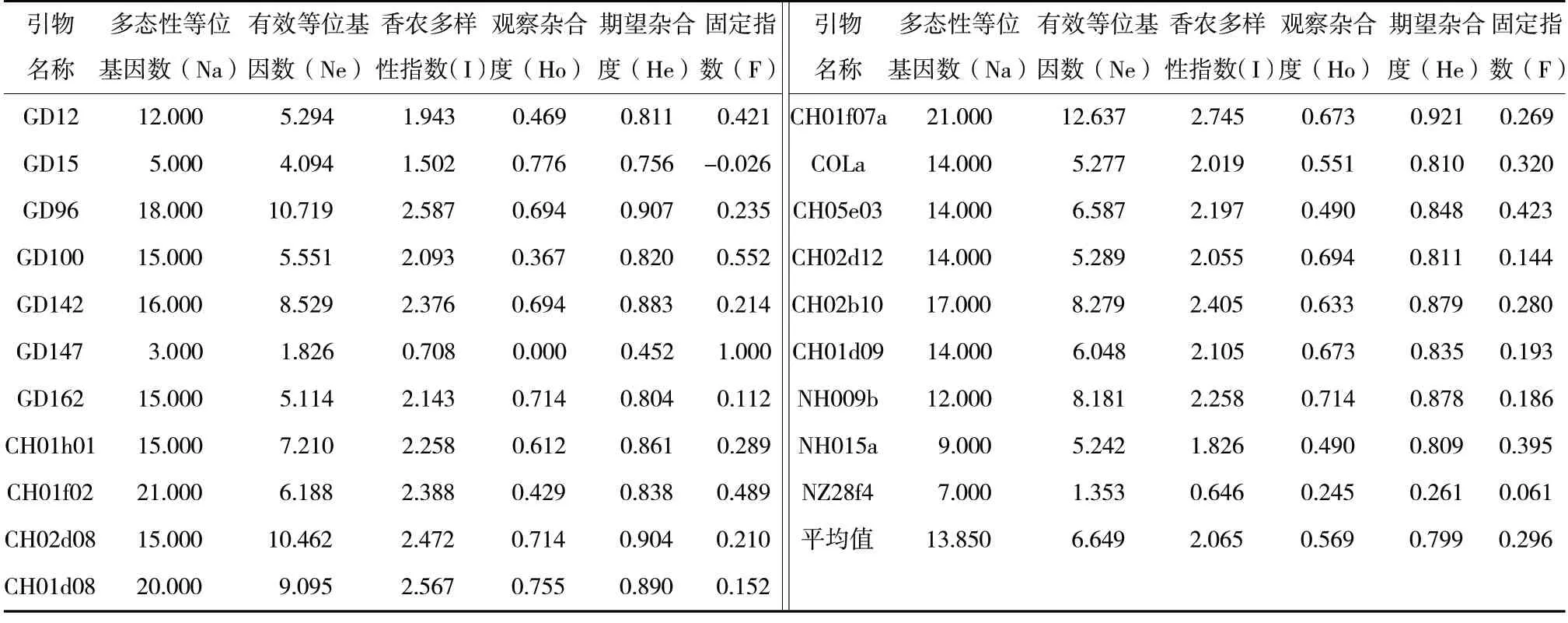
表3 不同SSR 位点的遗传多样性特征
2.2 不同苹果群体的遗传多样性和方差分析
49 份寒地苹果资源分属于3 个不同的群体(表4),群体分析发现中国苹果的多态性等位基因数、有效等位基因数和香农多样性指数最多,分别为12.750、6.885、2.054;观察杂合度楸子群体最高,为0.600,西洋苹果群体最低,为0.480;期望杂合度全部群体均高于0.500,中国苹果群体最高,为0.803,西洋苹果群体最低,为0.635,整体上遗传多样性较高;期望杂合度与观察杂合度差值最小的为楸子群体,差值最大的为中国苹果群体;固定指数在各个群体中均为正值,其中在楸子群体中最小,为0.144,与其他两个群体相比杂合子较多。对3 个群体进行群体分子遗传变异方差分析,群体内方差分量的贡献率占28%,个体内方差分量的贡献率占69%,遗传变异显著;群体间方差分量的贡献率占3%,遗传变异不显著。

表4 3 个苹果群体的遗传多样性
2.3 群体间的遗传分化
按照所属种划分群体后计算Nei 遗传距离和遗传分化系数(表5),楸子群体与西洋苹果群体间遗传距离最大,为0.411;其次是西洋苹果群体与中国苹果群体,为0.305;楸子群体与中国苹果群体间遗传距离最小,为0.261。不同群体之间遗传分化系数为0.047~0.081,西洋苹果群体与楸子群体遗传分化系数最高,为0.081;西洋苹果群体与中国苹果群体遗传分化系数居中,为0.058;中国苹果群体与楸子群体遗传分化系数最低,为0.047;体现了不同群体地理位置和遗传距离的相关性。

表5 寒地3 个苹果群体间的遗传距离和遗传分化系数
2.4 寒地苹果资源聚类分析
基于20 对引物对49 份供试材料的SSR 数据进行UPGMA 聚类分析(图1),遗传距离为0.80~1.00,表明各种质间亲缘关系差异较大。在遗传距离0.80 处供试的49 份苹果资源分为2 个大类:第Ⅰ类包括18 份资源,全部是中国苹果群体;第Ⅱ类包括31 份资源,其中楸子群体10 份,中国苹果群体16 份,西洋苹果群体5 份。在遗传距离0.81处,第Ⅰ类进一步分为Ⅰa 和Ⅰb 2 个亚类。其中Ⅰa 亚类包括124、甜丰、脆苹、花红、紫奎5 份资源;Ⅰb 亚类含有13 份资源,进一步细分可以看出青皮大秋、大皮沟红秋、大皮沟绿秋3 份资源聚为一类,鸡心果、462、紫香3 份资源聚为一类,龙头、龙头窄叶等7 份资源聚为一类。

图1 49 份寒地苹果资源的UPGMA 聚类图
2.5 群体遗传结构分析
基于SSR 分子标记数据对供试的49 份寒地苹果资源进行群体结构分析,参照Evanno 等[17]的方法来确定K 值。设置推测群体数K 为1~8,重复10次,当K=2 时,ΔK 取得最大值(图2),随后急剧下降,推测49 份苹果资源由于基因型不同分为2个类群(图3)。不同群体的材料在2 个类群中均有分布,类群1 含有21 份资源,包括楸子群体3份、中国苹果群体13 份和西洋苹果群体5 份。类群2 含有28 份资源,包括楸子群体7 份、中国苹果群体21 份。群体结构分析结果与聚类结果相类似,UPGMA 聚类Ⅰ类中除去中国苹果群体6 份全部归于STRUCTURE 分组类群2 中,UPGMA 聚类Ⅱ类中楸子群体10 份中3 份、中国苹果群体16 份中7 份和西洋苹果群体5 份归于STRUCTURE 分组类群1 中。
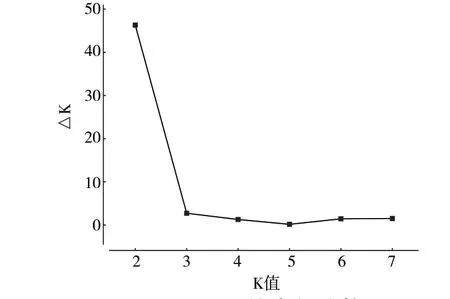
图2 ΔK 值变化趋势图

图3 K=2 时,49 份寒地苹果资源的遗传结构分析图
3 讨论
3.1 寒地苹果资源遗传多样性
SSR 分子标记技术在揭示苹果属不同群体间遗传差异具有广泛应用。Kumar 等[18]利用31 个SSR 位点对喜马拉雅海棠进行遗传多样性研究,共检测出96 个位点,每个SSR 位点的平均等位基因数为3.29个。Potts 等[7]利用10 个SSR 分子标记对164 份苹果资源进行扩增,共扩增出283 个等位基因,其中稀有等位基因百分率为39%。Ana 等[19]利用20 个SSR分子标记技术对西班牙东北部地区的183 份苹果种质进行遗传多样性研究,发现不同群体中多态位点的检出率为100%。出现差异的原因可能与所用标记引物和供试群体类型相关。本研究利用20 对SSR引物对49 份寒地苹果资源进行遗传多样性分析,共扩增出278 个多态性等位基因,平均多态性等位基因数为13.850,每对引物在群体中扩增出的多态位点的百分率为100%,表明供试寒地苹果不同群体间基因多态性丰富。
有效等位基因数(Ne)、香农多样性指数(I)、期望杂合度(He)等是评价群体变异程度高低的重要指标。本研究中,49 份寒地苹果资源总体遗传多样性的期望杂合度(He=0.799)、香农多样性指数(I=2.065)和有效等位基因数(Ne=6.649)均高于变叶海棠[20](He=0.438 9,I=0.628 2,Ne=1.81)、湖北海棠[21](He=0.262 8,I=0.401 5,Ne=1.437 5)和三叶海棠[22](He=0.699,I=1.458,Ne=3.954)等苹果属植物。Lassois 等[23]发现,杂合度大于0.5的群体具有较高的遗传多样性。本研究中49 份寒地苹果资源的期望杂合度(He)均高于0.5,遗传多样性相对较高。杂合度观测值和杂合度期望值的相似程度也反映了群体的遗传多样性,差值越小,遗传多样性越高。本研究中楸子差值小于西洋苹果和中国苹果,说明楸子群体遗传多样性高于其他两个群体。固定指数大小也能体现群体的遗传差异,固定指数为正值且数值越大,多样性越小。本研究结果显示楸子群体的固定指数最小,为0.144,与其他两个群体相比杂合子较多。Urrestarazu 等[24]利用16 对SSR 引物对493 份本地品种和45 个参考品种共扩增出267 个等位基因,其中参考品种仅占56%。Wasim 等[25]基于SSR 对喜马拉雅北部寒冷地区29 份苹果资源的遗传结构分析发现,种群内遗传变异占93%,而种群间的遗传变异仅占7%。本研究显示,49 份寒地苹果资源群体间变异占3%,显著低于前人研究结果,但整体趋势均显示变异主要存在于群体内,而不是群体间。本研究中楸子群体多样性指标(He=0.700,I=1.509,Ne=4.245)均低于高源等[26]对楸子种质资源的遗传多样性研究(He=0.868,I=2.446,Ne=9.399)。其原因一方面是材料全部采自中国东北,地域过于集中;另一方面群体数量太少,可进一步增加品种来进行验证。鉴于楸子大多为地方栽培品种且分布广泛,建议在寒地苹果育种中加大对楸子群体的考察收集,丰富群体的遗传多样性。
3.2 寒地苹果资源遗传结构
群体间遗传分化是评价群体变异的重要指标,Fst 值的高低反映群体间的遗传差异程度。Wright[27]认为,群体Fst 值在0~0.05,各种群间不存在分化;Fst 值在0.05~0.15 为中度分化;Fst 值在0.15~0.25为高度分化。本研究中楸子群体与中国苹果群体间遗传距离最小,为0.261,Fst 值最低,为0.047,群体间不存在分化;楸子群体与西洋苹果群体间遗传距离最大,为0.411,Fst 值最高,为0.081,其群体间属于中度分化。推测原因是寒地苹果品种选育中优先选择当地楸子作亲本与苹果杂交,存在基因渗透且交流频繁,导致楸子群体与中国苹果群体间无分化。发现两个群体之间的遗传距离与遗传差异相关,这与高源等[28]在对栽培种楸子的遗传多样性上面的研究结果一致。
为进一步明确各群体遗传结构,对49 份寒地苹果资源进行UPGMA 聚类,发现在遗传距离0.80处被分为2 个大类,与STRUCTURE 群体结构分析结果一致,但是在同类内部两种遗传关系分析结果并不完全一致,第Ⅰ类全部为中国苹果,其中鸡心果、甜丰、脆苹、花红、紫香、紫奎在群体结构中与楸子、西洋苹果归为一类,第Ⅱ类中楸子全部聚为一类,其中伊春小果海棠、伊春大果海棠、日新海棠在群体结构中与中国苹果和西洋苹果聚为一类,楸子群体与中国苹果群体聚类比较紧密,又与西洋苹果群体相互交错,各种群遗传距离和类群归属与地理位置不完全相关。Silva 等[29]研究发现,种群的杂交方式对种群分布有重要影响,所以我们推测俄罗斯远东地区和黑龙江省相邻,楸子群体大多分布在人类居住区附近,极易受到人为扩散产生属内自然杂交,导致基因渗透。同时本研究中采集各群体数量不一致对聚类结果可能会有一定影响,因此应加大不同种群苹果资源收集力度来完善遗传结构分析结果。
4 结论
本研究通过20 对多态性SSR 引物开展苹果群体的遗传多样性分析,49 份寒地苹果资源总体遗传多样性较高,中国苹果群体遗传多样性最高,西洋苹果群体遗传多样性最低,遗传变异主要存在于种群内的个体间(28%)和个体内(69%)。49 份寒地苹果资源共分为2 个大类,不同资源相互交错,结果表明遗传距离和类群归属与地理位置不完全相关,各群体间存在基因渗透和遗传分化。

