MicroRNA-205 通过甲基化修饰调节帕金森病多巴胺神经元LRRK2 表达
王洪伟,陶亮,吕禄廷,孙静慧,张腾腾,李杰,王建东
1.齐齐哈尔医学院附属第二医院神经内科,黑龙江齐齐哈尔 161006;2.齐齐哈尔医学院附属第二医院心内科,黑龙江齐齐哈尔 161006
帕金森病(parkinson disease, PD)是中枢神经系统常见的退行性疾病,严重影响老年患者的身体健康[1]。近年来研究表明,遗传因素是PD 发生和发展的重要原因之一,在5%~10%的患者中可以鉴定出一些遗传因素,并且与一般人群或对照组相比,受影响患者的一级家庭成员患该病的风险增加2~3倍[2]。另有研究发现PD 最常见的单基因形式之一是由编码富亮氨酸重复激酶2(Leucinerichrepeatproteinkinase2, LRRK2)的基因突变引起的[3],特发性PD 的发病机制中发挥作用,LRRK2-PD 和特发性PD 之间的密切相似性提示LRRK2-PD中神经退行性变机制的可能性,这可能为特发性PD 的病理生理学和治疗提供新见解。
MicroRNAs(miRNAs)是进化上保守的小的非蛋白质编码转录本,与靶信使RNA(mRNA)的3'-未翻译区(3'-UTR)的部分互补位点结合,从而调控其靶基因的翻译[4],许多miRNAs 通过调节靶向基因的翻译与神经系统中的神经元发育、突触可塑性、记忆形成和神经退行性疾病相关[5-6]。目前,虽然有关于miR-205 在神经退行性病变中的相关研究,但其在PD 纹状体中的表达以及对神经元凋亡的影响和机制尚未明确。因此,深入研究miR-205 与LRRK2 在PD 病理改变中的作用及作用机制对于治疗PD 至关重要。本研究通过对PD 细胞模型进行相关实验,探究PD 细胞模型中miR-205 与LRRK2之间的关系,试图通过该实验阐明PD 中miR-205对LRRK2 的调控机制。现报道如下。
1 材料与方法
1.1 材料
5%胎牛血清、1%的青霉素/链霉素双抗、高糖DMEM 培养基、细胞培养12 孔板、维生素A、TPA(phorb-ol ester 12-O-tetradecanoylphorbol-13-acetate)、MPP(1-methyl-4-phenyl-pyridiniumion)、10%胎牛血清、细胞培养箱、亚硫酸氢盐、甲基化检测试剂盒、miR-205 抑制剂、前体miR-205 及miR-205 阴性质粒、miRNA 提取试剂盒、电泳仪、PCR 仪。
1.2 方法
1.2.1 PD 模型细胞制备 人神经母细胞瘤细胞(SHSY5Y)购买后,采用含5%胎牛血清及1%的青霉素/链霉素双抗在高糖DMEM 中培养进行培养,24 h更换1 次液体,细胞覆盖皿底后用胰酶将其消化为单细胞,并制成1×104/mL 的细胞悬液。然后将细胞以1×104/孔的密度接种到包被明胶的12 孔板中,此时向培养液中添加10 μM 的维生素A,在5%CO2的湿培养箱中37℃条件下培养,48 h 后换液1 次,然后再继续培养24 h。随后,将培养液中的维生素A 替换为80 nM 的TPA,继续培养3 d。SH-SY5Y 细胞诱导分化6 d 后,此时的SH-SY5Y 细胞已经具有多巴胺神经细胞的生物学特征。将分化后的SH-SY5Y细胞分为两组,一组用含5% 胎牛血清的高糖DMEM 培养液培养作为对照组;一组用含1 mM 的MPP 及5%胎牛血清的高糖DMEM 培养液诱导为PD 模型细胞。培养48 h 后,多巴胺神经细胞诱导为PD 模型细胞。
1.2.2 PD 模型细胞中miR-205 甲基化检测 提取SH-SY5Y 细胞的DNA,用亚硫酸氢盐处理基因组DNA,所有未发生甲基化的胞嘧啶被转化为尿嘧啶,而甲基化的胞嘧啶不变;随后设计针对甲基化和非甲基化序列的引物进行PCR。通过电泳检测MSP 扩增产物,确定miR-205 启动子区域的甲基化,并进一步检测miR-205 的转录水平,确定LRRK2 的表达水平。
1.2.3 miR-205 过表达以及抑制试验 购买miR-205抑制剂、前体miR-205 及miR-205 阴性质粒[Ambion(Austin, TX, USA)],准备进行RNA 干扰及过表达试验,准备12 孔板,复苏SH-SY5Y 细胞,然后将细胞以1×105/孔的密度接种后,用含10%胎牛血清的DMEM 培养液进行培养。细胞培养24 h 后,将其分为4 组:无处理组、阴性对照组、前体miR-205、miR-205 抑制剂。细胞转染48 h 后,收集细胞,分别提取mRNA 进行检测,确定miR-205 水平与LRRK2 表达量之间的关系,明确miR-205 抑制剂在PD 模型细胞的调控机制。
1.2.4 q-PCR 试验 收集细胞,采用试剂盒提取mRNA。miRNA 试剂盒提取组织中总RNA,Qiagen miScript RT 试剂盒进行反转录。再以cDNA 为模板,在DNA 聚合酶作用下扩增合成miR-205 和LRRK2 片段。LRRK2 转录,使用SYBR Green Master mix,GAPDH 作为内源对照,方法参照试剂盒说明书。miR-205 转录水平分析,采用All-in-One™miRNA qRT-PCR Detection Kit 监测试剂盒,U6 作内源对照。PCR 条件:95℃加热40 s;然后95℃加热10 s,60℃延长30 s,总计40 个循环;最后72℃条件下处理5 min。表达量的计算方法采用2-ΔΔCt,ΔΔCt=[Ct(靶基因)-Ct(内参)]组1-[Ct(靶基因)-Ct(内参)]组2。
1.3 观察指标
各组细胞模型中qRT-PCR 检测miR-205、LRRK2 表达水平;使用miR-205 抑制剂后各组细胞模型LRRK2 表达水平;miR-205 过表达后各组细胞模型LRRK2 表达水平
1.4 统计方法
采用GraphPad Prism 软件对数据进行分析,实验的数据以(±s)表示,两组比较采用独立样本t检验,多组比较采用方差分析方法进行分析;方差分析两两比较结果采用Tukey-Kramer 多重比较检验确定统计学意义。P<0.05 为差异有统计学意义。
2 结果
2.1 PD 模型细胞中miR-205 水平下调,LRRK2 水平上调
本研究提取正常细胞以及PD 模型细胞的总RNA,通过q-PCR 方法检测两种细胞中miR-205 以及LRRK2 的表达水平,发现相较于正常细胞(1.02±0.14),PD 模型细胞中miR-205 的表达水平明显降低(0.59±0.03),差异有统计学意义(P=0.017),见图1A;而相较于正常细胞(1.00±0.11),PD 模型细胞中LRRK2 水平上调(1.50±0.10),差异有统计学意义(P=0.033),见图1B。
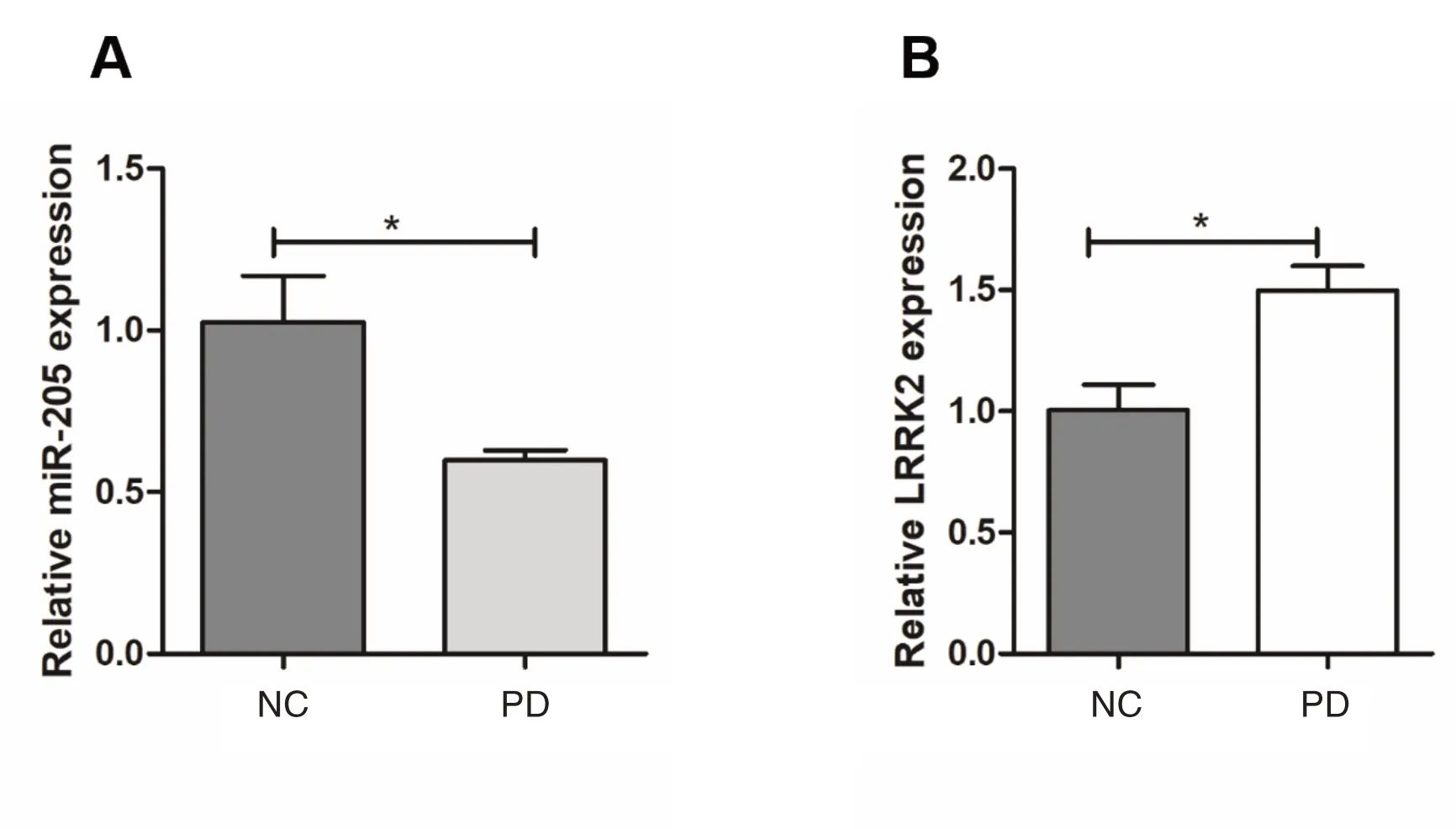
图1 miR-205 及LRRK2 表达水平
2.2 miR-205 抑制剂促进LRRK2 表达
miR-205 抑制剂被设计用于特异性结合内源性miR-205 并抑制其活性。经鉴定,相较于正常细胞(1.02±0.11)以及PD 模型细胞(1.47±0.12),转染miR-205 抑制剂后可诱导神经元培养物中LRRK2蛋白表达的剂量依赖性上调(1.87±0.11),差异有统计学意义(P=0.036),见图2。
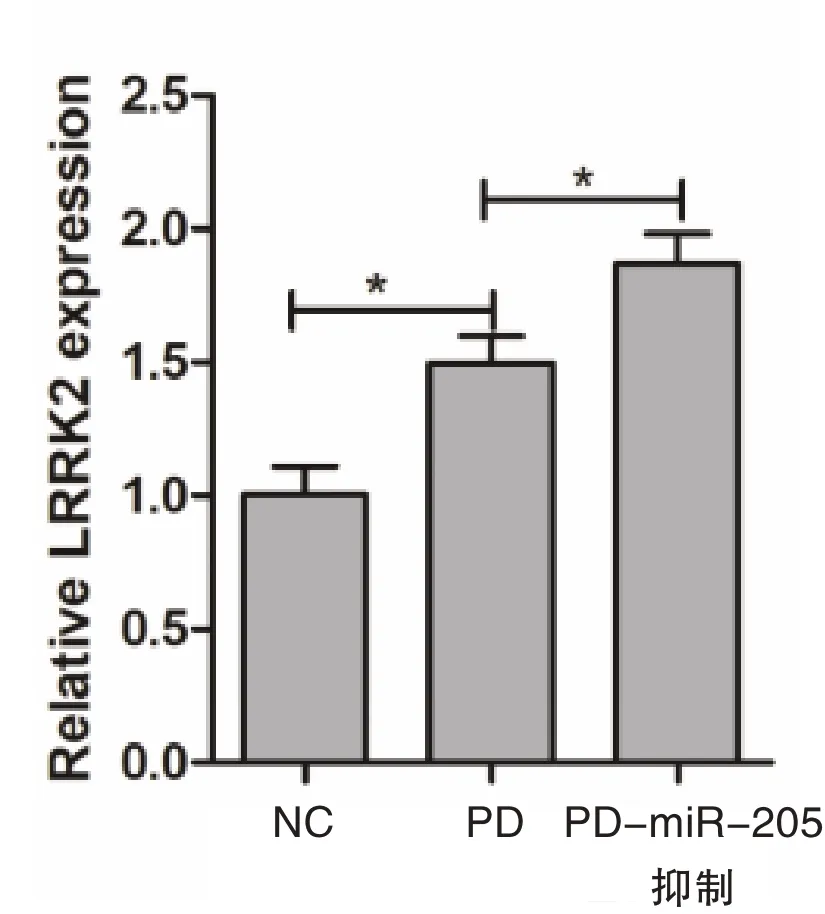
图2 miR-205 抑制后LRRK2 表达水平
2.3 miR-205 过表达可抑制LRRK2 表达
为了进一步研究miR-205 对LRRK2 表达的影响,将前体miR-205 转染到细胞中,通过q-PCR 分析LRRK2 转录水平。前体miR-205 进入细胞后被转化为成熟miR-205。观察到,相较于正常细胞(1.02±0.11)以及PD 模型细胞(1.47±0.12),使用前体miR-205 处理SH-SY5Y 细胞可持续抑制LRRK2蛋白表达约50%(0.87±0.11),差异有统计学意义(P=0.020),见图3。
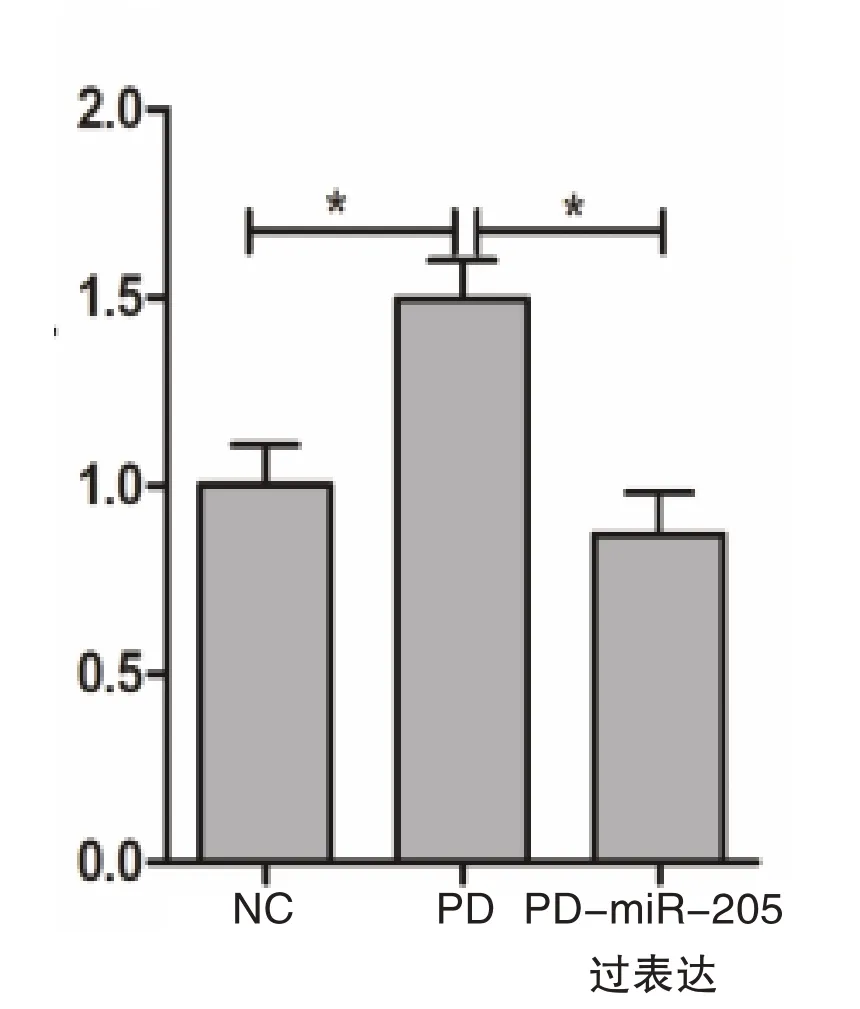
图3 miR-205 过表达后LRRK2 表达水平
3 讨论
miR-205 参与代谢、神经营养素信号调节等生物学过程,其异常表达与PD 的发生有关,但其在PD 患者纹状体中的表达以及对神经元凋亡的影响和机制尚未明确[7]。LRRK2 是常染色体遗传性PD最常见的病因。LRRK2 突变导致全球多达5%的家族性病例[8]。LRRK2 的错义突变与家族性和散发性PD 相关。LRRK2 基因表达的简单改变可能导致常见散发性PD 的可能性[9]。LRRK2 酶结构域的7个点突变(G2019S、I2020T、R1441C/G/H、Y1699C、N1437H)导致常染色体显性PD。重要的是,LRRK2的遗传变异体也是克罗恩病、麻风病和结核病的危险因素,这提示LRRK2 蛋白在中枢神经系统之外发挥重要作用,有研究表明LRRK2 蛋白在全身低水平表达,在肾脏、肺和免疫细胞中水平最高,在大脑中有少量表达[10]。此前已有研究尝试检测家族性和散发性PD 患者大脑中LRRK2 蛋白的表达水平[11]。
有研究表明,LRRK2 可能与miRNA 处理途径相互作用,调节蛋白质合成[12]。Chen Q 等[13]研究表明MALAT1/miR-205-5p 轴通过靶向LRRK2 调控MPP+诱导的MN9D 细胞凋亡,Cho HJ 等[14]检测了散发性PD 患者额叶大脑皮层中LRRK2 蛋白和LRRK2 靶向miR-205 的水平。他们发现,LRRK2 蛋白表达水平在PD 患者大脑中显著升高,而miR-205表达水平降低,进一步研究发现miR-205 可以直接调控LRRK2 的表达。并且体外细胞模型也已明确,LRRK2 蛋白的表达水平在PD 组中的表达显著增加[15],与本文出的结论一致,本研究在PD 模型细胞中也发现LRRK2 蛋白表达水平升高,而miR-205表达水平降低,当过表达miR-205 后,LRRK2 蛋白表达下降;与前期研究结论相似[15],本研究也进一步证明了miR-205 能抑制LRRRK2 的表达。因此,深入研究miR-205 与LRRK2 在PD 的病理改变中的作用及作用机制对于治疗PD 至关重要,研究miRNA-205 在PD 病理改变中的调控作用对于寻找PD 治疗新靶点具有重要意义。
为了研究PD 患者中miR-205 的过表达或抑制是否影响LRRK2 的表达,本研究使用SH-SY5Y 成功诱导出PD 细胞模型,并对PD 细胞模型进行miR-205 过表达及抑制实验,发现在PD 细胞模型中miR-205 可以抑制LRRK2 的表达,miR-205 的下调可能导致了LRRK2 蛋白在散发性PD 患者脑内的潜在致病性升高,而过表达miR-205 可能为抑制LRRK2 蛋白在PD 中的异常上调提供一种适用的治疗策略,这些结果表明内源性miR-205 是细胞中LRRK2 蛋白表达的抑制因子。本研究推测microRNAs 可能负责LRRK2 的转录调控,因为它们以序列依赖的方式结合到靶基因3'-UTR 的特定区域,从而抑制基因转录,进一步证实了miR-205 在调节LRRK2 表达中的作用。因此,本研究结果表明,miR-205 可能是PD 的潜在生物标志物,上调miR-205 水平可能为抑制散发性PD 中LRRK2 的表达提供一种可能的治疗途径。但是目前尚不清楚miR-205 在PD 患者大脑中的表达是如何下调的。因此进一步研究PD 患者脑内miR-205 基因位点的DNA 甲基化或其他修饰,可能为阐明散发性PD 患者miR-205 表达变化的机制提供线索。
综上所述,本研究进一步揭示了miR-205 调控LRRK2 蛋白表达的新机制,提示miR-205 可能作为散发性PD 的生物标志物和治疗靶点。

