水滑石基臭氧分解催化剂性能研究
马嘉川,郭明星,王 胜,王树东
(1. 大连海事大学 环境科学与工程学院,辽宁 大连 116026;2. 中国科学院大连化学物理研究所 洁净能源国家实验室,辽宁 大连 116023)
臭氧(O3),由三个氧原子构成,O-O 键的距离为0.128 nm,是氧气的同素异形体,具有极强的氧化性,主要来源于大气中的平流层,可阻挡紫外线、保护地球生物及生存环境。但是,当飞机在平流层巡航时,平流层臭氧将随着发动机引气进入油箱惰化系统和飞机环控系统,严重危害机舱设备和乘员健康。由于受飞行质量和空间限制,机载臭氧转换器要在极高的空速下运行,对臭氧分解催化剂提出了较高的要求[1]。开发一种低成本、耐湿性强、体积小、质量轻且具有优良催化分解臭氧性能的催化剂成为目前亟需解决的关键技术难题[2]。常规去除臭氧的方法主要有热分解法、活性炭吸附法、溶液吸收法、催化分解法[3-5]。热分解法受温度限制,具有一定的局限性;活性炭虽然价格低廉,但易失活,需多次再生更换,无法满足机载要求;溶液吸收法存在着废液难处理难回收等问题,而催化分解法可在较低温度下分解臭氧,运行周期长,因此,臭氧催化分解是解决机舱和近地面臭氧污染最有效的方法[6-10]。
臭氧分解催化剂主要有贵金属(Pd、Pt、Ag等)催化剂和过渡金属氧化物(MnO2、CuO、Fe2O3、CeO2等)催化剂。贵金属负载量1.5% 的Pd/Al2O3催化剂具有优异的臭氧分解性能,在30 ℃、RH <5%、WHSV=600000 mL/(gcat·h)条件下,反应7 h后臭氧转化率维持在95%以上[11]。过渡金属MnOx是研究最为广泛的臭氧分解催化剂,其形貌和价态都会显著影响其臭氧催化分解性能。Zhang 等[12]合成了不同价态的锰氧化物(MnO2、Mn3O4、Mn2O3和MnO2-H-200),经200 ℃氢气还原的MnO2(MnO2-H-200)由于表面丰富的氧空位,而具有最佳的臭氧分解性能,在30 ℃下,反应12 h 后转化率仍不低于96%。尽管贵金属催化剂和过渡金属氧化物催化剂具有优良的臭氧分解性能,但其耐水性有待提高[13]。因此,开发在含水工况下稳定分解臭氧的催化剂迫在眉睫。
LDH 是一种二维纳米层状八面体材料,其层状结构与Mg(OH)2类似。分子式可表示为其中,M2+(M=Mg2+、Mn2+、Ni2+、Fe2+、Co2+、Zn2+等)和M3+(M=Fe3+、Al3+、Mn3+、Co3+等)分别为二价和三价金属阳离子。A 为层间插层阴离子如等,可由不同的盐溶液引入[14]。由于其灵活可调的结构,LDH 常被应用于催化领域[15-17]。此外,通过适当组合制成的LDHs 复合材料,可以提高LDHs 的性能[18]。Wang 等[19]使用镁锰铝三种金属合成了一系列水滑石催化剂,其具有较大的比表面积和丰富的氧空位,解决了传统锰基臭氧分解催化剂表面积、氧空位少、臭氧分解稳定性差的问题;Ma 等[20]研究发现NiFe-LDH 催化剂结构稳定,具有优良的耐水性能,在30 ℃、臭氧体积分数为4.0×10-5、空速为840 L/(g·h)和相对湿度为65%的条件下,反应6 h 内臭氧转化率为 89%,规避了传统MnOx臭氧分解催化剂因水分子竞争吸附导致的快速失活问题。
由此可见,LDH 催化剂已展现出良好的应用前景。但目前关于水滑石基臭氧分解催化剂的研究报道较少,有必要开展更加系统的研究,进一步优化提升其臭氧分解性能。因此,本实验以廉价易得的过渡金属铁、镍、钴、锰为金属元素原料,用共沉淀法制备了四种LDH 催化剂(Ni3Fe-LDH、Ni3Co-LDH、Ni3Mn-LDH、Co3Fe-LDH)。探究在30 ℃、600000 mL/(g·h)、相对湿度分别为RH < 5%和RH >90%的条件下,臭氧催化分解活性及耐水性性能。
1 实验部分
1.1 实验材料与试剂
所有化学试剂都为分析纯,无需进一步提纯。硝酸镍(Ni(NO3)2·6H2O),购自天津大茂化学试剂厂;硝酸钴(Co(NO3)2·6H2O),购自上海麦克林生化科技有限公司;硝酸铁(Fe(NO3)3·9H2O),购自国药集团化学试剂有限公司;50%硝酸锰溶液(Mn(NO3)2,50%),购自上海麦克林生化科技有限公司;氢氧化钠(NaOH),购自国药集团化学试剂有限公司;无水碳酸钠(Na2CO3),购自天津科密欧化学试剂有限公司;30%过氧化氢溶液(H2O2,30%),购自天津大茂化学试剂厂。所有水溶液均为去离子水制备。
1.2 催化剂的制备
共沉淀法制备LDH:按物质的量比A2+∶B3+=3∶1,准确称量0.075 mol 的A 固体(A=Ni(NO3)2·6H2O或Co(NO3)2·6H2O),再称量0.025 mol 的B 物质(B=Co(NO3)2·6H2O、Fe(NO3)3·9H2O或Mn(NO3)2,将A 和B 物质混合溶解形成100 mL 混合溶液C。其中,Ni3Mn-LDH 和Ni3Co-LDH 的制备需要加入适量H2O2溶液。100 mL 混合溶液D 包含0.16 mol固体NaOH 和0.025 mol 固体Na2CO3。然后将C 和D 溶液倒入恒压漏斗,以相同速率滴加至80 ℃的装有200 mL 去离子水的三口烧瓶中,加入转子匀速搅拌,共沉淀时长为24 h,冷却至室温后抽滤洗涤至中性,放入烘箱80 ℃干燥18 h 后取出,研磨后即得到颗粒催化剂Ni3Fe-LDH、Ni3Co-LDH、Ni3Mn-LDH、Co3Fe-LDH。在后续低湿度(RH <5%)、高湿度(RH > 90%)臭氧分解条件下,反应24 h 后的样品分别在新鲜催化剂后加“-G”和“-S”标记。LDH 催化剂中的金属物质的量比经ICP 测试在3∶1 左右(见表S1)。
1.3 催化剂结构表征
采用荷兰PANAlytical Empyrean X 射线粉末衍射仪对催化剂进行晶相结构分析,实验条件为:CuKα 靶,管电压40 kV,管电流40 mA,扫描(2θ)为5°-80°。通过软件Jade 6.0 和X 射线衍射卡(JCPDS)对衍射结果进行定性分析。通过傅里叶-红外光谱表征(Nicolet 6700 Flexspectrometer)分析催化剂表面基团,4000-650 cm-1扫描。催化剂在100-1800 cm-1的拉曼光谱是在RENISHAW inVia 共焦显微拉曼光谱仪上获得,激发波长为532 nm。催化剂的比表面积等织构参数在美国Quantachrome NOVA 2200e 型全自动气体吸附分析仪上测得。测试前在80 ℃下真空脱气12 h,然后在液氮温度(77 K)下测试其N2吸附-脱附曲线,并由BET 和BJH 理论计算得出比表面积、孔容和孔径。在日本JSM-7800F 获得催化剂的扫描电子显微镜(SEM)照片,加速电压15 kV。测试时将样品分散到无水乙醇中,离心后取上清液分散到碳支撑膜上,再用导电胶将样品固定测试。催化剂表面的元素组成和价态信息在美国Thermo Fischer ESCALAB 250Xi 型X 射线光电子能谱仪上收集,测试选用Al 阳极靶、高真空(8 × 10-10Pa)、以标准C 1s的结合能(284.9 eV)电荷矫正,使用Avantage软件进行分析拟合。采用德国NETZSCH 公司的STA 449 F3 型同步热分析仪测定样品热力学稳定性。取适量粉末置于刚玉坩埚中,在空气气氛中以10 ℃/min 的升温速率由室温升至800 ℃。用强酸将催化剂样品完全溶解,并稀释定容,再用美国PerkinElmer 公司的Optima 8000 型光谱仪测定待测液中Ni、Co、Mn、Fe 元素的浓度。
1.4 催化剂性能评价
催化剂的臭氧分解活性在微型固定床石英管反应器(内径6 mm)中进行测试。称量0.15 g 颗粒催化剂(40-60 目)置于固定床反应器内,反应床层温度通过外置的管式炉控制,保持在30 ℃。质量空速600000 mL/(g·h)和干气(RH < 5%)、湿气(RH > 90%)下测定分解性能。臭氧发生器产生的臭氧质量浓度控制在28.96 mg/m3。反应器进出口臭氧浓度Cin和Cout通过臭氧分析仪(Thermo Scientific,49i)分析。臭氧转化率x通过下式计算:
2 结果与讨论
2.1 臭氧催化分解性能

图1 制得的LDH 催化剂臭氧催化分解性能Figure 1 Ozone catalytic decomposition performance of asprepared LDH catalysts (reaction conditions: ozone feed gas concentration 28.96 mg/m3,catalyst mass 0.15 g,mass space velocity 600000 mL/(g·h),temperature: 30 ℃,RH < 5%)
在30 ℃、WHSV=600000 mL/(g·h)、相对湿度RH > 90%的条件下,四种LDH 分解臭氧的催化性能如图2 所示。连续反应18 h 后,Ni3Co-LDH催化剂效果最好,维持在77%以上,其中,Ni3Co-LDH 臭氧活性曲线先降低后增加是由于管道内残留少量臭氧。Co3Fe-LDH 和Ni3Mn-LDH 在初始3.5 h内具有较高的臭氧转化率,是因为结晶度更好,暴露更多活性位点,但反应后通过对比发现水滑石结构坍塌(图S1、S2),使得活性下降较快。高湿度下催化活性的降低主要是由水分子在催化剂活性位上的竞争性吸附所致[21]。在LDH 催化剂表面存在大量羟基,水分子通过弱氢键吸附在催化剂的表面上,弱化了水分子对活性位的竞争影响;此外,水滑石结构上特殊的臭氧分解机理,维持了高湿度条件下的臭氧分解活性。

图2 制得的LDH 催化剂臭氧催化分解性能Figure 2 Ozone catalytic decomposition performance of asprepared LDH catalysts (reaction conditions: ozone feed gas concentration 28.96 mg/m3,catalyst mass 0.15 g,mass space velocity 600000 mL/(g·h),temperature: 30 ℃,RH > 90%)
2.2 催化剂表征分析
2.2.1 XRD 分析
通过XRD 研究了催化剂的晶相结构,如图3所示。结果表明,实验合成了LDH 结构催化剂,其结晶度从高到低的顺序为:Ni3Mn-LDH > Ni3Fe-LDH > Co3Fe-LDH > Ni3Co-LDH。合成的样品基本上为纯相的水滑石,无杂峰。其对应的标准PDF 卡片分别为JCPDS no.38-0715、JCPDS no.40-0215、JCPDS no.50-0235 和JCPDS no.40-0216。以Ni3Fe-LDH 为例,在11.4°、22.9°、60.5°、61.7°处的衍射峰,分别对应Ni0.75Fe0.25(CO3)0.125(OH)2·0.38H2O的(003)、(006)、(110)、(113)晶面。
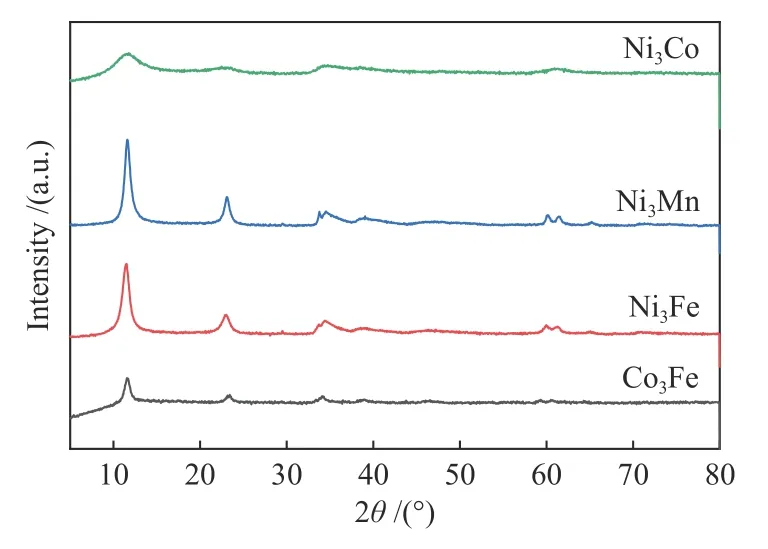
图3 合成LDH 催化剂的XRD 谱图Figure 3 XRD patterns of as-synthesized LDH catalysts
2.2.2 FT-IR 分析
采用红外透射谱图对合成的水滑石催化剂的结构和官能团进行了分析,如图4所示。在3420cm-1存在羟基的伸缩振动,表明具有丰富的表面羟基。1630cm-1处的峰可归因于层间水的-OH弯曲振动,表明水嵌入样品层中。1384和1060cm-1为振动峰,745cm-1处的峰归因于金属与氧的结合M-O(M=Ni 和Co)[22-24]。由上分析可知,层间阴离子以为主。结合XRD 和FTIR 谱图,可证实合成的四种催化剂均为层间阴离子以碳酸根为主的水滑石。
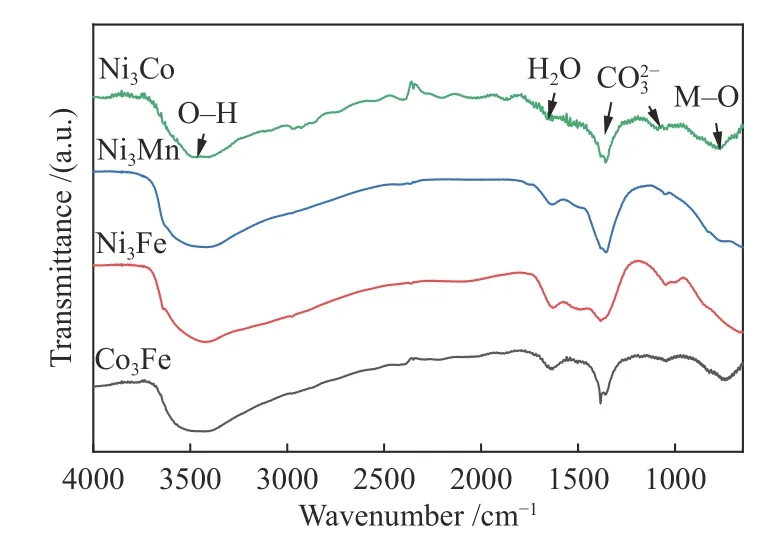
图4 制得LDH 催化剂的红外光谱谱图Figure 4 FT-IR spectra of as-prepared LDH catalysts
2.2.3 拉曼光谱测试
拉曼光谱有助于进一步探究材料的结构特征,它揭示了不同样品的差异。如图5 所示,低波数700 cm-1以下区域多为金属氧化物中金属-氧键的振动。制得的四种材料都分别在400-500 cm-1和500-600 cm-1存在振动峰。其中,Ni3Fe-LDH在大约454 和530 cm-1处特征峰分别代表Fe3+/Ni2+-O-Ni2+和Fe3+-O-Fe3+的振动(O 为-OH)[25,26];Ni3Co-LDH 大约在471 和529 cm-1处的峰,分别对应Ni-O 和Co-O 的振动[27];Co3Fe-LDH 在450 和514 cm-1处的谱峰,可归因于金属-OH振动[28];Ni3Mn-LDH 除了在大约462 和532 cm-1处出现Ni-O 振动以外;还在610 cm-1处显示第三个振动峰Mn-O[29]。不同金属离子的半径不同,金属-氧键距离呈现出不同的分布,对称性降低。与碳酸盐沉淀法合成的掺杂金属Ni、Fe 的Co3O4[30]进行比较,Ni3Co-LDH 和Co3Fe-LDH 在400-600 cm-1处的两个峰可归属于Co3O4的Co-O 振动。上述峰为水滑石结构特征峰[20],结合XRD 和FT-IR 分析进一步证明了水滑石相的形成。
多学科诊疗模式源于20世纪90年代,由美国率先提出,目前仍是全世界最新、最流行的诊疗模式。但这种诊疗模式在中山医院已有多年历史。
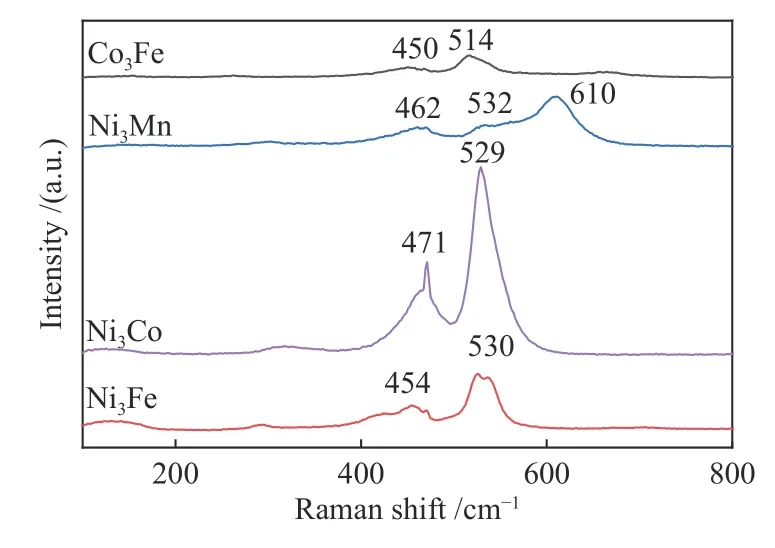
图5 不同LDH 催化剂的Raman 光谱谱图Figure 5 Raman spectra of different LDH catalysts
2.2.4 比表面积和孔径分布
合成的四种LDH 催化剂的N2吸附-脱附等温线,如图S3 所示。通过BET 和BJH 法,计算得到其比表面积、孔容和孔径,结果见表1。可以看出,所有样品的吸附-脱附曲线呈Ⅳ型等温线,存在明显的滞后环[31],表明上述材料以介孔结构为主。此外,由于存在较大的介孔,还表现出H3 型滞后环。由其织构参数可以看出,Ni3Co-LDH 比表面积最大,表面羟基含量更多,活性更好。Ni3Mn-LDH 比表面积最小,因此活性较差。Ni3Fe-LDH 的孔径最大,Ni3Mn-LDH 孔径最小,但其孔容最大。结合其臭氧催化分解性能,可以看出,尽管高比表面积的催化剂暴露更多的活性位点,但其不是LDH 反应活性的决定因素。

表1 不同LDH 催化剂的织构参数Table 1 Texture properties of different LDH catalysts
2.2.5 SEM 分析
对合成催化剂的微观形貌进行了SEM 表征,结果如图6 所示。由图6 可以看出,合成的四种水滑石结构催化剂具有不同的表面形貌,催化剂孔结构以二次堆积孔为主。Ni3Co-LDH 表面具有丰富的针状结构,可能是导致其具有高的比表面积的原因;Ni3Fe-LDH 主要以不规则片状构成;Co3Fe-LDH 则是不规则片层结构堆积而成;Ni3Mn-LDH 具有类似Co3Fe-LDH 的片层结构,但其片层更厚,因此,其比表面积较低。

图6 不同LDH 催化剂的扫描电镜照片Figure 6 SEM images of different LDH catalysts
2.2.6 表面化学态(XPS)与反应机理
对于气固臭氧催化分解反应,催化反应性能依赖于催化剂表面金属元素价态。分别将Ni3Co-LDH 和Ni3Fe-LDH 反应前后的催化剂进行了XPS表征。在干、湿气条件下反应前后的Ni3Co-LDH和Ni3Fe-LDH 的Ni 2p进行分析。如图7(a)和7(b),反应前后Ni2+并没有发生变化,具有优异的稳定性。这一结论在Wang 等[32]的研究中也得到了证实。而Ni 与Fe、Co、Mn 具有不同的结合能(图7(c)),催化剂活性差异可能是由M3+(Co、Fe、Mn)的掺杂导致。

图7 (a):新鲜及反应后Ni3Co-LDH 的Ni 2p XPS 谱图;(b):新鲜及反应后的Ni3Fe-LDH Ni 2p XPS 谱图;(c):不同LDH 新鲜催化剂的Ni 2p XPS 谱图;(d):Ni3Mn-LDH 的Mn 3s XPS 谱图Figure 7 (a): Ni 2p XPS spectra of fresh and used Ni3Co-LDH;(b): Ni 2p XPS spectra of fresh and used Ni3Fe-LDH;(c): Ni 2p XPS spectra of different LDH catalysts;(d): Mn 3s XPS spectrum of Ni3Mn-LDH
图8 表明,催化剂Ni3Fe-LDH中Fe 在反应前后以Fe3+形式稳定存在,如表2 和图9(d),新鲜的Ni3Co-LDH 的Co 以结合能781.3和782.0 eV 的Co3+(36.99%)和Co2+(63.01%)两种价态存在,再结合图10 可知反应过程中Co2+被氧化减少,Co3+含量增多。这表明部分Co2+的存在有利于臭氧分解反应,Co2+在臭氧反应气氛下会被氧化成Co3+;Co2+/Co3+在反应后比值下降,表明Co2+/Co3+是激活臭氧的电子供体。Co2+/Co3+氧化还原循环的存在,丰富了臭氧催化分解反应路径,因此,其具有更高的臭氧分解稳定性;Ni3Mn-LDH 催化剂的Mn 2p1/2和Mn 2p2/3的峰分别位于654.0 和642.3 eV(图11),归因于样品中Mn3+的存在[33-35]。由于Mn存在多种价态,通过 Mn 2s的XPS 谱图(见图7(d))计算平均价态(AOS)。公式如下[36]:
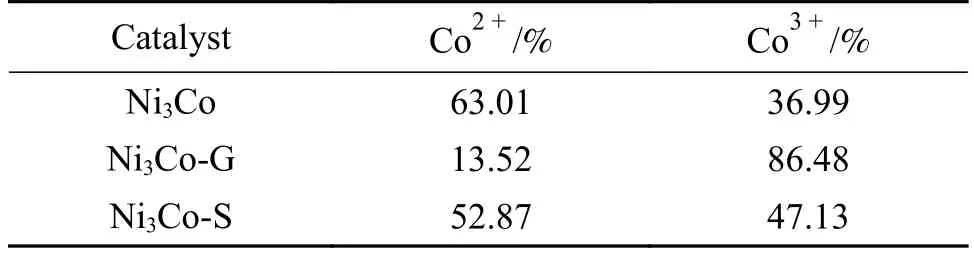
表2 Ni3Co-LDH 反应前后的Co2+ 与Co3+ 含量Table 2 Co2+ and Co3+ contents in fresh and spent Ni3Co-LDH samples
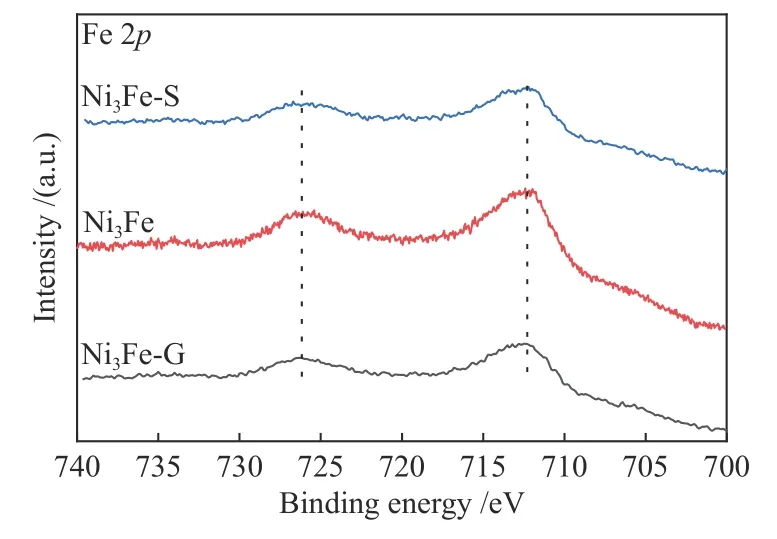
图8 新鲜及反应后Ni3Fe-LDH 的Fe 2p XPS 谱图Figure 8 Fe 2p XPS spectra of fresh and used Ni3Fe-LDH

图9 (a):新鲜Ni3Fe-LDH 的O 1s XPS 谱图;(b):RH < 5%失活的Ni3Fe-LDH 的O 1s XPS 谱图;(c):RH > 90%失活的Ni3Fe-LDH 的O 1s XPS 谱图;(d):新鲜Ni3Co-LDH 的Co 2p XPS 谱图Figure 9 (a): O 1s XPS spectrum of fresh Ni3Fe-LDH;(b): O 1s XPS spectrum of Ni3Fe-G;(c): O 1s XPS spectrum of Ni3Fe-S;(d): Co 2p XPS spectrum of fresh Ni3Co-LDH

图10 反应后Ni3Co-LDH 催化剂的 Co 2p XPS 谱图Figure 10 Co 2p XPS spectrum of used Ni3Co-LDH
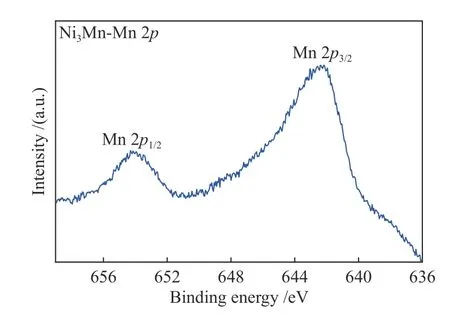
图11 Ni3Mn-LDH 的Mn 2p XPS 谱图Figure 11 Mn 2p XPS spectrum of Ni3Mn-LDH
式中,AOS 为表面Mn 的平均价态,ΔΕS为Mn 3s的分裂能。计算结果为3.21。反应过程Mn3+被氧化成Mn4+,催化剂随之失活。
为了更好地分析催化剂表面氧物种,对四种不同催化剂的O 1s进行分峰处理,见表3。如图9(a)-(c)所示,新鲜的Ni3Fe-LDH 催化剂表面吸附氧(Oads)、表面晶格氧(Olat)和表面羟基(OOH)的含量分别为67.61%、3.41%和28.98%;在RH <5%条件下反应24 h 后失活的催化剂Oads、Olat和OOH的含量分别为43.74%、2.57%和53.69%;反应后的Ni3Fe-LDH 催化剂表面吸附氧减少,表面羟基明显增多;RH > 90%条件下失活的催化剂Oads减少、Olat和OOH的含量都增加。由此可以推测,在含水气氛下,臭氧分解主要遵循H 转移氧化还原机理[32],具体反应路径如下:

表3 不同催化剂的表面氧物种分析Table 3 Quantitative analysis of surface oxygen species on different catalysts
如图12 所示,臭氧首先和两个羟基(M-OH)反应形成一个氧气分子和一个水分子;然后,两个水分子又吸附在四个金属(M-O)上,形成一个氧气分子,四个羟基配位恢复。因此,反应前后羟基氧变化不明显。
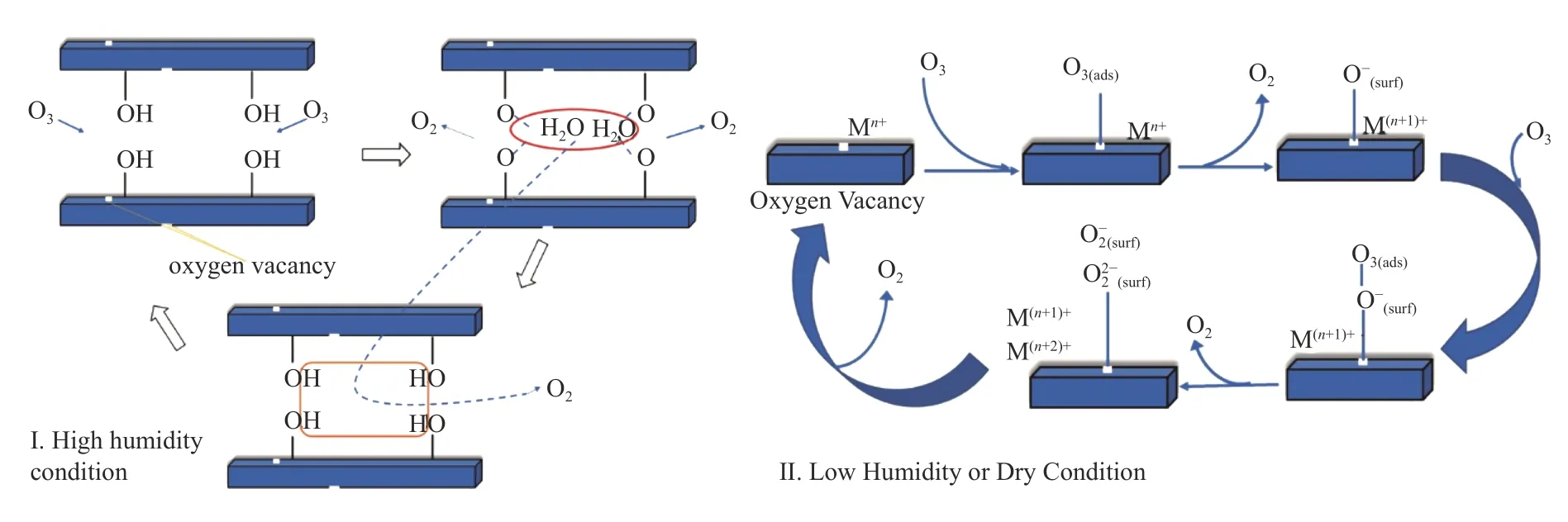
图12 LDH 催化剂上臭氧催化分解反应机理示意图Figure 12 Schematic diagram of ozone catalytic decomposition mechanism over hydrotalcite-based catalyst
在低湿度或干气条件下,初始时臭氧分解遵循H 转移氧化还原机理,但由于反应气氛中没有水分子的及时补充,主要的活性位应是氧缺陷。随着反应的进行,如果吸附氧物种如 O-2、O22-不能及时脱附或再生,氧缺陷(Oads)减少,OOH含量增加[3]。
2.2.7 TG 分析
图S4 为制得的催化剂的热重(TG)曲线。结果表明存在两个失重阶段。在30-200 ℃的质量损失归因于水滑石结构中物理吸附水和层间水的脱附,在200-400 ℃的质量损失源于水滑石层间的羟基脱除和层间碳酸根分解。400 ℃以后继续升温逐渐趋于平衡[37],此时得到的是稳定的金属氧化物。不同金属组成的LDH 热重曲线趋势基本相同,Ni3Fe-LDH 的失重比例最大,Ni3Co-LDH的失重率最小。不同催化剂晶型结构几乎没有差异,在XRD 谱图中也得到了证实。
3 结论
本实验通过共沉淀法合成了Ni3Fe-LDH、Ni3Co-LDH、Ni3Mn-LDH、Co3Fe-LDH 四种水滑石结构催化剂,并考察了其在高湿度和低湿度条件下的臭氧催化分解性能。结合XRD、Raman、XPS等表征发现,在反应条件为30 ℃、相对湿度RH <5%、WHSV=600000 mL/(g·h)的低湿度条件下,Ni3Fe-LDH 催化剂催化臭氧性能最好,与其Fe3+良好的结构稳定性及其表面吸附氧有关;而在反应条件为30 ℃、相对湿度RH > 90%、WHSV=600000 mL/(g·h)的高湿度条件下,由于大量表面羟基,Ni3Co-LDH 催化剂催化性能最好。相对而言,Ni3Co-LDH 在高低湿度条件下都表现出优良的臭氧分解性能。水滑石结构催化剂的合成,为提高耐水性能的臭氧分解催化剂开发提供了思路。

