长孢轮枝菌犜犪狇Man MGB探针实时荧光PCR快速检测方法
段维军 李雪莲 吕燕等



关键词 长孢轮枝菌;实时荧光PCR; TaqMan-MGB探针;
检测
中图分类号:S 432.44 文献标识码:A DOI:10.16688/j.zwbh 2022332
长孢轮枝菌Verticillium longisporum(C.Stark) Karapapa,Bainbr.&Heale,隶属于真菌界Fungi,子囊菌门Ascomycota,盘菌亚门Pezizomy-cotina,粪壳菌纲Sordariomycetes,肉座菌亚纲Hypocreomycetidae,小丛壳目Glomerellales,不整小球囊菌科Plectosphaerellaceae,轮枝菌属Verti-cillium[1]。该病菌目前主要分布于欧洲的瑞典[2]、德国[3]、英国[4-5]、比利时[6]、俄罗斯[7],北美洲的美国[8]和加拿大[3],亚洲的日本[9]和中国[10]。该病菌在中国局部分布,是近年新发现的植物病害。
长孢轮枝菌其主要寄主作物是十字花科植物,主要包括油菜Brassica napus、甘蓝B.oleracea、花椰菜B.oleracea var. botrytis、卷心菜B.oleraceavar.capitata、抱子甘蓝B.oleracea var. gemmif-era、苤蓝B.oleracea var. gongylodes、芜菁B.ra-pa、辣根Armoracia rusticana等[9,11-16]。在有些植物中,长孢轮枝菌与其近似种大丽轮枝菌Verticilli-um dahliae没有显著的寄主划分,例如油菜[2]、辣根[17]、甜菜Beta vulgarjs[18]、拟南芥Arabidopsis thaliana[19-20]和萝卜Raphanus sativus[21]。致病性测定研究表明,长孢轮枝菌也可侵染非十字花科植物[22],如小麦Triticum aestivum、豌豆Pisum sati-vum和燕麦Avena sativa[23]。
轮枝菌常随植物商品贸易而广泛扩散,如大丽轮枝菌[24],长孢轮枝菌不产生气生孢子,是一种土传病原菌[14],从该病菌A1/D1株系的广泛传播可以看出,人类活动在病害传播过程中起了重要作用[24]。对病菌进行有效快速检测是防范其危害的重要技术基础,可为抗病育种、植物检疫、防治效果评价等多项工作提供技术手段。目前,针对长孢轮枝菌的主要检测鉴定方法多为形态学结合DNA序列分析方法等[2-5,7,10,15],费时费力,且灵敏度不高。和常规PCR检测方法相比,实时荧光PCR检测方法具有检测时效快、特异性强、灵敏度高和易于操作等优点。本研究以长孢轮枝菌的actzn序列片段为靶标,建立了基于Taq Man-MGB探针的长孢轮枝菌快速检测方法,为长孢轮枝菌的检测提供技术支持。
1材料与方法
1.1供试菌株与引物、探针的设计合成
供试菌株共计46株,分别为:从青海萝卜上分离鉴定的7株长孢轮枝菌(均为A1/D1株系),从荷兰微生物菌种保藏中心获得的2株长孢轮枝菌(CBS 124.64为AID3株系,CBS 110220株系不详),以及一些其他种属的植物真菌37株(表1)。以上菌株均保存于本实验室,采用无菌水保存法保存,备用。
通过分析长孢轮枝菌及其近似种actin基因间的差异,应用Primer Express 3.0软件设计了特异性引物VLAF1(5′-GTGCCGCGGGCAAA-3′)、VLARl(5′-ACCGACAATGGAAGCTTGAAA-3′)以及探针VLAP1(5′-CTCGACATGATCTTTG-3′),预期产物大小为62bp(图1)。引物和TaqMan-MGB探针由上海立菲公司合成。
1.2 DNA提取
1.2.1菌丝DNA提取
用灭菌枪头刮取PDA平板上培养10 d的菌丝体,根据TANBeadPlant DNA Auto Kit操作说明,利用自动化核酸提取仪(ThermoFisher,King-fisher mL型),提取DNA。经超微量分光光度计(ThermoFisher,NanoDrop 2000C型)检测DNA浓度后,保存于-20℃备用。
1.2.2组织样品DNA提取
取萝卜组织约0.1 g,切成细丝状,提取DNA所用设备及试剂盒同1. 2.1。
1.3引物和探针特异性检测
采用10μL扩增反应体系:2×TaqMan Uni-versal PCR Master Mix 5μL,正向引物VLAF1(10μmol/L)0.5μL,反向引物VLAR1(10μmol/L)0.5μL,探针VLAP1(10 μmol/L)0.5μL,模板(供试菌株)DNA 1μL,超纯水2.5μL。以超纯水为空白对照。
反应条件为:95℃10 min;95℃15s,60℃1min,40个循环。
1.4实时荧光PCR体系的优化
1.4.1引物浓度优化
以菌株LV19-5 DNA为模板,正、反向引物浓度分别以0.1μmol/L递增,分别从0.1μmol/L递增至1.0μmol/L,1.3体系中其余各成分浓度保持不变,进行实时荧光PCR扩增,反应条件同1.3。
1.4.2探针浓度优化
以菌株LV19-5 DNA為模板,探针浓度以0.1μmol/L递增,从0.1μmol/L递增至1.0μmol/L,采用1.4.1优化后的引物浓度,1.3体系中其余各成分浓度保持不变,进行实时荧光PCR反应扩增,反应条件同1.3。
1.5灵敏度检测
以菌株LV19-5DNA为模板,用灭菌超纯水将DNA进行10倍梯度稀释,每个梯度进行3次重复,开展灵敏度检测。在10μL反应体系中,DNA含量分别为10ng、1.0ng、100pg、10pg、1.0pg。利用优化后的引物及探针浓度进行实时荧光PCR,反应条件同1.3。
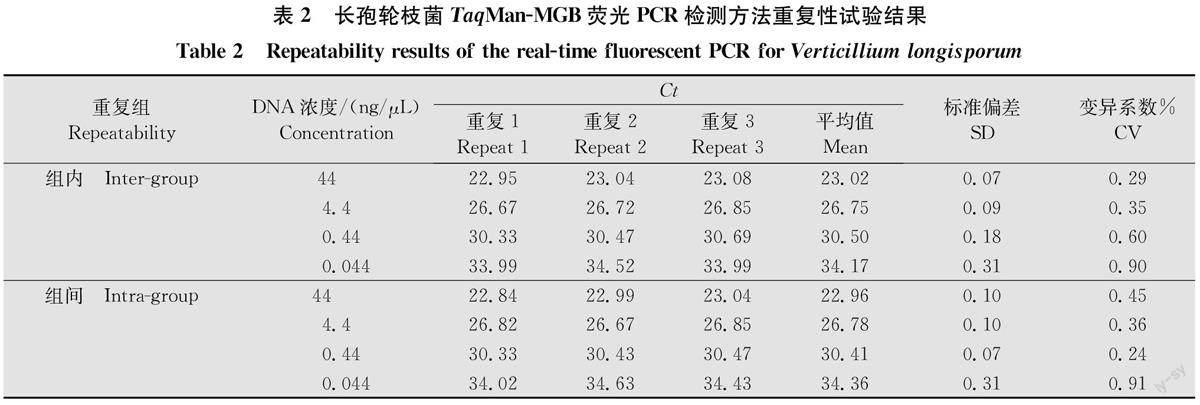
1.6重复性试验
以菌株LV19-5 DNA为模板进行重复性检测。用上述相同的条件分别进行3次独立重复试验,分析组内、组间差异。计算平均Ct值、标准偏差(standard deviation,SD)和变异系数(coefficient of variation, CV)。
1.7样品检测
选取2021年10月从青海采集的萝卜黑心病感病样品7份,从宁波菜市场购买的健康萝卜13份,参照1.2.2方法,取萝卜肉质组织提取DNA,进行实时荧光PCR检测,检验该方法的实用性。
2结果与分析
2.1特异性检测
在相同条件下,对表1中参试的9株长孢轮枝菌及其他37株菌进行实时荧光PCR检测。结果显示,所选取的来自不同地理来源的9株长孢轮枝菌可扩增产生明显扩增曲线,无扩增的为其他参试菌及空白对照。说明此实时荧光PCR检测方法具有较好的种特异性。
2.2实时荧光定量PCR的体系优化
2.2.1引物浓度优化
引物浓度优化试验结果显示,在0.1~0.8μmol/L范围内,Ct值随着浓度增大而减小,而△Rn值随着浓度增大而增大。因此,引物的最佳浓度为0.8μmol/L,此时Ct值最小,并且△Rn值达到最大(图2)。
2.2.2探针浓度优化
在确定最佳引物浓度的基础上进行探针浓度优化试验。结果显示,在0.1~0.8μmol/L范围内,Ct值随着浓度增大而减小,而△Rn值随着浓度增大而增大。因此,探针的最佳浓度为0.8μmol/L,此时Ct值最小,并且△Rn值达到最大(图3)。
2.2.3优化后的反应体系
通过优化引物和探针浓度,得到优化后的反应体系:2×TaqMan Universal PCR Master Mix5μL,引物VLAR1(10μmol/L)0.8μL,引物VLAF1(10μmol/L)0.8μL,探针VLAP1(10μmol/L)0.8μL,DNA 1μL, ddHO補足10μL。
2.3灵敏度检测及标准曲线的建立
灵敏度试验结果表明,本研究所建立的实时荧光PCR最低检测限是10 pg(图4)。
通过实时荧光PCR检测已知浓度梯度的总DNA,发现DNA浓度越高,Ct值越小,3个平行试验结果显示,所得标准曲线为y=-3.66x+26.83(R=0.9984),x代表DNA浓度的对数,y代表相应的Ct值(图5)。
2.4重复性检测
以菌株LV19-5 DNA的4个浓度(44、4.4、0.44、0.044ng/μL)进行组内、组间重复测定,各3次。通过统计分析可见,组内、组间重复CV值均小于1%,分别为0.29%~0.90%,0.24%~0.91%,说明本研究所建立的针对长孢轮枝菌的Taq Man-MGB荧光PCR检测方法,具有较好的重复性和稳定性。
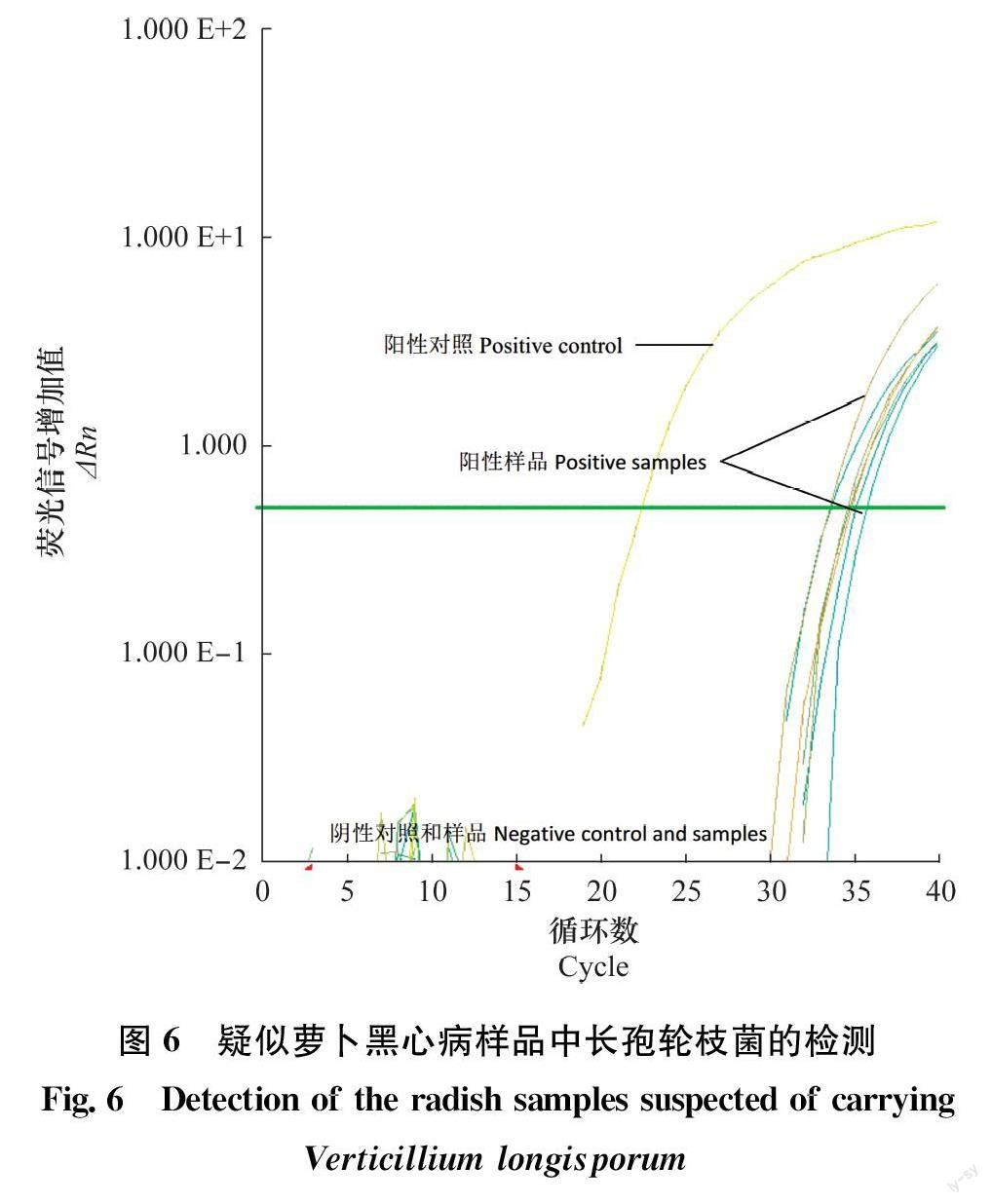
2.5实际样品检测
对收集的20份样品进行检测,其中7份为表现萝卜黑心病症状样品,13份为健康的萝卜样品。以LV19-5菌株的DNA为阳性对照。结果表明,20份样品中,7份疑似长孢轮枝菌感染的萝卜样品DNA扩增后均可产生荧光信号,健康萝卜未产生荧光信号(图6)。
3结论与讨论
轮枝菌是一类土传真菌,主要引起植物的维管束病害,可导致严重经济损失。在缺乏寄主情况下,病原菌可通过产生微菌核、休眠菌丝和厚垣孢子等休眠结构在土壤中长期存活,以度过不良环境[25],由于没有有效的化学药剂,且缺乏有效的抗病品种,生产中往往难以控制轮枝菌所造成的病害[14,26]。开展严格检疫是防范重要病原菌传播扩散乃至危害的重要技术手段,而这有赖于准确、特异、灵敏的检测方法。在对该属真菌分类学研究尚未查清之前,国内外针对轮枝菌中的重要病原菌如黑白轮枝菌V.albo_atrum[27-29],大丽轮枝菌V.dahliae[29-38],长孢轮枝菌V.longisporum[36]和三体轮枝菌V.tri-corpus[39-40]等已经开展了一些研究,建立了基于PCR、实时荧光PCR等技术的检测方法。但是,上述检测方法多建立在轮枝菌分类问题有效解决之前,因此准确性难以得到有效保证。例如黑白轮枝菌,V.albo-atrum sensu lato目前已被划分为3个不同的物种V.alfalfae、Vnonalfalfae和V.albo-atrum sensu stricton[15,41]。又如,长孢轮枝菌在很长一段时间被认为是大丽轮枝菌的一个变种即大丽轮枝菌长孢变种Verticillium dahliae var.longispo-rum C.Stark,其分生孢子中DNA含量接近大丽轮枝菌的1.75倍[2,42-43],长孢轮枝菌在细胞骨架蛋白(ACT)、翻译延伸因子(EF)、3-磷酸甘油醛脱氢酶(GPD)、线粒体草酰乙酸转运蛋白(OX)和色氨酸合酶(TS)等多个基因上具有等位基因,但在核糖体基因内转录间隔区(ITS)片段上不具有等位基因[16]。很明显,在获得上述科学认知之前,针对轮枝菌不同种类的快速检测存在很大局限性。
迄今为止,国内外已经开展了一些长孢轮枝菌检测技术的研究。Yu等[44]采用核糖体小亚基mtSSU rDNA和细胞色素b(cytochrome b)序列分析等方法,将北京地区大白菜黄萎病病原鉴定为长孢轮枝菌,并根据其核糖体ITS序列设计了特异性引物HWl-F/HW1-R,建立了该病菌的快速检测方法,但特异性研究中未能包括长孢轮枝菌近似种,如V.alfalfae、V.nonal falfae等,因此其特异性难以保证。Banno等[9]根据ITS、mtSSU-rDNA、cyto-chrome b、交配型(mating type)基因序列,结合RAPD研究,将日本群马县的甘蓝Brassica olera-cea var.capitata黄萎病病原鉴定为长孢轮枝菌。苗增建等[10]采用形态学与ITS序列分析相结合的方式,鉴定出引起青海省萝卜黑心病的病原为长孢轮枝菌、三体轮枝菌和瓜小织球壳菌Plectos phae-rella cucumerina。吕燕等[45]采用形态学特征观察结合多基因序列分析,进一步将青海地区萝卜黑心病病原鉴定为长孢轮枝菌A1/D1株系。此类检测鉴定方法建立在序列分析基础之上,耗时较长。In-derbitzin等[46]建立了针对多种轮枝菌的特异性PCR和多重PCR检测方法,但对于亲缘关系较近的种类,如大丽轮枝菌和长孢轮枝菌,无法通过特异性PCR区分,需要采用多重PCR才能加以区分,但该研究未对反应灵敏度进行研究,同时也仅采用分离株提取的DNA进行了验证,未在实际带菌样品中开展检验。特异性和灵敏度,是研究快速检测技术中最重要的考虑因素[47]。本研究在以ITS为靶标设计引物和探针过程中发现,长孢轮枝菌及其近似种ITS片段高度相似,难以设计出合适的引物和探针,因此改用actin片段作为靶标。为了设计出能够有效区分长孢轮枝菌的引物和探针,借鉴了轮枝菌属最新分类成果,在引物探针设计阶段对长孢轮枝菌及其近似种的多个基因序列进行了比对,最终筛选出变异区段较大且位于共同亲本A1的actin片段为靶标设计引物探针,该靶标存在于长孢轮枝菌3种不同株系中,且同源性较高,保证了特异性。同时,为了验证其特异性,我们在特异性试验中收集了长孢轮枝菌近似种V.alfae、V.nonalfalfae、V.albo-atrum、V.dahliae和V.tricorpus作为参试菌株,同时也包括了原划分在轮枝菌属中的Gibellu-lopsis nigrescens等菌株进行特异性验证。另外,供试长孢轮枝菌中包括了长孢轮枝菌模式分离物CBS124.64。特异性试验结果表明,本文所建立的实时荧光PCR方法对不同寄主来源或株系的长孢轮枝菌菌株均可检出,其他近似种或供试菌均不能检出,具有较好的种间特异性和种内一致性。
大多数已知的真菌杂交种报道与植物病原体相关,由于全球贸易等人类活动影响,造成以前地理隔离的物种之间相互接触并杂交,从而产生毒力增强和寄主范围扩大的新病原[48-49]。长孢轮枝菌起源于3次不同时间的进化。长孢轮枝菌有1个共同的亲本A1和3个不同的亲本D1、D2和D3,其中A1和D1亲本可能来源于未知的轮枝菌种类,而D2和D3亲本则可能源自大丽轮枝菌[16]。长孢轮枝菌不同株系间分离物存在致病性差异,如A1/D1和A1/D3株系常见于多种十字花科植物上。A1/D1株系主要报道于油菜上,在油菜上致病力最强[50]。目前分布在法国、德国、瑞典、加拿大、美国和日本等国家,但是在油菜以外的寄主植物上也有相关发生报道[25,45,51-52]。而A1/D2株系则仅见于辣根上[16,53]。本研究所设计的检测靶标位于长孢轮枝菌A1亲本分支actin序列上,由于长孢轮枝菌3种不同株系均含有Al亲本序列,因此,本研究所建立方法能够检测目前已经报道的长孢轮枝菌全部3个株系。在今后的研究工作中,可进一步针对长孢轮枝菌不同株系特征序列设计检测方法,以实现针对特定株系的快速检测。
Taq Man实时荧光PCR是在普通PCR的基础上,增加1条荧光标记的特异性探针,在完全封闭条件下通过荧光信号的强弱来实时监测PCR扩增产物量的变化,具有特异性强、灵敏度高、操作简单和不易污染等优点[54-55]。截至目前,国内外已有大量采用实时荧光PCR技术检测植物病原真菌的相关研究与报道[33-34,36,38,47,55-57],其灵敏度通常在1 pg左右。本研究中检测灵敏度为10pg,与以往针对其他病菌actin片段为靶标的检测灵敏度相似[55],可能是由于本检测靶标位置在A1亲本的actin片段上,而該片段在长孢轮枝菌DNA中拷贝数较低故含量较低所致。DNA检测靶标片段对于灵敏度有较大影响,通常基于ITS片段的引物探针灵敏度更高,例如向日葵黑茎病菌Plenodomus lindquistii灵敏度可达0.1 pg[47],杜鹃花枯萎病菌Ovulinia azaleae可达0.25 pg[56],这可能是ITS片段在上述病菌DNA中拷贝数较多,因此相对含量较高所致。应用此方法,可成功从疑似受长孢轮枝菌侵染的萝卜样品中检测鉴定长孢轮枝菌。本检测技术也可进一步用于其他疑似受该菌侵染样品的检测,如土壤、种子和植株等受侵染样品。
利用TaqMan-MGB探针,本研究首次建立了长孢轮枝菌实时荧光PCR快速检测方法,通过优化反应体系,确定了最佳引物终浓度和探针终浓度,均为0.8μmol/L;通过灵敏度试验,确定了最低检测限量为10μL反应体系中总DNA含量10 pg。该方法重复性好、稳定性高,检测过程完全闭管,无PCR后续处理需求,减少了PCR产物的污染,简化了检测步骤,节约了时间,具有良好的应用前景。

