脱水预处理对冷冻紫薯花色苷损失的影响
周新群,冯欣欣,3,孙 洁,孙 静,范新光,江利华,刘帮迪,*
(1.农业农村部规划设计研究院,北京 100125;2.农业农村部产地初加工重点实验室,北京 100121;3.河北工程大学生命科学与食品工程学院,河北 邯郸 056038;4.鲁东大学食品工程学院,山东 烟台 264025)
紫薯(Ipomoea batatas(L.) Lam)属旋花科番薯属草本植物,因其果肉呈紫色或深紫色,又称黑薯。紫薯含有多种生物活性成分,如花青素、膳食纤维、维生素、微量元素、类胡萝卜素等,具有抗氧化、抗肿瘤、增强免疫力等功能。2019年中国紫薯种植面积为18.5万 hm2,总产量为455.1万 t[1]。中国作为紫薯生产大国,以紫薯为原料的加工产品除涉及全粉、粉丝粉条等传统品类外,还有多种新型食品产品,如紫薯饮料、速冻薯块、速冻薯泥、淀粉糖等。此外,由于紫薯富含花色苷,具有抑菌性、调节肠道菌群和抗氧化等功能性,被开发为多种功能性产品。并且相较于蓝莓、葡萄、桑葚等小浆果原料花色苷,紫薯中花色苷在加工和贮藏过程中更稳定[2],因此,从紫薯中提取花色苷的产业正逐年扩大。目前,从紫薯中提取的花青素已广泛应用于食品、药品、化妆品等领域。2012—2017年,中国紫薯提取的花青素产量由1 201 t增长至5 662 t,产值在紫薯加工行业中的占比超过15%[3]。
花青素又称花色素,是一种天然色素,大多以糖苷的形式存在,单个糖苷形式的花青素称为花色苷。常见的花色苷有矢车菊色素(cyanidin,cya)、天竺葵色素(pelargonidin,pel)、飞燕草色素(delphindin,del)、芍药色素(peonidin,peo)、牵牛花色素(petunidin,pet)和锦葵色素(malvidin,mal)。花青素作为水溶性色素,属于类黄酮化合物,具有多种生物功效[4],但是花青素在食品加工和贮藏过程中极易受热、光照、氧化等条件的影响而发生变色和降解[5]。因此,提升花青素在加工过程中的稳定性成为近年来学术界的研究热点。
紫薯是甘薯的特殊品种,在中国华南地区广泛种植,主要采收季节在7月底至8月初,由于采收时环境湿度和温度高、微生物代谢活跃,且收获过程中易造成机械损伤导致受微生物侵染,因此易出现生理病害和腐烂现象[6]。此外,受环境湿度和温度的影响,夏季采后的紫薯呼吸强度和体内代谢水平较高,在窖藏过程中紫薯营养物质和生物活性物质大量被消耗[7]。这些问题都容易造成紫薯花青素在贮藏中大量损失,从而降低紫薯花青素的经济价值。因此,为了延长紫薯花青素提取加工的周期,保证紫薯原料的花青素含量,目前经常采用冷冻贮藏的方式进行原料贮藏[8]。
果蔬冻藏是指采用-18 ℃普通冷冻(缓冻)或低于-38 ℃的快速冷冻(速冻)方法将果蔬物料冻结,并在-38~18 ℃低温条件下贮藏的方法[9]。冻藏可以延长果蔬的贮藏期,最大程度保持果蔬食用品质和营养价值,达到果蔬加工标准和满足食用需求[10-11]。但也有大量研究表明,水分含量高的果蔬在-18 ℃缓冻结晶过程中,其细胞溶液水分凝结成大型的尖状冰晶,对果蔬细胞膜和细胞壁结构造成不可逆破坏,使果蔬在冷冻融化后出现汁液流失的现象,并出现以氧化褐变为代表的一系列劣变反应,从而使其丧失加工和食用价值[12]。在速冻条件下,当冻结速度过快时,果蔬细胞结构会由于低温断裂现象受到破坏[13]。此外,由于速冻成本高、能耗大,果蔬产业的实际加工过程中多采用普通缓冻[14]。脱水冷冻是一种新型的果蔬冻结贮藏方式,它是指先采用不同的物理方式对果蔬进行脱水处理,达到理想的水分含量后再进行冷冻贮藏。脱水冷冻作为一种新型协同冷冻技术已经开始被广泛研究,其中渗透脱水作为冷冻前预处理方式因具有多项优点而被广泛研究[15-16]。渗透脱水能够降低果蔬物料含水量,可以明显保护果蔬原有细胞结构;同时渗透脱水能够缩小产品体积,降低包装、配送和储存成本;渗透脱水还能够降低冷冻过程的热负荷,从而节约能源[17]。此外,许多研究表明,渗透脱水可以显著地保护果蔬物料冷冻和解冻循环中的感官、物理、化学性质和生物活性物质[18]。张雅丽等[19]的研究表明,串枝红杏通过低温真空干燥脱水预处理冻融加工成杏干后,在色泽、质地和生物活性等指标显著高于其他处理组。Fong-In等[20]研究了渗透脱水对荔枝冷冻后品质的影响,结果表明渗透脱水预处理显著降低了荔枝的含水量、汁液流失率和微生物负荷,提高了荔枝的硬度和可溶性固形物的含量。但有关富含花青素果蔬原料的脱水冷冻技术还缺乏详细研究。
花青素提取行业是典型的高价值农产品加工行业,具有广阔的发展前景和极高的利用价值,紫薯块作为提取花色苷的原料,贮藏过程中保持花色苷较高的保留率很重要,因此需要考虑预处理对贮藏过程中花色苷的保留能力。但是目前对于紫薯块冻藏过程中花色苷损失规律方面缺乏研究,亟需一种能提高花色苷保留率的技术来指导行业发展。本实验以紫薯为研究对象,探究紫薯块在不同的脱水预处理后、冷冻贮藏后等加工阶段花青素的损失情况,并分析其主要损失原因,以期能够为花青素提取行业的原料贮藏提供一些基础理论和技术可行性支撑。
1 材料与方法
1.1 材料与试剂
新鲜越南紫薯,购自北京新发地果蔬批发市场。
果糖-葡萄糖溶液 广州双桥有限公司;花青素检测试剂盒 上海信帆生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力试剂盒、总抗氧化能力试剂盒、过氧化物酶(peroxidase,POD)和多酚氧化酶(polyphenol oxidase,PPO)试剂盒 南京建成生物工程研究所;甲醇(色谱纯) 德国Merck公司;甲酸(色谱纯) 美国Sigma-Aldrich公司;盐酸(优级纯)信阳市化学试剂厂;花青素标准品 美国Sigma公司。
1.2 仪器与设备
101型电热鼓风干燥箱 北京中兴伟业仪器有限公司;TGL-16gR高速冷冻离心机 上海安亭科学仪器厂;Rapid-TA质构仪 上海腾拔仪器科技有限公司;HH-2A电热恒温水浴锅 上海贝仑仪器设备有限公司;THZ-C恒温振荡器 豪城实验仪器制造有限公司;UV-755B紫外分光光度计 上海佑科仪器仪表有限公司;PAL-1糖度仪浙江托普仪器有限公司;NR110色差仪 深圳3NH科技有限公司;D800相机 日本尼康公司;A11 basic液氮研磨机 德国IKA公司;DW-86L388J低温保存箱青岛海尔医疗股份有限公司;BC/BD-300DT调温冷藏箱美菱股份有限公司;LAC-350 HPY-2 人工气候箱上海龙跃仪器设备有限公司;QTRAP 6500+液相色谱-串联质谱仪 美国SCIEX公司;5424R离心机 德国Eppendorf公司;MM400球磨仪 德国Retsch公司;MIX-200多管涡旋振荡器 上海净信实业发展有限公司;KQ5200E超声清洗仪 昆山市超声仪器有限公司。
1.3 方法
1.3.1 样品制备及处理
实验前24 h将新鲜紫薯表面污泥洗净,自然条件下晾干备用。使用刀具将新鲜紫薯切成半径为(2.0±0.1)cm、厚度为(1.5±0.1)cm的均匀扇形紫薯块,为避免氧化褐变,切块后的紫薯及时进行后续脱水实验。实验设置4 个处理组:普通缓冻组(CK组)、自然风干处理组(VD组)、热风干燥处理组(HD组)、渗透脱水处理组(OD组)、真空冷冻干燥处理组(FD组),使用不同脱水方式将紫薯块统一脱掉原有水分含量的30%,具体处理方法如下。
CK组:紫薯块不进行任何处理;VD组:将紫薯块置于托盘内,放进条件为模拟常温25 ℃状态下环境的人工气候箱进行自然风干;HD组:将紫薯块置于托盘的铁网上,在温度55 ℃、风速1.0 m/s条件下进行热风干燥脱水;OD组:将紫薯块放入容器(料液比1∶5、体积分数为45%果糖-葡萄糖溶液)中,置于(25±1)℃水浴锅内进行渗透脱水,渗透脱水的样品在到达数据测定点时,将样品捞出,使用蒸馏水冲洗表面糖液,并用纸巾拭干;FD组:紫薯块切分好之后进行低温预冻,处理条件为:温度-80 ℃、时间1 h。FD的条件为:温度(-52±1)℃、真空度为1 Pa。在进行实验之前,要先将机器进行0.5 h的预冷,再将要进行脱水处理的样品放入其中,进行脱水实验。
在冷冻前,CK组以鲜样形式进行指标检测,VD组、HD组、OD组、FD组预处理脱水后部分样品直接进行各项指标的检测;各组样品用聚乙烯包装袋密封包装后置于-18 ℃冰箱冻藏,6 个月后取出,于(25.0±0.5)℃水浴锅中充分解冻后对各项指标进行测定。
1.3.2 花色苷含量的检测
1.3.2.1 样品前处理
将各处理组液氮磨粉的样品融化并涡旋混匀后,移取50 μL(相当于50 μg),溶解于950 μL提取液(50%甲醇-水溶液,含0.1%盐酸)中,涡旋5 min、超声5 min,离心(12 000 r/min、3 min),吸取上清液,用微孔滤膜(0.22 μm)过滤,并保存于进样瓶中,用于液相色谱-串联质谱分析。
1.3.2.2 液相色谱-串联质谱条件
色谱条件:色谱柱:ACQUITYBEHC18(2.1 mm×100 mm,1.7 μm);柱温 40 ℃;流动相A为超纯水(加入0.1%的甲酸),流动相B为甲醇(加入0.1%的甲酸);流速0.35 mL/min。
质谱条件:电喷雾离子源(electrospray ionization,ESI),温度550 ℃,正离子模式下质谱电压5 500 V,气帘气压力35 psi。根据优化的去簇电压(declustering potential,DP)和碰撞能(collision energy,CE),对每个离子对进行扫描检测。
1.3.2.3 花色苷含量的计算
样品中的花色苷含量按公式(1)计算。
式中:ρ为样品积分峰面积比值代入标准曲线方程得到的质量浓度/(ng/mL);V为提取时所用溶液的体积/μL;m为移取的样品质量/mg。
1.3.3 汁液流失率的测定
称量冻藏后解冻前样品的质量(m0/g)和充分解冻后样品的质量(m1/g),按照公式(2)计算汁液流失率。
1.3.4 细胞膜透性的测定
参考孙文丽等[21]的方法,略作改动测定细胞膜透性。果实膜透性用相对电导率来表征。称取3 g紫薯块,切成1 mm厚的薄片,放入50 mL离心管中并注入去离子水定容至25 mL,摇床110 r/min振荡30 min,测定电导率(P1/(μS/cm));煮沸10 min后迅速冷却,加水至原刻度,再测定溶液电导率(P2/(μS/cm));同时,测定去离子水的电导率(P0/(μS/cm))。相对电导率按公式(3)计算。
1.3.5 色泽的测定
选取不同处理组的紫薯块,用色差仪测定冻融后(L*、a*、b*)和未冷冻样品的色泽参数,其中L*值代表亮度,a*值代表红绿度,b*值代表黄蓝度,色差值ΔE计算如公式(4)所示。
1.3.6 过氧化物酶和多酚氧化酶活力的测定
POD和PPO活力使用相应试剂盒进行测定。
1.3.7 DPPH自由基清除能力和总抗氧化能力的测定
DPPH自由基清除能力和总抗氧化能力使用相应试剂盒进行测定。
1.4 数据处理与分析
实验进行3 次重复,采用Excel 2010软件对数据进行整理和作图,利用SPSS 18.0软件进行方差分析和多重差异显著分析,P<0.05表示具有显著差异;利用Hiplot平台(https://hiplot.com.cn/)进行聚类热图分析。
2 结果与分析
2.1 脱水预处理对冻融紫薯块外观的影响
紫薯块在冷冻融化后的外观如图1所示,与新鲜紫薯相比主要是色泽发生变化。新鲜紫薯的外观色泽鲜亮,饱和度较高。冷冻融化后HD和VD处理组紫薯块出现明显的褪色现象,部分果肉呈现白色,这可能是花色苷被降解和酚类物质被氧化所致[22],但OD和FD处理后紫薯块色泽饱满,与初始新鲜样品色泽较为接近。
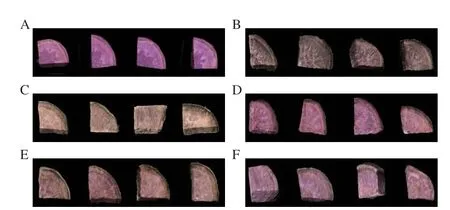
图1 脱水预处理对冷冻紫薯块融化后外观的影响Fig.1 Effect of dehydration pretreatment on appearance of frozen purple sweet potato cubes after melting
由表1可知,经脱水处理后,紫薯块的L*值相较于初始样品有明显提高,这可能是因为紫薯块表面花色苷在不同脱水处理后出现降解或溶解于溶液中,导致色泽变浅。冻融后,CK组L*值显著低于其他处理组且低于初始样品,可能是因为冻融过程中冰晶细胞结构发生破坏,细胞内花色苷和多酚类物质接触氧气和相关酶的可能性加大,导致果蔬颜色发生较大的变化[23]。OD组脱水处理后和冻融后L*值均最高。
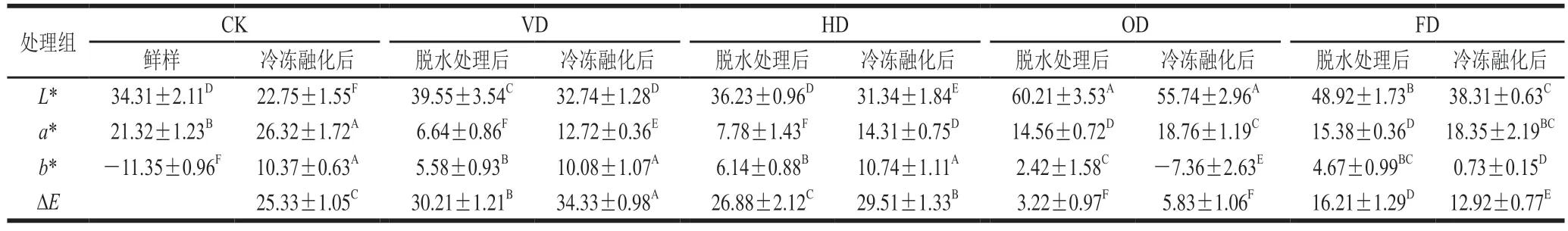
表1 不同处理下紫薯L*、a*、b*值变化Table 1 Changes in L*,a* and b* values of purple sweet potato under different treatments
与CK组相比,脱水处理和冻融后的OD组a*值和b*值最接近新鲜样品,其次为FD组,表明渗透脱水处理和真空冷冻干燥处理对紫薯块的色泽有良好的保持效果。HD组、VD组脱水处理后a*值和b*值变化较大,这是因为冻融后紫薯的细胞结构被破坏,细胞原有维持的区室状态也受损,PPO和POD参与到花色苷的生物降解中,造成紫薯颜色变深[24]。孙利娜[25]在利用酶法生产草莓浑浊汁的研究中发现,多酚化合物的氧化缩合及抗坏血酸的氧化分解反应是草莓汁色泽变化的主要原因。脱水处理和冻融后OD组色差值最小,分别为3.22和5.83,此处理组最接近新鲜样品,其次为FD组。HD组、VD组脱水处理后的色差值较大,说明色泽变化较大。
2.2 紫薯块在脱水冷冻过程中花色苷组分的变化
紫薯块在冻融后的色泽变化主要是细胞内富含的花色苷变化所致。如表2所示,新鲜紫薯块中共鉴定出6 类含有花色苷官能团的物质,分别是芍药花色素、矢车菊素、天竺葵素、矮牵牛素、飞草燕素和锦葵色素。其中,紫薯块中花色苷含量大于5 μg/g的有6 种,分别是芍药花色素-3,5,3’-O-三葡萄糖苷、芍药花色素-3-(咖啡酰葡萄糖基葡萄糖苷)-5-葡萄糖苷、芍药花色素-3-O-半乳糖苷、芍药花色素-3-O-阿魏酰-槐糖苷-5-葡萄糖苷、芍药花素-3-O-对羟基苯甲酰槐糖-5-葡萄糖苷和矢车菊素-3,5,3’-O-三葡萄糖苷,这6 种花色苷占紫薯块总花青素含量的90.76%。

表2 紫薯加工过程中花色苷成分含量的变化Table 2 Changes in anthocyanin contents during purple potato processing
通常来说,花青素在冷冻贮藏过程中十分稳定,许多研究指出蓝莓、黑莓、树莓的花青素在冷冻过程中含量基本不变化[26-28]。这主要是由于冷冻过程植物组织和内溶物质十分稳定,但脱水和冻融均可能导致花青素被氧化分解[29]。紫薯块预处理和冻融后各组分花色苷损失率如表3所示,27 种花色苷在脱水预处理和冻融过程中都出现不同程度的损失。在脱水冻融后,除OD组外,其他组别都呈现出大幅度下降的趋势。从表3可以看出,脱水处理后VD组、HD组、FD组花色苷总量损失率分别为41.01%、33.58%、34.19%。热风干燥处理在脱水过程中伴随较高的加工温度,花色苷在55 ℃高温下稳定性受到较大的影响,降解速率增加,反应速率加快,造成花色苷含量下降[30]。真空冷冻干燥是一种能够有效保护植物化合物和生物活性物质的脱水方式[31],但本研究中的真空冷冻干燥处理后花色苷损失率较高,可能是因为真空冷冻过程破坏了紫薯块的细胞结构。Mujumdar等[32]的研究表明,果蔬物料没有充分预冻时,可能造成植物细胞结构被大冰晶破坏,导致抗氧化活性、生物活性物质损失。冻融后VD、HD、FD组花色苷的损失率相较于脱水后分别增加了39.78、35.90、22.58 个百分点,而OD组样品在冻融后的花色苷损失率较脱水处理后仅增加了5.00 个百分点,研究结果说明渗透脱水处理可以最大程度地保护紫薯花色苷在冻融过程中的损失。
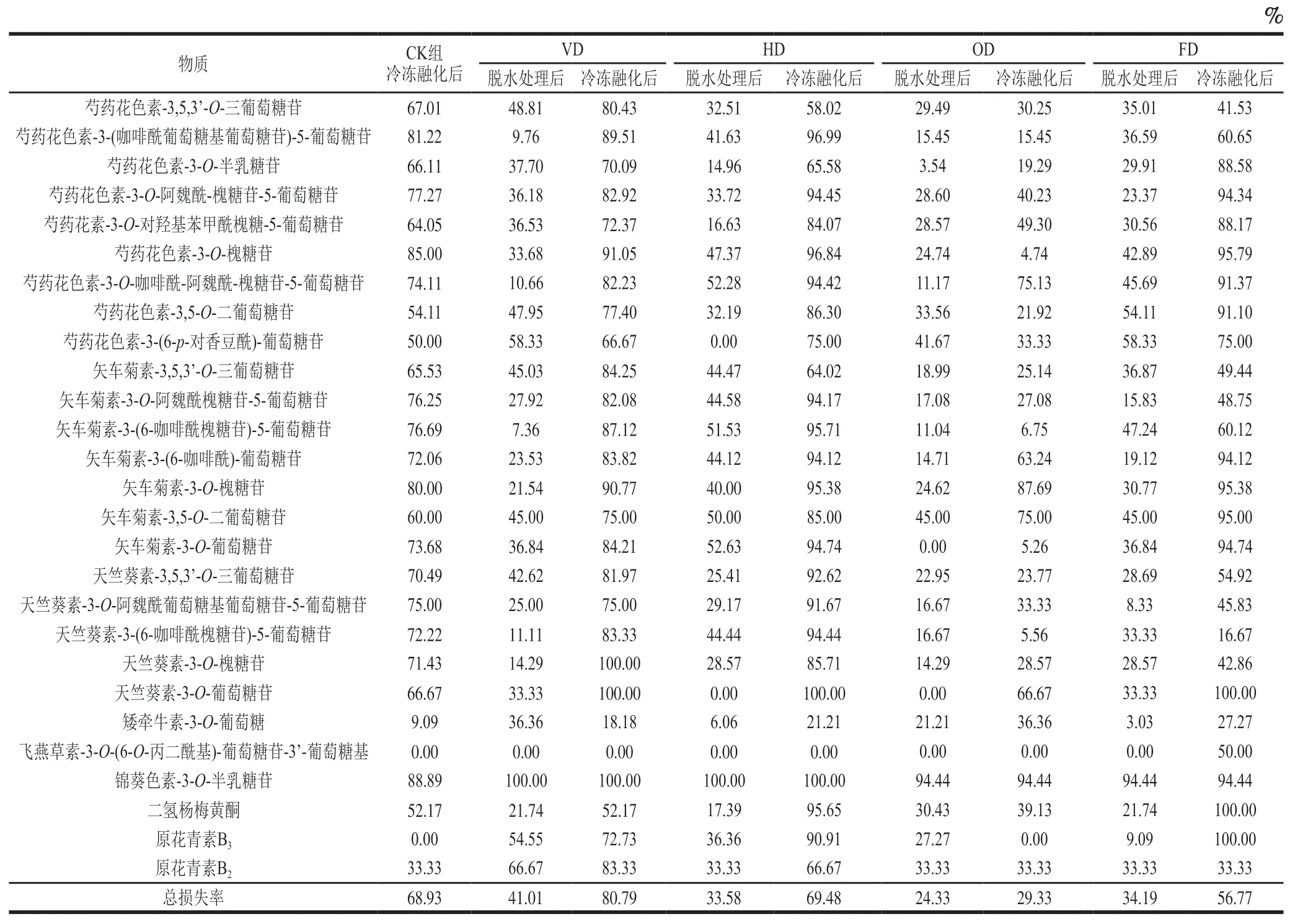
表3 紫薯加工过程中花色苷损失率Table 3 Loss rates of anthocyanins in purple sweet potato during processing
对紫薯块中最主要的6 种花色苷损失率进行分析发现,脱水处理后,紫薯块中主要花色苷在VD组损失率最高,OD组损失率最低。CK组冻融后大部分花色苷损失率高于50%,这是由于冷冻会诱导冰晶的形成,冰晶生长造成细胞损伤,冻融后花色苷随汁液流失流出紫薯块组织外,造成大量损失[33]。OD组冻融后大部分花色苷组分损失率均在60%以下,赵东宇[34]的研究表明添加单糖、还原性糖能够很大程度上抑制花色苷的降解。FD组冻融后有4 种芍药花色素和4 种矢车菊素类花色苷损失率高于90%,而天竺葵素-3-O-葡萄糖苷、二氢杨梅黄酮、原花青素B3则全部损失。这可能是冻融过程中,果蔬细胞破裂促使POD、PPO、花色苷和其他酚类(如儿茶酚、绿原酸、咖啡酸)充分接触,在此条件下,PPO开始分解花色苷,POD能将介质中的酚氧化为醌,醌与花色苷反应产生褐色缩合物[34]。除OD组外,其他处理组紫薯块中含量最高的两种花色苷(芍药花色素-3,5,3’-O-三葡萄糖苷和矢车菊素-3,5,3’-O-三葡萄糖苷)在经过脱水预处理和冷冻融化后损失率均超过40%。
2.3 脱水预处理对冷冻紫薯块汁液流失率和细胞膜透性的影响
汁液流失率是评价食品冻融后的一项重要品质,冷冻食品在冻融后由于细胞被破坏存在明显的汁液流失现象,极大程度影响了食品的食用、加工品质,并且在融化过程中会伴随着花色苷等营养物质的流出[35]。由图2可知,CK组汁液流失率最高,为16.74%,OD组汁液流失率显著低于其他处理组,这是因为CK组紫薯块水分含量高于其他脱水预处理组,且普通缓冻冻结时间长,冷冻速率低,在冷冻过程中生成的冰晶大且分布不均匀,导致冻融后紫薯块的细胞壁结构变得疏松,组织内空隙增大,弱化了细胞的持水能力,提高了汁液流失率,而OD预处理组汁液流失率最低。陈童等[36]研究发现,渗透脱水预处理可以在很大程度上保护西兰花在冷冻融化过程中细胞的完整性,可能是因为糖分子进入细胞组织内部,有效束缚了水分子,增强了果蔬组织的细胞刚性,减少了汁液流失。HD和VD组汁液流失率无显著差异。
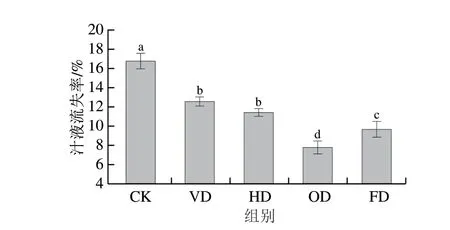
图2 脱水预处理对冷冻紫薯块汁液流失率的影响Fig.2 Effect of dehydration pretreatment on juice loss rate of frozen purple sweet potato cubes
果实细胞受到损伤后会影响细胞膜透性,细胞膜透性越高说明细胞内电解质外渗越严重,细胞膜功能性就越弱。在冷冻过程中果实细胞结构被冰晶尖刺结构破坏,细胞膜也会受到一定程度的损伤[37]。Parniakov等[38]的研究表明,冷冻前脱水是有效减少冰晶对细胞破坏的手段,但也有研究指出不当的脱水过程可能会在预处理加工环节破坏果蔬细胞[39]。如图3所示,紫薯块经不同脱水预处理后细胞膜透性均有所升高,其中FD组紫薯在脱水预处理后细胞膜透性最高,相对电导率达11.22%,显著高于其他3 个脱水处理组(P<0.05)。冻融后,未经脱水预处理的CK组相对电导率高达48.21%,说明果肉细胞电解质大量外渗,导致细胞膜透性增加,这与CK组汁液流失和花色苷损失结果相印证。脱水预处理可以有效抑制紫薯块冻融后细胞膜透性的降低,其中OD组效果最好,冻融后相对电导率仅为13.52%,显著低于其他组别(P<0.05)。
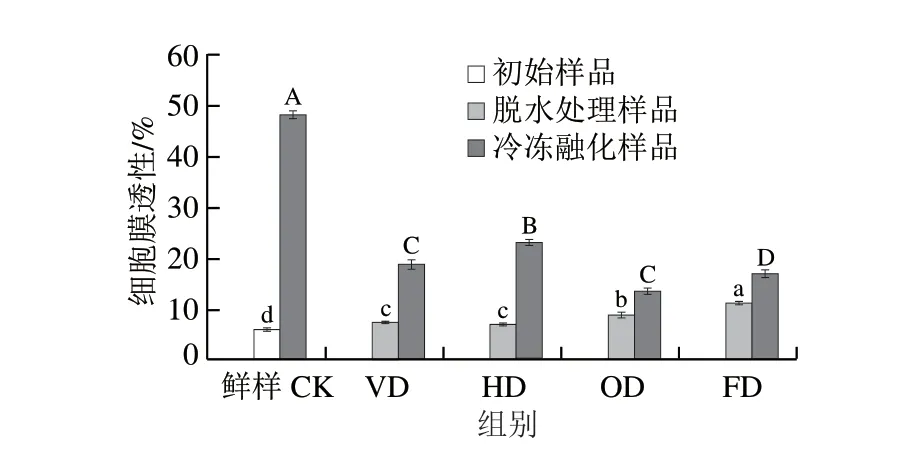
图3 脱水预处理对冷冻紫薯块细胞膜透性的影响Fig.3 Effect of dehydration pretreatment on cell membrane permeability of frozen purple sweet potato cubes
2.4 脱水预处理对冷冻紫薯块PPO和POD活力的影响
果蔬在加工过程中极易发生生物活性物质损失的现象,而这种现象通常与酶促氧化反应有关[40]。PPO和POD是造成酶促氧化褐变的主要酶类,因此果蔬加工中通常使用多种物理化学方式对以PPO和POD为代表的酶进行活性抑制处理,从而保护色泽、质地和生物活性物质等[40]。如图4所示,和鲜样相比,HD、OD和FD脱水处理均能够有效抑制PPO和POD的活力。但VD脱水处理后紫薯的POD、PPO活力分别为364.55、300.44 U/g,显著高于鲜样和其他脱水处理组(P<0.05)。这可能是因为自然风干的状态下,紫薯块除频繁与氧气接触外,还易受到外界环境刺激,如微生物侵染,导致紫薯块发生一系列生化代谢反应,从而提高了POD、PPO活力[41]。而OD脱水的高渗透压环境、HD脱水的高温环境和FD脱水的低温低压环境均能够有效抑制紫薯块中的酶活性。

图4 脱水预处理对冷冻紫薯块POD(A)和PPO(B)活力的影响Fig.4 Effect of dehydration pretreatment on POD (A) and PPO (B)activity of frozen purple sweet potato cubes
冷冻融化过程能够明显激活紫薯的POD和PPO,所有组别紫薯块在冻融后的这两种活力均高于脱水处理后的紫薯块。大量果蔬冷冻的相关研究均表明,冷冻过程中冰晶破坏植物细胞,释放并激活位于不同细胞器内的酶[42]。CK组冻融后POD和PPO活力较冷冻前分别上升45.16%和189.84%。OD脱水处理可以最有效地抑制紫薯冻融后的PPO和POD活力上升现象。OD组冻融后POD和PPO活力最低,是因为渗透脱水可以保持细胞结构的完整性,降低PPO和POD与氧气、底物接触的概率,从而有效抑制酶活力。de Ancos等[43]对‘Rubi’和‘Zeva’两个品种红树莓进行冷冻研究发现,有效减少冻融中氧化还原系统酶(PPO)的释放,可以减少红树莓花青素的降解。FD处理虽然可以抑制紫薯块PPO活力在冻融后上升,但却无法抑制POD活力。
2.5 脱水预处理冷冻对紫薯块抗氧化活性的影响
抗氧化活性是评价食品营养性和功能性的一项指标,许多果蔬冷冻研究指出果蔬的总抗氧化能力、花青素含量和冷冻品质之间存在极高的相关性[44-46]。果蔬的抗氧化活性主要来源于体内的抗氧化酶系和非酶生物活性物质[47],因此抗氧化活性可以良好地反映紫薯在脱水预处理、冷冻融化过程对紫薯花色苷的保护能力。
从图5A中可以看出,经过4 种脱水预处理后紫薯的DPPH自由基清除能力均显著低于鲜样(P<0.05)。脱水处理后VD组和HD组DPPH自由基清除能力最小,无显著性差异,OD组和FD组DPPH自由基清除能力相对较强,略低于鲜样。说明渗透脱水处理和冷冻干燥处理均能够有效保护紫薯块的活性氧清除系统,从而减少在脱水预处理过程中紫薯花色苷被氧化的可能性。在冷冻融化后,OD组DPPH自由基清除能力最强,达到226.73 μg/g;VD组和CK组DPPH自由基清除能力大幅度下降,与鲜样相比,损失率分别为34.71%、47.17%。
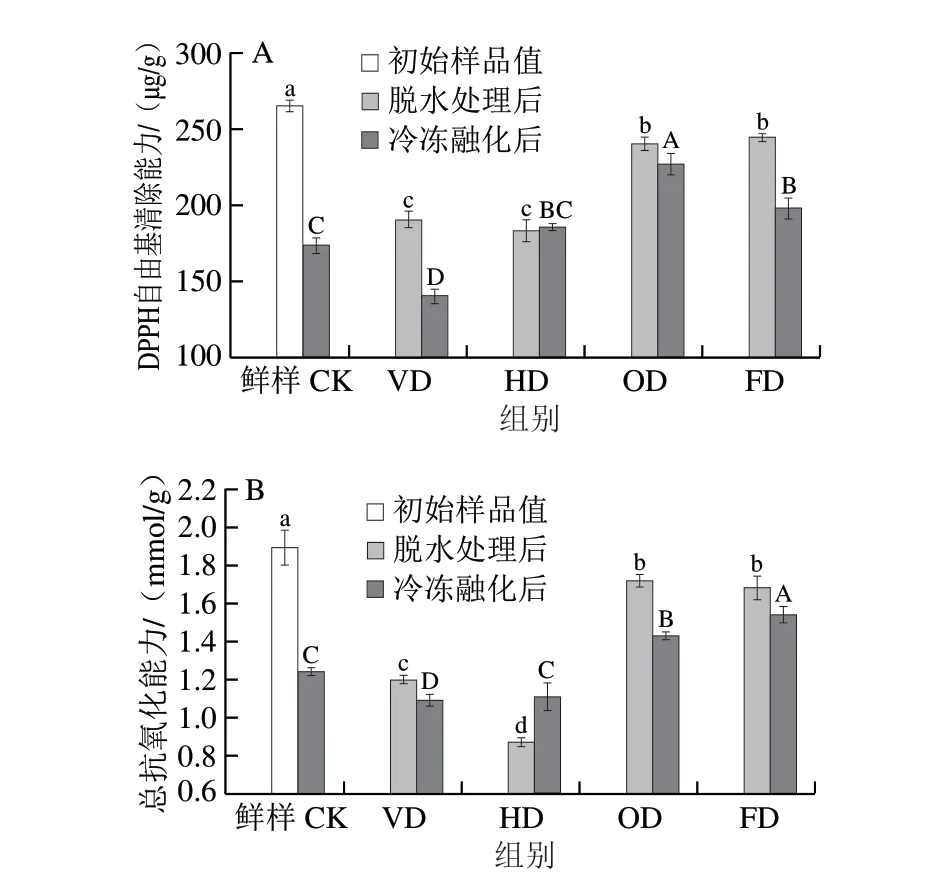
图5 脱水预处理对冷冻紫薯块DPPH自由基清除能力(A)和总抗氧化能力(B)的影响Fig.5 Effect of dehydration pretreatment on DPPH free radical scavenging ability (A) and total antioxidant capacity (B) of frozen purple sweet potato cubes
紫薯块的总抗氧化能力整体变化趋势和DPPH自由基清除能力相同(图5B)。经脱水处理后,OD处理组和FD处理组样品的总抗氧化能力最强,且没有显著差异(P>0.05)。HD脱水处理由于热环境对紫薯总抗氧化活性影响最大,总抗氧化能力降低最多,和鲜样相比下降了53.97%。仇胜囡[48]的研究指出,植物的活性氧清除体系酶活性通常较低且不稳定,因此HD热处理会导致活性氧清除体系中的酶活性大幅降低,不利于保护紫薯花青素。除HD处理组外,其余各组在冻融后,总抗氧化能力继续下降,但FD和OD组抗总氧化能力显著高于其他组别(P<0.05)。Santarelli等[49]对冷冻苹果的研究也指出,在冷冻前增加预处理可以有效减缓苹果的抗氧化活性损失。
2.6 脱水预处理和冷冻过程对紫薯块花色苷损失影响的相关性热图分析
图6是对各组紫薯中检测出的27 种花色苷损失率与其他指标变化率之间的相关性分析热图,色块颜色越接近,表示指标间的相关性越强;红色越深,表示花色苷损失率越高。紫薯块在冻融过程中花色苷更容易损失,冻融后仅有OD组位于鲜样的右方,属于花色苷损失较少的组别。FD、VD、HD和CK组的花色苷损失主要受POD活力、PPO活力、汁液流失率、DPPH自由基清除能力的影响。FD组融化后(FD-R)花色苷的损失率主要受POD、PPO活力的影响。曹少谦等[49]在研究蓝莓花色苷-PPO-邻苯二酚的偶合氧化反应机制时发现PPO与酚类底物结合产生醌类物质,这些物质再通过耦合氧化反应导致蓝莓花色苷降解,从而最终导致果实或者相关产品的褐变。VD和FD处理不能有效地抑制紫薯块冻融后的PPO和POD活力,导致紫薯块花色苷在冻融过程中出现较多的酶促氧化损失。CK组花色苷在冻融过程中损失受汁液流失率的影响较大,由于普通缓冻冷冻时间长,形成体积过大且不规则的冰晶,冰晶在生长过程中刺破细胞膜,导致冻融后细胞结构不再完整,同时加剧汁液流失[50]。因此紫薯块中的花色苷可能随汁液流失或被氧化分解。OD处理相对于其他处理组在冻融后最有效地保留了花色苷组分,可能是渗透脱水处理过程中糖溶质和紫薯块细胞组织中水分进行置换,起到了冷冻保护剂的作用,可以抑制冰晶在细胞间形成,减少花色苷随着汁液流失流出[51]。此外,渗透进入紫薯内的少量糖也可能改变花色苷共存物性质,从而保护花色苷活性,曹雪慧等[52]研究表明糖分子进入到蓝莓组织内部可以有效抑制花色苷的降解,对花色苷起到保护作用。
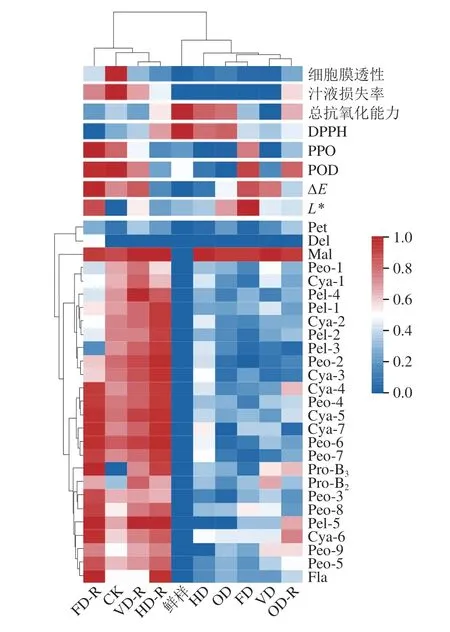
图6 紫薯花色苷损失率与其他理化指标变化率之间的相关性热图分析Fig.6 Heat map analysis between anthocyanin loss rate and other physicochemical index change rate of purple sweet potato
3 结论
OD预处理可以有效减少紫薯块花色苷在脱水预处理过程中和冷冻融化后的损失,有效抑制紫薯块中含量最高的两种花色苷(芍药花色素-3,5,3’-O-三葡萄糖苷和矢车菊素-3,5,3’-O-三葡萄糖苷)的损失。OD预处理可以通过降低紫薯细胞被破坏程度和汁液流失率,从而降低冻融过程中的酚酶与氧气、底物接触的几率,进而有效抑制PPO、POD的活力,保护紫薯块的DPPH自由基清除能力和总抗氧化活力,在冻融过程中增强紫薯块花色苷的抗氧化能力。因此,渗透脱水是4 种脱水预处理中最有效保护花色苷的方式,适合以提取花青素为目的紫薯的长期贮藏。但渗透脱水如何通过改变紫薯细胞间水态分布从而减少冰晶对细胞的破坏机制尚待进一步研究。

