耐碳青霉烯类大肠埃希菌耐药基因及同源性分析*
宋瑞雅,闫小利,陈清清,林玉玲
福建医科大学附属泉州第一医院检验科,福建泉州 362000)
大肠埃希菌为最常见的肠道杆菌,是医院及社区获得性感染的主要病原菌之一,大肠埃希菌感染可引起严重疾病,包括肺炎、脑膜炎、败血症等[1]。由于抗生素的广泛使用,碳青霉烯类耐药肠杆菌(CRE)不断增加,CRE造成的感染增加了临床的治疗难度,病死率较高,达30.0%~80.0%[2-3]。大肠埃希菌在CRE中占比排名第二,仅次于肺炎克雷伯菌[4-5]。因此,本研究对耐碳青霉烯类大肠埃希菌(CRECO)菌株的临床资料、耐药表型及耐药基因的ST型进行监测分析,从而为临床合理用药及感染防控提供依据。
1 材料与方法
1.1菌株来源 收集2017-2021年福建医科大学附属泉州第一医院临床分离的大肠埃希菌,剔除同一患者检出的重复菌株。共获得6 609株大肠埃希菌,其中CRECO 36株,对成功复苏的15株CRECO进行耐药基因及同源性分析。
1.2主要试剂和仪器 MH琼脂平板、血琼脂平板(广州市迪景微生物科技有限公司);MALDI-TOF微生物质谱仪(布鲁克公司);Phoenix100全自动细菌鉴定仪及药敏系统(美国BD公司);DYY-6C型电泳仪(北京六一仪器厂);凝胶成像仪(美国Bio-Rad公司);基因扩增仪(杭州博日科技有限公司);美罗培南、亚胺培南等药物敏感纸片(奥克欧德有限公司);PCR试剂盒(厦门万和信生物科技有限公司);引物(上海生工生物工程有限公司)。
1.3方法
1.3.1细菌鉴定及药敏试验 采用常规细菌培养方法对临床标本进行细菌培养,采用Phoenix100全自动细菌鉴定仪及药敏系统对37 ℃培养24 h的单个菌落进行鉴定及药敏试验,采用质谱仪及Kirby-Bauer(K-B)法进行药敏复核,结果判断遵循美国临床实验室标准化协会(CLSI)2021年版本标准。
1.3.2耐药基因检测 利用煮沸法提取菌株的DNA,PCR扩增碳青霉烯酶(CAPs)基因,引物参照文献[6],见表1。CAPs反应体系(50 μL): Premix Taq 25 μL,模板5 μL,正、反向引物各2 μL,双蒸馏水16 μL。反应参数:94 ℃预变性5 min;94 ℃变性50 s,退火温度50~55 ℃ 30 s,72 ℃延伸30 s,共35个循环;最后72 ℃延伸5 min。经1.2%琼脂糖凝胶电泳观察菌株是否携带待检的碳青霉烯耐药基因。电泳阳性的扩增产物送上海生工生物工程有限公司测序。测序结果经Blast比对分析,确定基因类型。
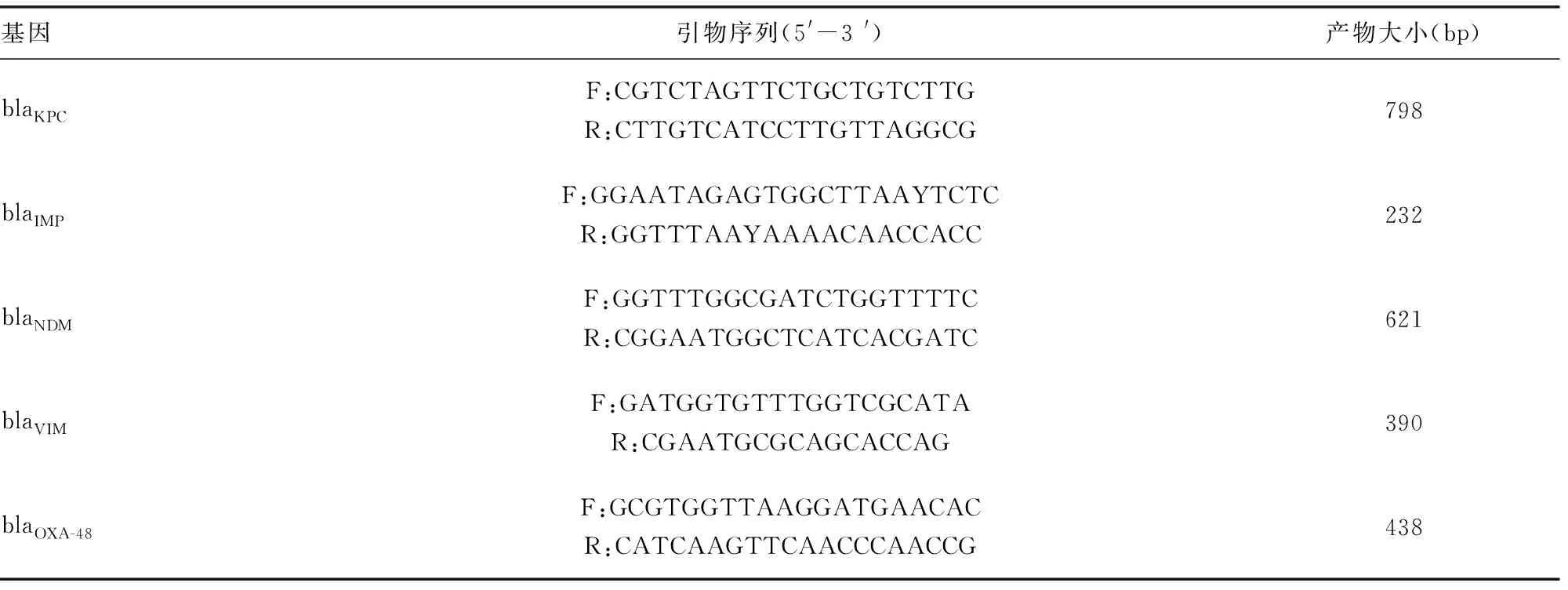
表1 CPAs基因及其引物
1.3.3多位点序列分型(MLST) 提取菌株的DNA,PCR扩增大肠埃希菌7个管家基因(adk、 fumC、icd、purA、gyrB、recA、mdh),引物设计参考MLST网站(http://mLst.ucc.ie/mLst/dbs/Ecoli)。反应体系(50 μL):Premix Taq 25 μL,模板5 μL,正、反向引物各2 μL,双蒸馏水16 μL。反应参数:94 ℃预变性5 min;94 ℃变性60 s,退火温度50~55 ℃ 30 s,72 ℃延伸50 s,共30个循环;最后72 ℃延伸5 min。扩增产物送上海生工生物工程有限公司测序。测序后的结果经过PubMlst数据库比对确定其ST型。
1.4统计学处理 采用WHONET5.6统计软件进行数据分析。计数资料以例数或百分率表示。
2 结 果
2.1菌株来源及分布 患者年龄主要分布在50~60岁及80岁以上,菌株来自17个科室,主要来源于泌尿外科(16.67%, 6/36)和老年病科泌尿外科(13.89%,5/36),其余来自儿科(5.56%,2/36)、感染病科(8.33%,3/36)、胃肠外科(8.33%,3/36)、消化内科(5.56%,2/36)、血液内科(2.78%,1/36)、重症医学科(8.33%,3/36)等。尿液标本分离的CRECO占55.56%(20/36);其次为静脉全血(8.33%,3/36)、脓液(11.11%,4/36)和痰液(8.33%,3/36)等。
2.2CRECO药敏情况 CRECO对8种抗菌药物的耐药率达100.0%,对7种抗菌药物耐药率>50.0%,对阿米卡星的耐药率<20.0%,对多黏菌素耐药率低(2.8%);对替加环素的敏感率高。见表2。
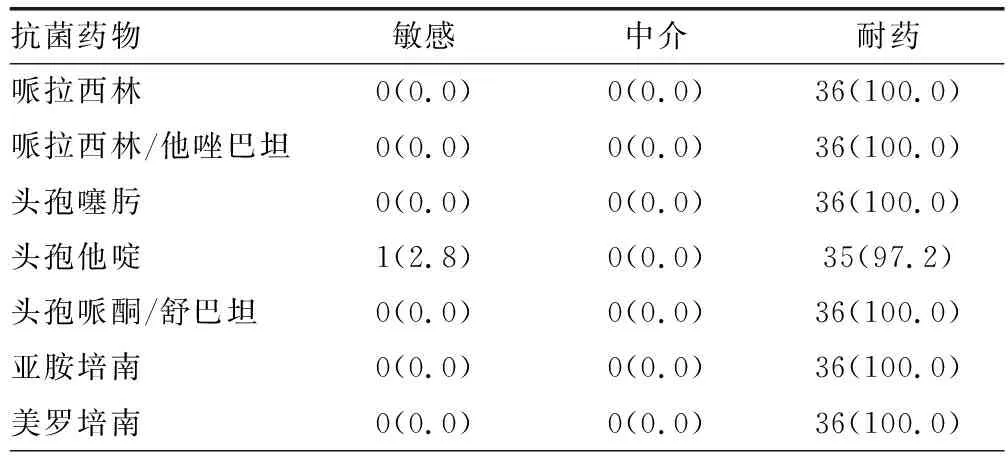
表2 CRECO对抗菌药物耐药率[n=36,n(%)]
2.3CRECO耐药基因分析 通过PCR扩增15株复苏菌株的耐药基因,共得获得14株阳性,有12株携带blaNDM[80%(12/14)],其中11株携带blaNDM-5,1株携带blaNDM-1;2株携带blaKPC[13.33%(2/15)];1株阴性。其余耐药基因(blaIMP、blaVIM、blaOXA-48)均未检出。
2.4MLST分型结果 同源性分析11株携带blaNDM-5基因的CRECO,结果显示大部分属于不同克隆型,ST型有ST156、ST117、ST2177、ST744、ST405和ST10Cplx(复合群),其中3株大肠埃希菌的ST型完全一致,属于ST10Cplx。见表3。

表3 CRECO管家基因和ST分型分析
3 讨 论
本研究中CRECO检出率为0.54%(36/6 609),与中国细菌耐药监测网(http:/ /www.chinets.com /Data /AntibioticDrugFast)报道的2021年全国CRECO平均检出率1.6%及福建地区1.1%基本一致;大肠埃希菌分离率居首位占18.96%,虽然CRECO检出率较低,但由于临床中大肠埃希菌检出基数大及CRECO治疗难度大,临床医生需继续做好CRECO的耐药监测。
本研究中CRECO呈现多重耐药状态:对头孢菌素类、喹诺酮类耐药率>95.0%;对多数抗菌药物耐药率>50.0%;对阿米卡星耐药率为19.4%,高于文献报道的大肠埃希菌对阿米卡星的耐药率(2.2%)[7];对多黏菌素耐药率低,尚未见替加环素耐药情况。目前,多黏菌素及替加环素被认为是对CRE感染临床常选择的治疗药物[8-9]。多黏菌素由于肾毒性和神经毒性较大应用较有限。刘周等[10]报道对多黏菌素B非耐药的CRECO有9.1%菌株携带mcr-9基因,而携带mcr-9菌株均表现为多黏菌素的诱导耐药,临床工作中应注意这一特殊表型。而近年来对替加环素耐药的CRECO也常见报道[11]。刘宇阳等[12]报道CRECO对替加环素异质性耐药率达37.5%。可见CRECO感染的治疗现状不容乐观,因此应对其耐药机制进一步研究,以遏制其耐药的传播。
现有研究认为CRECO的耐药机制主要有4种,其中以产碳青霉烯酶为主要耐药机制[13]。blaNDM和blaOXA-48被认为是碳青霉烯类耐药肠杆菌中产生金属-β-内酰胺酶和碳青霉烯酶的最常见原因[14]。产新德里金属β-内酰胺酶(NDM-1)是大肠埃希菌对碳青霉烯类药物耐药的主要机制之一,NDM-5是NDM-1的变体之一[15]。有研究表明,与NDM-1相比,NDM-5对碳青霉烯类抗菌药物具有更强的水解作用,耐药性更强[16]。本研究检测了15株CRECO碳青霉烯酶编码基因,阳性率为93.33%(14/15),以blaNDM-5检出为主,与文献报道我国CRECO blaNDM-5检出率最高相一致[17-18],可见国内CRECO以产blaNDM-5为流行株。1株试验阴性的原因可能是其他耐药机制引起,如膜孔蛋白缺失、外排泵等,有待进一步研究。利用MLST进行菌株的同源性分析,为进一步证实菌株的克隆型、区分菌株提供了重要依据。有研究报道,携带blaNDM-5的CRECO的ST型以ST410、ST167、ST361、ST405等流行为主[19-20]。本地区则以ST10Cplx流行为主,ST型分布在不同地区有所差异。本研究中携带blaNDM-5的CRECO虽有3株ST型完全一致,但其入院时间未重叠、所在科室不同,属于散发病例。目前,国内外尚未见NDM-5菌株引起暴发的相关报道。余艳等[21]报道,绝大多数blaNDM基因可位于20种不同类型的质粒上,可传递到其他细菌或整合到染色体,而引起blaNDM基因快速而广泛地传播。目前已有多个国家报道新型冠状病毒感染大流行期间CRECO检出率明显增加[22-23],因此应进一步加强对CRECO的监测以防造成CRECO扩散而增加治疗难度。

