川楝素抗肿瘤作用研究进展
刘艺苑,何理斌,高璐,邵喜英,2
1. 浙江中医药大学,浙江 杭州 310053;2. 浙江省肿瘤医院,浙江 杭州 310022
目前癌症已经成为全世界主要死亡原因,对人类健康产生了严重威胁。近半个世纪以来,尽管化疗为数百万患者提供了生存益处,但随之产生的耐药性和副作用限制了化疗的应用。许多天然产品都是从传统中药中开发出来的,中医药具有的悠久临床实践经验和既往病案是筛选抗癌天然化合物的宝贵资源。在过去的几十年里,通过体外、体内和临床研究已经证明了中医药在癌症干预、改善患者生活质量等方面的潜力。
川楝子具有疏肝泄热、行气止痛、杀虫、疗癣的功效,在我国古代常被用作肠道驱虫剂和农业杀虫剂[1-2],在《中华人民共和国药典》中记载为:味苦寒,有小毒,有酸味,归于肝胃小肠经。川楝子中含有多种类型的化合物,包括三萜、木脂素、黄酮、甾体、有机酸及其他类成分,主要成分为柠檬苦素型三萜[3]。川楝素是从川楝子和苦楝皮的根、皮中提取到的主要活性成分之一。川楝素(TSN,C30H38O11)的化学结构和性质如图1 所示。药理方面包括驱蛔杀虫、抗肉毒、抗肿瘤、抗病毒、对神经肌肉接头的作用、抗氧化、呼吸抑制及抑制破骨细胞等药理作用[4]。
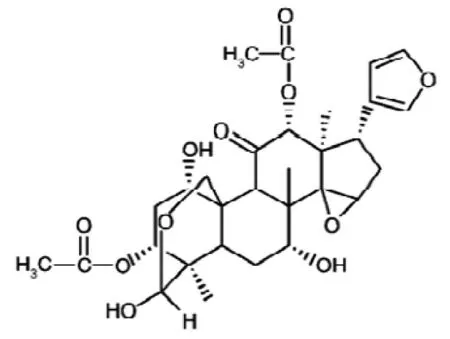
图1 川楝素化学结构
笔者总结了TSN 参与抑制肺癌、乳腺癌、宫颈癌、结直肠癌、胃癌、肝癌、骨肉瘤、卵巢癌、胰腺癌等多种癌症的相关生物学机制。这些结果揭示了不同肿瘤细胞系对TSN 的不同敏感性,支持了TSN 的有效性和广谱抗癌活性。
1 诱导细胞凋亡
细胞凋亡主要由外源性途径(死亡受体途径)、内源性途径(线粒体途径)和内质网途径介导[5]。外源性凋亡途径主要由Fas、DR3、DR4、DR5、TNFR1等多种受体介导,如Fas-FasL 和肿瘤坏死因子受体凋亡诱导配体(TRAIL),导致Caspase 级联反应的启动[6]。研究证实TSN 呈时间剂量依赖性抑制卵巢癌CAOV-3 和ES-2 细胞增殖,通过上调Fas、FasL 蛋白的表达,激活Caspase-8 和Caspase-3 来诱导人卵巢癌细胞凋亡[7]。内源性线粒体途径在细胞受到内部刺激因子作用被激活如缺氧、生长因子缺失、癌基因DNA 损伤,进而激活BCL-2 家族促凋亡因子,增加线粒体通透性释放出凋亡因子激活Caspase 级联[5]。目前多项研究证实TSN 通过内源性途径诱导癌细胞凋亡。TSN 通过p38 MAPK 途径诱导人胃癌AGS 细胞、HGC-27 细胞线粒体途径依赖性的凋亡[8]。还有研究认为TSN 除了通过外源性途径,也能诱导人卵巢癌CAVO-3 细胞和A2870 细胞的内源性途径凋亡[9]。同样TSN 也能通过内源性线粒体途径诱导胃癌SGC-7901 细胞[10]、三阴性乳腺癌MDA-MB-231 细胞[11]、尤文氏肉瘤SK-ES-1 细胞凋亡[12]。除此以外还有内质网途径,研究证实,TSN 在处理非小细胞肺癌A549 细胞时,细胞内活性氧和钙离子水平升高产生内质网应激,并通过PERK-Eif2a/ATF4 信号通路激活转录,通过CHOP、DR5 表达上调,由于TRAIL 是通过死亡受体介导对肿瘤的杀伤作用,TSN增强了A549 细胞对TRAIL 敏感性[13]。p53 是一个重要的肿瘤抑制基因,控制细胞凋亡,在至少50%的肿瘤中,p53 突变或失活,野生型p53 功能的丧失导致人类肿瘤的发展[14]。将乳腺癌MCF-7 细胞(ERβ+/p53 野生型)暴露于TSN 可导致深度凋亡,但TSN 对乳腺癌T47D 细胞(ERβ+/p53 L194F 突变型)的治疗效果较差,TSN 诱导凋亡的效果不同可能依赖于p53的不同表达[15]。TSN 还能够通过诱导肿瘤细胞凋亡来降低化疗药物的使用剂量,从而减轻高剂量带来的不良反应。大剂量的多柔比星具有心脏毒性,研究发现TSN 能过表达转录因子FOXO1,增强下游促凋亡分子如Noxa 和Bim,促使乳腺癌MDA-MB-231和MDA-MB-435 细胞发生线粒体途径凋亡,TSN 与多柔比星的协同作用降低了多柔比星对乳腺癌细胞产生显著杀伤性的使用浓度,减小了多柔比星对心脏的损伤[16]。
2 阻滞细胞周期
癌细胞在G1、S、G2、有丝分裂的细胞周期中由于DNA 不能修复导致异常增殖,可以通过蛋白激酶信号通路(CDK)保护癌细胞避免化疗造成的DNA损伤,所以肿瘤发生和耐药性与细胞周期检查点的缺陷相关[17]。TSN 可通过阻滞肿瘤细胞周期来抑制细胞的增殖。经TSN 处理后,三阴性乳腺癌MDAMB-231 细胞、胃癌AGS 细胞和HGC27 细胞、早幼粒白血病HL-60 细胞、淋巴瘤U937 细胞的细胞周期阻滞在G1/S 期[18]。
3 抑制肿瘤细胞迁移侵袭
肿瘤的侵袭、转移和多药耐药的发生是临床上肿瘤治疗失败的主要原因。表皮生长因子(EGF)和血管内皮生长因子(VEGF)与对应的跨膜受体结合促进肿瘤血管生成[19]。Zhang T 等[20]研究发现TSN 可与STAT3 的SH2 结构结合阻止STAT3 二聚化,破坏STAT3 与EFGR 复合物形成,从而抑制骨肉瘤143B细胞生长转移。降解细胞外基质(EMC)以及基底膜是抑制肿瘤细胞转移的关键机制,据报道,在乳腺癌细胞中MMP-2 和MMP-9 具有促进EMC 和基底膜降解的作用,MMP 的高表达与乳腺癌细胞转移密切相关[20]。TGF-β 能通过激活Akt/mTOR 通路促进转录因子ZEB1 和SNAIL 的表达进而诱导上皮间质转化(EMT)[21],EMT 的标志是上皮细胞的特征消失,出现间充质标志蛋白vimentin、N-cadherin 的表达上调,及E-cadherin 和其他细胞黏附分子的表达下调[22]。Chaffer CL 等[23]研究发现,TSN 能通过抑制核因子κB(NF-κB)/Snail 信号通路介导EMT 来抑制人卵巢癌细胞的迁移和侵袭能力。在处理肺癌A549 和H1975 细胞时,TSN 可能通过ERK1/2 和Snail 途径抑制TGF-β1 诱导的EMT、黏附、侵袭和迁移[24]。除此之外,Wnt/β-catenin 通路是介导多种癌症生物学过程的重要通路,包括增殖、分化、凋亡、遗传稳定性、侵袭和转移[25]。例如TSN 激活WWOX 通过JAK2/Stat3 和Wnt/β-catenin 信号通路抑制肝癌转移[26]。
4 逆转肿瘤细胞对化疗耐药
目前化疗已经成为癌症主要治疗手段之一,除了原发性多药耐药,肿瘤细胞还可能在多次化疗后对不同机理的化疗药产生交叉耐药,称为获得性多药耐药。笔者试图寻找到逆转耐药的药物来提高肿瘤细胞对化疗的敏感性,增加患者的生存率。肿瘤耐药往往与多药耐药基因MDR-1 激活导致P-gP 表达上调、过度表达多药耐药相关蛋白家族(MRPs)、胞内信号异常改变、DNA 修复异常、细胞周期与凋亡自噬途径变化、EMT 的发生、miRNAs 表达等相关[27],目前报道的TSN 逆转耐药的机制主要包括减少药物流出和诱导或抑制肿瘤细胞自噬。
4.1 减少药物流出多药耐药的主要机制是药物摄入障碍或向外转运增多导致药物在细胞内的积累减少。通过ATP 依赖的药物外排泵的过表达,化疗药物被泵出细胞,肿瘤细胞内的药物浓度降低,产生耐药性。最常见的药物外排泵是P-gp[28]。据报道,MRP2/ABCC2 和P-gp 可转运顺铂(CDDP),并导致细胞对CDDP 耐药。另外铜出口蛋白ATP7A、ATP7B 和铜转运蛋白hCTR1 也可以参与了CDDP 的转运。但最近研究证明TSN 并不调节P-gp,而是通过下调膜联蛋白Anxa4,抑制铜出口蛋白ATP7A 在细胞膜上的定位,从而减少了CDDP 从A549 细胞内的流出[29]。另外有研究证明在对阿霉素(ADM)耐药的乳腺癌MCF-7 细胞中,TSN 能够增加ADM 在细胞核中的浓度,逆转乳腺癌细胞对ADM 耐药[30]。
4.2 诱导或抑制肿瘤细胞自噬在癌症的发展过程中,自噬根据癌症的类型、阶段或遗传因素发挥着双重作用:一方面自噬可以防止慢性细胞损伤和炎症,抑制致癌p62 蛋白复合物的积累,会在特定环境下以与Caspase 无关的模式导致细胞死亡,称为自噬性细胞死亡,特别是在肿瘤早期[31]。有研究表明TSN 通过PI3K/Akt/mTOR 通路对胶质母细胞瘤(GBM)U87 细胞存在自噬诱导作用,并观察到自噬在GBM中起到促凋亡作用,用自噬抑制剂3-MA 阻断自噬可以明显减少细胞凋亡,而通过mTOR 抑制剂雷帕霉素增强自噬则导致更多细胞凋亡[32]。在甲状腺癌、结直肠癌和乳腺癌等多项研究中证明,自噬是增强肿瘤细胞对阿霉素敏感性的重要机制,阿霉素耐药与自噬的缺失密切相关[33-34]。研究表明TSN 能通过抑制PI3K/AKT/mTOR 信号通路逆转乳腺癌MDA-MB-231 细胞对阿霉素耐药[35],推测可能与TSN 诱导自噬相关,阿霉素和TSN 联合治疗可能是人类乳腺癌治疗的一种有效策略,还需进一步验证。另一方面自噬已被认为是多种癌症生存和耐药发展的有效机制。肿瘤细胞能通过自噬降解丧失功能的细胞器、蛋白质等胞内物质,实现细胞新陈代谢,为其他肿瘤细胞提供能量,特别在肿瘤晚期,自噬发挥细胞保护功能[31]。目前只有2 项研究描述了TSN 与哺乳动物细胞自噬的关系[16,36],研究指出TSN 通过诱导肺癌细胞和TNBC 的自噬而产生凋亡增敏效应。然而,由于没有应用自噬流分析,因此对结果的解释有待考究。另一项研究通过高含量筛选模型确定TSN 是自噬调节剂,并进一步证实它阻断自噬流和抑制其底物降解;TSN 在肿瘤细胞系和移植瘤裸鼠模型中都表现出高度的自噬抑制活性;发现TSN 在较低浓度(细胞培养10 nm,小鼠0.5mg/kg)时能有效抑制自噬流,表明TSN 是一种强效的自噬抑制剂,他们还研究了TSN 对化疗抗癌效果的互补作用,结果表明,在细胞和动物模型中,TSN 可抑制喜树碱诱导的保护性自噬,并显著提高Hela 细胞对喜树碱诱导的毒性的敏感性,具有良好的耐受性和安全性[37]。在另一项研究中TSN 同样发挥了自噬抑制剂作用使TNBC 细胞对伊立替康/SN-38 化疗敏感[38]。综上所述,TSN 有可能通过阻断化疗诱导的保护性自噬而被开发成一种抗癌药物,化疗联合自噬抑制剂可能是未来癌症治疗的新方向。
5 小结
笔者从诱导细胞凋亡、阻断细胞周期、抑制肿瘤细胞侵袭和转移、诱导或抑制肿瘤细胞自噬、增加化疗药物胞内浓度等方面总结了TSN 的广谱抗肿瘤作用,涉及分子机制和信号通路包括启动抑癌p53通路和抑制下调NF-κB、Wnt/β-catenin、PI3K-AKT和MAPK/ERK 通路。其中最重要的是,TSN 对于多种化疗药物的逆转耐药作用,不论是通过减少肿瘤细胞内的药物流出,还是增加肿瘤细胞的自噬性死亡,或者通过提高溶酶体pH 抑制自噬,逆转TNBC对伊立替康和阿霉素耐药。目前的早期自噬抑制剂如3-MA 和LY294002、靶向自噬晚期的抑制剂如CQ 和HCQ 均不是强效和选择性的,我们需要发现更有效、生物利用度更高、生物靶向性更好的药物。最后,TSN 的生物利用率较低,需要开发和筛选TSN 衍生物或修饰TSN 靶向结构使其作为一种新型增敏抗癌药物改善未来癌症治疗。

