养马岛附近海域藻华期间有色溶解有机质的生物可利用性研究
吕孝清, 高学鲁, 赵建民, 刘永亮, 王 斌, 杨 波, 谢 磊, 张乃星
养马岛附近海域藻华期间有色溶解有机质的生物可利用性研究
吕孝清1, 2, 高学鲁1, 2, 赵建民1, 刘永亮1, 2, 王 斌1, 2, 杨 波3, 谢 磊1, 2, 张乃星4
(1. 中国科学院烟台海岸带研究所, 山东 烟台 264003; 2. 中国科学院大学, 北京 100049; 3. 广东海洋大学深圳研究院, 广东 深圳 518114; 4. 国家海洋局北海预报中心, 山东 青岛 266061)
本研究利用吸收光谱和荧光激发-发射矩阵光谱-平行因子分析(EEMs-PARAFAC), 研究了养马岛附近海域海水中有色溶解有机质(CDOM)的浓度、组成、来源和生物可利用性, 并估算了浮游植物生长繁殖对CDOM及具有生物可利用性CDOM的贡献。结果表明, 表、底层海水中CDOM浓度(以吸收系数350计)平均值分别为1.62±0.42 m−1和1.30±0.47 m−1, 光谱斜率(275-295)平均值分别为0.022± 0.003 nm−1和0.023±0.003 nm−1。利用PARAFAC模型识别出4种荧光组分, 分别为陆源类腐殖酸C1、类色氨酸C2、类酪氨酸C3和微生物源类腐殖酸C4。荧光指数(FIX)、腐殖化指数(HIX)和生物指数(BIX)显示, CDOM受陆源输入和海洋自生源的综合影响。降解实验结果显示, 表、底层海水中生物可利用性CDOM百分比(%∆350)平均值分别为(23.36%±17.94%)和(8.93%±20.30%)。C1、C2和C4组分的荧光强度在培养之后降低, 而C3组分的荧光强度上升。各荧光组分生物可利用性依次递减的顺序为: %ΔC1 (23.75%±8.96%)>%ΔC4 (20.83%±11.71%)>%ΔC2 (11.67%±38.87%)>%ΔC3(−29.61%±39.90%), 显示培养之后CDOM的平均分子量和腐殖化程度降低。表层海水中350、%Δ350与Chl之间存在显著线性相关关系, 据此可以估算出浮游植物生长繁殖对CDOM的贡献为36.9%, 对具有生物可利用性CDOM的贡献为85.0%。
吸收光谱; EEMs-PARAFAC; 有色溶解有机质(CDOM); 生物可利用性; 浮游植物
有色溶解有机物(CDOM)是溶解有机物(DOM)的光活性部分, 能够强烈吸收紫外及蓝光波段辐射, 并参与多种元素的生物地球化学过程[1-2]。近岸海水中CDOM主要来源于陆源输入以及与浮游动植物、细菌等各种生物相关的原位生物生产[3-4]。微生物降解作为CDOM迁移的重要途径, 在水圈中无处不在, 可以实现溶解无机碳(DIC)、溶解有机碳(DOC)和微生物之间的碳循环[5-6]。
国内外学者主要利用其光学性质进行研究分析, 包括紫外-可见吸收光谱和荧光激发-发射矩阵光谱(EEMs)[5, 7-11]。吸收光谱的吸收系数(a)和光谱斜率(), 可以表征CDOM的浓度和分子量等信息。EEMs可以表征CDOM的组成[12], 能够追踪CDOM的来源和转化。平行因子分析(PARAFAC)可用于描述CDOM复杂的特征, 能够将EEMs谱图分解为几个独立的荧光组分, 可以获得更多关于CDOM浓度、组成和来源的信息[13-14]。
营养盐通过河流、大气沉降和沿海水产养殖等方式输入黄海, 导致该海域富营养化严重, 为浮游植物暴发式生长提供了生源要素, 导致沿岸藻华频发[15-17]。浮游植物生长繁殖能够将DOM释放到水生生态系统中, 是河口及近岸海域DOM的主要来源[18-19]。同时其生长代谢过程产生的有机质及死亡后的残骸最终被异养原核生物消耗。因此, 浮游植物和微生物降解对于全球碳循环动态非常重要[20]。在2021年10月下旬, 山东半岛烟威近岸大规模暴发了以多纹膝沟藻为优势藻种的藻华[21], 持续时间长达50 d。在此期间我们采集海水样品, 通过室内微生物降解实验, 并利用吸收光谱和荧光激发-发射矩阵光谱-平行因子分析(EEMs-PARAFAC)研究了养马岛附近海域藻华发生期CDOM的光谱特征和微生物可利用性, 并估算了浮游植物生长繁殖对CDOM的贡献。这项研究为理解藻华发生期CDOM的特征及环境归趋提供了新的视角, 对于探究近岸海域的碳循环具有重要意义。
1 材料与方法
1.1 研究区域
研究海区(养马岛附近海域, 37°44′~37°63′N, 121°39′~122°87′E)位于北黄海, 紧邻烟台东部海岸线[7](图1), 属于典型的半封闭海域, 受陆源输入影响强烈, 有重要的研究意义。另外, 该海域是我国北方重要的海湾扇贝()养殖基地之一, 养殖周期为每年的5—11月[7]。气候变化主要以东亚季风为主[22], 具明显的季节周期性, 降水主要集中在每年的6—9月。
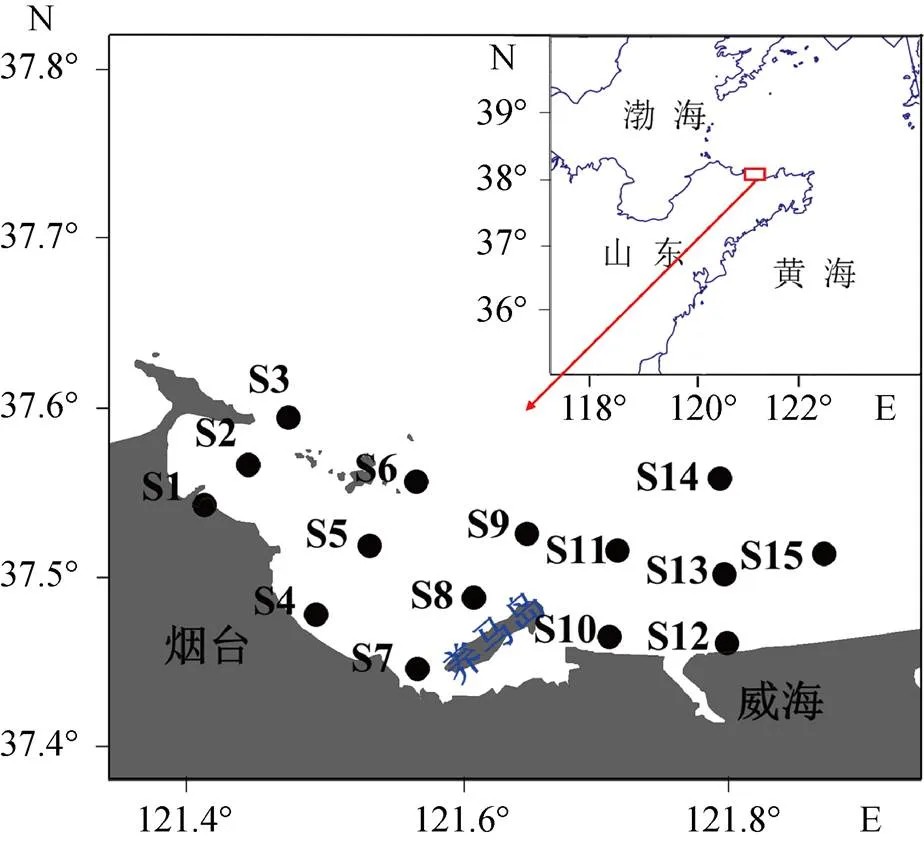
图1 养马岛附近海域采样站位图(审图号: GS(2020)4618号)
1.2 样品采集
于2021年11月15至17日, 对养马岛附近海域开展常规调查, 站位分布如图1所示。使用Niskin采水器采集15个站位的表层(水深1~2 m处)、底层(距海床1 m深度左右)海水样品, 体积约500 mL, 并于当天运回实验室。使用0.7 μm Whatman GF/F(灼烧550 ℃, 5 h)滤膜过滤水样, 并将滤膜用铝箔包裹于−20 ℃冷冻保存, 用于Chl的分析测定[23-24]。一部分滤液(100或300 mL)用于微生物降解实验, 剩余于4 ℃冰箱内保存以便后续实验操作。
1.3 培养实验
取100 mL滤液转移至HDPE塑料瓶(HCl浸泡并用超纯水多次冲洗)中, 瓶盖未旋紧, 以便瓶内系统与空气相通。将其置于培养箱中于25 ℃、黑暗条件下避光培养28 d[13], 分别于培养前(第0 d)和培养后(第28 d)取样50 mL, 用0.22 μm聚醚砜滤膜(PALL)过滤, 滤液转移至经酸洗并高温灼烧(550 ℃, 5 h)的棕色硼硅酸盐玻璃瓶中, 用于CDOM光学特性的分析[9]。滤液于4 ℃避光保存直至测定前恢复至室温。其中, 在S3、S5、S7、S10、S13和S15站位的表、底层降解实验中, 每组设置3个平行实验, 测定结果取其平均值。
1.4 样品测定
1.4.1 Chl测定
将滤膜浸于10 mL 90%的丙酮溶液中低温(4 ℃)、避光萃取12 h, 在台式离心机上以4 000 rpm的转速离心10 min, 取其上清液用特纳Trilogy 7200型荧光仪进行测定[24-26], 其精度为0.01 μgּL−1。
1.4.2 吸收光谱测定
使用配有10 cm石英比色皿的普析TU-1810型紫外-可见分光光度计, 在200~800 nm波长范围内以1 nm的间隔扫描CDOM吸收光谱[9, 27]。并对通过0.22 μm聚醚砜滤膜过滤的超纯水进行扫描, 将其作为空白值。吸收系数(ɑ)及光谱斜率的计算方法和指示意义见表1。本文选取波长在350 nm处的吸收系数(350)作为评价CDOM浓度的指标[28], 对275~295 nm波长范围的吸光度进行非线性拟合得到光谱斜率275-295[29]。
1.4.3 荧光光谱测定
三维荧光激发-发射矩阵(EEMs)由日立F-7000型荧光分光光度计测定。激发波长(x)的范围为200~ 500 nm(间隔5 nm), 发射波长(m)的范围为200~500 nm (间隔为2 nm), 将过滤后(0.22 μm聚醚砜滤膜)的超纯水作为空白样品。用MATLAB(R2018b)软件中的DOMFluor工具箱对EEMs进行平行因子分析(PARAFAC), 并用当日测定的超纯水在λx=350 nm下的积分面积进行拉曼单位(R.U.)校正[30]。根据公式计算了荧光指数(FIX)、腐殖化指数(HIX)和生物指数(BIX), 具体的计算方法及指示意义见表1。
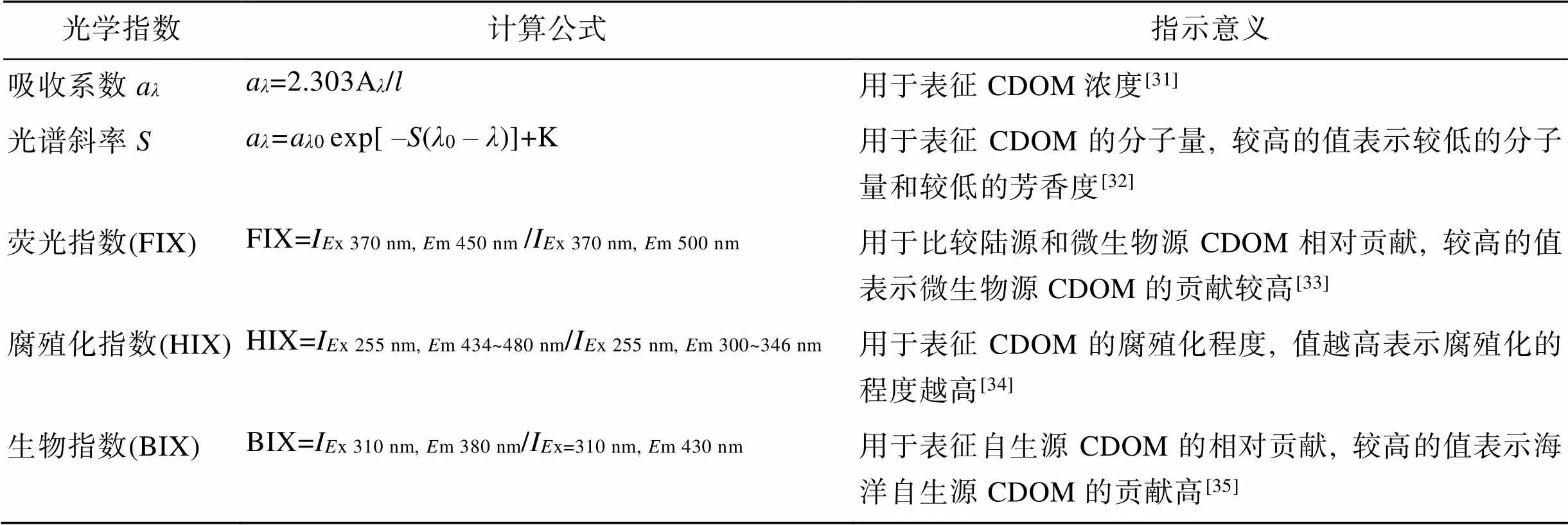
表1 本文中使用的光学指数的描述及计算
1.5 数据处理与分析
1.5.1 生物可利用性CDOM计算
%Δ可以表示具有生物可利用性有色溶解有机质(或荧光溶解有机质)的百分比[36], 具体计算公式为:
%Δ=(0d–28d)/0d×100%
其中,是吸收系数350及各荧光组分的强度。
1.5.2 数据处理
利用OriginPro 2018对Chl和光谱参数进行显著性分析(Mann-Whitney U检验)(<0.05表示存在显著性差异)和相关性分析。利用ODV(Ocean Data View)和MATLAB R2018b软件绘制采样站位图(图1)和荧光组分图, 其他绘图均利用OriginPro 2018软件完成。
2 结果与讨论
2.1 Chl a特征
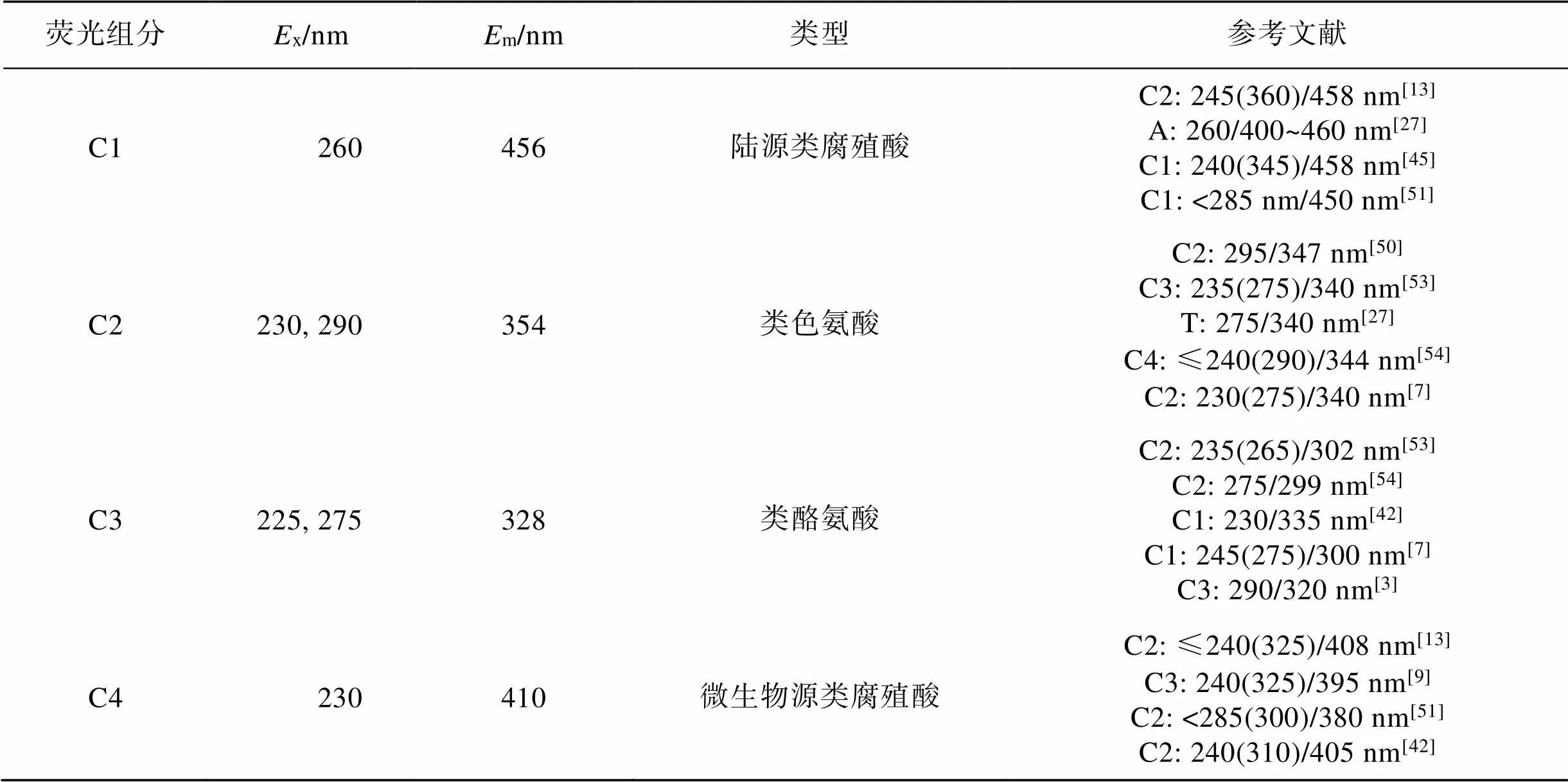
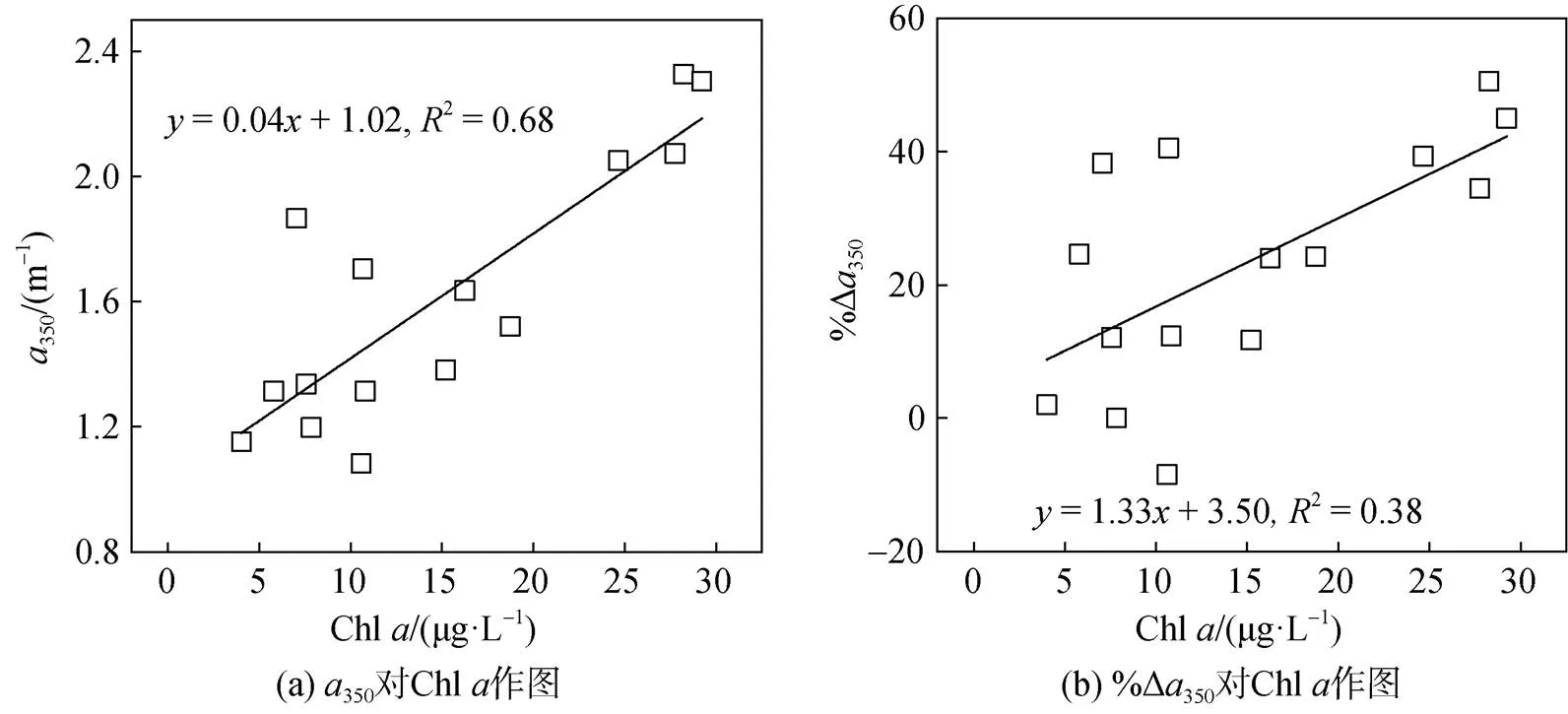
调查期间表层海水中Chl的浓度为4.02~ 29.24 μgּL−1(14.97±8.79 μgּL−1), 显著高于底层[0.51~ 32.20 μgּL−1(5.81±9.92 μgּL−1)](<0.05), 并远高于2019年在该海域的调查结果(0.57±0.18 μgּL−1)[7]。Harrison等[37]认为当Chl> 5 μgּL−1时具备赤潮发生的可能, 因此表层除S11站位外, 其余站均已达到藻华发生的阈值, 尤其是S9和位于离岸较近的S7、S10和S12站位, 其浓度为24.67~29.24 μgּL−1, 已达到高度富营养化状态(20 μgּL−1 350作为表征CDOM浓度的指标, 总体呈近岸高、远岸低的分布特征(图1, 表2和表3)。培养前表层、底层海水350分别为1.08~2.33 m−1(1.62±0.42 m−1)和0.85~2.83 m−1(1.30±0.47 m−1), 明显高于2019年的结果(表层: 0.69±0.14 m−1; 底层: 0.67±0.11 m−1)[7], 这可能与调查期间浮游植物的暴发性增殖有关。一方面浮游植物光合作用会向水体中释放有机质, 这一过程可用以下方程式表示: 106CO2+122H2O+16HNO3+ H3PO4→ (CH2O)106(NH3)16H3PO4+138O2[39]。另一方面由于该海域藻华已持续约20 d, 微生物对藻类的降解也是海洋CDOM的主要来源[40]。 表2 表层海水中Chl a和降解前后CDOM光谱参数汇总 续表 注: 平行实验的数据在表中以均值形式呈现。 表3 底层海水中Chl a和降解前后CDOM光谱参数汇总 经过培养实验后, 表、底层海水的350值下降(图2a), 表明CDOM在微生物的作用下发生降解。表层海水中%Δ350为−8.51%~50.50%(23.36%±17.94%), 显著高于底层[−27.03%~58.54% (8.93%±20.30%)](<0.05), 这可能是由于表层浮游植物产生的CDOM是底层有机质的来源, 有机质在向下输送的过程中, 经微生物耗氧分解生成难降解有机质[41]。另外表层CDOM受太阳辐射影响后更易被微生物降解[42]。 图2 培养前后吸收系数a350和光谱斜率S275-295的变化 注: *代表存在显著性差异(<0.05) 作为CDOM平均分子量的指标,275-295值越低, 说明高分子量物质所占比例越大[32]。表、底层海水275-295值分别为0.017~0.025 nm−1(0.022±0.003 nm−1)和0.014~0.026 nm−1(0.023±0.003 nm−1)(表2, 表3), 略低于2019年的结果(表、底层均值: 0.027±0.000 nm−1)[7], 尤其是在表层达高度富营养化状态的S7、S9、S10和S12站位, 其275-295值仅为0.017~0.020 nm−1(0.018±0.001 nm−1)。出现这一现象的原因可能与浮游植物产生的类腐殖酸和透明胞外聚合物颗粒(TEP)等高分子量物质有关。TEP中含有分子量介于1 kDa~0.2 μm的胶体前体, 在样品过滤时进入滤液会增加CDOM的分子量[3, 43-44]。 275-295值在培养之后显著增大(<0.05)(图2b), 表明在微生物的作用下CDOM的平均分子量减小, 但这与Xu等[11]、张怡晅等[45]的结果相反。这可能是由于培养过程中微生物代谢高分子量陆源类腐殖酸, 从而将其转化为低分子量CDOM[46-47]。 本研究利用PARAFAC对样品的EEMs进行分析, 共鉴别出4种荧光组分(图3, 表4), 包括2种类腐殖酸荧光组分(C1和C4)和2种类蛋白荧光组分(C2和C3), 4种荧光组分的最大激发波长(x)、最大发射波长(m)及组分类型如表4所示。C1(x/m= 260 nm/456 nm)属于陆源类腐殖酸, 具有较高分子量[45], 广泛存在于营养物质丰富的环境中, 如受污废水等影响的水域中[48]。C2(x/m=230 nm, 290 nm/ 354 nm)和C3(x/m=225 nm, 275 nm/328 nm)分别属于类色氨酸和类酪氨酸荧光组分, 广泛存在于自然水体中, 均与生物生产和微生物活动有关[9, 11, 13, 49-50]。C4(x/m=230 nm/410 nm)属于微生物源类腐殖酸, 是水体中异养细菌原位生产的副产物[51], 该组分既受海洋自生源的影响, 也受陆源和人类活动的影响[52]。 培养前各站位C1~C4组分的荧光强度如表2和表3所示, 在表、底层海水中分别为0.006~0.009 (0.007±0.001) R.U.、0.009~0.029 (0.016±0.006) R.U.、0.006~0.018 (0.009±0.003) R.U.、0.007~0.011 (0.009± 0.001) R.U.和0.005~0.008 (0.007±0.001) R.U.、0.009~ 0.028 (0.015±0.005) R.U.、0.004~0.020 (0.009±0.004) R.U.、0.006~0.010 (0.008±0.001) R.U., 在表、底层无显著性差异(>0.05)。其中, 类蛋白组分(C2 + C3)的荧光强度所占的比例最大, 在各站位的平均比例为(60.20%±6.04%), 结果表明类蛋白是养马岛附近海域荧光DOM的主要组分, 这与Yang等[7]结果一致。 表4 由PARAFAC确定的四个荧光组分光谱特征 培养前后4种组分的荧光强度变化如图4所示, 可以看出%ΔC1(23.75%±8.96%)>%ΔC4(20.83%±11.71%)>%ΔC2(11.67%±38.87%)>%ΔC3(−29.61%±39.90%), 表明类腐殖酸组分发生降解, 而类蛋白组分(尤其是类酪氨酸)相对积累, 其平均比例由培养前的(60.20%±6.04%)上升至(64.98%±3.83%), 这可能与微生物的生长和代谢产物的释放有关[46]。尽管有报道显示藻类释放的类腐殖酸组分生物活性较低, 难以被微生物利用[55], 但在本研究中该组分明显发生降解。王子豪等[18]、Bai等[19]的研究表明, 浮游植物释放的DOM能够被异养细菌迅速消耗并刺激其活性, 形成以异养细菌为主的二次生产力, 培养过程中细菌丰度总体上可能呈上升的趋势[11, 56]。腐殖酸物质作为细菌生长的间接外部能源被摄取的过程中, 可同时释放出蛋白类胞外聚合物[56-57]。且当类腐殖酸(主要是陆源类腐殖酸)物质有氨基酸结构时, 两者可以相互转化[46, 58], 因此陆源类腐殖酸是荧光DOM生物降解的积极贡献者。类酪氨酸的生物活性低于类色氨酸, 这可能是造成两者荧光强度变化差异的原因[59]。前者在降解过程的生成/转化速度可能高于降解速度, 因此该组分的荧光强度主要表现为积累, 后者与之相反。 荧光指数(FIX、HIX、BIX)通常用于表征DOM的来源。FIX可以作为区分陆源和微生物源DOM相对贡献的指标, 其值>1.9表明微生物源DOM的贡献较大[33]。HIX表征CDOM的腐殖化程度[34], 其值越高表明腐殖化程度越高, HIX>10或<5表征CDOM以陆源输入或海洋自生为主[35]。BIX反映自生源CDOM的相对贡献, 其值>1可表征以海源自生为主的DOM, 而以陆源为主的DOM, 其BIX值相对较低(<0.6)[35]。培养前FIX、HIX和BIX在表、底层海水中无显著性差异(>0.05), 范围分别为1.57~1.99(1.77±0.10)、1.18~1.81(1.56±0.16)和1.11~1.52(1.24±0.08)(表2, 表3), 表明CDOM受陆源输入和海洋自生源的综合影响。经微生物降解后, 表、底层HIX值显著降低(<0.05) (图5b), 表明CDOM的腐殖化程度下降, 这与高分子量陆源类腐殖酸组分的降解及类酪氨酸组分的积累有关。然而, FIX、BIX值的变化并不显著(>0.05) (图5a, 5c), 表明两者在CDOM的微生物利用过程中较为稳定。 在表层水体中,350和Chl之间存在极显著相关性(<0.01), 对两者进行线性拟合, 其截距可代表非藻华源CDOM浓度(1.02 m−1)(图6a)。经计算浮游植物生长繁殖对表层水体CDOM的贡献为36.9%, 略高于Yang等[9]的结果(11.6%~35.2%), 但明显低于Zhang等[3]在渤海湾的研究结果(63%)。这可能是由于该海域藻华已暴发一段时间, 非活性有机体(主要是一些退化的藻类细胞)及浮游植物的原位降解产物可能是CDOM的主要来源[40]。 注: *代表存在显著性差异(<0.05) 注: *代表存在显著性差异(<0.05) 图6 表层海水中a350对Chl a和%Δa350对Chl a的散点图 经过培养之后, Chl与350的变化值(%Δ350)之间也存在极显著相关性(<0.01)(图6b), 经计算浮游植物生长代谢对表层具有生物可利用性CDOM的贡献为85.0%, 表明浮游植物生长繁殖产生的CDOM具有较高的生物可利用性, 是该海区具有生物可利用性CDOM的主要来源。 与CDOM相比, 表层浮游植物生长对荧光组分的贡献较小, 具体表现为C1~C4荧光最高值均出现在Chl较低(10.82 μg·L−1)的S6站(表2), 并且, S10和S12站(Chl>20 μg·L−1)的C1、C3和C4组分的荧光强度要低于平均值, 这可能与浮游植物的生长阶段有关[60], 如果浮游植物处于暴发期, Chl浓度较高, 但类蛋白和类腐殖酸组分的荧光强度可能会较低; 反之, 如果处于衰退期, 荧光组分的荧光强度可能较高, Li等[61]在对南黄海绿潮的研究中发现了类似结果。同时微生物对藻类的降解释放也是荧光溶解有机质的重要来源[28]。 大气沉降、河流输入和人类活动可为养马岛附近海域提供养分, 从而为浮游植物在短时间内增殖创造了条件[28, 62]。新鲜CDOM输入, 会刺激微生物的生长代谢, 微生物通过利用现有的有机质合成自身生长代谢所需的氨基酸, 导致含有氨基酸结构的陆源类腐殖质组分被降解, 进而产生类蛋白组分[46], 这也证明了难降解CDOM在微生物过程中的降解潜力, 为CDOM的生物降解提供了新的视角。然而微生物降解过程中通常伴随着温室气体(如CO2)的排放, 这可能会减弱海洋的“碳汇”功能, 对减缓“温室效应”有不利影响。 本文研究了养马岛附近海域藻华发生期CDOM的光谱特征和生物可利用性, 并估算了浮游植物生长繁殖对CDOM的贡献, 主要结果如下: (1) 调查期间CDOM具有高丰度、高分子量的特征。通过EEMs-PARAFAC分析识别出4种荧光组分, 分别为陆源类腐殖酸(C1)、类色氨酸(C2)、类酪氨酸(C3)和微生物源类腐殖酸(C4)。其中, 类蛋白荧光(C2+C3)为主要荧光组分。荧光指数(FIX、HIX和BIX)表明CDOM受陆源输入和海洋自生源的综合影响。 (2) 经过28 d室内培养实验后, CDOM发生降解。类腐殖酸物质的荧光强度降低, 而类蛋白物质(尤其是类酪氨酸)积累且所占比例升高, 从而导致CDOM的平均分子量和腐殖化程度降低。 (3) 浮游植物生长繁殖释放的CDOM具有较高的生物可利用性, 占总生物可利用性CDOM的85.0%; 它也是表层CDOM的重要来源, 其贡献值为36.9%。 [1] JAFFÉ R, CAWLRY K, YAMASHITA Y. Applications of excitation emission matrix fluorescence with parallel factor analysis(EEM-PARAFAC) in assessing environmental dynamics of natural dissolved organic matter (DOM) in aquatic environments: A review[J]. ACS Symposium Series, 2014, 1160: 27-73. [2] GUÉGUEN C, CUSS C W. Characterization of aquatic dissolved organic matter by asymmetrical flow field- flow fractionation coupled to UV-Visible diode array and excitation emission matrix fluorescence[J]. Journal of Chromatography A, 2011, 1218(27): 4188-4198. [3] ZHANG Y, LIU M M, FU X T, et al. Chromophoric dissolved organic matter (CDOM) release byin the central Bohai Sea[J]. Marine Chemistry, 2022, 241: 104107. [4] COBLE P G. Marine optical biogeochemistry: the chemistry of ocean color[J]. Chemical Reviews, 2007, 107(2): 402-418. [5] GAN S C, WU Y, ZHANG J. Bioavailability of dissolved organic carbon linked with the regional carbon cycle in the East China Sea[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2016, 124: 19-28. [6] JIAO N Z, HERNDL G J, HANSELL D A, et al. The microbial carbon pump and the oceanic recalcitrant dissolved organic matter pool[J]. Nature Reviews Microbiology, 2011, 9(7): 555-556. [7] YANG B, GAO X L, ZHAO J M, et al. The impacts of intensive scallop farming on dissolved organic matter in the coastal waters adjacent to the Yangma Island, North Yellow Sea[J]. Science of the Total Environment, 2022, 807(3): 150989. [8] WU K, LU K J, DAI M H. The bioavailability of riverine dissolved organic matter in coastal marine waters of southern Texas[J]. Estuarine, Coastal and Shelf Science, 2019, 231: 106477. [9] YANG B, GAO X L. Chromophoric dissolved organic matter in summer in a coastal mariculture region of northern Shandong Peninsula, North Yellow Sea[J]. Continental Shelf Research, 2019, 176: 19-35. [10] KANURI V, MUDULI P, ROBIN R, et al. Bioavailable dissolved organic matter and its spatio-temporal variation in a river dominated tropical brackish water lagoon, India[J]. Marine Pollution Bulletin, 2018, 131: 460-467. [11] XU H C, GUO L D. Intriguing changes in molecular size and composition of dissolved organic matter induced by microbial degradation and self-assembly[J]. Water Research, 2018, 135: 187-194. [12] MENDOZA W G, ZIKA R G. On the temporal variation of DOM fluorescence on the southwest Florida continental shelf[J]. Progress in Oceanography, 2014, 120: 189-204. [13] YANG L Y, CHEN C T A, Hong H S, et al. Mixing behavior and bioavailability of dissolved organic matter in two contrasting subterranean estuaries as revealed by fluorescence spectroscopy and parallel factor analysis[J]. Estuarine, Coastal and Shelf Science, 2015, 166: 161-169. [14] STEDMON C A, BRO R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: a tutorial[J]. Limnology and Oceanography: Methods, 2008, 6(11): 572-579. [15] FU M L, CAO S C, LI J S, et al. Controlling the main source of green tides in the Yellow Sea through the method of biological competition[J]. Marine Pollution Bulletin, 2022, 177: 113561. [16] XIAO J, WANG Z L, LIU D Y, et al. Harmful macroalgal blooms (HMBs) in China’s coastal water: Green and golden tides[J]. Harmful Algae, 2021, 107: 102061. [17] YANG F X, WEI Q S, CHEN H T, et al. Long-term variations and influence factors of nutrients in the western North Yellow Sea, China[J]. Marine Pollution Bulletin, 2018, 135: 1026-1034. [18] 王子豪, 冯立娜, 张传松, 等. 青岛近岸绿潮区溶解有机质微生物可利用性研究[J]. 中国环境科学, 2022, 42(12): 1-10. WANG Zihao, FENG Lina, ZHANG Chuansong, et al. Study about microbial bioavailability of dissolved organic matter in Qingdao coastal green tide area[J]. China Environmental Science, 2022, 42(12): 1-10. [19] BAI L L, CAO C C, WANG C H, et al. Toward quantitative understanding of the bioavailability of dissolved organic matter in freshwater lake during Cyanobacteria blooming[J]. Environmental Science and Technology, 2017, 51(11): 6018-6026. [20] NEEDHAM D M, FUHRMAN J A. Pronounced daily succession of phytoplankton, archaea and bacteria following a spring bloom[J]. Nature Microbiology, 2016, 1: 1-7. [21] 李晓东, 苏丽, 李晓捷, 等. 2021—2022年山东荣成海带产区大规模溃烂灾害综合调查分析[J/OL].中国农业科技导报, 2022, [2022-12-16], https://doi.org/ 10.13304/j.nykjdb.2022.0728. LI Xiaodong, SU Li, LI Xiaojie, et al. Comprehensive Analyses of Large-Scale Saccharina japonica Damage in the Principal Farming Area of Rongcheng Shandong Province in 2021—2022[J/OL]. Journal of Agricultural Science and Technology, 2022, [2022-12-16], https:// doi.org/10.13304/j.nykjdb.2022.0728. [22] CHEN C T A. Chemical and physical fronts in the Bohai, Yellow and East China seas[J]. Journal of Marine Systems, 2009, 78: 394-410. [23] 赵宇航, 韦钦胜, 辛明, 等. 春末东海北部冷涡区的环境特征及藻华成因探讨[J]. 中国环境科学, 2023, 43(3): 1349-1359. ZHAO Yuhang, WEI Qinsheng, XIN Ming, et al. Environmental characteristics and phytoplankton bloom mechanisms in the cold eddy of northern East China Sea in late spring[J]. China Environmental Science, 2023, 43(3): 1349-1359. [24] ZHANG W J, DONG Z J, ZHANG C, et al. Effects of physical-biochemical coupling processes on theandred tides in October 2019 in the Yantai nearshore, China[J]. Marine Pollution Bulletin, 2020, 160(1): 111609. [25] 廖秀丽, 戴明, 巩秀玉, 等. 南海南部次表层叶绿素质量浓度最大值及其影响因子[J]. 热带海洋学报, 2018, 37(1): 45-56. LIAO Xiuli, DAI Ming, GONG Xiuyu, et al. Subsurface chlorophyllmaximum and its possible causes in the southern South China Sea[J]. Journal of Tropical Oceanography, 2018, 37(1): 45-56. [26] PARSONS T R, MAITA Y, LALLI C M. A manual for chemical and biological methods for seawater analysis[M]. Oxford: Pergamon Press, 1984: 101-173. [27] QI L M, XIE H X, GAGNÉ J, et al. Photoreactivities of two distinct dissolved organic matter pools in groundwater of a subarctic island[J]. Marine Chemistry, 2018, 202: 97-120. [28] 杨波. 养马岛附近海域生源要素的生物地球化学研究[D]. 北京: 中国科学院大学, 2019: 1-196. YANG Bo. The biogeochemical study on biogenic elements in the coastal waters near the Yangma Island[D]. Beijing: University of Chinese Academy of Sciences, 2019: 1-196. [29] 刘梦梦, 张永, 崔全刚. 渤海和北黄海CDOM的来源、时空分布及其调控机制[J]. 海洋环境科学, 2022, 41(4): 572-578.LIU Mengmeng, ZHANG Yong, CUI Quangang. Sources, distributions and controls of chromophoric dissolved organic matter in the Bohai Sea and the North Yellow Sea[J]. Marine Environmental Science, 2022, 41(4): 572- 578. [30] BAGHOTH S, SHARMA S, AMY G. Tracking natural organic matter (NOM) in a drinking water treatment plant using fluorescence excitation-emission matrices and PARAFAC[J]. Water Research, 2011, 45(2): 797-809. [31] HU C M, MULLER-KARGER F E, ZEPP R G. Absorbance, absorption coefficient, and apparent quantum yield: a comment on common ambiguity in the use of these optical concepts[J]. Limnology and Oceanography, 2002, 47: 1261-1267. [32] HELMS J, STUBBINS A, RITCHIE J, et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter[J]. Limnology and Oceanography, 2008, 53(3): 955-969. [33] MCKNIGHT D M, BOYER E W, WESTERHOFF P K, et al. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography, 2001, 46: 38-48. [34] OHNO T. Fluorescence inner-filtering correction for determining the humification index of dissolved organic matter[J]. Environmental Science and Technology, 2002, 36(4): 742-746. [35] HUGUET A, VACHER L, RELEXANS S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 2009, 40(6): 706-719. [36] 郭燕妮, 姚晓龙, 陈慧敏, 等. 鄱阳湖丰枯情景对有色可溶性有机物生物可利用性及收支平衡的影响[J]. 环境科学, 2022, 43(2): 837-846.GUO Yanni, YAO Xiaolong, CHEN Huimin, et al. Influences of hydrological scenarios on the bioavailability, fate, and balance of chromophoric dissolved organic matter in Lake Poyang[J]. Environmental Science, 2022, 43(2): 837-846. [37] HARRISON P J, PIONTKOVSKI S, AL-HASHMI K. Understanding how physical-biological coupling influences harmful algal blooms, low oxygen and fish kills in the Sea of Oman and the Western Arabian Sea[J]. Marine Pollution Bulletin, 2017, 114(1): 25-34. [38] BRICKER S B, FERREIRA J G, SIMAS T. An integrated methodology for assessment of estuarine trophic status[J]. Ecological Modelling, 2003, 169(1): 39-60. [39] REDFIELD A C, KETCHUM B H, RICHARDS F A. The influence of organisms on the composition of the sea water[M]//HILL M N. The Sea. New York: Interscience Publishers, 1963: 26-77. [40] ROCHELLE-NEWALL E J, FISHER T R. Production of chromophoric dissolved organic matter fluorescence in marine and estuarine environments: an investigation into the role of phytoplankton[J]. Marine Chemistry, 2002, 77(1): 7-21. [41] WANG F, ZHOU Y, WANG P, et al. Potential role of scallopsin deposition of particulate nutrient and trace elements in a eutrophic estuary, northern China[J]. Aquaculture Environment Interactions, 2018, 10: 135-147. [42] SONG X Y, ZHAO Y, ZHANG L Y, et al. Photodegradation, bacterial metabolism, and photosynthesis drive the dissolved organic matter cycle in the Heilongjiang River[J]. Chemosphere, 2022, 295: 133923. [43] GUO L D, WEN L S, TANG D G, et al. Re-examination of cross flow ultrafiltration for sampling aquatic colloids: evidence from molecular probes[J]. Marine Chemistry, 2000, 69(1): 75-90. [44] ALUWIHARE L I, REPETA D J. A comparison of the chemical characteristics of oceanic DOM and extracellular DOM produced by marine algae[J]. Marine Ecology Progress Series, 1999, 186: 105-117. [45] 张怡晅, 庞锐, 任源鑫, 等.不同来源有色溶解性有机物光化学/微生物降解过程[J]. 湖泊科学, 2022, 34(5): 1550-1561. ZHANG Yixuan, PANG Rui, REN Yuanxin, et al. Photochemical and microbial alteration of chromophoric dissolved organic matter (CDOM) in aquatic ecosystems associated with different sources[J]. Journal of Lake Sciences, 2022, 34(5): 1550-1561. [46] NI M F, LI S Y. Ultraviolet humic-like component contributes to riverine dissolved organic matter biodegradation[J]. Journal of Environmental Sciences, 2023, 124: 165-175. [47] STEPANAUSKAS R, MORAN M A, BERGAMASCHI B A, et al. Sources, bioavailability, and photoreactivity of dissolved organic carbon in the Sacramento-San Joaquin River Delta[J]. Biogeochemistry, 2005, 74(2): 131-149. [48] MURPHY K R, HAMBLY A, SINGH S, et al. Organic matter fluorescence in municipal water recycling schemes: toward a unified PARAFAC model[J]. Environmental Science and Technology, 2011, 45(7): 2909-2916. [49] ZHOU Y Q, LIU M, ZHOU L, et al. Rainstorm events shift the molecular composition and export of dissolved organic matter in a large drinking water reservoir in China: High frequency buoys and field observations[J]. Water Research, 2020, 187: 116471. [50] KIM T H, WASKA H, KWON E, et al. Production, degradation, and flux of dissolved organic matter in the subterranean estuary of a large tidal flat[J]. Marine Chemistry, 2012, 142/144: 1-10. [51] LIAO Z Y, WANG Y, XIE K T, et al. Photochemistry of dissolved organic matter in water from the Pearl River (China): Seasonal patterns and predictive modelling[J]. Water Research, 2022, 208: 117875. [52] 王林项, 李修竹, 唐新宇, 等. 浒苔绿潮暴发对南黄海海域溶解有机物的影响[J]. 中国环境科学, 2020, 40(2): 806-815. WANG Linxiang, LI Xiuzhu, TANG Xinyu, et al. Effects of the occurrence of green tide (blooms) on dissolved organic matters in the Southern Yellow Sea[J]. China Environmental Science, 2020, 40(2): 806-815. [53] 许明, 刘伟京, 白永刚, 等. 太湖蓝藻水华期可溶有机物的生物降解[J]. 中国环境科学, 2018, 38(9): 3494-3501. XU Ming, LIU Weijing, BAI Yonggang, et al. Biodegradation of dissolved organic matter in Lake Taihu during cyanobacterial blooms[J]. China Environmental Science, 2018, 38(9): 3494-3501. [54] 程琼, 庄婉娥, 王辉, 等. 夏季闽江CDOM的空间分布与降解特征[J]. 环境科学, 2019, 40(1): 157-163. CHENG Qiong, ZHUANG Wane, WANG hui, et al. Spatial distribution and degradation of CDOM in the Minjiang River in summer[J]. Environmental Science, 2019, 40(1): 157-163. [55] VILLACORTE L, EKOWATI Y, NEU T R, et al. Characterisation of algal organic matter produced by bloom- forming marine and freshwater algae[J]. Water Research, 2015, 73: 216-230. [56] LIPCZYNSKA-KOCHANY E. Humic substances, their microbial interactions and effects on biological transformations of organic pollutants in water and soil: a review[J]. Chemosphere, 2018, 202: 420-437. [57] 张铭, 蔡鹏, 吴一超, 等. 细菌胞外聚合物: 基于土壤生态功能的视角[J]. 土壤学报, 2022, 59(2): 308-323. ZHANG Ming, CAI Peng, WU Yichao, et al. Bacterial extracellular polymeric substances: From the perspective of soil ecological functions[J]. Acta Pedologica Sinica, 2022, 59(2): 308-323. [58] BERTO S, DE LAURENTIIS E, TOTA T, et al. Properties of the humic-like material arising from the photo- transformation of l-tyrosine[J]. Science of the Total Environment, 2016, 545/546: 434-444. [59] GUILLEMETTE F, DEL GIORGIO P A. Reconstructing the various facets of dissolved organic carbon bioavailability in freshwater ecosystems[J]. Limnology and Oceanography, 2011, 56(2): 734-748. [60] 季乃云, 赵卫红, 王江涛, 等. 胶州湾赤潮暴发水体中溶解有机物质荧光特征[J]. 环境科学, 2006, 27(2): 257-262. JI Naiyun, ZHAO Weihong, WANG Jiangtao, et al. Fluorescence characteristics of dissolved organic matter during algal bloom in Jiaozhou Bay[J]. Environmental Science, 2006, 27(2): 257-262. [61] LI X Z, LI C H, BAI Y, et al. Composition variations and spatiotemporal dynamics of dissolved organic matters during the occurrence of green tide (blooms) in the Southern Yellow Sea, China[J]. Marine Pollution Bulletin, 2019, 146: 619-630. [62] XIE L, GAO X L, LIU Y L, et al. Perpetual atmospheric dry deposition exacerbates the unbalance of dissolved inorganic nitrogen and phosphorus in coastal waters: A case study on a mariculture site in North China[J]. Marine Pollution Bulletin, 2021, 172: 112866. Bioavailability of chromophoric dissolved organic matter in the coastal waters adjacent to Yangma Island during an algal bloom LV Xiao-qing1, 2, GAO Xue-lu1, 2, ZHAO Jian-min1, LIU Yong-liang1, 2, WANG Bin1, 2, YANG Bo3, XIE Lei1, 2, ZHANG Nai-xing4 (1. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Shenzhen Institute of Guangdong Ocean University, Shenzhen 518114, China; 4. North China Sea Marine Forecasting Center of State Oceanic Administration, Qingdao 266061, China) The concentrations, composition, and sources of chromophoric dissolved organic matter (CDOM) in the coastal waters adjacent to Yangma Island were studied by measuring the absorption spectra and fluorescence excitation–emission matrix-parallel factor analysis (EEM-PARAFAC), and the contribution of phytoplankton growth and reproduction on CDOM and its bioavailability were estimated. The results revealed that the average concentrations of CDOM reflected by350in the surface and bottom seawater were 1.62±0.42 m−1and 1.30±0.47 m−1, and the spectral slopes275-295were 0.022±0.003 nm−1and 0.023±0.003 nm−1, respectively. Four fluorescence components were identified by the PARAFAC model, namely, terrestrial humic-like C1, tryptophan-like C2, tyrosine-like C3, and microbial humic-like C4. The fluorescence, humification, and biological indexes indicated that CDOM was influenced by terrestrial input and marine autochthonous sources. Degradation incubation experiments indicated that the percentages of bioavailability CDOM (%∆350) were (23.36%±17.94%) and (8.93%±20.30%) in the surface and bottom seawater, respectively. The fluorescence intensities of C1, C2, and C4 decreased while that of C3 increased. The bioavailability of fluorescent components decreased in the following order: %ΔC1(23.75%±8.96%)> %ΔC4(20.83%±11.71%)>%ΔC2(11.67%±38.87%)>%ΔC3(−29.61%±39.90%), which indicates that the mean molecular weight and humification degree of CDOM decreased after microbial degradation.350and %Δ350had significant linear correlations with Chl, based on which phytoplankton growth and reproduction were estimated to contribute 36.9% and 85.0% to CDOM and bioavailable CDOM, respectively. absorption spectrum; EEMs-PARAFAC; chromophoric dissolved organic matter (CDOM); bioavailability; phytoplankton Feb. 8, 2023 X145 A 1000-3096(2023)6-0030-12 10.11759/hykx20230208003 2023-02-08; 2023-02-23 中国科学院战略性先导科技专项(XDA23050303) [Strategic Priority Research Program of the Chinese Academy of Sciences, No. XDA23050303] 吕孝清(1996—), 女, 山东济南人, 硕士研究生, 主要从事海洋生物地球化学研究, E-mail: lvxiaoqing1020@163.com; 高学鲁(1976—),通信作者, 男, 山东招远人, 研究员, 主要从事海洋生物地球化学研究, E-mail: xlgao@yic.ac.cn (本文编辑: 赵卫红)2.2 吸收光谱参数变化特征



2.3 PARAFAC识别的荧光DOM组分的变化
2.4 荧光指数变化特征
2.5 浮游植物生长繁殖对研究海区CDOM的贡献
2.6 生物可利用性CDOM的潜在环境影响
3 结论

