全蝎-土鳖虫药对抑制NF-κB信号通路减轻胶原诱导关节炎小鼠骨破坏研究
赵呈雷,何晶晶,王馨莹,卢 曼,杨 杰,曹 鹏, 3
全蝎-土鳖虫药对抑制NF-κB信号通路减轻胶原诱导关节炎小鼠骨破坏研究
赵呈雷1, 2,何晶晶1,王馨莹1,卢 曼1,杨 杰1, 2,曹 鹏1, 2, 3
1. 南京中医药大学附属中西医结合医院,江苏 南京 210028 2. 江苏省中医药研究院,江苏 南京 210028 3. 南京中医药大学药学院,江苏 南京 210023
研究全蝎-土鳖虫药对减轻胶原诱导的关节炎(collagen-induced arthritis,CIA)模型小鼠关节骨破坏的作用以及对破骨细胞分化的核因子-κB(nuclear factor-κB,NF-κB)信号通路的影响,探讨全蝎-土鳖虫药对治疗类风湿关节炎的机制。DBA/1J小鼠随机分为正常组、模型组及全蝎-土鳖虫低、高剂量组和甲氨蝶呤组。除正常组外,其余组建立CIA模型,正常组和模型组ig纯净水,其余各组给药干预4周。测定各组小鼠足趾肿胀情况;采用Micro-CT扫描的方法重建小鼠关节3D图并分析相关骨参数;苏木素-伊红(HE)染色观察小鼠踝关节病理变化;抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色检测关节中破骨细胞分化情况。体外实验考察全蝎-土鳖虫药对对核因子-κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)处理的小鼠骨髓来源的巨噬细胞诱导破骨细胞的影响;免疫荧光染色检测NF-κB p65核定位情况。Western blotting检测破骨细胞分化、CIA小鼠骨组织中NF-κB信号通路相关蛋白表达。各给药组显著降低CIA模型小鼠足趾肿胀(<0.05、0.01);与模型组比较,Micro-CT 3D重建结果表明,全蝎-土鳖虫药对明显抑制CIA模型小鼠骨破坏,保留小鼠骨结构完整性,显著改善骨参数(<0.05、0.01);全蝎-土鳖虫药对显著减少关节TRAP染色阳性细胞数量(<0.01);全蝎-土鳖虫药对高剂量组显著降低CIA小鼠骨组织中NF-κB p65磷酸化水平(<0.01)。体外实验结果显示,全蝎-土鳖虫药对显著抑制破骨细胞的分化(<0.01),抑制NF-κB p65核定位;与RANKL对照组比较,全蝎-土鳖虫药对组p65、核因子-κBα抑制蛋白(inhibitor of nuclear factor-κB alpha,IκBα)磷酸化水平明显降低(<0.05、0.01)。全蝎-土鳖虫药对能够减轻CIA小鼠骨破坏,可能是通过抑制NF-κB信号通路活化、降低破骨细胞的分化而发挥作用。
全蝎-土鳖虫药对;类风湿关节炎;胶原诱导的关节炎小鼠;破骨细胞;NF-κB信号通路
类风湿关节炎(rheumatoid arthritis,RA)是一种以对称性、慢性多关节滑膜炎、骨及软骨破坏为主要特征的自身免疫性疾病。RA是一种临床常见病和多发病,全世界约有1%的成人发病。随着滑膜的增生,后期可对关节软骨和骨组织侵蚀,造成关节软骨、骨和滑囊破坏,最终关节畸形和功能丧失[1]。RA反复发作,不断侵蚀关节骨和软骨,严重影响患者生活质量,同时也是导致我国人群劳动力丧失和致残的主要疾病之一,目前尚无有效治疗RA骨破坏的方法,因此,抑制骨破坏被认为是治疗RA的重点[2]。破骨细胞是人体内唯一具有骨吸收功能的细胞,许多证据表明,破骨细胞在RA骨破坏中起着关键作用[3-4],RA患者骨破坏关节部位存在大量分化成熟的破骨细胞,抑制破骨细胞的分化成熟有利于防治RA骨破坏。研究表明,在RA发病中多种细胞因子可以激活核因子-κB(nuclear factor-κB,NF-κB)信号通路,NF-κB信号通路是破骨细胞分化的主要信号通路之一[5]。
全蝎-土鳖虫药对为临床治疗RA的常用药对,具有祛风通络、逐瘀散结的功效,在控制RA疾病发展方面疗效明显。全蝎-土鳖虫药对是否通过抑制破骨细胞分化起到治疗RA的作用尚不清楚。本研究采用II型胶原诱导的关节炎(collagen-induced arthritis,CIA)小鼠模型,探讨全蝎-土鳖虫药对治疗CIA小鼠骨破坏的作用,观察全蝎-土鳖虫体外对破骨细胞分化NF-κB信号通路的影响,初步研究其潜在的作用机制,为全蝎-土鳖虫治疗RA的临床应用提供理论依据。
1 材料
1.1 动物
SPF级雄性DBA/1J小鼠50只,6~8周龄,体质量18~22 g,购自上海斯莱克实验动物有限责任公司,生产许可证号SCXK(沪)2017-0005;SPF级雄性C57BL/6小鼠6只,7周龄,购自常州卡文斯实验动物有限公司,生产许可证号SCXK(苏)2021-0013。动物饲养于江苏省中医药研究院实验动物中心,室温(20±2)℃,相对湿度50%~60%,12 h光/暗循环光照,自由饮水和摄食。动物实验符合江苏省中医药研究院动物实验伦理审查委员会批准,实验动物伦理号AEWC-20211123-174。
1.2 药材
全蝎(郑州润龙制药股份有限公司,批号18040115)、土鳖虫(江苏华洪药业科技有限公司,批号201806),经江苏省中医药研究院黄一平研究员鉴定分别为钳蝎科动物东亚钳蝎Karsch的干燥体和鳖蠊科昆虫地鳖雌虫Walk的全体。
1.3 药品与试剂
甲氨蝶呤片(2.5 mg/片,批号036210701)购自上海上药信谊药厂有限公司;免疫级牛II型胶原(批号210217v)、完全弗氏佐剂(批号190288)、弗氏不完全佐剂(批号210332)购自美国Chondrex公司;重组小鼠巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF,批号ME4920081)、重组小鼠核因子-κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL,批号CWA2519111)购自美国R&D公司;抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)试剂盒(批号SLBP7795V)购自美国Sigma-Aldrich公司;p65抗体(批号13)、p-p65抗体(批号17)、核因子-κBα抑制蛋白(inhibitor of nuclear factor-κB alpha,IκBα)抗体(批号17)、p-IκBα抗体(批号18)、β-actin抗体(批号12)、HRP标记的IgG二抗,HRP连接抗体(批号29)购自美国CST公司;CCK-8试剂(批号110427)购自美国MCE公司。
1.4 仪器
HERA CELL 150型CO2培养箱(美国Thermo公司);SG604型二级生物安全柜(美国BAKER公司);Skyscan 1176型Micro-CT(德国Bruker公司);Odyssey近红外双色激光成像系统(美国LI-COR公司);520MR型鼠爪肿胀测量仪(美国IITC公司);Axio Observer A1型蔡司倒置显微镜(德国Carl Zeiss公司);Mini-Protean垂直板电泳槽、Mini Trans-Blot小型转印槽(美国Bio-Rad公司)。
2 方法
2.1 全蝎-土鳖虫药对的制备
全蝎-土鳖虫药对组方临床处方常用剂量为全蝎6 g、土鳖虫10 g。分别取全蝎、土鳖虫粉碎,过24目筛。按质量比3∶5分别取全蝎、土鳖虫过筛粉末,混合,加10倍量的去离子水煎煮提取2次,每次45 min,合并提取液,减压浓缩,得0.2 g/mL的浓缩液。通过高效液相色谱法检测提取物主要成分腺苷、次黄嘌呤含量,其平均质量分数分别为0.045%、0.25%,同时通过竞争性酶联免疫吸附法测定makatoxin-3[6]的质量分数为0.09%,对全蝎-土鳖虫药对提取物进行质控。
2.2 CIA模型的建立与分组
将50只雄性DBA/1J小鼠随机分为正常组、模型组及全蝎-土鳖虫低、高剂量组和甲氨蝶呤组,每组10只。按照文献方法制备CIA模型[7-8],将2 mg/mL牛II型胶原蛋白与2 mg/mL完全弗氏佐剂在相对无菌的4 ℃环境下混合乳化,以乳剂滴入水中不扩散为乳化完成终点。首次免疫,除正常组外,其余每只小鼠在尾部距离尾根0.5 cm处sc 0.1 mL上述乳化好的乳剂,此为第0天;第21天加强免疫,免疫佐剂为弗式不完全佐剂,加强免疫时距离尾根部1.5 cm,每只小鼠免疫剂量0.1 mL。
2.3 给药方法
参考《药理实验方法学》[9]附录中人和动物间按体表面积折算的等效剂量比值表,计算小鼠的全蝎-土鳖虫药对等效剂量为2.08 g/(kg·d),其2倍剂量4.16 g/(kg·d)定为高剂量,甲氨蝶呤组剂量为0.65 mg/kg。待CIA模型小鼠建立成功后ig药物,正常组和模型组ig等体积的生理盐水,1次/d,甲氨蝶呤组每周2次ig给药,给药4周。
2.4 足肿胀度测量
采用鼠爪肿胀测量仪测量小鼠双后肢容积,以鼠爪对水的压力的质量转换值(g)表示,每4天测量1次,直至处死。
2.5 Micro-CT扫描
实验结束后,处死小鼠,随机取各组5只小鼠左后肢进行Micro-CT扫描分析,扫描参数:层厚18 µm,电压50 kV,电流455 µA。扫描结束后采用CTvox软件对骨骼进行3D重建,采用CTAn软件分析骨参数(骨密度、骨小梁厚度、骨表面积与骨体积比值、骨体积分数)。
2.6 组织学染色分析
将已固定好的小鼠右后肢膝关节以下部分剔除皮肤和肌肉组织,置10% EDTA脱钙溶液中脱钙4周,将脱钙好的小鼠骨骼组织进行石蜡包埋切片,切片厚度5 µm。对切片进行苏木素-伊红(HE)和TRAP染色。
2.7 小鼠骨髓单核-巨噬细胞(bone marrow-derived macrophages,BMMs)的分离和培养
BMMs从6~8周龄的雄性C57BL/6小鼠的长骨中分离得到[10],分散在含10%胎牛血清、30 ng/mL M-CSF的α-MEM培养基中,置37 ℃、5% CO2的培养箱中培养3 d,贴壁细胞即为BMMs。
2.8 细胞毒性试验
采用CCK-8实验评价全蝎-土鳖虫药对对BMMs的毒性。将全蝎-土鳖虫药对提取浓缩液用α-MEM培养基进行稀释,过0.22 µm无菌微孔滤膜,设置0.125、0.250、0.500、1.000、2.000 mg/mL剂量组,各剂量组分别置于渗透压仪中检测,渗透压均在哺乳动物细胞适宜的260~320 mmol/kg范围内。BMMs以5×103/孔接种于96孔板,培养在含10%胎牛血清、30 ng/mL M-CSF的α-MEM培养基中。细胞培养24 h后,加入上述不同质量浓度的全蝎-土鳖虫药对提取物,分别继续培养48、96 h,培养结束后每孔加入10 µL CCK-8溶液,37 ℃培养箱继续培养2 h,用酶标仪检测450 nm处吸光度()值,计算细胞毒性,每个质量浓度设置5个复孔。
2.9 破骨细胞分化及给药
将BMMs消化后以1×104/孔接种于48孔板,培养在含30 ng/mL M-CSF、50 ng/mL RANKL破骨细胞分化诱导液中,同时给予全蝎-土鳖虫药对提取液干预,设置空白组、RANKL对照组及全蝎-土鳖虫(0.125、0.250、0.500、1.000 mg/mL)组,每组平行设置3个孔,连续培养5 d,每2天全量换液1次,BMMs分化成多核的破骨细胞。破骨细胞分化结束后加入4%多聚甲醛溶液固定10 min,依据TRAP染色试剂盒说明进行TRAP染色,细胞核≥3的细胞为TRAP染色阳性多核破骨细胞,并在光学显微镜下观察并计数阳性细胞数量。
2.10 免疫荧光实验
将细胞爬片置入24孔板中,BMMs细胞以2×104/孔接种于24孔板中,加入30 ng/mL M-CSF培养24 h,设置空白组、RANKL对照组及全蝎-土鳖虫(1.0 mg/mL)组,其中全蝎-土鳖虫给药8 h后加入RANKL进行诱导,RANKL诱导1 h,吸弃培养基,用4%多聚甲醛固定20 min,0.5% Triton X-100渗透15 min,PBS清洗2次,加入1%牛血清白蛋白阻断30 min,将固定的细胞与p65一抗孵育过夜,PBS清洗3次,避光加入荧光标记二抗孵育1 h,PBST清洗爬片3次,滴加DAPI避光孵育5 min,PBST清洗4次,用含抗荧光猝灭剂的封片液封片,荧光显微镜观察采集图像。
2.11 Western blotting检测NF-κB通路相关蛋白表达
2.11.1 Western blotting检测RANKL诱导的BMMs细胞相关蛋白表达 BMMs以6×105/孔接种于6孔板,于含10%胎牛血清、30 ng/mL M-CSF的α-MEM培养基中培养过夜,加入1 mg/mL全蝎-土鳖虫提取物,6 h之后加入50 ng/mL的RANKL分别刺激5、10、20、30、60 min,细胞用PBS清洗2次,加入RIPA裂解液,冰上裂解30 min,BCA法测定蛋白浓度。蛋白样品经8%~12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,分别加入p-IκBα、IκBα、p-p65、p65抗体孵育后显影,采用Image J软件进行定量统计分析。
2.11.2 Western blotting检测CIA小鼠骨组织中相关蛋白表达 实验结束后,处死小鼠,随机取各组3只小鼠后肢,去除皮肤及肌肉组织,将含有踝关节和趾关节的后肢骨置研钵中,加入适量液氮冷冻,迅速研磨,得骨组织粉末,收集骨组织粉末置1.5mL离心管中,加入RIPA裂解液和研磨珠,离心管置低温研磨仪中充分研磨,研磨结束后离心,取上清,BCA法测定蛋白浓度。采用Western blotting检测p-p65和p65蛋白表达。
2.12 统计学分析
3 结果
3.1 全蝎-土鳖虫抑制CIA小鼠足趾肿胀
如图1所示,小鼠第2次免疫后7 d脚趾最先开始出现肿胀,随着时间的进展,模型组小鼠脚背和踝关节出现严重肿胀,后爪关节僵硬,第44天肿胀达到高峰。与模型组比较,全蝎-土鳖虫组第32天后呈剂量相关性地显著减轻了CIA小鼠足趾肿胀程度(<0.05、0.01)。甲氨蝶呤组能显著抑制CIA小鼠足趾肿胀情况(<0.05),其抑制效果与全蝎-土鳖虫低剂量组类似。
3.2 全蝎-土鳖虫降低CIA小鼠关节骨破坏
Micro-CT成像分析可以更直观地评估全蝎-土鳖虫药对抑制CIA小鼠骨破坏的效果,对小鼠足关节Micro-CT扫描结果进行3D重建,得小鼠足3D骨结构图。如图2所示,模型组小鼠骨表面粗糙、关节变形,有严重的骨侵蚀和关节破坏的特征。与模型组比较,全蝎-土鳖虫低、高剂量组对CIA小鼠骨侵蚀和关节破坏均有保护作用,且高剂量组几乎未见骨侵蚀。3D重建图显示,甲氨蝶呤组能抑制CIA小鼠骨破坏,全蝎-土鳖虫高剂量组抑制踝关节和趾骨关节骨破坏作用要优于甲氨蝶呤组。全蝎-土鳖虫低、高剂量组能显著改善CIA小鼠的骨密度、增加骨小梁厚度、提高骨体积分数、降低骨表面积与骨体积比值(<0.05、0.01)。骨参数结果表明,全蝎-土鳖虫能延缓CIA小鼠骨侵蚀放射学进展,对CIA小鼠骨侵蚀具有显著缓解作用。

与正常组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01,图2、4、9同
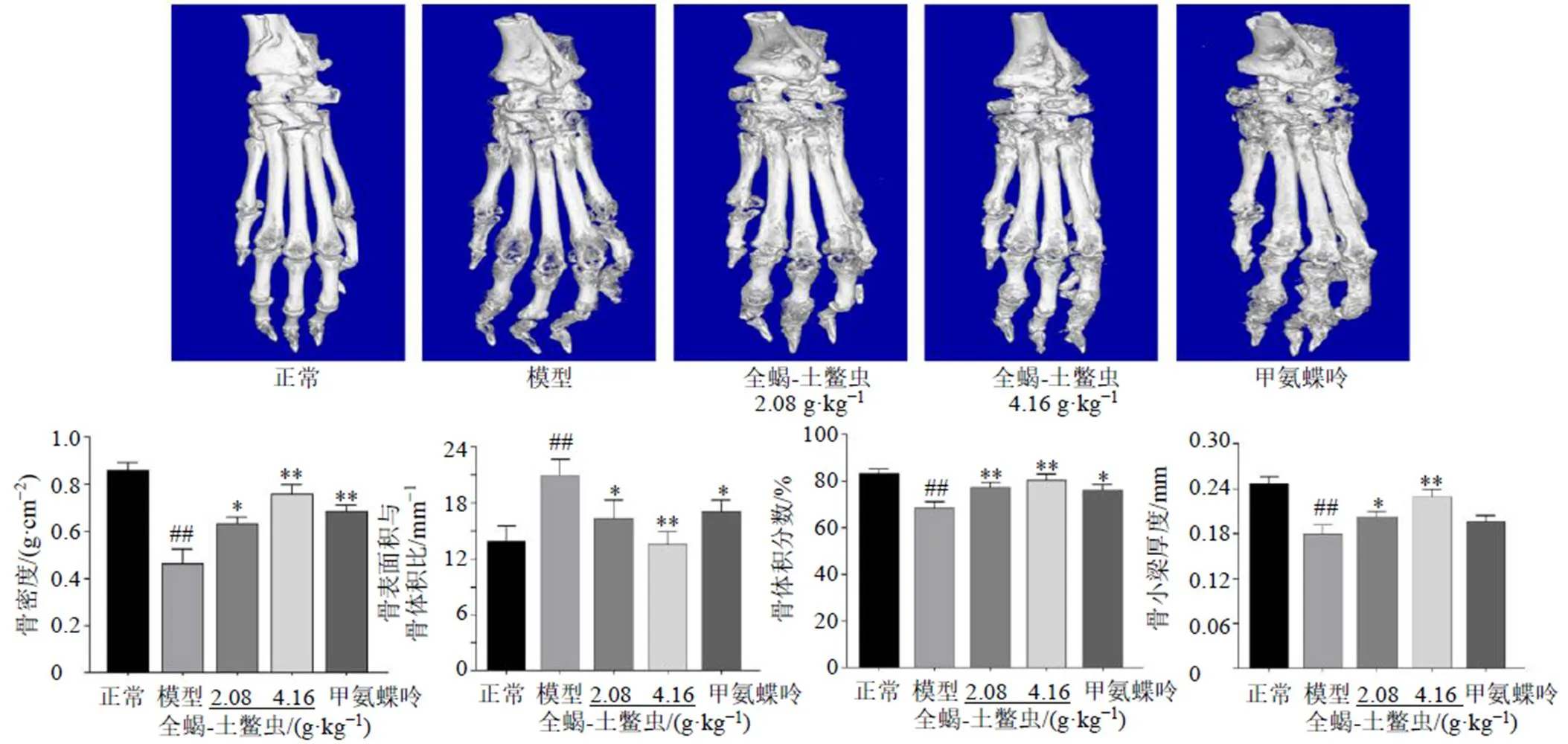
图2 全蝎-土鳖虫对CIA小鼠骨破坏的影响和相关骨参数分析(, n = 5)
3.3 全蝎-土鳖虫改善CIA小鼠关节病理并减少关节破骨细胞分化
3.3.1 病理切片HE染色观察 如图3所示,模型组可见滑膜组织增生、关节软骨侵蚀、关节腔狭窄、关节内大量炎性细胞浸润。与模型组比较,全蝎-土鳖虫组和甲氨蝶呤组可减轻滑膜增生、关节软骨破坏、关节腔炎性细胞浸润,且全蝎-土鳖虫高剂量组优于甲氨蝶呤组。
3.3.2 TRAP染色分析 如图4所示,模型组小鼠关节内可见大量染成红色的阳性破骨细胞,全蝎-土鳖虫低、高剂量组均能显著抑制小鼠关节内破骨细胞的分化形成(<0.01),且其抑制作用呈剂量相关性。甲氨蝶呤组能抑制小鼠关节内破骨细胞的分化(<0.01),但其抑制作用低于全蝎-土鳖虫低、高剂量组。
3.4 全蝎-土鳖虫对BMMs细胞活力的影响
如图5所示,与空白组比较,0.250、0.500、1.000 mg/mL的全蝎-土鳖虫对BMMs的增殖无明显影响,0.125 mg/mL的全蝎-土鳖虫对BMMs增殖有显著促进作用(<0.05、0.01);2.000 mg/mL的全蝎-土鳖虫对BMMs增殖有显著抑制作用(<0.01)。因此,选择全蝎-土鳖虫质量浓度≤1 mg/mL进行后续研究。

图3 全蝎-土鳖虫对CIA小鼠关节骨破坏的影响(HE, ×200)

图4 全蝎-土鳖虫对CIA小鼠关节破骨细胞形成的影响(, n = 3)

与空白组(0 mg·mL−1)比较:*P<0.05 **P<0.01
3.5 全蝎-土鳖虫抑制RANKL诱导的BMMs细胞分化成破骨细胞
如图6所示,BMMs细胞加入M-CSF、RANKL诱导5 d后,大量的TRAP染色阳性的破骨细胞在RANKL对照组出现。与RANKL对照组比较,全蝎-土鳖虫组呈剂量相关性显著降低TRAP染色阳性破骨细胞分化数量(<0.01)。表明全蝎-土鳖虫能够抑制破骨细胞的形成。
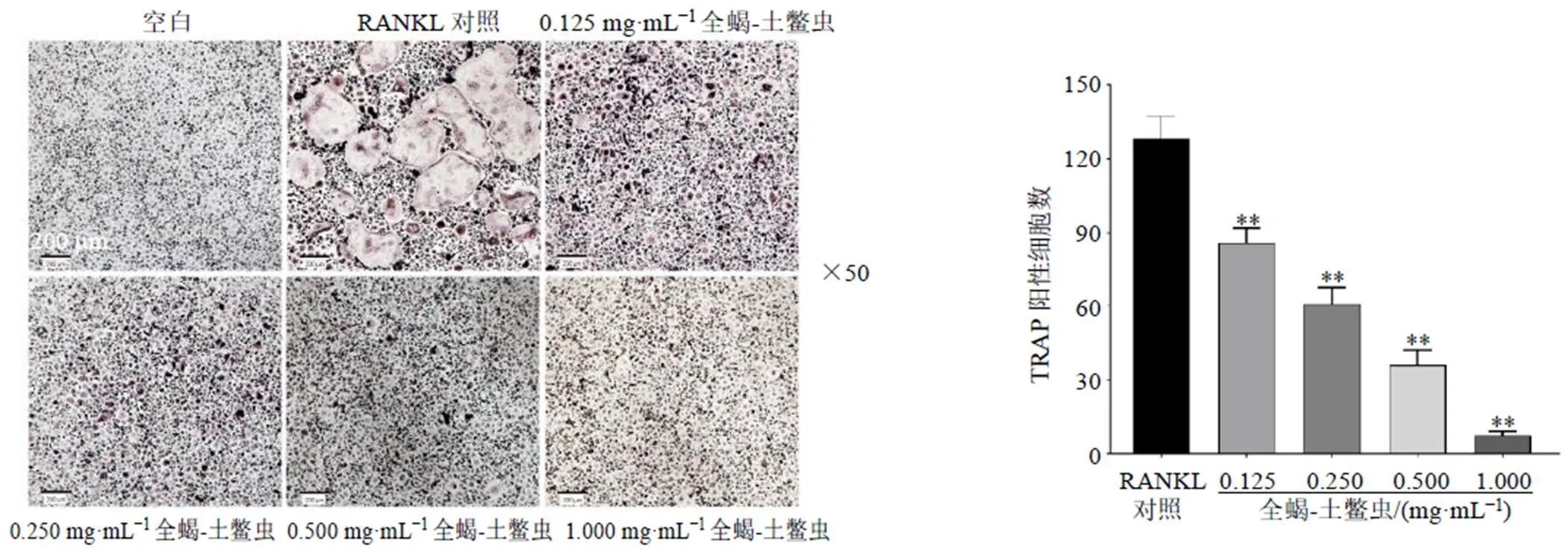
与RANKL对照组比较:*P<0.05 **P<0.01,图8同
3.6 全蝎-土鳖虫减少RANKL诱导的BMMs细胞NF-κB p65核定位
通过免疫荧光染色观察NF-κB p65定位,细胞核被DAPI染成蓝色,NF-κB p65染成红色。如图7所示,空白组、1.000 mg/mL全蝎-土鳖虫组NF-κB p65表达较弱,且主要分散在胞质中,胞核呈空洞状。RANKL对照组NF-κB p65表达增强,呈亮红色分布于胞核中。全蝎-土鳖虫能够抑制RANKL诱导的BMMs细胞NF-κB p65表达及核定位。

图7 全蝎-土鳖虫对破骨细胞形成NF-κB p65核定位的影响(免疫荧光, ×120)
3.7 全蝎-土鳖虫抑制破骨细胞分化中NF-κB通路相关蛋白表达
RANKL为破骨细胞分化因子,RANKL刺激BMMs时间不同,BMMs向破骨细胞分化的NF-κB信号通路相关蛋白表达量不同。如图8所示,1.000 mg/mL全蝎-土鳖虫处理BMMs细胞后,加入RANKL分别刺激5、10、30、60 min,显著降低了p-IκBα水平(<0.01);RANKL分别刺激5、10、20、30、60 min能显著降低p-p65的表达(<0.05、0.01)。表明全蝎-土鳖虫能够在不同时间点抑制破骨细胞分化NF-κB信号通路相关蛋白表达。
3.8 全蝎-土鳖虫抑制CIA小鼠骨组织中NF-κB通路相关蛋白表达
Micro-CT成像结果表明,CIA小鼠的踝关节和趾关节容易发生骨侵蚀和关节破坏。如图9所示,与正常组比较,模型组骨组织中p-NF-κB p65蛋白表达水平显著升高(<0.01);与模型组比较,全蝎-土鳖虫低、高剂量组p-NF-κB p65蛋白表达水平呈下降趋势,且高剂量组p-NF-κB p65蛋白表达水平显著降低(<0.01)。

图8 全蝎-土鳖虫对破骨细胞分化NF-κB通路相关蛋白表达的影响(, n = 3)
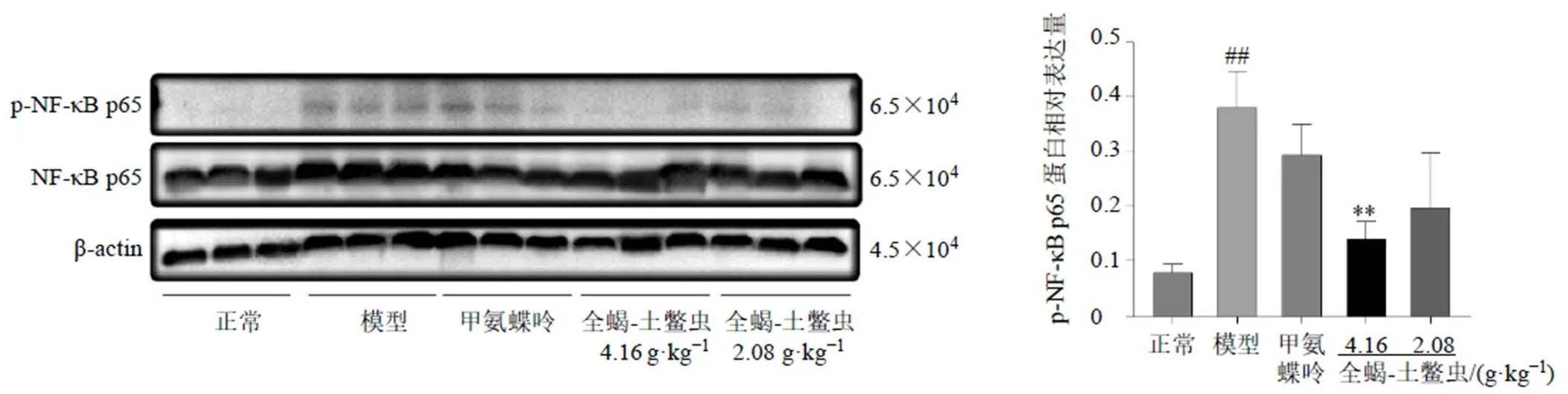
图9 全蝎-土鳖虫对CIA小鼠骨组织NF-κB通路相关蛋白表达的影响(, n = 3)
4 讨论
RA属中医痹症范畴,根据RA骨破坏的发展规律,其中医主要病机可概括为外邪(风、寒、湿为主)内侵,袭踞经隧,气血为邪所阻,周流不畅,湿停为痰,血停为淤,痰瘀交阻,凝涩不通,痹阻经络,病延日久,邪入骨骸,蓄于骨节,胶着不去,骨节肿痛,结节畸形,甚则溃破,最终导致骨质损伤,关节破坏。RA骨破坏患者常久痛多瘀,关节肿痛,功能障碍,缠绵不愈,多是病邪与瘀血凝聚骨节,胶结难解,常规草木之品,恒难凑效。须采用透骨搜络、涤痰化瘀之品,可搜剔深入骨骱之痰瘀,以蠲肿痛,利关节,壮筋骨。虫类善行,入药搜剔穿透力雄,为开闭解结之良药,能软坚除痰、破血消癥,治疗顽痹具有殊效[11]。
全蝎具有息风止痉、攻毒散结、通络止痛的功效,对于风寒湿痹久治不愈,筋脉拘挛,甚则关节变形之顽痹,作用颇佳。土鳖虫具有破血逐淤、消肿止痛、续筋接骨的功效。现代药理研究表明,全蝎具有免疫调节、镇痛、抗炎的作用[12-13],土鳖虫具有促进骨折愈合、抗血栓、免疫调节的作用[14]。临床上全蝎、土鳖虫配伍相须为用,能开坚结,祛瘀血,散顽风,消凝痰,对于难治性风湿入络、痰瘀互结之RA关节屈伸不利,甚至畸形者作用较好。
骨是一种动态组织,通过在破骨细胞与成骨细胞之间的平衡来持续重塑以保持骨骼的完整性。正常生理条件下,破骨细胞的骨吸收和成骨细胞的骨形成活动受到严格控制[15]。RA表现为慢性炎症,破坏了这种生理平衡,从而有利于骨吸收而不是骨形成。破骨细胞是唯一能进行骨吸收的细胞类型,大量证据表明,在关节炎动物模型中发现了具有破骨细胞表型的多核细胞[16-17]。破骨细胞的分化主要是由核因子受体激活剂RANKL调控,RANKL诱导了一些与破骨细胞活化有关的基因编码蛋白的表达,如组织蛋白酶-K、TRAP、破骨细胞相关Ig样受体(osteoclast-associated immunoglobulin-like receptor,OSCAR)和基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)等[18]。RANKL与其在单核破骨前体细胞上的特定受体RANK的结合启动了一系列转录变化,最终导致破骨细胞分化[19-20]。
RANKL与RANK结合激活的NF-κB信号通路在破骨细胞形成中起着关键作用[21-22]。NF-κB信号通路广泛存在于多种细胞过程中,包括各种免疫细胞的激活和分化过程、树突状细胞的成熟以及巨噬细胞的天然和获得性免疫途径[23]。NF-κB信号通路由NF-κB、IκB和IκB激酶(IκB kinase,IKK)组成。当细胞受到胞外信号刺激时可激活NF-κB经典信号通路,信号传递到IKK,IκB在IKK诱导下发生磷酸化而被降解,暴露NF-κB核转移定位信号区域,NF-κB活化进入细胞核,进而激活NF-κB信号通路[24]。NF-κB信号通路是细胞因子与炎症反应之间的桥梁。RA是一种与炎症相关的自身免疫性疾病,与NF-κB信号通路的过度激活密切相关[25]。本研究采用CIA小鼠模型及RANKL诱导的体外破骨细胞分化模型,确认了全蝎-土鳖虫药对治疗RA骨破坏的药效。全蝎-土鳖虫药对在整体动物水平上能显著抑制CIA模型小鼠的骨破坏,减少关节破骨细胞TRAP染色阳性细胞数量,改善关节病理。体外能显著抑制BMMs向破骨细胞的分化,并能降低破骨细胞分化的NF-κB p65、IκBα磷酸化水平,减少NF-κB p65的核定位,体内结果表明全蝎-土鳖虫高剂量组能显著降低CIA小鼠骨组织中NF-κB p65磷酸化水平,表明全蝎-土鳖虫药对可以通过抑制NF-κB信号通路,减少破骨细胞分化,进而抑制RA骨破坏。
综上,本研究针对全蝎-土鳖虫药对抑制RA骨破坏及其作用机制进行研究,结果表明,全蝎-土鳖虫药对作为临床常用动物药药对能够抑制RA骨破坏,表现为调控过度激活的NF-κB信号通路中p65、IκBα磷酸化水平,抑制破骨细胞的分化,降低CIA小鼠骨组织中p-NF-κB p65蛋白表达水平。提示全蝎-土鳖虫可能通过抑制NF-κB信号通路降低RA骨破坏。本研究为全蝎-土鳖虫药对临床治疗RA特别是有RA骨破坏放射学进展的患者,提供了组方遣药选择的理论依据,同时为该药对进一步开发成治疗RA骨破坏的药物提供了相关基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Carmona-Rivera C, Carlucci P M, Moore E,. Synovial fibroblast-neutrophil interactions promote pathogenic adaptive immunity in rheumatoid arthritis [J]., 2017, 2(10): eaag3358.
[2] McInnes I B, Schett G. Pathogenetic insights from the treatment of rheumatoid arthritis [J]., 2017, 389(10086): 2328-2337.
[3] McDonald M M, Khoo W H, Ng P Y,. Osteoclasts recycle via osteomorphs during RANKL-stimulated bone resorption [J]., 2021, 184(5): 1330-1347.
[4] Auréal M, Machuca-Gayet I, Coury F. Rheumatoid arthritis in the view of osteoimmunology [J]., 2020, 11(1): 48.
[5] Bae S, Zeng S, Park-Min K H. Nuclear receptors in osteoclasts [J]., 2020, 53: 8-17.
[6] Chen Y G, Xu E J, Sang M,. Makatoxin-3, a thermostable Nav1.7 agonist fromKarsch (BmK) scorpion elicits non-narcotic analgesia in inflammatory pain models [J]., 2022, 288: 114998.
[7] Haleagrahara N, Miranda-Hernandez S, Alim M A,. Therapeutic effect of quercetin in collagen-induced arthritis [J]., 2017, 90: 38-46.
[8] 马喆, 宋志敏, 韩雅馨, 等. 白芍总苷对胶原诱导性关节炎大鼠长期给药的组织分布研究[J]. 中草药, 2023, 54(10): 3167-3178.
[9] 徐叔云, 卞如濂, 陈修. 药理实验方法学 [M]. 第3版. 北京: 人民卫生出版社, 2001: 1861.
[10] Wu T L, Li F, Sha X,. A novel recombinant RANKL vaccine prepared by incorporation of an unnatural amino acid into RANKL and its preventive effect in a murine model of collagen-induced arthritis [J]., 2018, 64: 326-332.
[11] 林良佳. 虫类药治疗顽固性类风湿性关节炎疗效观察 [J]. 新中医, 2016, 48(7): 117-119.
[12] 白洁, 江华, 李强, 等. 蝎毒素对人T淋巴细胞系Jurkat E6-1细胞增殖的影响 [J]. 时珍国医国药, 2010, 21(12): 3112-3113.
[13] 徐龙生, 冯勤丽, 张小平, 等. 蜈蚣全蝎散镇痛效应及毒副作用实验研究 [J]. 中华全科医学, 2018, 16(3): 346-348.
[14] 刘丹, 李兴暖, 秦仲君, 等. 土鳖虫多肽的制备及免疫调节作用研究 [J]. 中药材, 2012, 35(9): 1382-1385.
[15] Bolamperti S, Villa I, Rubinacci A. Bone remodeling: An operational process ensuring survival and bone mechanical competence [J]., 2022, 10(1): 48.
[16] Gan K, Xu L X, Feng X K,. Celastrol attenuates bone erosion in collagen-induced arthritis mice and inhibits osteoclast differentiation and function in RANKL-induced RAW264.7 [J]., 2015, 24(2): 239-246.
[17] Li Y Q, Yang C, Jia K X,. Fengshi Qutong Capsule ameliorates bone destruction of experimental rheumatoid arthritis by inhibiting osteoclastogenesis [J]., 2022, 282: 114602.
[18] Tanaka Y, Ohira T. Mechanisms and therapeutic targets for bone damage in rheumatoid arthritis, in particular the RANK-RANKL system [J]., 2018, 40: 110-119.
[19] Takayanagi H. RANKL as the master regulator of osteoclast differentiation [J]., 2021, 39(1): 13-18.
[20] 李平顺, 王钢, 周孟茹. 基于RANKL-RANK-OPG环路探讨骨痨愈康丸改善肝肾亏虚型类风湿关节炎患者骨破坏机制研究 [J]. 中华中医药杂志, 2020, 35(3): 1603-1607.
[21] Tsukasaki M, Takayanagi H. Osteoimmunology: Evolving concepts in bone-immune interactions in health and disease [J]., 2019, 19(10): 626-642.
[22] 章平衡, 刘健, 谈冰, 等. 新风胶囊通过降低NF-κB通路活性改善类风湿关节炎患者血瘀状态 [J]. 中华中医药杂志, 2016, 31(11): 4684-4689.
[23] Liu S, Ma H X, Zhang H X,. Recent advances on signaling pathways and their inhibitors in rheumatoid arthritis [J]., 2021, 230: 108793.
[24] Hayden M S, Ghosh S. Shared principles in NF-κB signaling [J]., 2008, 132(3): 344-362.
[25] Sun S C. The non-canonical NF-κB pathway in immunity andinflammation [J]., 2017, 17(9): 545-558.
-drug pair inhibits NF-κB signaling pathway and alleviates bone destruction in collagen-induced arthritis mice
ZHAO Cheng-lei1, 2, HE Jing-jing1, WANG Xin-ying1, LU Man1, YANG Jie1, 2, CAO Peng1, 2, 3
1. Affiliated Hospital of Integrated Traditional Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China 2. Jiangsu Province Academy of Traditional Chinese Medicine, Nanjing 210028, China 3. College of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China
To investigate the effect of Quanxie ()-Tubiechong () drug pair on alleviating joint bone destruction in collagen-induced arthritis (CIA) mice and nuclear factor-κB (NF-κB) signaling pathway for osteoclast differentiation, and explore the mechanism therapy for treating rheumatoid arthritis.DBA/1J mice were randomly divided into normal group, model group,-low-and high-dose groups, and methotrexate group. Except for the normal group, the other groups were established with CIA models. The normal group and model group were treated with purified water, the other groups were treated with medication for four weeks. The swelling of toes of mice in each group was measured; Micro CT scanning method was used to reconstruct 3D images of mouse joints and analyze relevant bone parameters; HE staining was used to observe the pathological changes of the mouse ankle joint; Tartaric acid resistant acid phosphatase (TRAP) staining was used to detect the differentiation of osteoclast in joints.experimental study on the effect of-drug pair on receptor activator of nuclear factor-κB ligand (RANKL) treated mice bone marrow derived macrophages induced osteoclast. Immunofluorescence staining was used to detect NF-κB p65 nuclear localization. Western blotting was used to detect the differentiation of osteoclast and NF-κB signaling pathway related protein expressions in bone tissue of CIA mice.Each administration group significantly reduced toe swelling in CIA model mice (< 0.05, 0.01); Compared with model group, Micro-CT 3D reconstruction results showed that-drug pair significantly inhibited bone destruction in CIA model mice, preserved bone structural integrity of mice, and significantly improved bone parameters (< 0.05, 0.01);-drug pair significantly reduced the number of TRAP positive cells in joints (< 0.01);-drug pair high-dose group significantly decreased NF-κB p65 phosphorylation level in bone tissue of CIA mice (< 0.01). The results ofexperiment showed that-drug pair significantly inhibited the differentiation of osteoclast and NF-κB p65 nuclear localization; Compared with RANKL control group, p65 and inhibitor of nuclear factor-κB alpha (IκBα) phosphorylation levels were significantly decreased in-drug pair group (< 0.05, 0.01).-drug pair can alleviate bone damage in CIA mice, which may be through inhibiting NF-κB signaling pathway activation and reducing the differentiation of osteoclast.
-drug pair; rheumatoid arthritis; collagen-induced arthritis mice; osteoclast; NF-κB signaling pathway
R285.5
A
0253 - 2670(2023)17 - 5640 - 09
10.7501/j.issn.0253-2670.2023.17.017
2023-04-01
江苏省中医药科技发展专项(2020ZX16);国家自然科学基面上项目(81773973);南京中医药大学自然科学基金资助项目(XZR2021037)
赵呈雷,副研究员,硕士生导师,主要从事中药药理与新产品开发研究。E-mail: zhaocl292 @163.com
[责任编辑 李亚楠]

