紫芝菌株Gs-1液体培养产漆酶的培养基优化研究
杨创明,娄海伟,2*,李 阳,赵仁勇,2,牛永武,龚 颖,田双起*
1.河南工业大学 粮油食品学院, 河南 郑州 450001 2.河南工业大学 小麦和玉米深加工国家工程研究中心, 河南 郑州 450001
白腐真菌紫芝(Ganodermasinense)是中国特有的药食两用真菌品种之一,分类学上隶属于真菌界、担子菌门、伞菌纲、多孔菌目、灵芝科、灵芝属[1]。截至目前,在紫芝中发现了多种生物活性化合物,如三萜类、多糖、核苷酸、脂肪酸、活性肽等[2],故紫芝具有抗肿瘤、抗氧化、降血糖和降血脂等[3]生理功能。紫芝菌丝体在生长过程中会分泌漆酶(Laccase,Lac)、木质素过氧化酶(Lignin peroxidase,Lip)、锰过氧化物酶(Manganese peroxidase,Mnp)等胞外酶[4],这些酶能够将环境中的木质素、纤维素、半纤维素等大分子降解为小分子化合物,以供菌丝体吸收和利用[5]。其中,漆酶由于具有较高的氧化还原电势和良好的催化活性而受到学者们的广泛关注[6]。
漆酶是一种含铜的酚类氧化酶[7],由于其底物广泛,能催化氧化酚类、胺类及芳香类化合物,且能环境友好地将分子氧还原成水,被广泛应用于食品工业、药物合成、生物修复、生物传感器、污水处理和造纸等领域[8]。漆酶来源广泛,在植物、动物、细菌、真菌中均有发现,其中,白腐真菌是漆酶的主要生产者[9]。然而,白腐真菌在自然生长过程中所产漆酶的量和活力远远达不到工业化生产的需求[10],需要采用相应方式以提高漆酶活力。
目前提高漆酶活力的方式主要有两种:一种是宏观层面上,即对培养基优化[11]、培养条件优化[12]、向培养基中加入诱导物[13];另一种则是微观层面,即通过基因工程手段将漆酶基因进行克隆和异源表达[14]。前者具有操作简单且效果明显等优点,但大多数具有良好诱导效果的诱导物是人工合成的,通常价格昂贵且具有潜在毒性[15],将其加入培养基中,不仅增加生产成本,还影响漆酶制品的安全性并限制其应用领域(如食品工业和饲料工业)。后者则操作相对烦琐且不易找到合适的表达载体进行高效表达。因此,目前优化培养基或培养条件、筛选低成本且安全的诱导剂是提高菌株产漆酶的主要方式。
基于食品工业和饲料工业对绿色、安全、高活性漆酶的需求,作者以食用安全的紫芝菌株Gs-1为出发菌株,以无毒无害且成本较低的农副产品(如稻壳、大豆秸秆、玉米芯、麦麸、豆粕和花生壳等)作为诱导物,采用单因素试验和响应面试验设计优化紫芝Gs-1产漆酶的最适液体培养基(碳源、氮源、金属离子以及农副产品诱导物等),低成本生产绿色、安全且高活性的紫芝漆酶,以满足食品工业对漆酶的需求,同时为实现农副产品的高值化利用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
紫芝菌株Gs-1,保藏于河南工业大学粮油食品学院粮食资源转化与利用实验室。豆粕:山东香驰控股有限公司;稻壳、大豆秸秆、花生壳、木屑:连云港苏锐秸秆加工厂;玉米芯、麦麸:联丰农产品深加工厂。
1.1.2 试剂
葡萄糖、硫酸镁:分析纯,天津市科密欧化学试剂有限公司;蛋白胨:北京奥博星生物技术有限责任公司;酵母浸粉:安琪酵母股份有限公司;磷酸二氢钾、氢氧化钠:分析纯,天津市恒兴化学试剂制造有限公司;丁二酸:分析纯,成都艾科达化学试剂有限公司;愈创木酚:分析纯,上海麦克林生化科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200.0 g、葡萄糖20.0 g、硫酸镁1.5 g、磷酸二氢钾3.0 g、琼脂20.0 g,用蒸馏水定容至1 000 mL。
产酶培养基:马铃薯200.0 g、葡萄糖20.0 g、复合氮源(蛋白胨3.0 g、酵母粉3.0 g)、磷酸二氢钾3.0 g、硫酸镁1.5 g,用蒸馏水定容至1 000 mL。
1.2 仪器与设备
ZHJH-C1109C超净工作台:上海智城分析仪器制造有限公司;YXQ-LS立式压力蒸汽灭菌锅:上海博讯实业有限公司;5424高速离心机:德国Eppendorf公司;UV-2550紫外可见分光光度计:岛津企业管理(中国)有限公司;ZQZY-C8恒温振荡培养箱:上海知楚仪器有限公司;HH-4数显恒温水浴锅:上海华燕医疗器械有限公司;YS-08小型高速粉碎机:北京燕山正德机械设备有限公司。
1.3 方法
1.3.1 菌株活化
将紫芝菌株Gs-1接种于PDA培养基,于恒温培养箱中避光培养(25 ℃、7~10 d),待菌丝长满PDA平板后,用于后续试验。
1.3.2 产酶曲线的测定
用打孔器取5块8 mm×8 mm的菌丝块,接种于装有100 mL产酶培养基的250 mL锥形瓶中,25 ℃、180 r/min摇床避光培养11 d。48 h开始检测发酵液漆酶活力,然后每24 h检测一次,连续测量10 d,绘制产酶曲线。
1.3.3 生物量的测定
将发酵后的培养液倒入50 mL离心管中,离心(4 ℃、8 000 r/min、5 min)得到沉淀的菌丝体,将菌丝体用蒸馏水清洗5次,于70 ℃烘箱中烘至恒重,称量获得菌丝体干重(以g/L表示)。
1.3.4 单因素试验
以漆酶活力为指标,以不同碳源、氮源、金属离子、农副产品诱导物及其不同质量浓度为影响因子进行单因素试验,影响因子的设置如下。
碳源:分别以果糖、半乳糖、蔗糖、乳糖、麦芽糖、可溶性淀粉、糊精作为碳源,替代产酶培养基中的葡萄糖,添加量为20 g/L,确定最适碳源,同时设置最适碳源质量浓度分别为0、10、20、30、40、50、60 g/L,研究碳源种类和最适碳源质量浓度对紫芝菌株Gs-1产漆酶的影响。
氮源:分别以蛋白胨、胰蛋白胨、牛肉膏、酵母浸粉、硝酸铵、尿素、硫酸铵、氯化铵作为氮源,替代产酶培养基中的复合氮源,添加量为6 g/L,确定最适氮源,同时设置最适氮源质量浓度分别为0、2、4、6、8、10 g/L,研究氮源种类和最适氮源质量浓度对紫芝菌株Gs-1产漆酶的影响。
金属离子:分别以0.1、1.0、5.0 mmol/L的Fe3+、Fe2+、Cu2+、Mn2+、Zn2+、K+替代产酶培养基中的Mg2+,确定最适金属离子,同时设置最适金属离子浓度分别为0、0.5、1.0、1.5、2.0、2.5、3.0 mmol/L,研究不同种金属离子和最适金属离子浓度对紫芝菌株Gs-1产漆酶的影响。
农副产品诱导物:以无毒无害且成本较低的稻壳、大豆秸秆、木屑、玉米芯、麦麸、豆粕、花生壳等农副产品为诱导物,粒度为80~100目,添加量为20 g/L,确定最适农副产品诱导物,同时设置最适农副产品诱导物质量浓度分别为0、10、20、30、40、50、60 g/L,研究不同诱导物和最适诱导物质量浓度对紫芝菌株Gs-1产漆酶的影响。
1.3.5 响应面设计
在单因素试验基础上,选择影响较大的3个因素,采用响应面试验设计优化紫芝Gs-1产漆酶最适培养基条件。
1.3.6 粗酶液的制备
将发酵后的液体培养基倒入离心管中,离心(4 ℃、8 000 r/min、5 min)得到含漆酶的上清液,然后采用0.22 μm微孔滤膜过滤上清液,获得的滤液用于漆酶活力测定。
1.3.7 漆酶活力的测定方法
采用愈创木酚法[16]测定粗酶液中漆酶的活力。反应体系为3 mL,含1 mmol/L愈创木酚的丁二酸-氢氧化钠缓冲液2.4 mL,粗酶液0.6 mL。反应时间为30 min,反应温度为30 ℃。待反应完成后,立即测定反应体系在465 nm处的吸光度(OD465)。漆酶活力的定义:在上述测定条件下,每分钟水解1 μmol愈创木酚所需漆酶的量定义为一个酶活力单位(U)。酶活力计算公式如下:
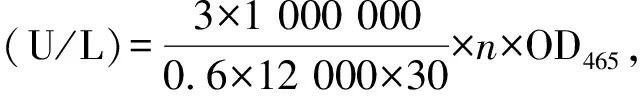
式中:3为反应液总体积,mL;0.6为反应体系中酶的量,mL;12 000为摩尔消光系数;30为反应时间,min;1 000 000为μmol与mol的换算系数;n为酶液稀释倍数。
1.4 数据分析
试验设置3个重复,数据以平均值±标准差表示。用Origin 2018软件作图,采用Design-Expert 8.0.6.1进行响应面设计,采用IBM SPSS 26进行数据处理及显著性分析。
2 结果与分析
2.1 产酶曲线的测定
紫芝菌株Gs-1分泌漆酶的曲线见图1,漆酶活力和生物量随发酵时间的延长而增大。在前3 d,漆酶活力和生物量均很低,从第4 天开始,漆酶活力和生物量逐渐增加,在第8 天漆酶活力达到最大值(256.50 U/L);当发酵时间超过8 d时,随着时间的延长,漆酶活力逐渐降低,而生物量无显著变化,这可能是因为随着紫芝Gs-1的生长,菌丝球增加,其胞外漆酶活性也逐渐变大,在第8 天达到峰值,随后由于菌丝球出现自融的情况,酶活力逐渐降低[17]。因此,选择第8 天作为后续试验的发酵产漆酶时间。
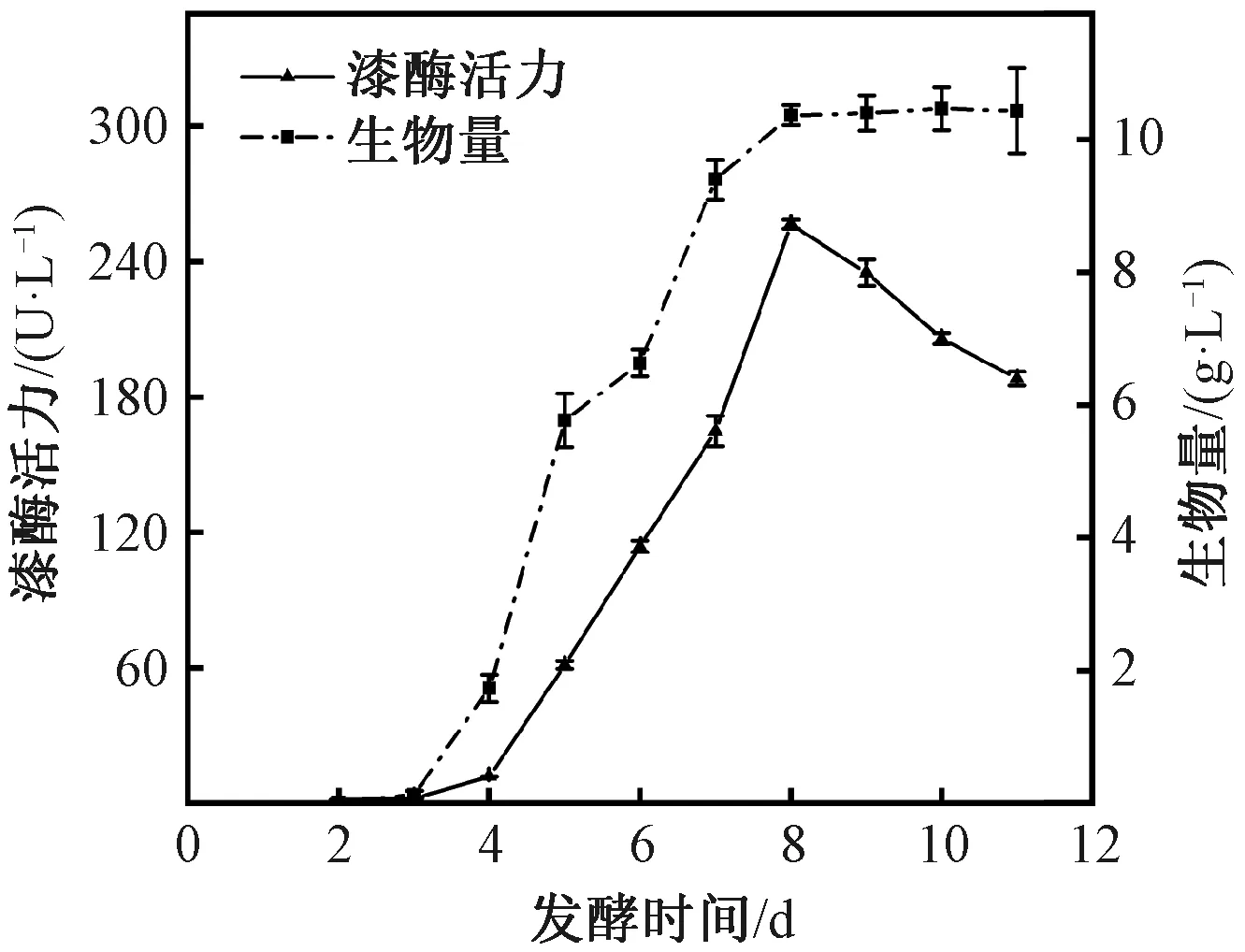
图1 紫芝Gs-1产漆酶曲线Fig.1 Curves of laccase secreted by G. sinense Gs-1
2.2 单因素试验
2.2.1 碳源对紫芝菌株Gs-1产漆酶的影响
由图2(a)可知,在单糖(葡萄糖、果糖、半乳糖)中,葡萄糖对紫芝菌株Gs-1产漆酶的影响最大,其次是果糖和半乳糖。在二糖(蔗糖、乳糖、麦芽糖)中,对紫芝产漆酶影响最大的是麦芽糖,其次分别为乳糖和蔗糖。在多糖(可溶性淀粉、糊精)中,可溶性淀粉对紫芝产漆酶活力的影响大于糊精。总体而言,对紫芝菌株Gs-1产漆酶影响最大的是葡萄糖,可能原因是葡萄糖作为生物体主要供能物质,较易被紫芝Gs-1吸收利用,为紫芝菌丝体的生长和胞外漆酶的分泌提供碳骨架和能量[18]。刘晓雪等[19]在优化平菇产漆酶的培养基时,发现葡萄糖为最佳碳源,漆酶活力最高达到189.72 U/g,杜杰克等[20]优化TrametessanguineaWTFA5产漆酶培养基时,同样发现葡萄糖为最佳碳源,漆酶活力最高达到755 U/L。因此,选择葡萄糖作为紫芝菌株Gs-1产漆酶的最适碳源。
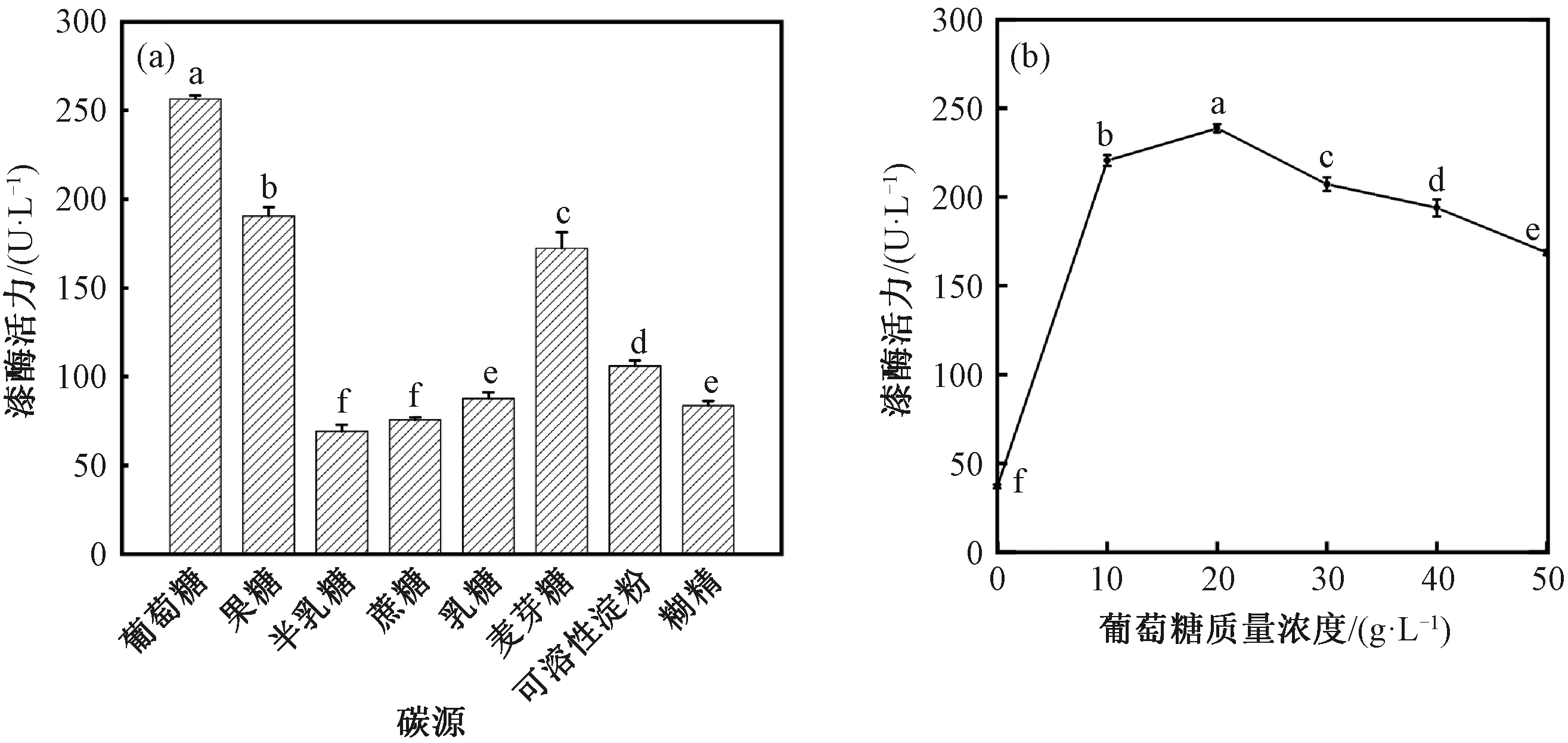
注:不同字母表示数据差异显著(P<0.05)。图3—图5同。图2 碳源和葡萄糖质量浓度对紫芝Gs-1产漆酶的影响Fig.2 Effects of carbon sources and glucose concentration on the secretion of laccase by G. sinense Gs-1
由图2(b)可知,葡萄糖质量浓度对紫芝产漆酶有显著影响,当葡萄糖质量浓度为20 g/L时,漆酶活力达到最大值238.72 U/L;当葡萄糖质量浓度小于20 g/L时,漆酶活力随着葡萄糖质量浓度的增加而增加,这可能是因为葡萄糖作为速效碳源有利于紫芝Gs-1菌丝体的吸收利用,从而影响其次级代谢,使漆酶活力增加;当葡萄糖质量浓度大于20 g/L时,漆酶活力随着葡萄糖质量浓度的增加而降低,这可能是因为培养基的渗透压随葡萄糖浓度的增大而变大,影响紫芝Gs-1的生长代谢,从而导致漆酶活力降低[21]。Othman等[22]研究不同浓度葡萄糖对TrichodermaharzianumS7113产漆酶活力的影响,发现T.harzianumS7113产漆酶的最佳葡萄糖质量浓度为15 g/L。Kang等[23]研究在不同温度下,不同浓度葡萄糖对漆酶活力的影响,发现葡萄糖浓度为0.1 mol/L时,漆酶活性达到最大。因此,最佳葡萄糖质量浓度为20 g/L。
2.2.2 氮源对紫芝菌株Gs-1产漆酶的影响
由图3(a)可知,有机氮源(蛋白胨、酵母粉、牛肉膏、胰蛋白胨、尿素)对紫芝产漆酶的影响由大到小依次为胰蛋白胨、牛肉膏、酵母浸粉、蛋白胨、复合氮源(蛋白胨+酵母浸粉)、尿素,无机氮源对紫芝产漆酶的影响由大到小依次为硝酸铵、氯化铵、硫酸铵。总体而言,除尿素外,有机氮源较无机氮源更有利于紫芝Gs-1分泌漆酶,可能的原因是:尿素和无机氮源(硫酸铵、硝酸铵、氯化铵)的成分较单一,而本研究所用有机氮源(尿素除外)均含有丰富的氨基酸等营养因子,相比于无机氮源,能更好地促进紫芝Gs-1分泌胞外漆酶;由于不同菌株的生长和次级代谢对氮源的需求不同,因此,在不同氮源种类条件下,紫芝分泌胞外漆酶的能力存在显著差异[24]。因此,胰蛋白胨最有利于紫芝Gs-1分泌胞外漆酶,这与孙瑞雪等[25]的研究结果一致。

图3 氮源和胰蛋白胨质量浓度对紫芝Gs-1产漆酶的影响Fig.3 Effects of nitrogen sources and tryptone concentration on the secretion of laccase by G. sinense Gs-1
由图3(b)可知,随着胰蛋白胨质量浓度的增加,发酵液中紫芝漆酶的活力先升高后降低,当胰蛋白胨质量浓度为4 g/L时,紫芝漆酶的活力达到最大值(514.39 U/L),但与胰蛋白胨浓度为2 g/L时的漆酶活力无显著差异。胰蛋白胨质量浓度为0 g/L,漆酶活力能达到479.67 U/L,比胰蛋白胨添加量为6 g/L时的漆酶活力高,这表明胰蛋白胨的过量添加对紫芝Gs-1分泌漆酶有抑制作用。考虑生产成本因素,因此选取2 g/L的胰蛋白胨进行后续试验。
2.2.3 金属离子对紫芝菌株Gs-1产漆酶的影响
由图4(a)可知,随着金属离子浓度的增加,漆酶活力均呈现先升高后降低的趋势,且都在1.0 mmol/L时达到最大酶活力。当金属离子浓度为0.1、1 mmol/L时,Cu2+对紫芝分泌漆酶影响均最大;当金属离子浓度为5.0 mmol/L时,不同金属离子对紫芝分泌漆酶的影响由大到小依次为Mg2+、Fe3+、Mn2+、Fe2+、K+、Cu2+、Zn2+。总体而言,Cu2+最有利于紫芝Gs-1分泌漆酶,因此选择Cu2+作为最适金属离子并进行浓度梯度试验。
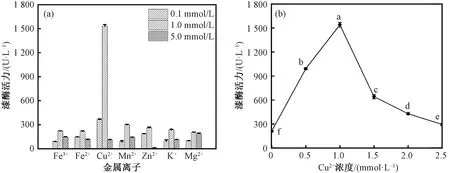
图4 金属离子和Cu2+浓度对紫芝Gs-1漆酶的影响Fig.4 Effects of metal ions and Cu2+ concentration on the secretion of laccase by G. sinense Gs-1
由图4(b)可知,紫芝Gs-1胞外漆酶的活力随着Cu2+浓度的增加而呈现先升高后降低的趋势,在Cu2+浓度为1.0 mmol/L时,紫芝胞外漆酶的活力达到最大值1 540.86 U/L。当Cu2+浓度小于1.0 mmol/L时,紫芝漆酶活力随着Cu2+浓度的增加而升高,这可能是因为漆酶属于铜蓝蛋白家族[26],其分子结构中包含铜原子,培养基中的Cu2+是紫芝合成漆酶所必需的元素,低浓度的Cu2+会促进紫芝合成并向胞外分泌漆酶,从而使发酵液中的漆酶活力增加[27];当Cu2+浓度大于1.0 mmol/L时,紫芝漆酶活力随着Cu2+浓度的增加而降低,这可能是因为高浓度的Cu2+会对细胞产生毒性,不利于紫芝菌丝球的生长和胞外漆酶的分泌,从而使发酵液中的漆酶活力降低[28]。因此选取Cu2+浓度为1.0 mmol/L。
2.2.4 农副产品诱导物对紫芝菌株Gs-1产漆酶的影响
由图5(a)可知,不同的农副产品诱导物均可显著促进紫芝Gs-1分泌胞外漆酶,诱导物对紫芝产漆酶的影响由大到小依次为豆粕、大豆秸秆、花生壳、稻壳、麦麸、木屑、玉米芯。其中,在产酶培养基中添加豆粕,可使紫芝胞外漆酶的活力达到最大值3 065.06 U/L,较对照组的漆酶活力(249.56 U/L)提高了约11.28倍。在上述农副产品诱导物中,豆粕对紫芝Gs-1分泌胞外漆酶的诱导效果最佳,因此选择豆粕作为最适诱导物进行后续试验。
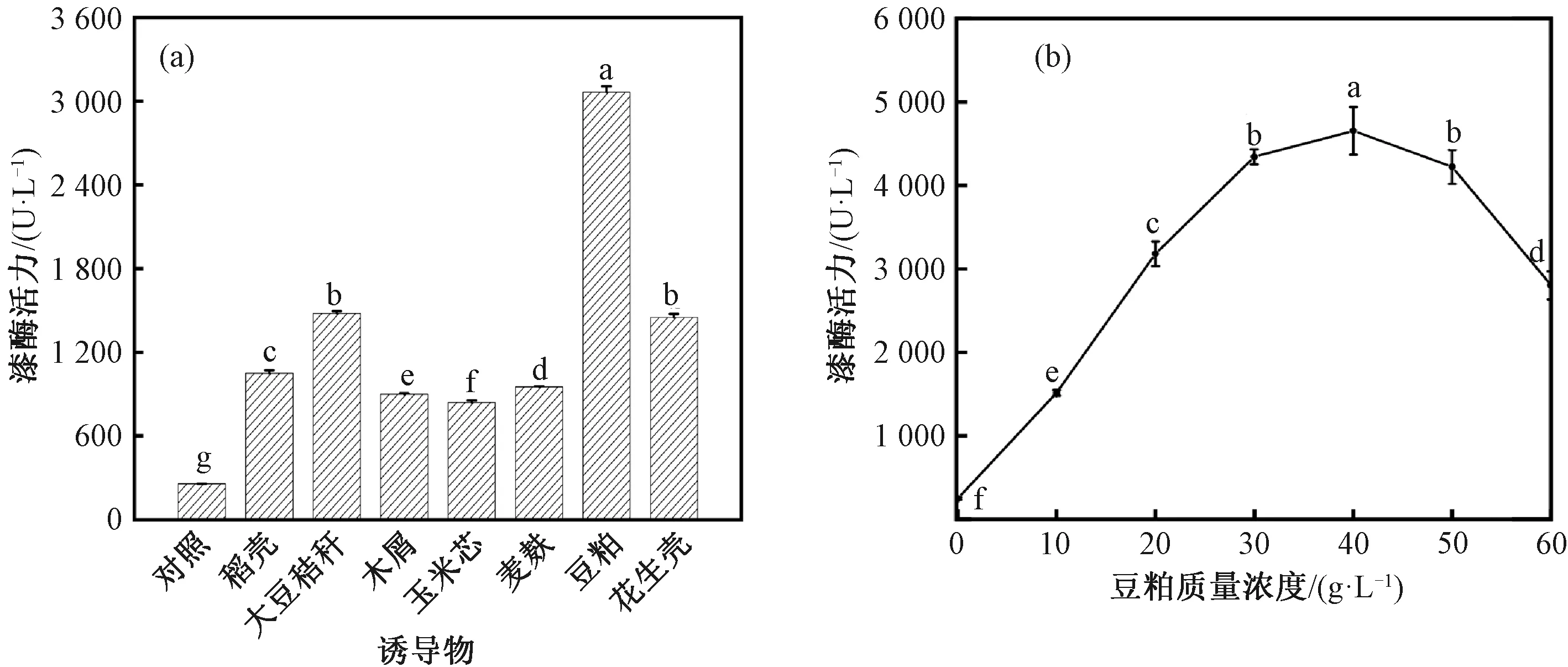
图5 农副产品诱导物和豆粕质量浓度对紫芝Gs-1产漆酶的影响Fig.5 Effects of agricultural by-products as inducers and soybean meal concentration on the secretion of laccase by G. sinense Gs-1
由图5(b)可知,豆粕质量浓度显著影响发酵液中的紫芝漆酶活力。当豆粕质量浓度小于40 g/L时,漆酶活力随着豆粕质量浓度的增加而增加,这可能是因为豆粕中含有丰富的氨基酸和酚类物质,且生产豆粕过程中的热处理可使芳香族氨基酸转化为具有酚类结构的化合物[29],酚类物质和具有酚类结构的化合物的增加,诱导了紫芝Gs-1胞外漆酶的分泌;当豆粕质量浓度为40 g/L时,漆酶活力达到最大值4 653.15 U/L;当豆粕质量浓度大于40 g/L时,漆酶活力随着豆粕质量浓度的增加而降低,这可能是因为豆粕质量浓度过高,导致产酶培养基过于黏稠,影响摇瓶发酵过程中的传质速率(包括营养成分的传递和氧气的传递),进而影响紫芝Gs-1胞外漆酶的分泌。窦欣[30]研究不同豆粕质量浓度对菌株Ganodermasp. SYBC L48液体发酵产漆酶的影响,发现豆粕质量浓度为6 g/L时,菌株Ganodermasp. SYBC L48的漆酶活力达到最大。Colla等[31]以豆粕为氮源、蔗渣为碳源,采用固态发酵法研究不同碳氮比对菌株Lentinuscrinitus发酵过程中漆酶活力的影响,发现随豆粕浓度的增加漆酶活力先增加后降低,在豆粕含量为15%、甘蔗渣含量为85%条件下,培养5 d时达到最大酶活力。由此可见,豆粕作为天然、绿色诱导剂可以诱导不同菌株高产漆酶,可替代高成本的人工合成诱导剂以降低生产成本,同时也为拓展豆粕的应用方向提供思路。因此选豆粕质量浓度为40 g/L。
2.3 响应面试验
2.3.1 响应面试验设计
在单因素试验可知,葡萄糖质量浓度、Cu2+浓度、豆粕质量浓度对Gs-1产漆酶活力影响高于胰蛋白胨,因此选择这3个因素为自变量,以漆酶活力为响应值,采用Box-Behnken试验设计优化紫芝Gs-1产漆酶的最适培养基条件,具体设计见表1。

表1 Box-Behnken试验设计Table 1 Experimental design of Box-Behnken
2.3.2 响应面试验结果与回归模型分析
响应面试验设计与结果见表2。经回归分析得到回归方程为Y= 6 506.08-244.81X1+239.02X2-403.97X3+263.91X1X2-121.54X1X3+19.68X2X3-723.90X12-649.82X22-264.37X32。
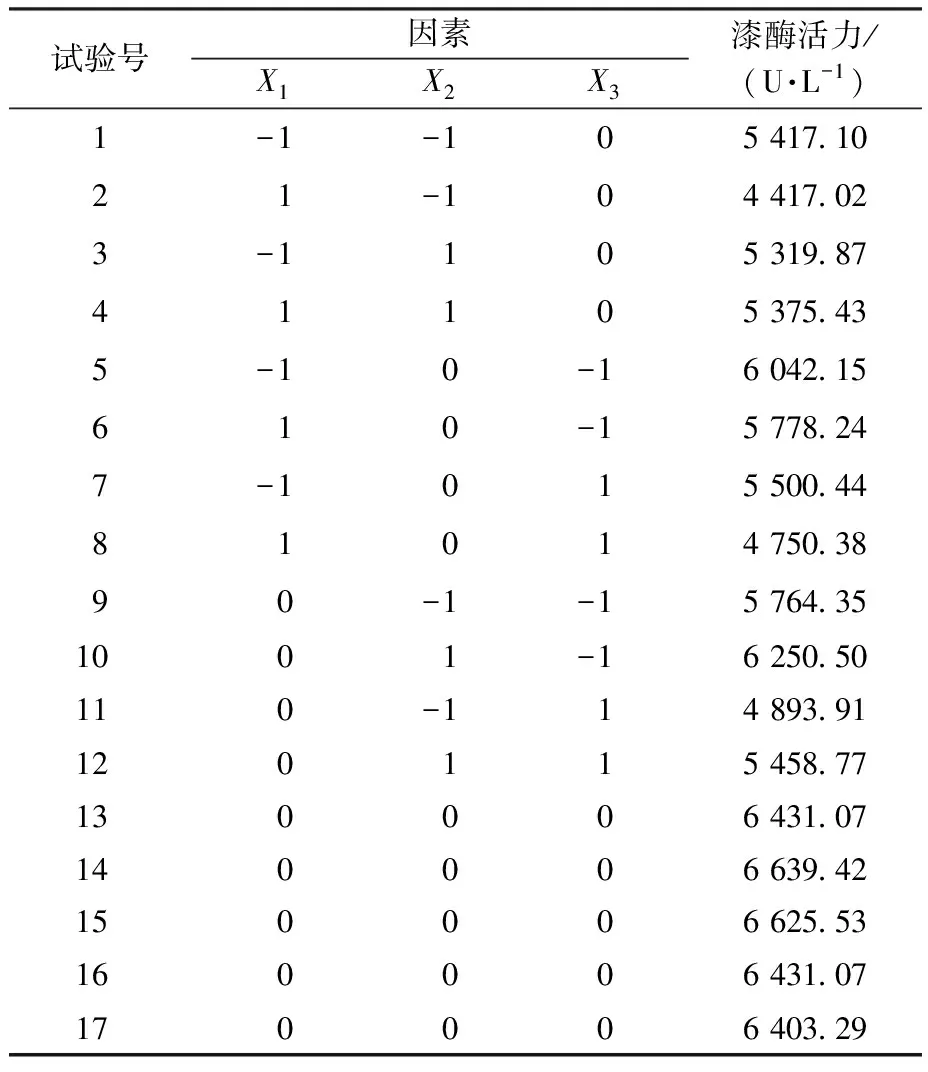
表2 响应面试验设计与结果Table 2 Design and results of response surface experiment


表3 回归模型方差分析Table 3 Analysis of variance of regression model
2.3.3 交互作用结果分析
各因素之间的交互作用对紫芝漆酶活力的影响的响应面见图6,漆酶活力随着葡萄糖质量浓度、Cu2+浓度以及豆粕质量浓度的增加呈现先升高后降低的趋势,说明此模型有极大值。从响应面陡峭程度来看,随Cu2+浓度和葡萄糖质量浓度的增加,漆酶活力变化起伏较大;随着豆粕质量浓度的增加,漆酶活力变化相对平缓。葡萄糖质量浓度与Cu2+浓度的交互作用>葡萄糖质量浓度与豆粕质量浓度的交互作用>Cu2+浓度与豆粕质量浓度的交互作用,此结果与表3方差分析结果一致。

图6 各因素交互作用对紫芝Gs-1漆酶活力影响的响应面Fig.6 Response surface plots of the interaction of various factors on laccase activity of G. sinense Gs-1
2.3.4 验证试验
基于Box-Behnken设计的试验结果,采用软件Design-Expert 8.0.6.1优化紫芝菌株Gs-1产漆酶的最适液体培养基,优化的最适液体培养基条件:葡萄糖质量浓度19.21 g/L、Cu2+浓度1.08 mmol/L、豆粕质量浓度32.59 g/L。在此优化条件下,紫芝漆酶活力的预测值为6 683.91 U/L,在优化条件下进行验证试验,测得紫芝漆酶活力的实测值为6 787.58 U/L。紫芝漆酶活力的预测值和实测值之间的相对误差仅为1.55%,无显著差异,表明建立的模型具有较好的实用性。紫芝菌株Gs-1在未优化培养基中所产胞外漆酶活力为256.50 U/L,优化后的漆酶活力(6 787.58 U/L)是优化前漆酶活力的26.46倍,漆酶活力显著提高。
3 结论
培养基是影响紫芝产漆酶的重要因素,本研究优化了紫芝菌株Gs-1产漆酶的最适液体培养基条件。采用单因素试验研究碳源、氮源、金属离子和农副产品诱导物对紫芝Gs-1产漆酶的影响,基于单因素试验结果,采用Box-Behnken试验设计优化并确定了紫芝Gs-1产漆酶的最适液体培养基为葡萄糖质量浓度19.21 g/L、胰蛋白胨质量浓度2.0 g/L、Cu2+浓度1.08 mmol/L、豆粕质量浓度32.59 g/L。在优化的液体培养基条件下,紫芝Gs-1发酵液中的漆酶活力达到了6 787.58 U/L,是未优化液体培养基中漆酶活力的26.46倍,效果极为显著。本研究采用了食用安全且成本低廉的豆粕作为诱导物,显著促进了紫芝分泌胞外漆酶,极大提高了液体培养基中漆酶的活力,显著优越于成本较高且具潜在毒性的人工合成诱导物。本研究优化的液体培养基,未采用有毒、有害成分,因此生产的紫芝漆酶可应用于食品工业和饲料工业,应用前景广阔。

