TKI治疗EGFR基因突变非小细胞肺癌患者疗效与PD-L1表达的关系*
马好霞,李进磊,王丽雁
晋城市人民医院肿瘤科,山西晋城 048000
非小细胞肺癌(NSCLC)为临床常见恶性肿瘤,其生长速度快,恶性程度高,可严重危害患者的生命安全[1]。手术和联合化疗是目前肺癌的主要治疗方案,但约70%患者确诊时已为中晚期,无手术机会,而一线化疗的患者中位生存期仅为8~10个月[2-3]。众多研究表明,表皮生长因子受体(EGFR)基因突变的NSCLC患者对酪氨酸激酶抑制剂(TKI)类药物的反应性良好,可作为NSCLC的靶向治疗药物,延长EGFR基因突变NSCLC患者无进展生存期(PFS)[4-5]。而程序性死亡配体-1(PD-L1)是免疫调节的重要通路,可参与肿瘤的免疫逃逸过程。既往文献报道PD-L1表达与EGFR基因突变NSCLC患者临床病理相关,而关于PD-L1表达与EGFR-TKI疗效之间的关系研究较少。基于此,本研究探讨EGFR基因突变NSCLC患者采用TKI治疗疗效与PD-L1表达的相关性,以期为EGFR-TKI靶向治疗的个体化治疗提供参考。现报道如下。
1 资料与方法
1.1一般资料 对2016年7月至2017年7月在本院进行治疗的EGFR基因突变NSCLC患者88例进行临床及随访研究。纳入研究患者中,男48例,女40例;年龄58~78岁,平均(69.89±7.22)岁。纳入标准:(1)经病理组织证实为NSCLC;(2)直接测序法(二代测序)验证为EFGR基因突变阳性;(3)预计生存期>3个月;(4)世界卫生组织体力状况评分(ECOG)0~2分;(5)对本次研究知情、同意。排除标准:(1)重要脏器功能不全者;(2)其他恶性肿瘤者;(3)血液系统疾病者;(4)不愿配合沟通者。本研究经患者或者其家属知情同意,并经过本院伦理委员会批准实施。
1.2治疗方法 对经二代测序技术验证EGFR基因突变的NSCLC患者给予吉非替尼(250 mg,1次/天)或埃克替尼药物(125 mg,3次/天)治疗。从患者服药开始后每间隔1个月进行1次胸部CT影像学检查,并按照实体肿瘤疗效评价标准(RECIST)评价治疗效果。
1.3仪器与试剂 恒温箱(GD100-P12,英国)、切片机(Leica RM2235,德国)、显微镜(OLYMPUS,日本)、PCR仪(上海之江生物科技股份有限公司)、兔抗人PD-L1单克隆抗体、DAB显色剂、PBS、固定液、梯度乙醇、修复液、二甲苯(试剂盒均供自丹麦Dako公司)、DNA分离试剂盒(试剂盒购自于艾德生物医药科技有限公司)。
1.4PD-L1表达检测 免疫组织化学法:采用Max Vision法,组织切片常规脱蜡、水化、抗原修复、滴加一抗及二抗、DAB显色后行苏木精复然、封片、镜检。提取DNA后实施荧光定量PCR检测PD-L1。结果评判标准:PD-L1表达以细胞膜和细胞质呈棕黄色或棕褐色颗粒为阳性,见图1、2。

注:A为组织形态;B为PD-L1强阳性;C为PD-L1弱阳性;D为PD-L1阴性。
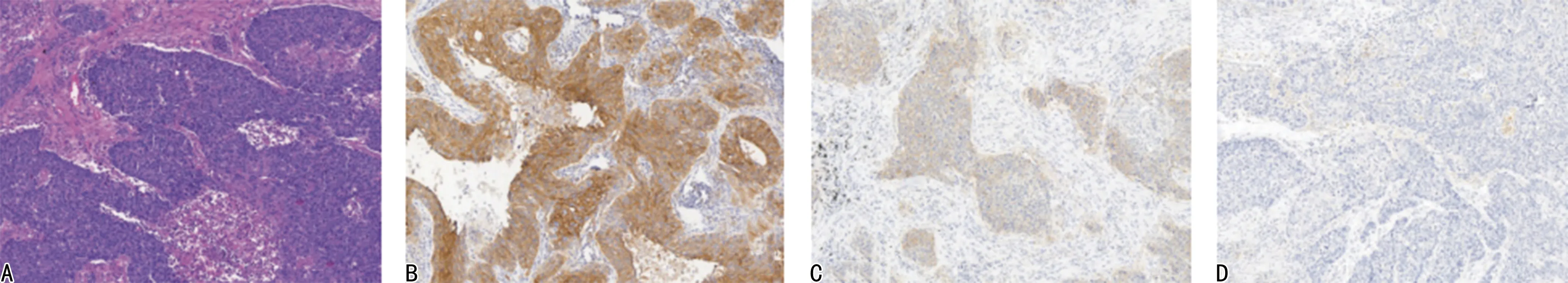
注:A为组织形态;B为PD-L1强阳性;C为PD-L1弱阳性;D为PD-L1阴性。
1.5观察指标 (1)疗效:治疗第1个月后,对患者均进行门诊复查,之后每2~3个月进行1次随访,根据RECIST1.1版实体瘤疗效评价标准中完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)评估疗效。其中客观缓解率(ORR)=(CR例数+PR例数)/总例数×100%,疾病控制率(DCR)=(CR例数+PR例数+SD例数)/总例数×100%。(2)治疗前与治疗3个月后采集空腹静脉血,分离血清,取上清液-70 ℃冻存,测定细胞角蛋白19片段(CYFRA21-1)水平。CYFRA21-1水平>6 ng/mL为水平增高,CYFRA21-1水平≤6 ng/mL为水平正常。(3)生存时间分析:治疗后通过门诊、电话访问等方式对患者随访5年(60个月),随访截止至2022年7月31日,记录两组患者PFS、总生存时间(OS),终点事件分别为肿瘤进展与死亡或随访结束。
1.6统计学处理 采用IBMSPSS22.0软件分析数据,计数资料用频数或百分率表示,组间比较采用χ2检验;EGFR基因突变NSCLC患者疗效的影响因素采用二元Logistic回归分析,生存时间采用Kaplan-Meier法分析,组间累积生存概率比较采用Log-Rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1TKI治疗短期疗效 经治疗后,88例EGFR基因突变NSCLC患者中CR 2例(2.27%)、PR 40例(45.45%)、SD 18例(20.45%)、PD 28例(31.82%),ORR为47.73%(42例),DCR为68.18%(60例)。88例患者治疗中发生腹泻6例、皮疹4例、呕吐8例、黏膜炎3例、末梢神经炎3例、中性粒细胞减少4例,其中呕吐及中性粒细胞减少各1例达到3级不良反应级别。药物毒性反应经药物减量或暂停及对症处理后好转,均未出现药物毒性反应相关死亡病例。88例EGFR基因突变NSCLC患者中49例血清CYFRA21-1表达水平正常,39例CYFRA21-1水平升高,其中血清CYFRA21-1水平正常及升高者的PFS分别为15个月及11个月(P<0.05)。
2.2EGFR基因突变NSCLC患者疗效单因素分析 单因素结果显示,不同性别、年龄、吸烟情况、病理类型、肿瘤最大径、分化程度、ECOG及突变类型的EGFR基因突变NSCLC患者的疗效比较差异均无统计学意义(P>0.05),但不同临床分期、淋巴转移及PD-L1表达的患者疗效比较差异有统计学意义(P<0.05)。见表1。
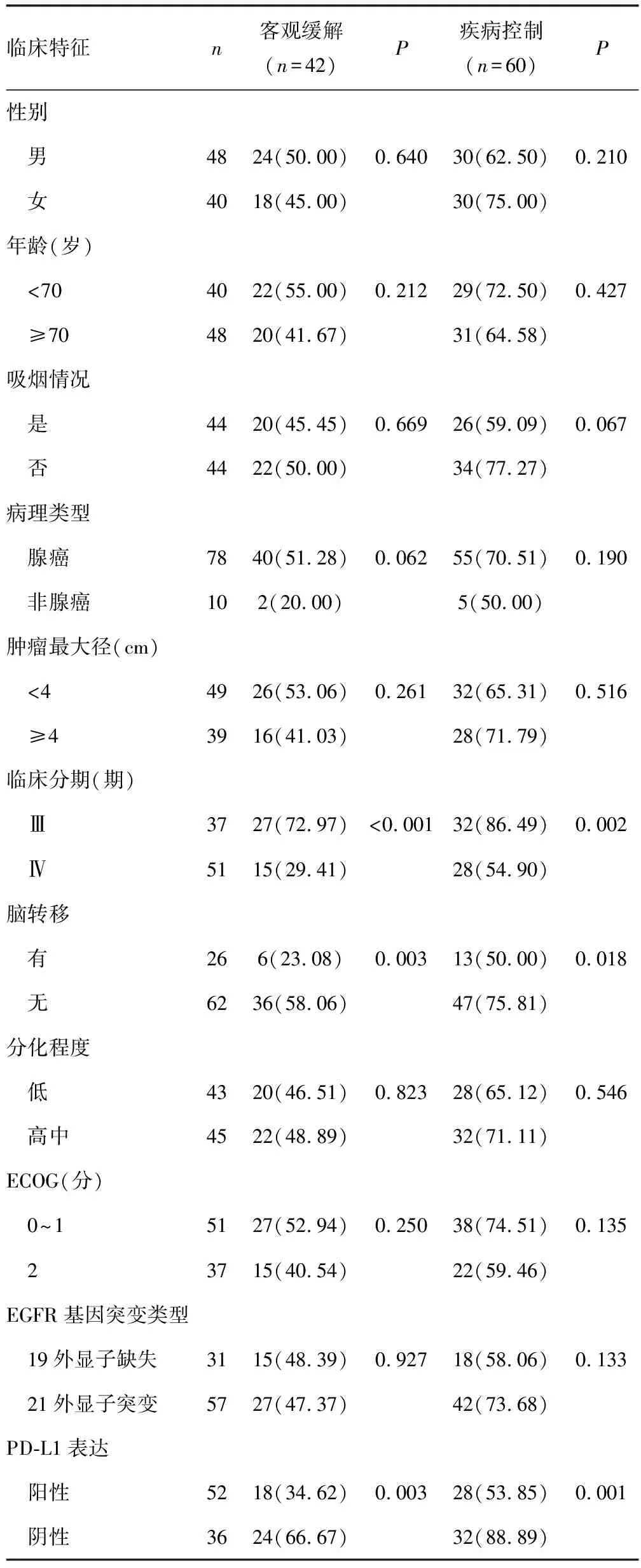
表1 EGFR基因突变的NSCLC患者疗效单因素分析[n(%)]
2.3EGFR基因突变NSCLC患者疗效多因素分析 以“ORR”为因变量(赋值:0=是,1=否),以“病理类型、临床分期、脑转移、PD-L1表达”为自变量,纳入Logistic回归分析。结果显示,腺癌、临床分期Ⅲ期为ORR的保护因素(OR=0.226、0.135,P<0.05),PD-L1阳性、脑转移为ORR的危险因素(OR=4.461、9.120,P<0.05)。以“DCR”为因变量(赋值:0=是,1=否),以“病理类型、临床分期、脑转移、PD-L1表达”为自变量,纳入Logistic回归分析。结果显示,腺癌、临床分期Ⅲ期为DCR的保护因素(OR=0.139、0.192,P<0.05),PD-L1阳性、脑转移为DCR的危险因素(OR=10.668、10.296,P<0.05)。见表2。
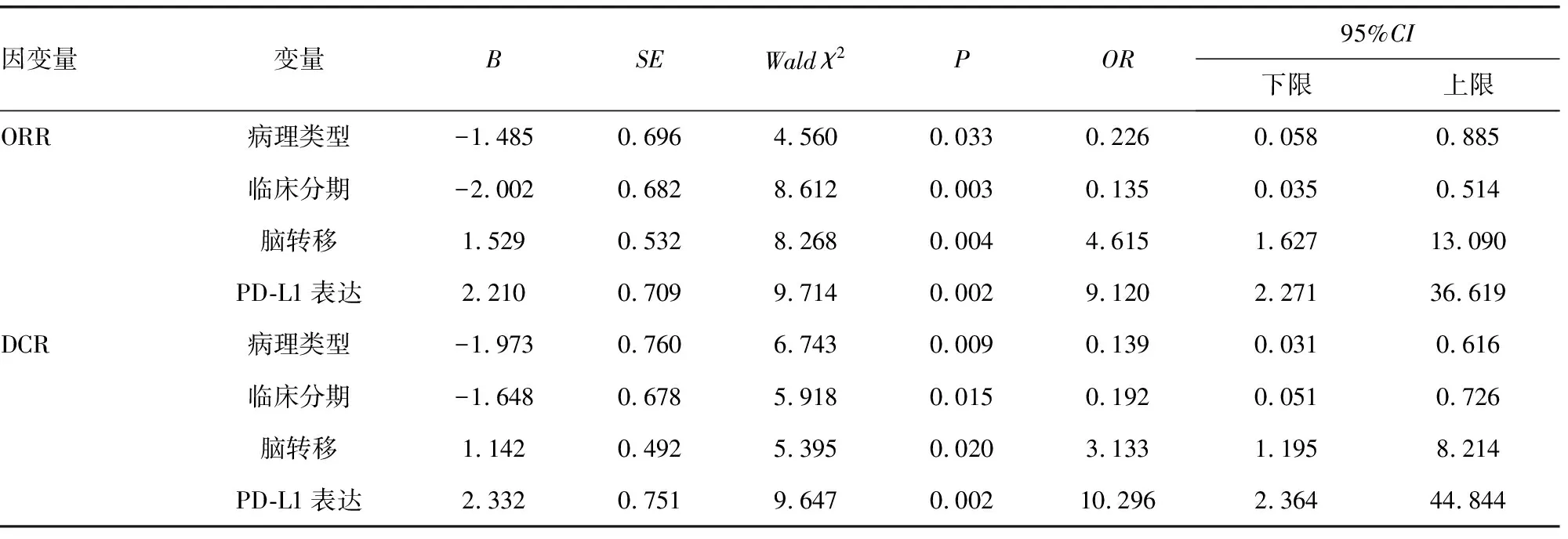
表2 EGFR基因突变NSCLC患者疗效多因素分析
2.4PD-L1表达与NSCLC临床病理特征关系 单因素分析结果显示,不同性别、年龄、吸烟情况、病理类型、肿瘤最大径、分化程度、ECOG及EGFR基因突变类型的EGFR基因突变NSCLC患者的PD-L1阳性率比较差异均无统计学意义(P>0.05);但有脑转移的患者PD-L1阳性率高于无脑转移者(P<0.001)。见表3。
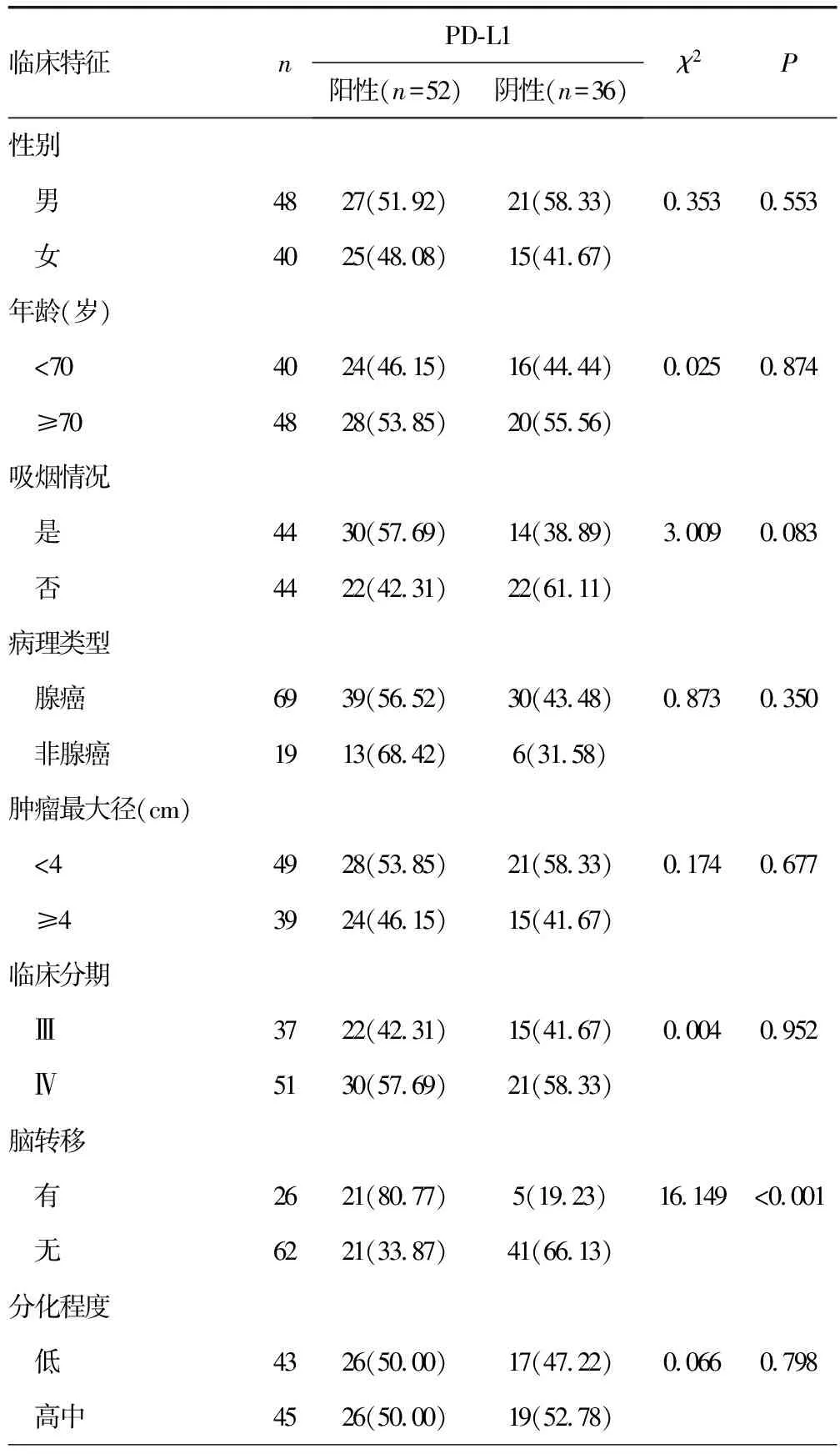
表3 PD-L1表达与EGFR基因突变的NSCLC临床病理特征关系[n(%)]
2.5PD-L1表达生存分析 随访结束至2021年7月,其中PD-L1阴性组患者失访3例,平均随访6~60个月,中位随访时间20个月,无疾病进展16例,中位PFS为15个月;PD-L1阳性组患者失访2例,平均随访5~60个月,中位随访时间16个月,无疾病进展10例,中位PFS为11个月。PD-L1阴性患者PFS及OS均高于阳性患者,Log-Rank检验显示两组PFS生存曲线、OS生存曲线差异均有统计学意义(P<0.05)。见图3、4,表4。
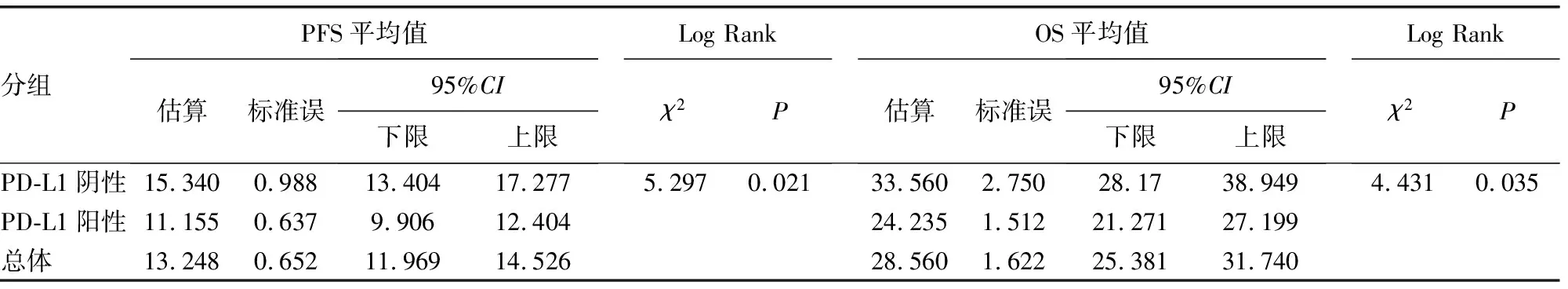
表4 生存时间的平均值与中位值
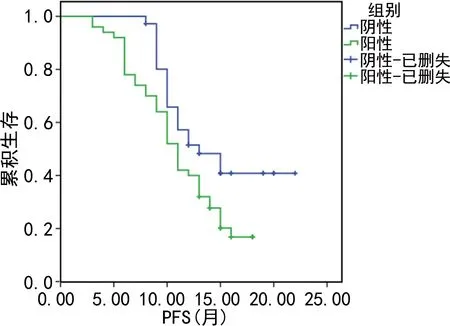
图3 PD-L1表达与PFS生存曲线的关系
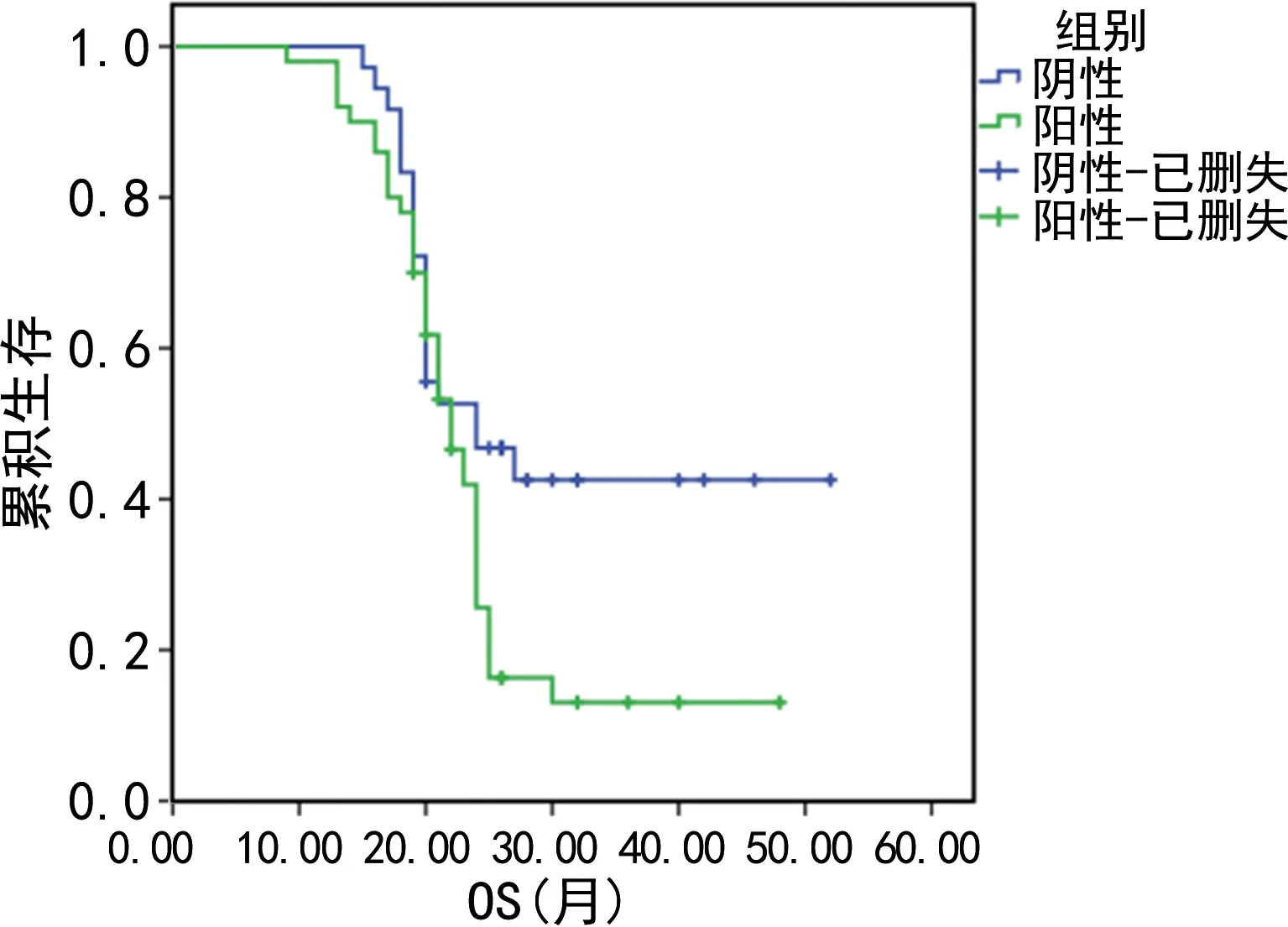
图4 PD-L1表达与OS生存曲线的关系
3 讨 论
EGFR为细胞膜表面的糖蛋白受体,属酪氨酸激酶受体家族中的一员,在NSCLC细胞膜表面表达阳性率可达40%~80%[6]。已有研究指出,EGFR可与其配体EGF进行结合,进而促进配体酪氨酸的自身磷酸化,造成下游信号通路如PI3K/AKt和Ras/Raf/MAP激酶通路的活化,进一步促进肿瘤细胞的生长及转移[7-9]。2012年NSCLC临床实践指南指出,对于晚期、复发的EGFR基因突变的NSCLC患者,TKI为一线治疗药物,其可通过与细胞内酪氨酸激酶结构域上ATP位点竞争性结合,抑制EGFR自身磷酸化,达到阻断酪氨酸激酶活化及下游信号通路传导,进而抑制肿瘤细胞周期进程的作用[10]。本研究结果显示,经治疗后,88例EGFR基因突变NSCLC患者中ORR为47.73%,DCR为68.18%,与上述观点一致。对于EGFR基因突变的晚期NSCLC患者而言,TKI治疗可有效延长患者的生存时间,但TKI治疗对于不同临床特征的患者,其疗效也存在差异。本研究Logistic回归分析结果显示,PD-L1阳性、脑转移为ORR、DCR的危险因素,且有脑转移的EGFR基因突变NSCLC患者PD-L1阳性率高于无脑转移者。以上结果均表明PD-L1阳性表达者EGFR-TKI原发耐药的可能性更大[11]。
PD-L1为PD-1的主要配体,其主要表达于T细胞、B细胞、树突状细胞、肥大细胞等。据文献报道,PD-L1可与受体PD-1进行结合,从而对T细胞的活化与增殖产生抑制作用,进而参与免疫逃逸[12]。且有研究指出,PD-L1还可增强Tregs细胞的免疫抑制作用[13]。提示PD-L1主要通过抑制肿瘤局部微环境的免疫效应,从而实现肿瘤免疫逃逸、促进肿瘤生长及转移的目的。而PD-L1信号通路与NSCLC驱动基因EGFR存在一定相互作用。有研究显示,当EGFR基因通路激活后,PD-L1水平升高,进而介导肿瘤的免疫逃逸[14-15]。但EGFR-TKI治疗可有效对敏感细胞系中EGFR信号的活化产生抑制作用,进而降低PD-L1水平。提示PD-L1水平与EGFR信号通路关系密切并受其调控。有研究指出,PD-L1表达阴性的EGFR基因突变NSCLC患者进行TKI治疗后其治疗至疾病进展时间及OS均显著延长[16]。本研究中,EGFR基因突变NSCLC患者中,PD-L1阴性患者PFS及OS均高于PD-L1阳性患者。此外生存分析显示,PD-L1阴性患者PFS、OS均长于PD-L1阳性者,该结果与上述研究结论具有一致性。但也有部分研究者认为,对于NSCLC患者而言,不论其EGFR基因突变状态如何,PD-L1过度表达的患者其OS均较短[17]。故关于PD-L1表达与EGFR-TKI治疗疗效及预后的关系仍需研究验证,但其作为NSCLC临床预测因子的有效性仍是不可否认的。
综上所述,PD-L1阴性EGFR基因突变NSCLC患者TKI治疗效果更佳,其具有更高的ORR、DCR及更长的PFS及OS;且PD-L1表达阳性可能为EGFR-TKI治疗疗效的潜在预测指标。本研究不足之处为单中心、非随机对照研究,且研究样本量较少,因此仍有待进一步行多中心、大样本的随机对照试验进行深入报道。

