DWI 联合T2 mapping 对腮腺肿瘤的定性诊断价值
李治群 徐钐 孙笑芬 万江花 刘旭东 李蕊蕊 邹嘉琦 施玉森
在我国,腮腺肿瘤约占所有唾液腺肿瘤的70%,其中约80%是良性肿瘤[1-4]。手术切除是腮腺肿瘤的主要治疗方式,不同组织类型肿瘤选择的手术方式也不同。目前腮腺肿瘤手术正由传统的外科手术方式向微创手术方向发展,良性肿瘤可采取小切口手术、内镜辅助等微创手术[5],但腮腺恶性肿瘤一般仍需采用传统手术方式[6],因此术前精准定性是制定腮腺肿瘤手术计划的关键。MRI 检查是腮腺肿瘤术前评估的重要手段,近年来随着MRI 技术的进步,MRI 在腮腺肿瘤的术前诊断中表现出巨大的潜能。多项荟萃研究结果表明常规MRI 联合扩散加权成像(diffusionweightedimaging,DWI)和动态增强(dynamic contrast-enhanced,DCE)能获得满意的诊断效果,并且能够表征某些良性肿瘤[7-9]。不过,DCE 需要注射钆对比剂,对于肾功能不全和有不良反应的患者其应用受限。由于腺淋巴瘤的表观扩散系数(apparent diffusion coefficient,ADC)与恶性肿瘤存在一定的重叠,单独的ADC值有时不能准确区分腮腺良、恶性肿瘤,需要与其他技术联合应用以提高其诊断效能[10]。横向弛豫时间成像(T2mapping)可直接定量组织的T2弛豫时间,能反映组织内细胞外液和胶原蛋白的含量。有研究认为T2值可作为腮腺肿瘤的附加影像生物标记物[11]。为此,笔者收集了本院82 例腮腺肿瘤患者的MRI 数据,采用Logistic 线性回归方法回顾性分析DWI 联合T2mapping 对于腮腺肿瘤的定性诊断价值。
1 资料与方法
1.1 一般资料
选取2017 年1 月—2022 年12 月在海南医学院第一附属医院就诊的腮腺肿瘤患者,纳入标准:1)经手术病理证实的腮腺原发肿瘤;2)术前接受过MRI 检查,包括平扫、DWI 和T2mapping 序列;3)检查前未接受过穿刺活检等检查或治疗。排除标准:1)以囊性为主的肿瘤;2)图像质量不佳;3)图像资料不完整。
1.2 MRI 检查方法
MR 设备为GE Discovery MR 750W 3.0 T磁共振扫描仪,16 通道相控阵头颈联合线圈,仰卧位,平静呼吸。检查序列为常规平扫、T2mapping 及DWI。具体参数如下:1)平扫:快速自旋回波序列轴位T1WI、轴位和冠状位T2WI 压脂序列,层厚/层距为3 mm/1 mm,视野20 cm×20 cm,矩阵288×224。2)轴位T2mapping:TR 2000 ms;TE 时间为8.3 ms,间隔8.3 ms;层厚/层距为3 mm/1mm,视野20 cm×20 cm,矩阵320×226。3)轴位DWI:采用短时反转恢复序列,TR 4200 ms,TE 90 ms,层厚/层距为3 mm/1 mm,视野20 cm×20 cm,扩散敏感系数(b 值)为0 和1000 s/mm2。
1.3 图像后处理方法
将DWI 和T2mapping 图像传至ADW 4.7 工作站,采用Function Tool 软件包进行后处理。由一位8 年工作经验的放射科医师在对病理不知情的情况下完成所有患者的ADC 值和T2值测量。具体方法:将图像放大,参考轴位T2WI 图像选择肿瘤实性成分的最大层面,在ADC 图和T2mapping伪彩图上沿肿瘤的实性部分外缘分别勾画兴趣区(region of interest,ROI),避开肿瘤内坏死、囊变、出血等区域,每个病例测量3 次,取3 次的平均值作为该病例的ADC 值和T2值(图1)。

图1 ROI 勾画示意图。a)参考轴位T2WI 压脂序列图像,选择肿瘤实性成分最大层面;b)在ADC 图上手动勾画ROI,尽量沿肿瘤边缘勾画;c)在T2 mapping 伪彩图上手动勾画ROI。图2 女,49 岁,左侧腮腺多形性腺瘤。a)轴位T1WI 示左侧腮腺浅叶肿瘤呈低信号,边界清楚;b)轴位T2WI 示肿瘤呈混杂信号;c)轴位DWI 示病灶呈稍高信号;d)ADC 图示病灶扩散不受限,平均ADC 值为1.42×10-3 mm2/s;e)轴位T2 mapping 伪彩图,肿瘤平均T2 值为114.3 ms。图3 男,48 岁,右侧腮腺腺淋巴瘤。a)轴位T2WI 压脂示病灶呈混杂T2 信号,内见多个囊变区;b)轴位DWI 序列示病灶呈不均匀高信号;c)轴位ADC 图示实性成分扩散受限,平均ADC 值为0.94×10-3 mm2/s;d)轴位T2 mapping伪彩图,肿瘤内实性部分平均T2 值为61.2 ms。图4 男,57 岁,左侧腮腺腺样囊性癌。a)轴位T2WI 压脂示左侧腮腺病灶呈稍高信号,信号略不均匀;b)轴位DWI 序列示病灶呈高信号;c)轴位ADC 图示病灶实性成分扩散受限,平均ADC 值为0.93×10-3 mm2/s;d)轴位T2 mapping 伪彩图,肿瘤平均T2 值为75.3 ms。
1.4 统计学方法
采用SPSS 26.0 软件进行统计学分析。符合正态分布的计量资料采用均数±标准差(x+s)表示,组间差异性检验采用独立样本t 检验;分类变量以例数和百分率(n;%)表示,组间差异采用χ2检验;采用受试者工作特征(receiveroperatingcharacteristic,ROC)曲线绘制ADC 和T2值鉴别腮腺良、恶性肿瘤的ROC 曲线,计算曲线下面积(area under curve,AUC)、敏感度、特异度、Youden 指数和95%置信区间(confidence interval,CI)。以最大约登指数确定ADC 和T2值的最佳阈值。再用Logistic 线性回归分析将ADC 值与T2值进行线性拟合,并绘制联合参数的ROC 曲线,获得相应的诊断效能。通过MedCalc 统计软件采用DeLong 检验比较单参数和联合参数的ROC 曲线,并绘制三者的ROC 曲线对比图。所有统计检验均计算双尾P 值,P<0.05为差异具有统计学意义。
2 结果
腮腺良、恶性肿瘤患者共82 例,其中良性肿瘤54 例(65.9%),男31 例,女23 例,年龄20~76 岁,平均(47.2±15.1)岁;恶性肿瘤28 例(34.1%),男16例,女12 例,年龄21~68 岁,平均(52.1±13.7)岁。本组资料病理组织学亚型的具体构成见表1。
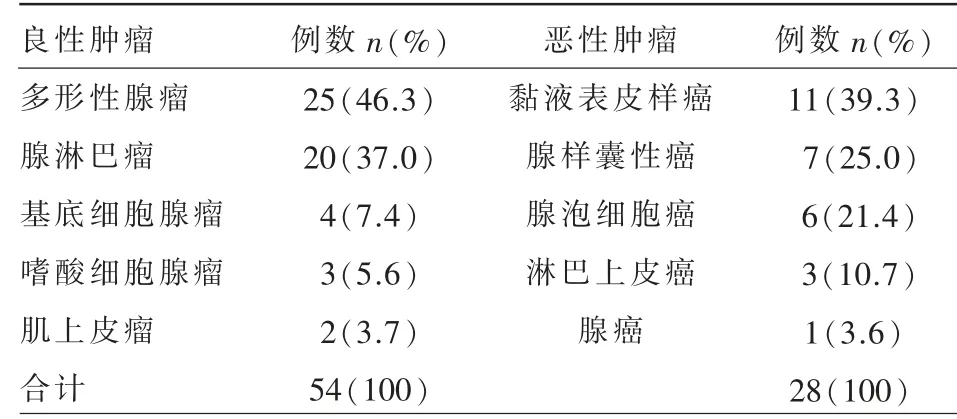
表1 82 例腮腺肿瘤的病理组织学亚型构成
良性肿瘤的平均ADC 值(1.16±0.30)×10-3mm2/s,平均T2值为(95.6±30.6)ms(图2、3)。恶性肿瘤的平均ADC 值为(0.97±0.18)×10-3mm2/s,平均T2值为(65.5±12.7)ms(图4)。良性肿瘤的ADC 值和T2值均明显高于恶性肿瘤,差异均具有统计学意义(P<0.01)。
根据ROC 曲线分析,ADC 值和T2值作为单参数鉴别腮腺良、恶性肿瘤的AUC 分别为0.73(95%CI:0.62~0.82)和0.79(95%CI:0.68~0.87)(图5)。分别以1.17×10-3mm2/s 和76.2 ms 作为截断值时可获得最佳诊断效能。ADC 值与T2值的联合参数区分腮腺肿瘤的AUC 为0.89(95%CI:0.80~0.95)(图6)。各参数诊断效能见表2。
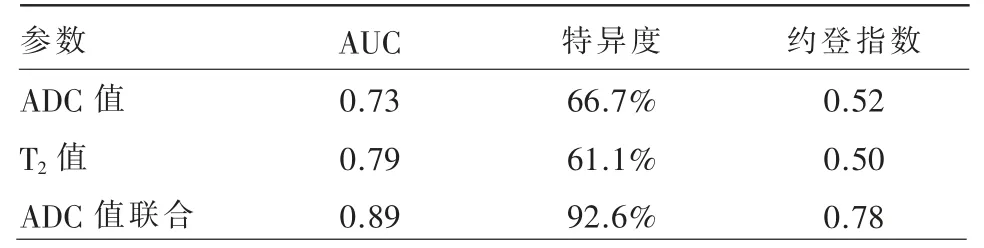
表2 单参数和联合参数鉴别腮腺肿瘤的诊断效能
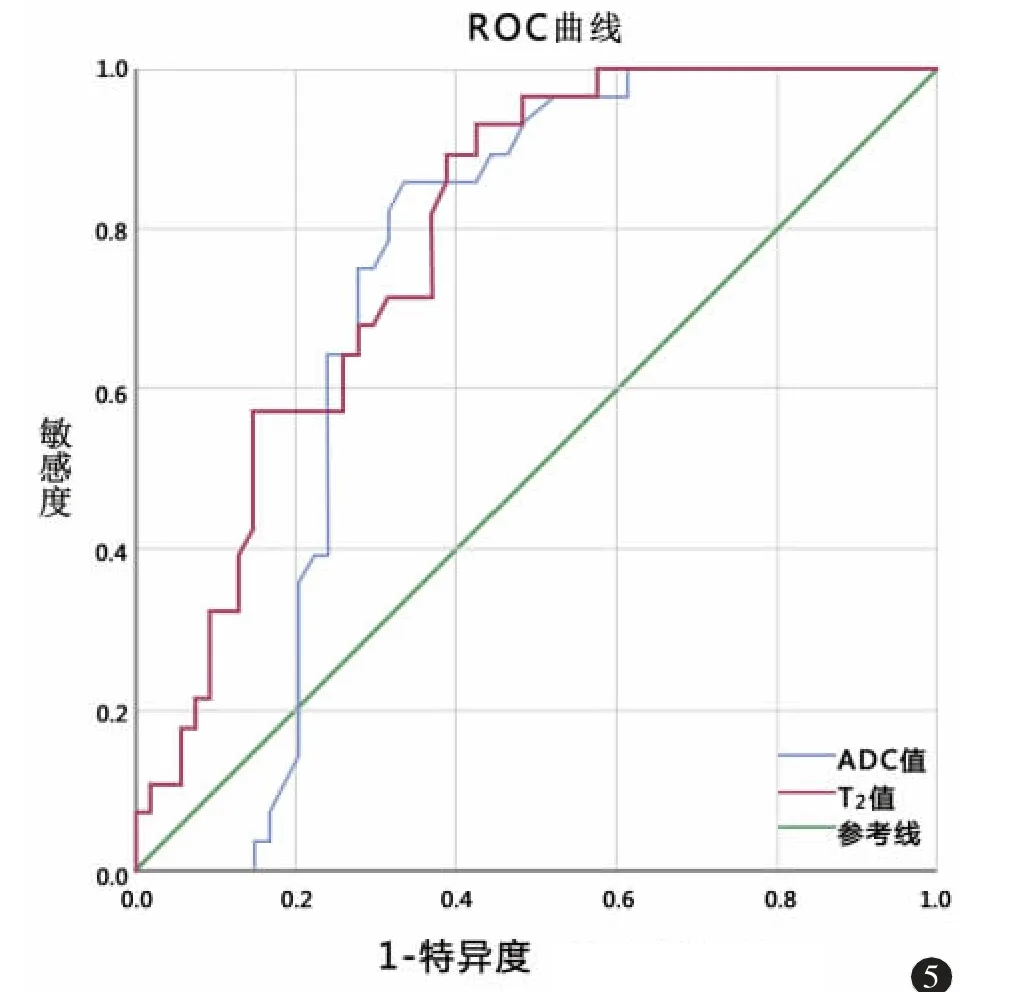
图5 ADC 值和T2 值的单参数ROC 曲线。

图6 ADC 值和T2 值的联合参数ROC 曲线。
笔者对比分析了三种方法的ROC 曲线,结果显示联合参数与ADC 值的ROC 曲线之间具有统计学差异(Z 值=2.39,P=0.02),而联合参数与T2值(Z 值=1.68,P=0.09)之间以及ADC 值与T2值(Z值=1.04,P=0.30)之间均无统计学差异,这表明ADC值与T2值的联合诊断效能高于作为单参数的ADC 值。
3 讨论
大量研究报道证实DWI 具有提高MRI 鉴别腮腺肿瘤效能的潜力[12,13]。但DWI 作为单参数鉴别腮腺肿瘤时存在一些问题,即特异度不够高。一项系统性研究[9]的结果显示ADC 值区分腮腺良、恶性肿瘤的敏感度为81%~97%,特异度只有47%~64%。因此,有学者认为DWI 与其他功能技术联合应用可能会获得更好的结果。
本研究目的是探讨T2mapping 技术与DWI 联合应用时是否有助于提高DWI 对腮腺肿瘤的定性诊断能力。本研究结果显示ADC 值与T2值作为单参数鉴别腮腺肿瘤的AUC 分别为0.73 和0.79,敏感度和特异度分别为85.7%、66.7%和89.3%、61.1%,二者的ROC 曲线之间没有统计学差异,与文献报道相符[14]。但当二者作为联合参数鉴别腮腺肿瘤的AUC 达到了0.89,明显高于作为单参数的ADC 值(P<0.05),但与T2值没有统计学差异。这表明T2mapping 与DWI 联合应用时可以提高DWI 对腮腺肿瘤的鉴别诊断效能。
T2mapping 技术是一种定量成像技术,T2值反映组织的固有特性,具有较高客观性和可重复性。T2值主要与组织内的水含量有关,游离水分子的T2值高于结合水。良性肿瘤生长缓慢,细胞密度相对较低,游离水含量较高,T2值相对较高;恶性肿瘤细胞体积较大,细胞密度相对较高,细胞外间隙较小,游离水含量较少,因而T2值小于良性肿瘤[15],这也提示T2值在鉴别腮腺良、恶性肿瘤方面具有一定的特异性。本研究结果显示腮腺恶性肿瘤的平均T2值明显低于良性肿瘤(P<0.05),与文献报道相符[16]。
本研究还发现在良性肿瘤组中腺淋巴瘤的T2值[(69.4±15.0)ms]显著低于多形性腺瘤[(112.7±26.8)ms],且与恶性肿瘤无统计学差异,这与Wu等[11]报道的结果相符。腺淋巴瘤是仅次于多形性腺瘤的第二常见的腮腺良性肿瘤,且其发病率有逐年上升趋势[17,18]。本组资料中腺淋巴瘤在良性肿瘤组的占比为37.0%。多形性腺瘤因含有不同比例的黏液样、软骨样基质,而基质中丰富的游离水导致T2值较高;而腺淋巴瘤含有丰富、致密的淋巴组织间质,细胞外间隙较小,游离水含量较低,同时肿瘤内有多发小囊腔,囊腔内的液体蛋白含量较高,因而T2值较低[19]。文宝红等[20]的研究显示腮腺肿瘤T2值由高到低依次是多形性腺瘤、基底细胞腺瘤、恶性肿瘤和腺淋巴瘤,这一研究结果提示T2mapping 在区分腮腺肿瘤的病理亚型方面具有巨大潜力。
本研究还存在一些不足:首先,样本量较小,且为单中心数据;其次,由于成像设备和参数的影响,导致研究结果可能存在一定差异;最后,手动勾画ROI 的过程中可能存在一定偏倚。
综上所述,DWI 联合T2mapping 技术可以有效区分腮腺良、恶性肿瘤,可作为钆剂增强禁忌者的替代方案。