超高效液相色谱-三重四极杆质谱法同时测定化妆品中13种α-羟基酸的含量
高天阳,蒋亚奇,林钰镓,刘春霖,冉金凤,李启艳
(山东省食品药品检验研究院,国家药品监督管理局化妆品原料质量控制重点实验室,济南 250101)
α-羟基酸是一类羟基位于α位的羧酸[1],包括葡糖醛酸、羟基乙酸、扁桃酸等,它们可使皮肤光滑、细嫩、柔软,具有除皱、保湿、抗衰老等作用[2-3],因而被广泛应用于化妆品中。但过量使用α-羟基酸会对皮肤产生较强的刺激性[4],还会减弱皮肤对紫外线的抵抗力,甚至造成皮肤灼伤,因此α-羟基酸的安全性逐渐受到重视。
为有效控制α-羟基酸的使用量,《化妆品安全技术规范》(2015年版)明确规定化妆品中α-羟基酸总量不得超过6%(质量分数)[5]。随后,国家食品药品监督管理局于2019年在第12号通告中发布了《化妆品中10 种α-羟基酸的高效液相色谱测定法》[6],并以此作为标准方法控制α-羟基酸的总量。除标准方法外,文献报道中关于α-羟基酸的检测方法有液相色谱法[7-8]、气相色谱法[9]、离子色谱法[10]、毛细管电泳法[11]、液相色谱-质谱法[12]等。然而,现有的液相色谱-质谱法中仅测定了酒石酸、苹果酸、乳酸、柠檬酸、乙醇酸5 种α-羟基酸的含量[13]。葡萄糖酸、乳糖酸和α-羟基癸酸作为新一代果酸,因具有刺激性小、保湿效果强等优点而被越来越多的添加到化妆品中,增加对这些α-羟基酸的测定有利于得到更准确的α-羟基酸总量测定结果。目前,尚未见葡萄糖酸、乳糖酸和α-羟基癸酸的含量测定方法的相关报道。鉴于此,本工作提出了超高效液相色谱-三重四极杆质谱法同时测定化妆品中葡萄糖酸、乳糖酸、α-羟基癸酸等13种α-羟基酸含量的方法,以期为化妆品中α-羟基酸的质量控制提供参考。
1 试验部分
1.1 仪器与试剂
岛津Nexera X2 型超高效液相色谱仪和LCMS-8050 型三重四极杆质谱仪联用系统;MS105DU 型电子天平;A10型超纯水仪;Universal 320R 型高速冷冻离心机;XK 96-B 型涡旋混匀器;KQ-500DE型超声波清洗器。
单标准储备溶液:分别精密称取葡糖醛酸、葡萄糖酸、乳糖酸、酒石酸、羟基乙酸、苹果酸、乳酸、柠檬酸、2-羟基丁酸(由DL-2-羟基丁酸钠折算)、扁桃酸、羟基辛酸、二苯乙醇酸、α-羟基癸酸标准品各10 mg,用水溶解,分别转移至10 mL 容量瓶中,用水定容,配制成质量浓度均为1 g·L-1的单标准储备溶液。
混合标准溶液:分别精密移取单标准储备溶液适量,混匀,用水稀释,配制成羟基辛酸、二苯乙醇酸、α-羟基癸酸的质量浓度为0.1 mg·L-1,羟基乙酸、乳酸的质量浓度为10 mg·L-1,其余8种α-羟基酸的质量浓度为1 mg·L-1的混合标准溶液。
混合标准溶液系列:取混合标准溶液适量,用水逐级稀释,配制成羟基辛酸、二苯乙醇酸、α-羟基癸酸的质量浓度分别为2,5,10,20,50,100μg·L-1,羟基乙酸、乳酸的质量浓度分别为0.2,0.5,1,2,5,10 mg·L-1,其余8种α-羟基酸的质量浓度分别为20,50,100,200,500,1 000μg·L-1为混合标准溶液系列。
葡糖醛酸、葡萄糖酸、乳糖酸、酒石酸、羟基乙酸、苹果酸、柠檬酸、DL-2-羟基丁酸钠、扁桃酸、羟基辛酸、二苯乙醇酸、α-羟基癸酸标准品的纯度均大于97%;乳酸标准品的纯度大于90%;甲醇、乙腈、甲酸、乙酸铵均为色谱纯;异丙醇为分析纯;试验用水为自制超纯水。
1.2 仪器工作条件
1.2.1 色谱条件
Agilent Zorbax RRHD SB-Aq C18色谱柱(100 mm×2.1 mm,1.8μm);柱温40 ℃;进样量5μL;流量0.3 mL·min-1;流动相A 为0.1%(体积分数,下同)甲酸溶液,B为乙腈。梯度洗脱程序:0~4.0 min时,B 为0;4.0~10.0 min时,B 由0升至95%,保持2.0 min;12.0~12.1 min,B由95%跳转至0,保持2.9 min。
1.2.2 质谱条件
电喷雾离子(ESI)源,负离子扫描模式,多反应监测(MRM)模式;雾化气流量3.0 L·min-1,加热气流量10.0 L·min-1,干燥气流量10.0 L·min-1;接口温度300 ℃,加热模块温度500 ℃,脱溶剂温度250 ℃;碰撞气为高纯氩气。13种α-羟基酸的其他质谱参数见表1,其中“*”表示定量离子。

表1 质谱参数Tab.1 MS parameters
1.3 试验方法
精密称取样品0.2 g,置于10 mL 具塞比色管中,加水至10 mL(若样品不易在水中分散,先加1 mL异丙醇涡旋使分散均匀,再加水至10 mL),涡旋混合30 s,于60 ℃超声提取30 min,放冷至室温后,以转速8 000 r·min-1离心5 min,上清液经0.22μm 滤膜过滤,按照仪器工作条件测定。
2 结果与讨论
2.1 流动相的选择
试验分别以乙腈、甲醇为有机相,在水相中分别添加0.1%甲酸溶液、0.01 mol·L-1乙酸铵溶液,考察了不同流动相对13种α-羟基酸的分离效果和质谱响应的影响。结果显示:以乙腈为有机相时,13种α-羟基酸的分离效果较好;水相中添加乙酸铵可改善大部分化合物的峰形和质谱响应,但乳糖酸、羟基乙酸和乳酸的质谱响应低,乳酸的峰形较差;水相中添加甲酸时,13种α-羟基酸的分离效果和质谱响应均较佳。因此,试验最终选用乙腈-0.1%甲酸溶液为流动相。
在优化的仪器工作条件下,13种α-羟基酸的提取离子色谱图见图1。

图1 13种α-羟基酸的提取离子色谱图Fig.1 Extracted ion chromatograms of the 13 α-hydroxy acids
2.2 质谱条件的选择
试验采用ESI源分别在正、负离子扫描模式下对13种α-羟基酸进行一级质谱全扫描,确定母离子。对母离子进行二级质谱扫描,选择至少2个特征碎片离子(除扁桃酸外,扁桃酸只有一个响应较高的离子碎片),响应最高的碎片离子作为定量离子,响应次高的碎片离子作为定性离子。结果表明,正离子扫描模式下,大部分化合物的分子离子峰响应较低,部分化合物无法找到二级特征碎片离子;负离子扫描模式下,13种化合物均可优选出丰度较高的离子。因此,试验选择负离子扫描模式。
选用质量浓度为1.0 mg·L-1的单标准溶液,结合LCMS-8050 软件的MRM 电压自动优化功能,优化目标化合物的母离子、子离子、碰撞能量及采集时间等。同时分析的目标化合物较多时,质谱采集点数和离子对驻留时间均影响其响应和定量准确度[14],试验依据各化合物的保留时间±1.5 min进行分段,减少冗余采集通道的浪费,在兼顾质谱采集点数的同时,保证各化合物的驻留时间,提高其响应灵敏度和定量准确度。具体的质谱条件见1.2.2节。
2.3 样品前处理条件的选择
因为α-羟基酸易溶于水、难溶于非极性有机溶剂,样品以水为溶剂进行超声提取,而对于油包水型等在水中不易分散的样品,先加异丙醇分散样品,再加水超声提取,此步骤与标准方法[6]一致,但在标准方法中,样品先置于“90 ℃水浴中30 min以去除挥发性有机溶剂”,经考察发现,省去此步骤也不影响质谱定量的准确度和精密度,故简化此步骤,可缩短样品前处理时间。具体的样品前处理条件见1.3节。
2.4 基质效应
基质效应(ME)是指色谱分离时共洗脱的物质改变了待测成分的离子化效率,进而引起信号的抑制或增强[15]。在液质联用分析时,基质效应是普遍存在的问题,往往会降低方法的灵敏度和影响方法的准确度[16-17]。
试验采用空白基质溶液工作曲线斜率与空白溶剂标准曲线斜率的百分比来考察基质效应[18-19]。市售宣称美白祛斑、保湿滋润功效的化妆品的基质类型以水剂、乳液和膏霜居多,因此选取上述3种基质的阴性化妆品,按试验方法处理,制得空白基质溶液。再分别以空白溶剂和空白基质溶液为稀释溶剂,配制混合标准溶液系列,进样分析,绘制标准曲线和工作曲线,得到线性回归方程,参照ME=k1/k2(其中k1为空白基质溶液工作曲线的斜率,k2为空白溶剂标准曲线的斜率)计算基质效应,结果见图2。

图2 13种α-羟基酸的基质效应Fig.2 Matrix effects of the 13α-hydroxy acids
由图2 可知,3 种基质化妆品的基质效应为85.0%~120%,说明这3种基质对目标化合物的测定干扰较小,因此试验方法中以空白溶剂稀释制备混合标准溶液系列。
2.5 标准曲线、检出限和测定下限
按照仪器工作条件测定混合标准溶液系列,以α-羟基酸的质量浓度为横坐标,以对应的峰面积为纵坐标绘制标准曲线。13种α-羟基酸的线性范围、线性回归方程和相关系数见表2。

表2 线性参数、检出限和测定下限Tab.2 Linearity parameters,detection limits and lower limits of determination
取样品0.2 g,加水10 mL进行提取,离心过滤后测定,分别以3倍信噪比(S/N)计算检出限(3S/N),以10倍信噪比计算测定下限(10S/N),结果见表2。
结果表明:13种α-羟基酸的质量浓度在一定范围内与对应的峰面积呈线性关系,相关系数均不小于0.999 0;羟基辛酸、二苯乙醇酸、α-羟基癸酸的检出限为0.030μg·g-1,羟基乙酸、乳酸的检出限为3.0μg·g-1,其余8 种α-羟基酸的检出限均为0.30μg·g-1,该方法中α-羟基酸的检出限均低于现行标准方法(葡糖醛酸150μg·g-1、酒石酸60μg·g-1、羟基乙酸40μg·g-1、苹果酸40μg·g-1、乳酸100μg·g-1、柠檬酸40μg·g-1、2-羟基丁酸80μg·g-1、扁桃酸2μg·g-1、羟基辛酸40μg·g-1、二苯乙醇酸1μg·g-1)[6]和文献[20]报道(酒石酸20μg·g-1、苹果酸60μg·g-1、乳酸90μg·g-1、柠檬酸40 μg·g-1、2-羟基丁酸400μg·g-1、扁桃酸2μg·g-1、羟基辛酸200μg·g-1、二苯乙醇酸1μg·g-1)的检出限。
2.6 精密度和回收试验
分别以水剂、乳液、膏霜等3种基质的阴性化妆品为研究对象,按各化合物的测定下限(低)、5倍测定下限(中)和10倍测定下限(高)等3个浓度水平进行加标回收试验,每个浓度水平测定6个平行样品,按试验方法进样测定,计算每种基质中各化合物的回收率和相对标准偏差(RSD),结果见表3。
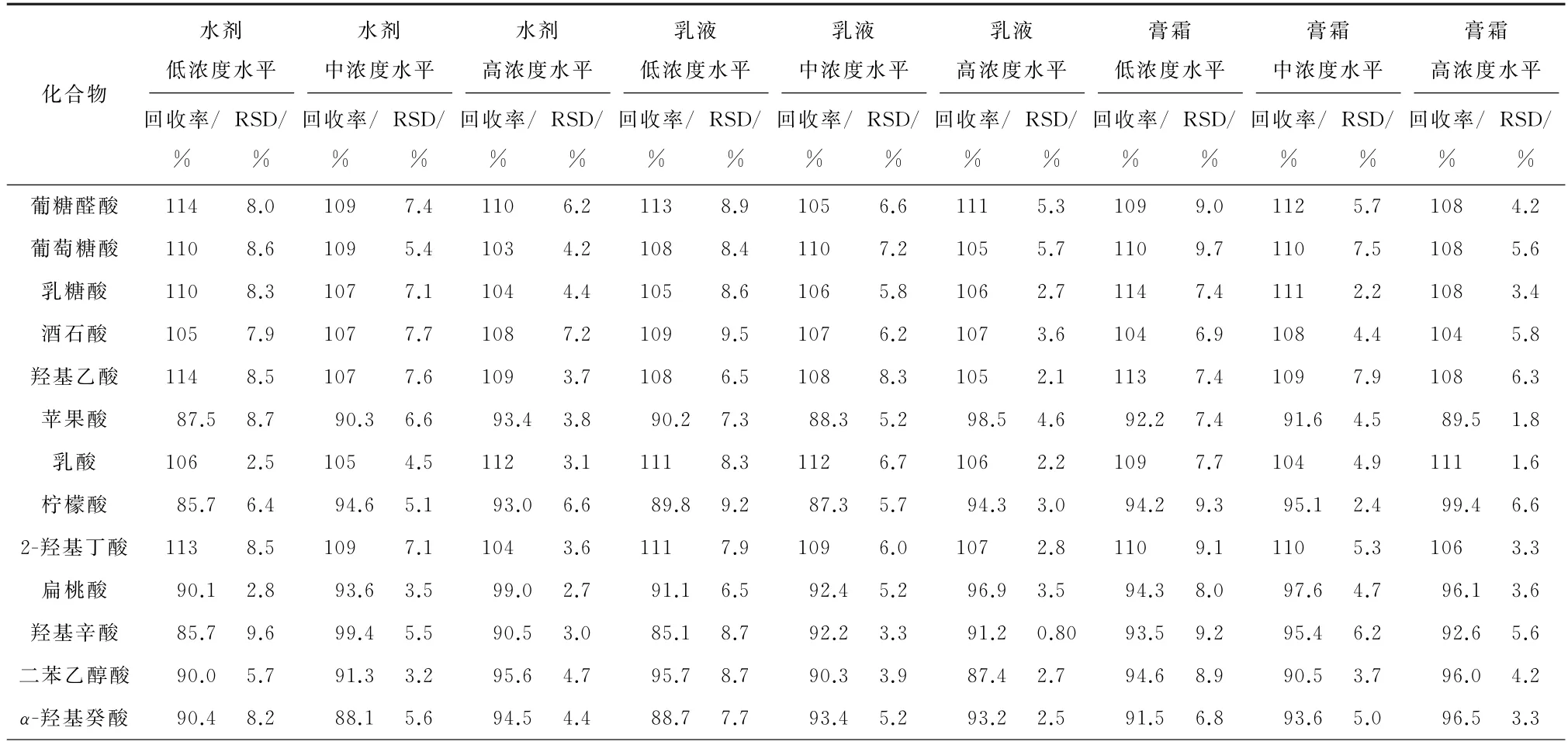
表3 精密度和回收试验结果(n=6)Tab.3 Results of tests for precision and recovery(n=6)
结果显示,13种α-羟基酸的回收率为85.1%~114%,测定值的RSD 为0.80%~9.7%,表明方法准确度和精密度能满足检测要求。
2.7 样品分析
随机选取20批市售化妆品,按照试验方法测定样品中13种α-羟基酸的含量,结果见表4。

表4 样品分析结果Tab.4 Analytical results of the samples
结果显示:20批样品均未检出2-羟基丁酸、羟基辛酸、二苯乙醇酸和α-羟基癸酸;9批样品中检出乳酸,检出率最高;检出α-羟基酸的总量为20~6 800 mg/100 g,有1批样品检出α-羟基酸总量占比大于6%,超出《化妆品安全技术规范》(2015 年版)限值规定,该批样品检出了标准方法中未涉及的葡萄糖酸和乳糖酸,若按标准方法中列出的10 种α-羟基酸计算总量,该样品符合标准规定,该结果验证了标准方法以10 种α-羟基酸计算总量并不完善。
本工作提出了超高效液相色谱-三重四极杆质谱法测定化妆品中13种α-羟基酸含量的方法。该方法克服了液相色谱法干扰多、灵敏度低的缺点,完善了标准方法中α-羟基酸的测定种类,操作简便、快速,精密度和准确度良好,可用于化妆品中13种α-羟基酸的含量测定。

