汛期前后不同土地利用类型河流浮游细菌组成及功能预测:以清潩河(许昌段)为例
王革林,谷立坤,于鲁冀,刘萌硕,鲁浩天,范鹏宇,王 莉*
1.郑州大学生态与环境学院,河南 郑州 450000
2.河南工程学院,河南 郑州 450000
3.郑州大学综合设计研究院有限公司,河南 郑州 450000
浮游细菌是水生态系统的主要组成部分,具有种类丰富、功能多样和环境响应灵敏等特点[1-2],可通过同化、异化等代谢过程影响生态系统中的物质循环、污染物质释放等地球化学循环过程[3-5],是提高河流水环境自净能力和河流生态系统修复能力的关键因素[6].浮游细菌空间格局的形成,受空间异质性和河流连通度的影响,河流生态系统水位的变化(包括汛期)改变了河流连通度,进而造成浮游细菌多样性和功能的差异[7-9].汛期时,强降雨将外源污染物带入河流,引起水体营养盐的变化,影响浮游细菌群落的组成[10].细菌的随流输运能力受河流连通度的影响,水位较高时,河道连通度增大,进而影响细菌群落空间构成.此外,人类活动和土地利用方式的改变也是影响浮游细菌空间差异的主要原因[11].土地利用类型的变化直接反映了人类活动对河流水质和水生态的重要影响力[12].不同利用类型的土地以各自的方式影响着地表水的传输(阻滞或加速),进而影响污染物从陆地到地表水的传递[13].改变后的地表水将形成一种与原始环境不同的河流生境,产生基于水生生物对新形成环境适应性的生物筛选,构成不同的浮游细菌群落结构.
为了适应不同类型的栖息地,微生物经常会形成一些特定的结构和功能去应对不同的环境压力[14].已有研究表明,降雨径流污染是城市景观水体氮磷等营养盐的主要来源之一[15],降雨会将土壤中积累的营养盐带入水体,也会引起水体水文和水动力学特征的变化,造成浮游细菌群落变化[16].乡村区和城镇区人类活动强度和土地利用方式的差异也是造成河流细菌空间异质性的主要原因[11],在重金属含量较高的城镇区和农业区河段,微生物多样性较低,在陆源污染输入较少的居民区和清洁区,微生物多样性差异性较小[17],β-变形菌和δ-变形菌在清洁区丰度显著高于工业区和农业区[18],α-变形菌和γ-变形菌的丰度在工业区和居民区最高.因此,了解汛期前后不同土地利用类型浮游细菌群落组成变化和功能差异,对于识别水域浮游细菌在生态系统中的功能和作用,治理和保护水生态环境具有深远的意义.
本研究以清潩河流域为研究对象,依据周边环境及水生态环境功能分区将流域划分为不同土地利用类型的河段,采用高通量测序技术分析了汛期前后不同土地利用类型河段内浮游细菌群落结构,并基于PICRUSt2 进行了浮游细菌功能基因预测,尤其是氮循环功能基因.结合水环境理化指标,进一步探讨了引起浮游细菌群落组成和功能变化的环境因子,以期为不同土地利用类型河流水环境保护提供参考依据.
1 材料与方法
1.1 采样点分布及样本采集
本研究以河南省清潩河流域为对象,依据赵雪霞等[19]在清潩河流域(许昌段)的水生态环境功能分区体系,综合考虑自然地理因素(地貌、河流自然状况)和人为因素(水资源利用状况、水环境污染状况和土地资源利用状况),将研究区域划分为4 个不同土地利用类型的河段,分别为清洁区(clear water area,CW)、城镇区(urban area,UW)、乡村区(village area,VW)和农业区(agricutural area,AW),如图1 所示.在清潩河流域共选取32 个采样点,其中C1~C4位于清潩河干流上游,C1点位为增福庙水库,C2~C4为水库下游,两侧人类干扰较少,划分为清洁区;U1~U14流经长葛市,人口密度大,有工业企业存在,划分为城镇区;V1~V6位于清潩河二级支流灞陵河,流经多为村庄,河岸两侧有生活污水排放口存在,划分为乡村区;A1~A8位于清潩河一级支流小泥河,两岸多为农田,无排污口影响,划分为农业区.

图1 研究区采样点的分布Fig.1 Distribution of sampling points in the study area
每年7-9 月为清潩河汛期,本研究样品采集工作于汛期前(2021 年6 月) 和汛期后(2021 年10 月)进行.大部分采样点河段水深不超过4 m,使用有机玻璃采水器采集水面下0.5~1.0 m 处水样于玻璃采样瓶内,带回实验室储存于4 ℃冰箱内,并在48 h 内完成理化指标的检测.量取600 mL 水样经20 μm 筛绢预过滤,除去大型浮游植物和浮游动物,预过滤后的水样经0.22 μm 无菌微孔滤膜过滤,用以收集浮游细菌,将滤膜剪碎置于50 mL 无菌离心管中.在干冰保存状态下送往广州美格基因科技有限公司进行微生物检测.
1.2 理化指标检测方法
将采集的水样在实验室过滤后,依据《水和废水监测分析方法》测定其理化性质.溶解氧(DO)浓度和水温(WT) 采用便携式水质监测仪(HACH-DS5,哈希,美国)测定;pH 和氧化还原电位(ORP) 采用pH 计(HI-8424,哈纳,意大利) 测定;电导率(EC)采用便携式电导率仪(S7-Meter,梅特勒托利多,美国)测定;总氮(TN)浓度采用碱性过硫酸钾消解紫外分光光度法测定;总磷(TP)浓度采用过硫酸钾消解钼锑钪比色法测定;氨氮(NH4+-N)浓度采用纳氏试剂分光光度法测定;亚硝态氮(NO2--N)浓度采用N-乙二胺分光光度法测定;硝态氮(NO3--N)浓度采用酚二磺酸法测定;化学需氧量(CODCr)采用重铬酸钾法测定.
1.3 高通量测序分析
使用DNA 提取试剂盒对滤膜进行基因组DNA抽提后,采用微量紫外分光光度计(NanoDop®ND-1000,Wilmington,DE,美国)测定提取到的DNA 浓度和纯度.将合格的样品送往广州美格基因科技有限公司,通过MiSeq 300(Illumina Inc,San Diego,CA,美国)测序仪完成高通量测序,结果以FASTQ 文件格式储存.使用fastq 软件对原始数据进行质控,而后使用FLASH 软件进行拼接[18].使用Qiime2 流程在基于默认参数上对质控拼接之后的序列降噪处理[19].按最小样本序列进行抽平,再参照Sliva 16S rRNA 数据库(v 138),使用Qiime2 中的Naive bayes 对ASVs 进行物种分类分析.
1.4 数据统计分析
理化指标分析:由于各组样品理化指标数据无法同时满足正态分布和方差齐性,故使用 Schirer-Ray-Hare非参检验法进行水质数据分析[20],单因素或多因素ANOVA 用于探讨样点间环境因子和浮游细菌多样性的差异.
生物指标分析:通过R 软件的“vegan”包计算浮游细菌群落结构的α多样性,分别以Chao 指数和Shannon-Wiener 指数表示细菌的丰度和多样性.在美格基因云平台(http://cloud.magigene.com) 进行物种组成分析和β多样性分析并绘图.使用LefSe 在线工具分析各组之间显著性差异的生物标志物,进一步分析各组细菌丰富度差异[21].使用SPSS 软件对细菌和环境因子做Spearman 相关性分析,所得结果在Origin内以热图的形式呈现.使用PICRUSt2 软件将16S rRNA序列与参考基因组数据库进行比对,预测细菌代谢功能,并结合16S rRNA 基因拷贝数差异和原始ASV 表格的物种丰度数据进行校正,提高丰度预测可靠性[22].
2 结果与分析
2.1 河流水质理化性质
汛期前后清潩河理化指标Schirer-Ray-Hare 检验结果如表1 所示.研究发现,汛期前,河流TN 浓度整体的平均值为(7.57±2.40) mg/L,超GB 3838-2002《地表水环境质量标准》Ⅲ类标准限值5.0~10.0 倍;VW 区NH4+-N 浓度最高(3.19 mg/L),达到劣Ⅴ类标准.汛期后,UW、VW 和AW 区TN 浓度几乎不发生变化,NH4+-N 浓度达到Ⅴ类标准;NO3--N 和NO2--N浓度大于汛期前,且NO3--N 在人类干扰较大的UW、VW 和AW 区增加量高于CW 区.
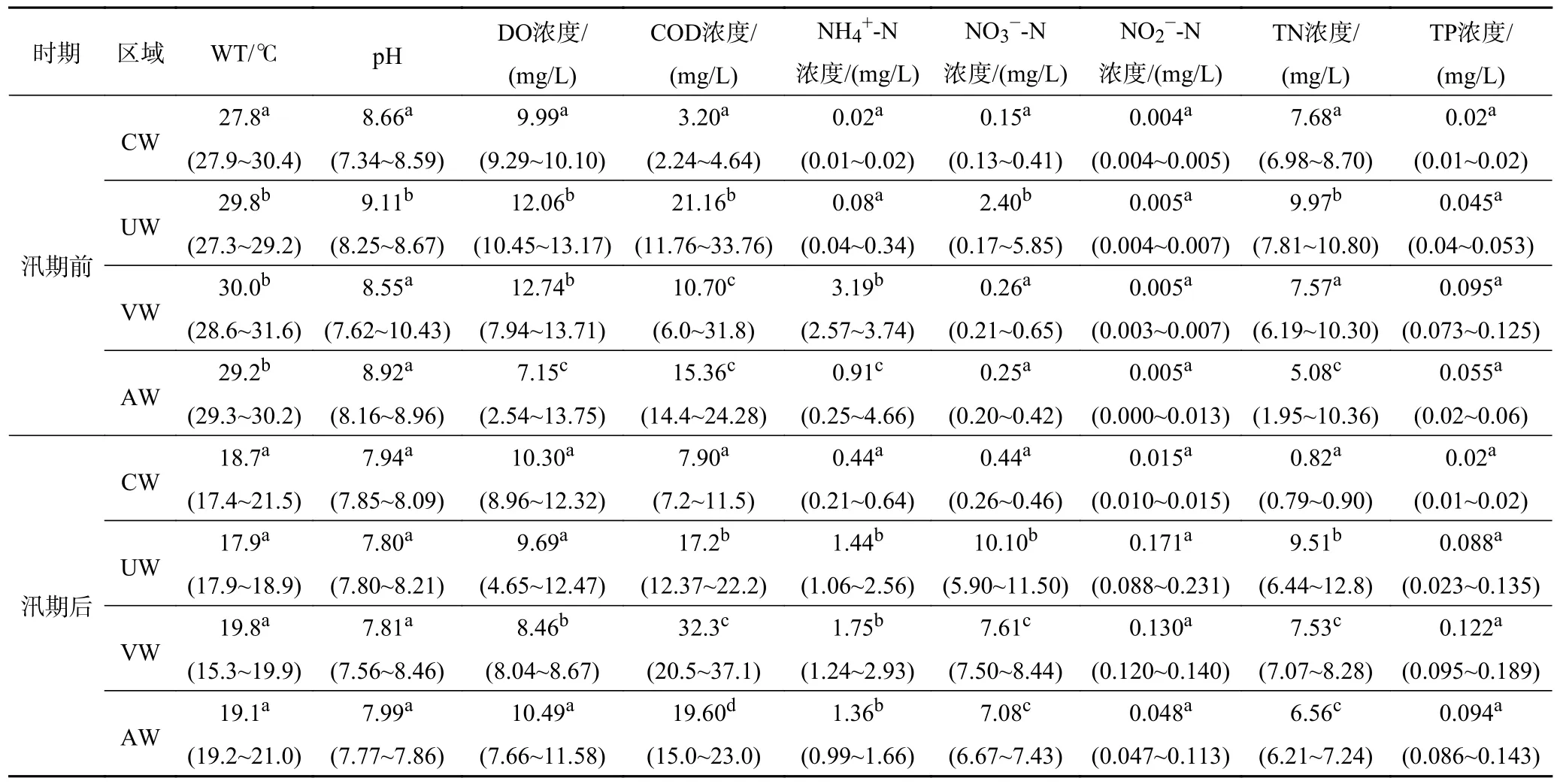
表1 不同时期清潩河流域水体理化指标Table 1 Physical and chemical indexes of Qingyihe River Basin at different periods
2.2 浮游细菌多样性和丰度分布特征
汛期前后各区域河段Chao 指数和Shannon-Wiener指数的变化情况如图2 所示.汛期前,受人类干扰较强的AW、UW 和VW 区Chao 指数及Shannon-Wiener指数均显著(P<0.05)高于CW 区.汛期后,Chao 指数和Shannon-Wiener 指数均表现出AW 区>VW 区>CW区>UW 区的特征,与汛期前相比,Chao 指数和Shannon-Wiener 指数均有所下降,其中UW 区下降最多,CW 区下降最少.

图2 不同区域多样性指数分析Fig.2 Diversity index analysis chart
在ASV 水平上对汛期前后各区域采样点位的浮游细菌进行PCoA 分析,结果(见图3) 显示,PCoA1轴解释度为29.9%,PCoA2 轴解释度为15.4%.沿PCoA1 轴方向CW 区与其他三区有明显区分,且汛期前后UW、VW 和AW 区的差别明显.沿PCoA2 轴方向CW 区汛期前和汛期后区分明显,汛期前,VW和UW 区显著区分,与AW 区重叠;汛期后,VW、UW 和AW 区重叠,说明汛期对有人类干扰的UW、VW 和AW 区浮游细菌群落差异作用大于土地利用类型的影响.
2.3 浮游细菌群落组成与差异
2.3.1 群落组成特征
2.3.1.1 优势菌组成特征
高通量测序结果〔见图4(a)〕表明,汛期前后四区域浮游细菌主要有变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)等12 个菌门组成,占总菌门的98%以上.变形菌门是UW、VW 和AW 区的第1 优势菌门,相对丰度在51.8%~54.7%之间,远高于CW 区的35.5%.放线菌门是CW 区的第1 优势菌门,相对丰度为46.9%,其他三区放线菌门的相对丰度仅在16.1%~22.9%之间;拟杆菌门是UW 区的第2 优势菌门,是其他三区的第3 优势菌门;UW 区绿弯菌门和酸杆菌门的相对丰度均高于其他三区.汛期后浮霉菌门(Planctomycetes)相对丰度有所增加,而装甲菌门(Armatimonadetes)的相对丰度下降,硝化螺菌门(Acidobacteria)的相对丰度在各区表现为UW 区>VW区>AW 区>CW 区.

图4 不同区域河流浮游细菌群落组成Fig.4 Composition of river bacterioplankton community in different regions
对汛期前后各区域丰度排名前28 位的优势菌属进行分析,结果如图4(b)所示.优势菌属主要为hgcI_clade、Limnohabitans、Acinetobacter、CL500-29_marine_group、Flavobacterium等,在各区域中占总菌群丰度的52.2%~81.5%.相对于UW、VW 和AW 区,CW 区表现出较高的hgcI_clade和CL500-29_marine_group相对丰度,且汛期后大于汛期前;而UW、VW 和AW 区Limnohabitans和Acinetobacter 的相对丰度大于CW 区,且汛期后Limnohabitans在UW 区增加最多.汛期后Acidibacter、Flavobacterium和Nitrospira的相对丰度大于汛期前.
2.3.1.2 致病菌分布特征
根据世界卫生组织《饮用水质量准则》(第四版)[23]中饮用水中致病微生物列表,筛选出对人类具有致病作用的优势菌群进行分析,结果如图5 所示.汛期前,河流主要致病菌属为Acinetobacter、Flavobacterium和Pseudomonas,在CW 和UW 区的相对丰度约是VW 和AW 区的5 倍,且Acinetobacter的相对丰度占CW 和UW 区总致病菌属的86%以上,Flavobacterium的相对丰度占VW 和AW 区总致病菌属的33%~60%.汛期后,CW 和UW 区致病菌属的相对丰度下降明显,VW 和AW 区致病菌属的相对丰度略有增加;河流主要致病菌属为Flavobacterium和Acinetobacter,且Flavobacterium的相对丰度占UW和VW 区总致病菌属的80% 以上,Acinetobacter的相对丰度占AW 区总致病菌属的64.1%.

图5 汛期前后不同区域河流致病菌属相对丰度Fig.5 Relative abundance of fluvial pathogens in different regions before and after flood season
2.3.2 群落差异分析
通过LEfSe 工具计算汛期前后各区域中的差异菌属,所有菌在门纲目科属水平的差异信息用饼形图表示[24-25].如图6 所示,汛期前后浮游细菌群落共有18 个菌门存在显著差异,优势菌门(LDA≥4.0)仅有放线菌门、Patescibacteria、变形菌门、拟杆菌门、浮霉菌门、酸杆菌门、蓝藻门和疣微菌门等8 个菌门.汛期前优势菌门中,AW 区的拟杆菌门、CW 区的放线菌门、VW 区的疣微菌门和蓝藻门与其他区域存在显著性差异;汛期后优势菌门中,仅有UW 区的酸杆菌门、CW 区的浮霉菌门和疣微菌门与其他区域有显著性差异(P<0.05).

图6 不同样品间差异的季节分布Fig.6 Different seasonal distribution among different samples
在属水平上,汛期前,CW 区有10 个菌属与其他区域存在显著性差异(P<0.05),其中α-变形菌的Sphingorhabdus、Sphingomonas和Hyphomonas,厚壁菌门的Chryseomicrobium和Exiguobacterium,拟杆菌门的Sphingobacterium和Candidatus_Aquirestis为优势属(LDA≥4.0);UW 区有17 个属存在显著性差异,其中α-变形菌的Rhodobacter和Magnetospirillum,δ-变形菌的Oligoflexus,γ-变形菌的Azospira、Acinetobacter和Pseudomonas,酸杆菌门的Pseudarthrobacter,嗜热丝菌门的Caldisericum,疣微菌门的Terrimicrobium和Luteolibacter为优势菌属;VW 区共有16 个属存在显著性差异,其中α-变形菌的Novosphingobium,γ-变形菌的GKS98_freshwater_group和Sphaerotilus,蓝藻菌门的Cyanobium_PCC_6307,疣微菌门的Brevifollis为优势菌属;AW 区有11 个属于存在显著性差异,其中拟杆菌门的Cloacibacterium,变形菌门的Polynucleobacter和C39为优势菌属.汛期后具有差异性的菌属减少,其中CW 区有10 个菌属存在显著性差异,酸杆菌门的CL500_29_marine_group和hgcI_clade,浮霉菌门的CL500_3,γ-变形菌的Limnobacter,疣微菌门的LD29为优势菌属;UW 区有12 个属存在显著性差异,酸杆菌门的Aurantimicrobium,拟杆菌门的Pseudarcicella、Flavobacterium和Solitalea为优势菌属;VW 区有7 个菌属存在显著性差异,仅拟杆菌门的Sediminibacterium为优势菌属;AW 区有11个属存在显著性差异,放线菌门的Candidatus_Planktoluna,变形菌门的Limnohabitans和Malikia为优势菌属.
2.3.3 微生物群落组成与环境因子的关系
通过Mentel Test 分析,发现汛期前各区域浮游细菌优势属与环境因子存在极显著相关关系(P=0.008),将水体理化参数与优势菌属进行RDA 排序,结果如图7(a)所示,各区域点位区分明显,主要受pH、DO浓度、COD 浓度、NH4+-N 浓度和EC 的影响.AW 区样品差异较小,主要受COD 浓度、NH4+-N 浓度和EC 因素的影响;UW、VW 和CW 区样品差异性较大,引起群落差异的主要环境指标为pH、DO 浓度和NO3--N 浓度.RDA 分析结果也表明,Sediminibacterium、Candidatus_Aquiluna和Fluviicola均与COD和NH4+-N浓度呈正相关.

图7 不同区域浮游细菌与环境因子RDA 分析Fig.7 RDA analysis of bacterioplankton and environmental factors in different regions
汛期后,Mentel Test 分析也表明环境因子与浮游细菌优势属呈显著相关(P=0.012),将结果进行RDA排序后,如图7(b) 所示.汛期后样品间差异性更小,主要影响因子为pH、NO3--N 浓度、NO2--N 浓度、TN浓度和ORP.CW 区样品差异主要受ORP、TP 浓度和NH4+-N 浓度的影响;AW 区样品差异主要受pH、DO 浓度、ORP 和TP 浓度的影响;UW 和VW 区样品差异主要受COD、NO3--N、NO2--N、TN 浓度及ORP的影响.排序结果也表明,Limnohabitans、hgcI_clade、Acidibacter和CL500-29_marine_group与TP、NH4+-N、COD 浓度及ORP 均呈显著负相关;MWH-UniP1_aquatic_group和Acinetobacter与pH 和DO 浓度均呈正相关.
为进一步明确浮游细菌与环境因子之间的关系,将优势菌门和优势菌属与环境因子做Spearman 相关性分析.由图8(a)可知,影响微生物菌门的主要环境因子有化学指标COD、NH4+-N、NO2--N、NO3--N、TN和TP,以及物理指标ORP 和EC,且这些指标与拟杆菌门和Epsilonbacteraeota 门均呈显著正相关,与蓝菌门、芽单胞菌门、异常球菌-栖热菌门(Deinococcus-Thermus)、衣原体门、酸杆菌门、浮霉菌门、疣微菌门、Patescibacteria、绿弯菌门、放线菌门和 Dependentiae门均呈显著负相关.

图8 细菌群落结构与环境因子Spearman 相关性热图Fig.8 Bacterial community structure and environmental factor Spearman correlation heat map
优势菌属多为变形菌门、拟杆菌门、放线菌门和蓝藻菌门.由图8(b)可知,变形菌门的Pseudorhodobacter、Limnohabitans和Limnobacter属均与COD、NH4+-N、NO2--N 和NO3--N 浓度呈显著相关;拟杆菌门的Sediminibacterium、Solitalea、Flavobacterium和Fluviicola均与NO2--N、NO3--N、TN 和COD 浓度呈显著正相关;蓝菌门的Cyanobium_PCC-6307与NO2--N、NO3--N 和TP 浓度均呈显著负相关.
2.4 微生物群落氮转化功能分析
为了解汛期前后不同土地利用类型河流浮游细菌功能的差异,采用PICRUSt2 软件将样本的ASV序列与内部参与序列进行对比,预测每个ASV 的基因拷贝数,确定样本的基因丰度,结果如图9 所示.通过数据库比对,在一级水平上获得样本的6 大功能信息[26-27],发现新陈代谢是清潩河流域的主要功能,占比为81.4%~82.2%,在UW 区占比最大,AW 区占比最小,汛期前后占比不变.在二级水平上主要由29 个子功能组成,其中细胞活性、脂质代谢、碳水化合物代谢等9 个功能在CW 区占比为68.4%,远高于其他三区;汛期后,癌症概要、其他氨基酸代谢、聚糖生物合成与代谢等8 个功能在UW 区占比最高,其他次生产物的生物合成、翻译、膜运输等9 个功能在AW区占比最高.
进一步将样本基因序列和KEGG 数据库中65个氮代谢相关的基因进行比对,筛选出参与氮代谢过程丰度最高的基因[28],发现反硝化、氮同化和异化还原过程相关基因丰度较高,固氮和硝化过程相关基因丰度较低.由图10 可知,编码固氮酶的nifK、nifH和nifK基因在汛期后VW 区和汛期前AW 区占比均较高;编码氨单加氧酶的amoA、amoB、amoC和编码羟胺氧化还原酶的hao基因在CW 区和汛期前AW 区丰度均较高.反硝化过程中,编码硝酸盐还原酶的narG和narH基因在AW 区丰度均较高,且汛期后大 于汛期前;编码亚硝酸还原酶的nirK基因在汛期前VW 和AW 区丰度均较高;编码一氧化氮还原酶的norB、norC基因,以及编码氧化亚氮还原酶的nosZ基因在VW 和AW 区丰度均较高.硝酸盐异化还原过程中,编码硝酸盐异化还原酶的napA和napB基因与编码固氮酶的基因丰度分布相同;编码甲酸依赖型亚硝酸盐还原酶的nrfA基因丰度汛期后高于汛期前,且在汛期后UW 和VW 区丰度较高;编码亚硝酸盐还原酶的nirD基因丰度最高.硝酸盐同化还原过程中,编码硝酸盐同化还原的nasA和nirB基因丰度均高于narB、nasB和nirA基因.

图10 氮代谢功能基因热图Fig.10 Heat map of functional genes of nitrogen metabolism
3 讨论
3.1 汛期前后不同土地利用类型河流浮游细菌多样性变化特征
汛期前浮游细菌多样性高于汛期后.汛期前,流速较慢,稳定的水体为浮游细菌提供了良好的环境,有利于处于竞争弱势的细菌繁殖,提高了细菌多样性[29];河流水温偏高,水体中细菌活性较强,进而导致浮游细菌在不同环境中表现出较大的空间差异性[30].汛期时,径流量增大,水位升高,河道连通性加强,促进了细菌的扩散和稀释作用,使得细菌空间差异性变小[31];强降雨将土壤中积累的营养盐带入河流,使NH4+-N 和NO3--N 浓度增加,导致降解污染物的特异性菌群大量繁殖抑制其他细菌的生长[4],造成多样性下降,这种效应在汛期后仍然存在.
不同土地利用类型河流浮游细菌多样性和丰富度差异明显.汛期前,各区域Chao 指数和Shannon-Wiener 指数均表现为UW 区>VW 区>AW 区>CW 区,该排序与人口密度大小排序一致.其原因可能是,UW 区人口密集,居民生活污水排放较多,水体中COD、NO3--N 和TN 浓度均较高,为细菌的生长繁殖提供了良好的生存环境[32-34];VW 和AW 区人口密度较小,污水排放量少,且VW 区河流汇入AW 区,AW 区细菌多样性和丰富度均低于VW 区,说明污水排放对浮游细菌的影响程度大于农业面源污染;CW区受人类干扰最小,水质稳定,细菌多样性和丰富度指数最低.汛期后,UW 区Chao 指数和Shanon 指数下降最多,其次为VW,CW 区下降最少.CW 与UW区属上下游关系,汛期后CW 与UW 区多样性指数相近,也论证了河流连通性增大,浮游细菌空间差异性减小;AW 和VW 区相交,但VW 区多样性指数低于AW 区,说明汛期对人类干扰较强区域的河流(UW 和VW 区)中浮游细菌的多样性影响较大,且影响程度大于区域的影响.
PCoA 和RDA 分析也得到了类似的结果.汛期前,VW 和UW 区差异明显,汛期后,VW、UW 和AW区重叠,表明汛期减弱了人类活动对河流浮游细菌空间差异性的影响,该结果与韩雪梅等[30]在老灌河研究浮游细菌多样性的结果一致.汛期前,影响AW 和UW 区细菌空间差异的主要环境因子分别为COD 浓度、NH4+-N 浓度、WT、EC,以及pH、DO 浓度、NO3--N浓度.汛期后主要为pH、NO3--N 浓度、NO2--N 浓度、TN 浓度和ORP.以上结果也验证了人类活动(包括氮和磷的输入)的轻度干扰有利于细菌多样性增加的结论.另外,已有研究表明受各种外部环境因素和内部物种间相互作用的影响,浮游细菌的时期性演替是一个每年重复的过程[35].
3.2 汛期前后不同土地利用类型河流浮游细菌群落组成变化特征
变形菌门是UW、VW 和AW 区的第1 优势菌门,在水环境中普遍存在,α-变形菌在氮循环中起到固氮作用[36],β-变形菌在淡水中占主导地位[13],γ-变形菌是化能异养菌,介导氢、硫和铁的生物地球化学循环[37],还有研究表明变形菌门在参与氮循环、氧化硫化物和降解有机物等方面具有重要作用[38].α-变形菌、β-变形菌和γ-变形菌占UW、VW 和AW 区总变形菌门的66.2% 以上,因此推断在受人类干扰的UW、VW 和AW 区河流中,变形菌门是物质循环的重要参与者.绿弯菌门和酸杆菌门是已知指示氮素污染物的微生物[39],该菌门相对丰度均表现出汛期前大于汛期后的特征,与TN 浓度变化一致.浮霉菌门在缺氧条件下能够利用亚硝酸盐氧化铵离子脱氮,汛期后NH4+-N 和NO2--N 浓度较高可能是造成该菌门相对丰度相对较高的原因.装甲菌门是广泛分布在湖泊尤其是温泉、热泉的优势细菌类群[40],汛期前高温天气为该菌的繁殖提供了良好的环境.
hgcI_clade和CL500-29_marine_group与蓝藻密切相关[41],CW 中hgcI_clade和CL500-29_marine_group的相对丰度均明显高于其他区域,说明该地区存在蓝藻异常增殖的风险;Limnohabitans偏好非酸性环境[42],在硝酸盐还原和磷循环中起着关键作用[43],该菌在AW 和VW 区相对丰度较高,与AW 和VW区河流NO3--N 和TP 浓度均呈正相关.Acinetobacter是污水细菌群落的核心类群,常见于人类和动物肠道及分泌物中,被作为人类干扰污染的指示菌种[44],除CW 外,其余三区Acinetobacter的相对丰度均较高.Thiobacillus通过氧化各种含硫化合物获得能量,可以为各种水生植物提供硫元素,但也增加了水污染的风险[45],该菌在汛期后的UW、VW 和AW 区较多且高于汛期前,说明汛期后水污染风险增加.Flavobacterium靠分解有机物生存,使得水质在一定程度得以提高[46-47].汛期后该菌的相对丰度显著升高,且在UW 区相对丰度最高,说明汛期增加了河流中有机物浓度,该结论与2.1 节一致.另外,Flavobacterium中的某些菌种具有致病作用,集中分布在江河、土壤沉积物和鱼的发病组织中[48],同时它还可以引起医院内感染,尤其是婴幼儿更容易感染[49].因此,对于该菌属也不容忽视,需强防护意识.
3.3 汛期前后不同土地利用类型河流浮游细菌功能预测空间变化特征
河流过量的氮输入会影响介导氮循环过程关键基因的丰度和比例,从而影响各个氮循环过程的速率[50].董志颖等[51]采用PICRUSt 功能预测分析过量氮输入对细菌群落代谢潜力的影响,发现氮输入在一定程度上影响了微宇宙中的固氮、硝化、反硝化、异化硝酸盐还原到铵和同化硝酸盐还原途径的关键基因.
本文采用PICRUSt2 功能预测分析汛期前后细菌氮代谢潜力的差异,发现参与氮代谢过程的反硝化、氮异化和同化还原基因丰度最高,是河流中生物脱氮的关键基因[52],且脱氮能力在受人类干扰的UW、VW 和AW 区最强.汛期前,有8 个涉及脱氮过程的基因丰度高于汛期后,分别为反硝化基因(nirK、norB和norC)、氮同化基因(napB) 和氮异化基因(narB、nasA、nirA和nirB);其中反硝化基因在AW区丰度最高,氮同化基因主要在UW 区,氮异化基因主要在VW 区,说明AW 区反硝化能力最强,UW 和VW 区硝态氮主要通过氮同化和氮异化的方式去除.汛期后,有6 个涉及脱氮的基因丰度高于汛期前,分别为反硝化基因(narG、narH和nosZ)、氮同化基因(nasB)和氮异化还原基因(nrfA和nirD).结合基因功能家族预测基因拷贝数和氮循环相关基因丰度分析,汛期后氮代谢能力整体高于汛期前,且反硝化和氮异化还原基因丰度在UW 和VW 区显著升高,编码亚硝酸还原酶的nirD与编码一氧化氮还原酶的norB和norC基因丰度增加最多,结合2.1 节分析,发现汛期后人类干扰区的NO3--N 和TN 浓度均升高,反硝化和硝酸盐异化还原细菌繁殖,促进了NO2--N 向氮气的转化.的转化.
4 结论
a) 汛期前后清潩河流域不同土地利用类型河流浮游细菌多样性存在显著性差异,且汛期对有人类干扰的UW、VW 和AW 区多样性影响最大.汛期前浮游细菌Shannon-Wiener 指数和Chao 指数高于汛期后,且人口密集的UW 区数值最大;汛期后,浮游细菌群落空间差异性减小,TN、NH4+-N 和COD 浓度增加,浮游细菌多样性和丰富度指数下降,且UW 区指数下降最多.
b) 差异性分析结果表明,汛期前共17 个门、54个属存在显著性差异,汛期后共有12 个门、40 个属存在显著性差异,不同土地利用类型是影响细菌群落组成的主要因素.CW 区与蓝藻密切相关的hgcI_clade和CL500-29_marine_group丰度最高,存在水体富营养化的风险;UW 区Limnohabitans、Rhodobacter和Rhodobacter丰度最高,氮素污染严重;AW 和VW区Flavobacterium、Nitrospira和Thiobacillus 丰度最高,氮磷循环能力最强.
c) PICRUSt2 功能预测分析表明,反硝化、氮同化和异化还原是清潩河流域的主要氮代谢功能,不同土地利用类型河流中氮代谢功能差异明显,在人类干扰较强的UW、VW 和AW 区氮代谢基因丰度远高于CW 区.

