湖北荆州地区鸡传染性贫血病病毒的流行病学调查及致病性分析
荣俊,李杨*,杨玉莹,李国攀
1.长江大学生命科学学院,湖北 荆州 434025 2.长江大学动物科学学院,湖北 荆州 434025
鸡传染性贫血病毒(Chicken anemia virus,CAV)属于圆环病毒科环状病毒属,是一种无包膜的二十面体病毒[1]。自我国于1992年由崔现兰等[2]首次分离报道该病毒后,全国各地相继发现该病的流行。在对我国多个省市2014—2015年CAV的分子流行病学的调查中发现,CAV阳性率为13.30%,其中混合感染率为55.56%,为主要的感染类型[3]。对我国13个省市的调查表明,2016-2019年CAV阳性率为12.5%~25.69%[4],而且CAV的感染在很多国家普遍存在,阳性率甚至高达60%以上[5-6]。CAV在鸡群中是水平和垂直传播的[7],且不同日龄的鸡均容易感染,幼鸡感染后会导致严重贫血和免疫抑制,甚至死亡。高日龄鸡感染后会导致免疫系统受损,从而与禽腺病毒(FADV)、马立克氏病毒(MDV)等病毒产生混合感染[8]。因存在诱发多种疾病混合感染与疫苗免疫失败的风险,给养鸡业带来严重的经济损失。
CAV基因组全长约2.3 kb,为单股负链环状DNA,共含有3个开放读码框,分别编码主要为结构蛋白的VP1、支架蛋白VP2以及名为凋亡蛋白的非结构蛋白VP3,VP1和VP2是中和抗体的主要靶点[9]。VP1与高度保守的VP2和VP3不同,VP1从氨基酸位点139到151位为高突变区,这些氨基酸的突变可能直接影响CAV的复制、传染性及其致病性。因此,VP1通常用于CAV的遗传进化和分子研究[10]。
由于对近年的分离毒株的致病性研究较少,为进一步了解CAV的流行情况与毒株的致病性,本研究通过PCR检测,调查了湖北荆州地区菜市场肉鸡感染CAV情况,对CAV全长核苷酸序列和VP1的氨基酸序列进行了系统发育分析,分析了CAV的遗传进化以及VP1蛋白的分子特征,并采用动物回归试验分析强毒株JZ2118的致病性,以期更好地了解在我国传播的CAV的流行病学及分子特征与致病性之间的联系。
1 材料与方法
1.1 主要试剂
DNA提取试剂盒与pTOPO-BluntT 载体购自北京艾德莱生物科技有限公司;琼脂糖凝胶DNA回收试剂盒购自Omega公司;大肠杆菌DH5α感受态细胞购自南京诺唯赞生物科技有限公司;2×Hieff Canace®Plus PCR Master Mix(With Dye)高保真酶预混液与Hieff UNICON®Universal Blue qPCR SYBR Green Master Mix购自翌圣生物科技股份有限公司。
1.2 样本收集与处理
2021年在湖北荆州地区6个菜市场收集肉鸡鸡肝样品224份,将收集鸡肝用高通量组织冷冻研磨仪进行匀浆,研磨后的组织匀浆4 000g离心5 min,取得匀浆上清并参照艾德莱DNA提取试剂盒说明书提取DNA,所提取的DNA储存于-20 ℃。
1.3 病料中CAV的PCR检测
根据GenBank中参考序列NX15091(KY486150)设计1对PCR引物,CIAV All Seq F(5′-GCATTCCGAGTGGTTACTATT-3′)/CIAV All Seq R(5′-GATTGTGCGGTAAAAGCATTT-3′)覆盖CAV全基因组序列。PCR产物通过10 g/L琼脂糖凝胶电泳及Bio-Rad凝胶成像系统成像进行分析,并用Omega DNA凝胶回收试剂盒进行回收。
1.4 CAV全基因测序及序列分析
将PCR扩增的CAV全基因片段亚克隆到pTOPO-Blunt T 载体,再转化至大肠杆菌DH5α感受态细胞中,筛选阳性克隆送至武汉擎科生物技术有限公司进行测序,从而获得分离毒株的全基因组序列。用MEGA 7软件对CAV全基因组序列和VP1、VP2、VP3氨基酸序列进行比对和分析,并构建CAV分离株与GenBank中32个已发表同源性较高的CAV(见表1)全基因序列和VP1氨基酸序列的遗传进化树。
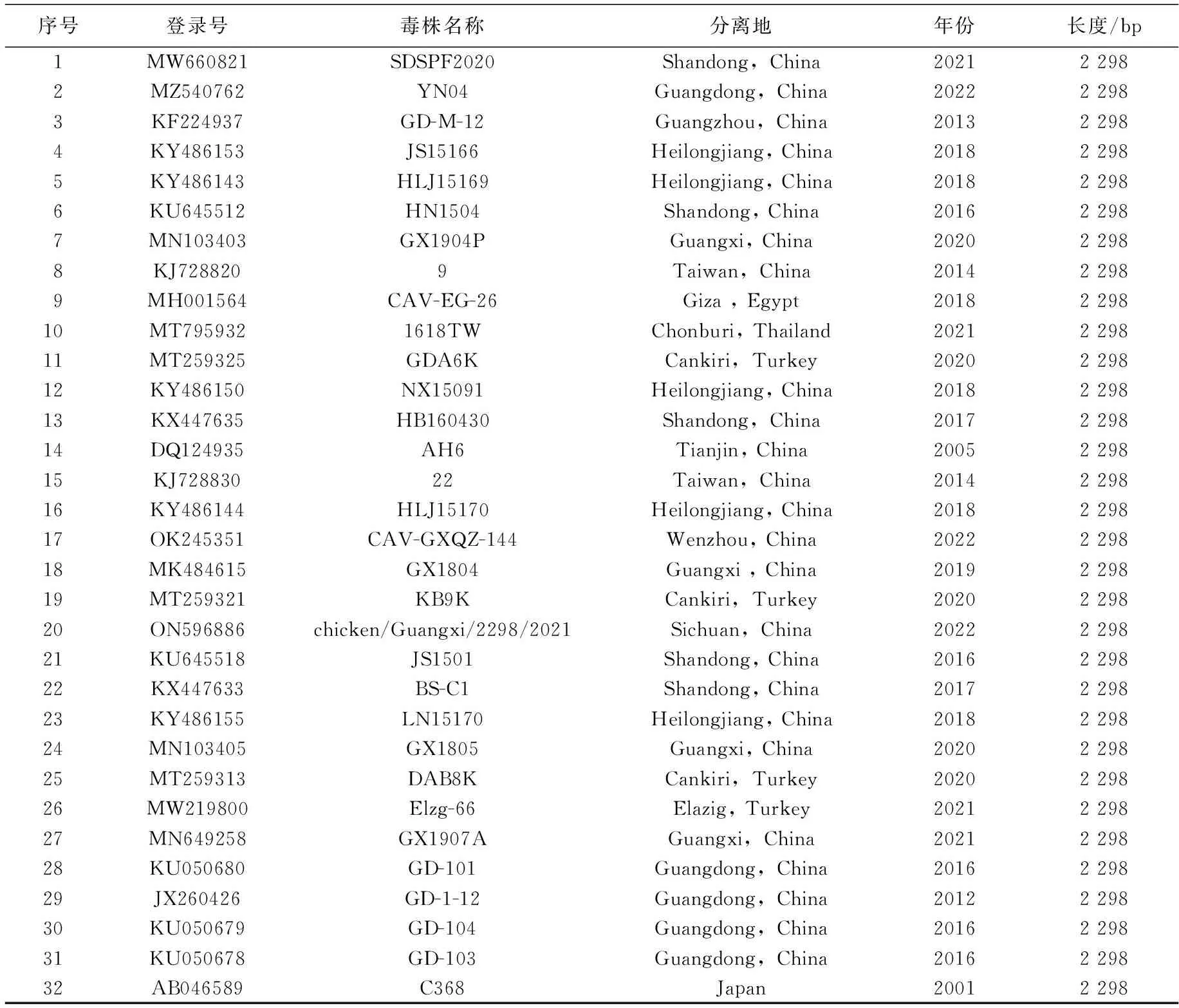
表1 参考株序列信息
1.5 动物回归试验
将阳性病料鸡肝脏提取的DNA,通过PCR扩增对禽腺病毒(FADV)、传染性法氏囊病病毒(IBDV)、禽白血病病毒(ALV)、网状内皮细胞增生病病毒(REV)与马立克氏病病毒(MDV)分别进行检验[11]。选取其他病毒检测为阴性,且含有符合强毒株特征的JZ2118毒株的鸡肝用研磨仪进行研磨,研磨后的匀浆4 000g离心5 min,取上清液,用0.22 μm滤器除菌过滤,分离出病毒液。
将孵化的1日龄SPF雏鸡分为2组,攻毒组(n=23)与对照组(n=10)。攻毒组每只胸肌注射100 μL(荧光定量检测:1.15×109病毒拷贝数)JZ2118毒株组织病毒液,对照组以同样方式注射100 μL生理盐水,每天观察精神状态及监测肛温体重。感染14 d后采集全血进行血常规检测并全部剖检,测定肝组织CAV的病毒载量及胸腺组织与法氏囊组织的病理切片。
1.6 病毒载量测定
参照北京艾德莱DNA提取试剂盒说明书提取肝脏组织DNA。采用实时荧光定量PCR中绝对定量法检测组织病毒载量,根据与JZ2118毒株序列设计引物Prime 2 FP P6D(5′-ACCACCTCAAGCGACTTC-3′)/Prime 2 RP P6D(5′-GCAGCCTCACACTATACG-3′),扩增CAV基因组序列中长度为123 bp的核苷酸序列,用于标准曲线制作及待检样品的检测。
1.7 血常规检测
使用10% EDTA-Na2溶液作为全血的抗凝剂,按照全血与抗凝剂25∶1的比例采集全血,进行血常规检测。
1.8 病理组织切片
取胸腺与法氏囊,用4%的多聚甲醛固定液固定,进行石蜡包埋与苏木精-伊红染色(HE染色),再进行显微观察。
2 结果与分析
2.1 CAV病原检测
通过PCR检测,从收集的224份鸡肝样品中,共检出18份CAV阳性病料(见图1),CAV阳性率为8.04%。检测的新CAV毒株使用格式PPYYXXX命名,其中PP是采样位置,YYXXX是样本来源的时间和顺序,毒株命名依次为JZ2101~JZ2118。
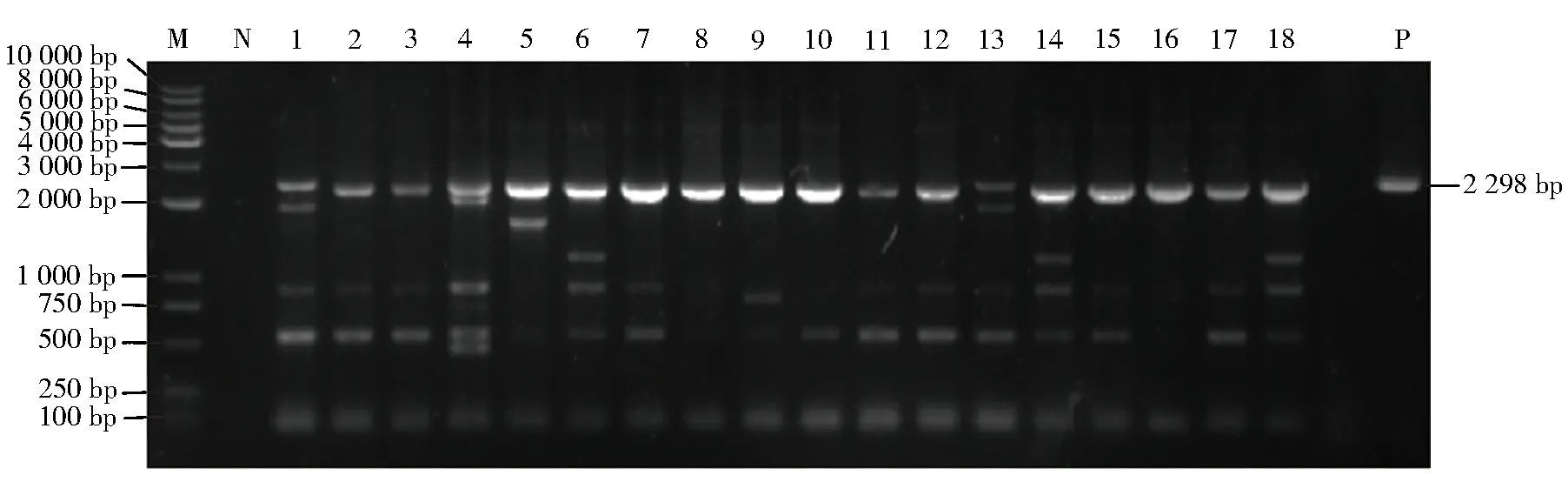
注:M为标准分子量DNA Maker;1~18为CAV JZ2101-JZ2118基因条带检测;N为阴性对照;P为阳性对照。图1 全长CAV基因组扩增结果Fig.1 CAV gene band test results
2.2 CAV全基因组序列分析
通过对18个CAV毒株全长基因序列的测序,基因片段的大小均为2 298 bp,与32个参考株的全基因组序列构建遗传进化树(见图2),遗传进化树可分为3个基因群,分别是JZ2101、JZ2103、JZ2104、JZ2106、JZ2107、JZ2109、JZ2116、JZ2118毒株与主要来自广东、广西的毒株被归类于A组,JZ2102、JZ2108、JZ2110、JZ2112、JZ2113、JZ2114毒株与主要来自土耳其、天津的毒株被归类于B组,JZ2105、JZ2111、JZ2115、JZ2117与主要来自山东、黑龙江的毒株被归类于C组。国内强毒株GD-103、GD-104及日本强毒株C368全部被归类于A组,A组中毒株JZ2118、JZ2107与JZ2109与3株强毒株亲缘关系最近,与3株强毒株的核苷酸序列同源性为98.9%~99.4%。
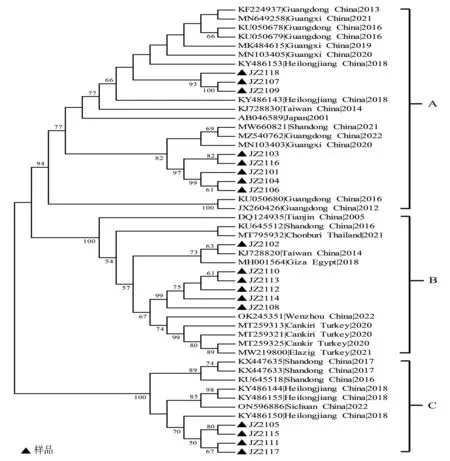
图2 CAV全基因组进化树分析Fig.2 Phylogenic tree analysis of the CAV complete genome
2.3 CAV的VP1、VP2、VP3序列分析
根据GenBank获得参考株与18个毒株的VP1、VP2、VP3核苷酸序列,18个毒株的VP1、VP2、VP3的核苷酸序列大小分别为1 350、651、366 bp,与参考序列相比未发现插入或缺失。18个毒株的VP1的同源性为96.1%~99.9%,VP2的同源性为98.9%~100%,VP3的同源性为99.7%~100%,VP2和VP3都非常保守,主要核苷酸突变发生在VP1蛋白的编码区。
用MEGA 7软件对VP1、VP2与VP3蛋白的核苷酸序列进行翻译和比对,结果表明,18个毒株的VP1有36个氨基酸位点发生替换,VP2有4个氨基酸位点发生替换,VP3未发生氨基酸替换。VP1蛋白有15个位点的突变频率较高,突变信息如表2所示,其他突变频率较低的位点是F12L、P14A、V107E、G137V、A164S、W168C、L170V、M157L、D177H、N183S、G194V、K216R/T、G231E、D239A、V240I、Y242S、H246L、V436I、Y444S;VP2蛋白发生4个氨基酸替换,分别为E24G、N36D、F170Y、R205K,且均为JZ2101毒株的氨基酸替换。

表2 新分离株的VP1蛋白中的主要氨基酸差异
VP1氨基酸序列进化树(见图3)也分为3个组群,JZ2101、JZ2103、JZ2104、JZ2106、JZ2107、JZ2109、JZ2116、JZ2118与主要来自广东、广西的毒株被归类于A组,JZ2105、JZ2111、JZ2115、JZ2117与主要来自山东、黑龙江的毒株被归类于C组,JZ2102、JZ2108、JZ2110、JZ2112、JZ2113、JZ2114与主要来自土耳其毒株被归类于B组,分组结果几乎与全基因序列的进化树相同,说明了CAV的遗传进化主要与VP1蛋白的氨基酸突变有关。VP1氨基酸序列进化树中的A组与C组分离毒株中氨基酸位点75V、89T、125L、139K、141Q、144E、394Q与国内强毒株GD-103、GD104株及日本强毒株C368全部一样,表明A组和C组中的毒株均符合强毒株特征。尤其A组中的分离毒株可能与这3株强毒株具有相似的致病性。

图3 CAV VP1氨基酸序列进化树分析Fig.3 Phylogenetic tree analysis of CAV VP1 amino acid sequence
2.4 JZ2118毒株的致病性分析
1日龄SPF雏鸡攻毒10 d后开始出现精神萎靡、羽毛蓬松、体重下降等临床症状;在攻毒第11 d开始出现死亡,并出现肛温先升高后下降的现象。在感染14 d后,攻毒组23只,死亡19只,仅4只存活,致死率高达82.6%,对照组全部存活(见图4(a))。
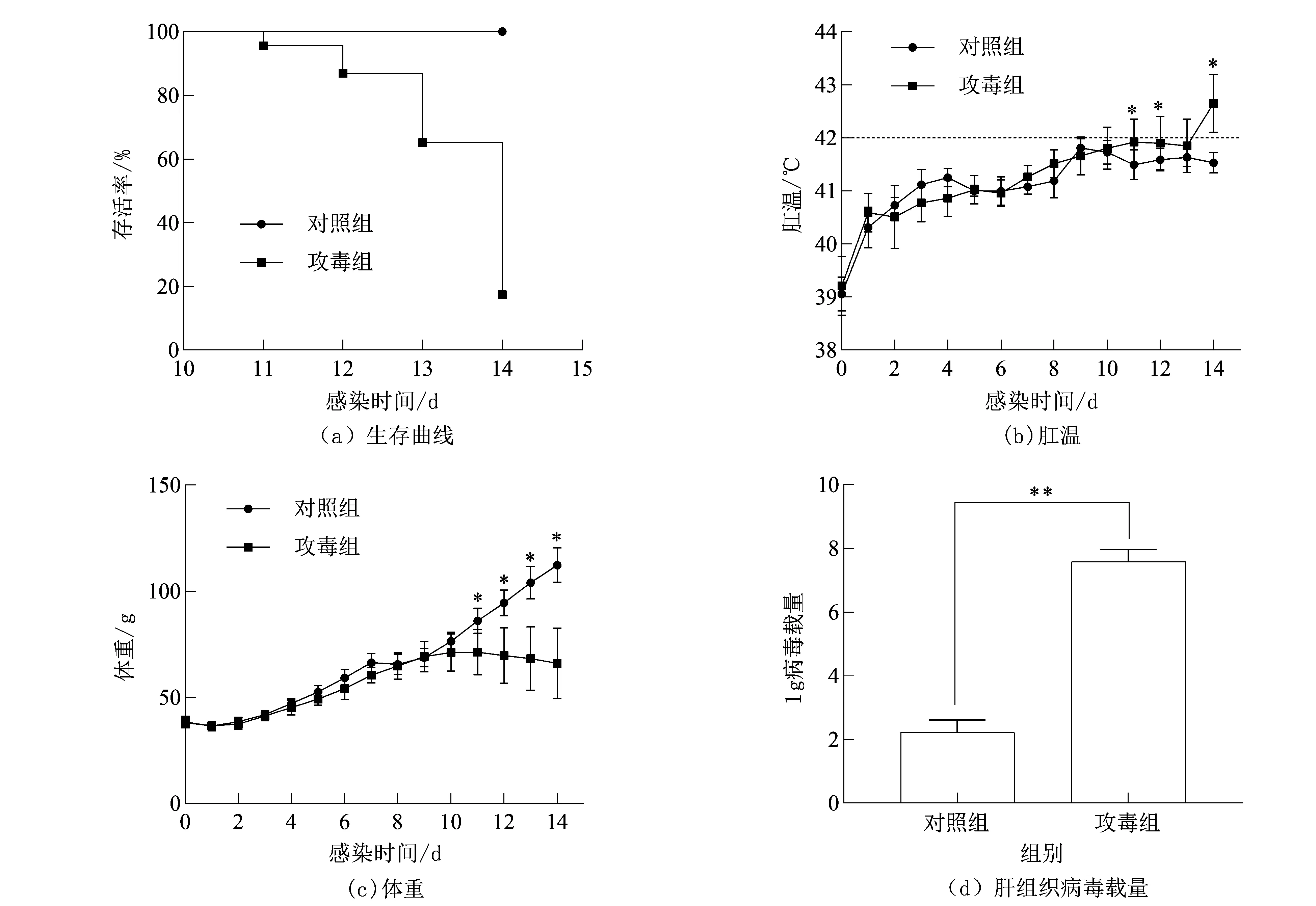
注:*表示具有显著性差异(P<0.05),** 表示具有极显著性差异(P<0.01)。图4 对照组与攻毒组生存曲线、肛温、体重、病毒载量的比较Fig.4 Comparation of the survival curve,temperature,body weight,viral load of liver tissueof the control group and the challenge group
根据每日肛温监测,刚孵化的1日龄SPF雏鸡肛温在(39.21±0.56)℃左右,随着日龄的增长肛温逐渐上升,逐渐稳定在41.5 ℃左右(见图4(b)),而攻毒组的鸡在死亡的前2 d肛温会出现升高,升到42 ℃以上,甚至43 ℃以上;刚孵化的1日龄雏鸡体重一般在(38.03±2.21)g,对照组鸡的体重在2周内不断增加,2周后能达到100 g以上,而攻毒组鸡的体重在感染10 d左右开始出现下降或增长缓慢(见图4(c)),2周后体重降到70 g以下。
通过荧光定量PCR获得的标准曲线方程为Ct=-3.327lgN+37.677,式中:Ct为阈值循环数,N为病毒拷贝数,相关系数R2=0.992,扩增效率为99.8%,计算得出对照组每毫克肝组织的病毒拷贝数约为102,攻毒组每毫克肝组织病毒拷贝数约为107,对攻毒组与对照组每毫克肝组织病毒拷贝数的对数值用独立样本t检验进行统计分析(见图4(d)),即两组具有极显著性差异(P<0.01)。
由采集全血的血常规检测结果(见表3)可知,对照组与攻毒组的白细胞(WBC)数目、红细胞(RBC)数目、血红蛋白浓度(HGB)、红细胞压积(HCT)、平均红细胞血红蛋白浓度(MCHC)、淋巴细胞数目(Lym)、中性粒细胞(Neu)数目、中性粒细胞比例、淋巴细胞(Lym)比例、嗜酸性粒细胞(EOS)数目通过独立样本t检验分析均具有极显著性差异(P<0.01)。其中RBC数目、HGB、HCT与MCHC下降表明攻毒组出现了严重的贫血,WBC数目与Neu比例下降表明鸡受到了病毒感染,Lym比例下降说明鸡感染后对其造成了免疫缺陷,EOS数目下降说明鸡发生了再生障碍性贫血。
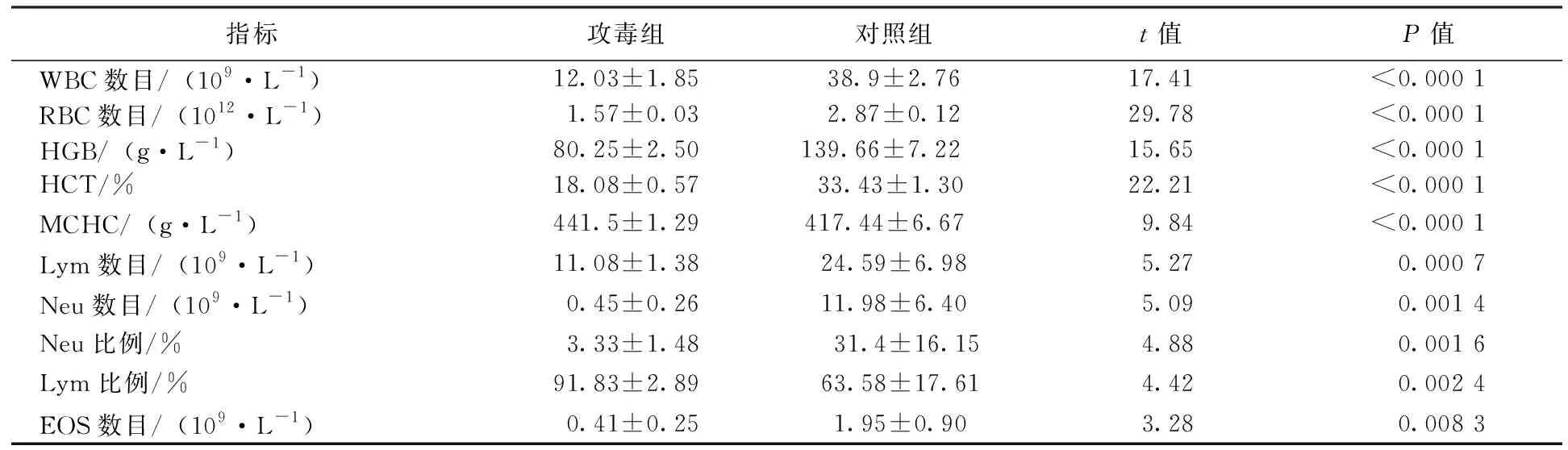
表3 血常规检测结果
通过对胸腺组织与法氏囊组织的病理切片的结果来看,图5(a)中对照组胸腺皮质与髓质界限分明,皮质有大量的淋巴细胞,而图5(b)中攻毒组胸腺皮质与髓质的界限消失,皮质内淋巴细胞严重减少,且并伴有出血症状,胸腺结构破坏严重;图5(c)中对照组的法氏囊滤泡与滤泡之间紧密相接,且滤泡内有较多的淋巴细胞,而图5(d)中攻毒组的法氏囊发生滤泡萎缩,滤泡之间间隙增大,且淋巴细胞数量减少,表明雏鸡感染CAV后免疫系统被严重破坏,从而发生免疫抑制。
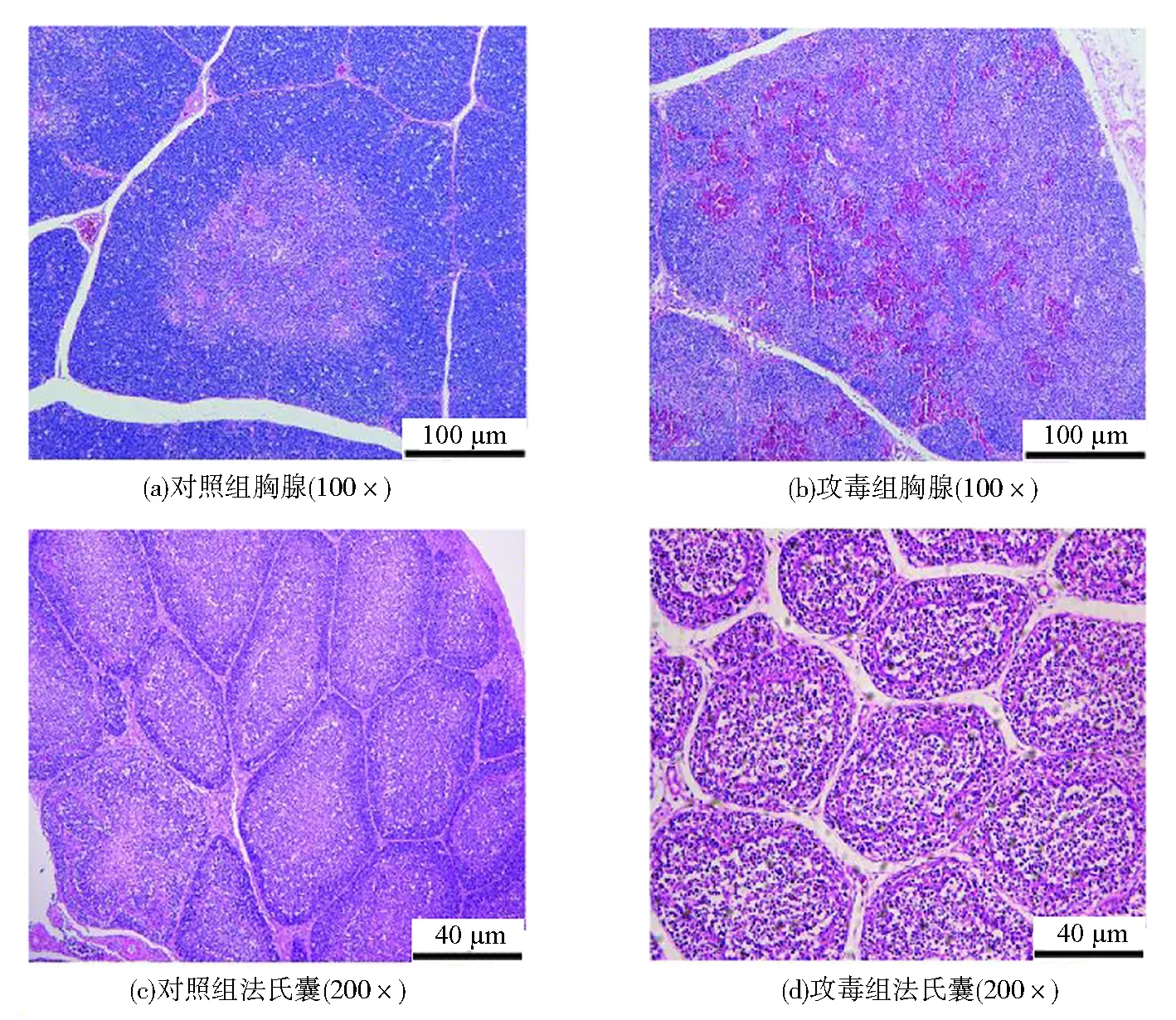
图5 感染14日鸡的胸腺与法氏囊HE染色结果Fig.5 Results of thymus with bursal HE staining in chickens infected on 14 days
3 讨论
有研究表明,VP1蛋白的第394位氨基酸是毒力的主要遗传决定因素,谷氨酰胺(Q)和组氨酸(H)分别代表高和低致病性,以及毒力衰减的其他突变(75I、125I、139Q和144Q)[12]。其中18株CAV毒株的VP1蛋白的394位氨基酸均为谷氨酰胺(Q),且JZ2101、JZ2103、JZ2104、JZ2105、JZ2106、JZ2107、JZ2109、JZ2111、JZ2115、JZ2116、JZ2117、JZ2118都具有75V、89T、125L、141Q和144E的组合,表明都不具有减毒特征,且与已经鉴定过为强毒株的AV1550株、GD-103株、GD-104株、C368株的第75、89、125、141、144氨基酸位点相同[13-14]。本研究中,荆州地区肉鸡中CAV的感染率为8.04%,虽然低于近年来其他地区调查的感染率12.5%~25.69%,但在18株的CAV毒株中有12株符合强毒株特征,强毒株占66.7%,说明荆州地区流行CAV毒株多为强毒株。而且其中JZ2118毒株经过动物回归试验也证明具有较强的致病性,推测另外11株可能具有同样较强的致病性。
TODD等[15]研究表明,如果VP1蛋白位点第75、89、125、141和144位同时发生氨基酸突变,即使在第394位氨基酸为谷氨酰胺(Q),鸡感染CAV后也不会导致贫血、白骨髓和胸腺萎缩。本研究中JZ2102、JZ2108、JZ2110、JZ2112、JZ2113、JZ2114毒株都发生75I、125I、139Q和144Q的突变。TODD等[16]将Cuxhaven-1 CAV在173次细胞培养传代后获得克隆的减毒CAV分离物,在幼鸡传代10次后恢复了致病性,其中VP1蛋白的第287位氨基酸从丙氨酸(A)变为天冬氨酸(D)。而JZ2102、JZ2108、JZ2110、JZ2112、JZ2113、JZ2114毒株的第287位氨基酸均为丙氨酸(A),推测这6株毒株很可能为减毒毒株。
王林等[17]研究表明,1日龄与7日龄的SPF鸡比21日龄更容易感染CAV,且肌肉注射比口服的致病性更强。本研究中,1日龄肌肉注射的攻毒方法致死率达到82.6%,在感染的10~14 d达到致病的关键期,从各项临床症状及相关病理变化体现了分离株JZ2118的高致病性。本研究进一步了解了CAV的遗传进化及分子特征与致病性之间的联系,验证符合强毒株特征的JZ2118毒株的确具有高致病性。后续研究需要对CAV作进一步的分子和病原特征分析,以找出它们之间的变异,这将有助于相关疫苗的研发以及制定适当的控制策略,防止家禽业的损失。

