鸡MyD88基因对巨噬细胞增殖和凋亡的影响
丁梦霞,朱召岩,于燕鸽,王冰欣,昝瑞隆,田亚东,孙桂荣,韩瑞丽,蒋瑞瑞,康相涛,闫峰宾*
(1.河南农业大学 动物医学院,河南 郑州450046;2.河南农业大学 动物科技学院,河南 郑州 450046)
髓样分化因子88(myeloid differentiation factor 88,MyD88)是Toll样受体(toll-like receptor,TLR)信号通路中的一个关键接头分子,在传递上游信息和疾病发生发展中具有重要的作用[1-2]。Toll样受体是重要的天然免疫受体家族,是连接非特异性免疫和特异性免疫的桥梁。现有研究证明,除了TLR3以外,MyD88参与了TLRs家族其他所有成员介导的免疫反应[3]。研究发现,激活MyD88所介导的TLR4/MyD88/NF-κB信号通路,可导致Th1/Th2免疫失衡,破坏机体免疫系统[4]。MyD88活化后能参与调控多条信号通路,从而影响机体的免疫、增殖、凋亡等生理过程[5]。细胞增殖和凋亡是生物生长发育的基础,鸡巨噬细胞(HD11)的增殖和凋亡对维持家禽机体正常的器官结构和免疫功能至关重要。目前有关MyD88的研究多集中在动物感染性疾病、人类肿瘤和小鼠肠道炎,而在家禽中的报道较少。迄今为止,未见MyD88基因在鸡HD11细胞增殖和凋亡过程中作用的相关报道。
在前期研究中,通过转录组测序发现MyD88基因在皮质酮(corticosterone,CORT)诱导的雏鸡应激模型中通过TLR4/MyD88信号通路对鸡的免疫功能具有潜在调节作用[6]。免疫功能的改变会影响动物的生长发育,体内代谢紊乱,改变细胞周期进程,导致细胞异常凋亡等。MyD88作为连接先天性和适应性免疫应答的关键信号转导基因,在人和小鼠方面研究屡有报道,但是,其在鸡HD11细胞增殖和凋亡过程中的作用尚不明确。因此,为探究免疫相关基因MyD88对鸡HD11细胞增殖和凋亡的影响,本试验通过构建MyD88基因过表达载体,以及合成干扰片段,并分别转染至鸡HD11细胞中,为深入解析MyD88基因在鸡HD11细胞增殖和凋亡过程中的作用提供依据。
1 材料与方法
1.1 实验材料HD11细胞由中国农业科学院北京畜牧兽医研究所赵桂苹教授赠予;RPMI1640培养基和胎牛血清购自Biological Industries(BI)公司;CCK-8试剂盒购自南京诺唯赞生物科技股份有限公司;细胞周期检测试剂盒购自江苏凯基生物技术有限公司;转染试剂Lipofectamine 2000购自美国Invitrogen生命技术公司;MyD88过表达载体(pcDNA3.1-EGFP-MyD88)由武汉金开瑞生物工程有限公司构建;MyD88干扰片段(si-RNA)由上海吉玛制药技术有限公司合成。
1.2 HD11细胞的培养将HD11细胞复苏后置于37℃、5% CO2恒温培养箱中培养,待细胞密度达到90%以上,即可进行细胞传代,待细胞传代至F3代,即可用于后续试验。
1.3 CCK-8检测细胞活性将HD11细胞均匀铺在96孔板中,待细胞完全贴壁后根据说明书使用Lipofectamine 2000转染MyD88过表达质粒(pcDNA3.1-EGFP-MyD88)和干扰片段(si-MyD88)及相应对照pcDNA3.1-EGFP和si-NC,转染12,24,36,48 h后每孔加入10 μL CCK-8试剂,孵育2 h后,采用多功能酶标仪在450 nm波长下检测细胞吸光度。
1.4 流式细胞术检测细胞周期将HD11细胞均匀铺在12孔板中培养,待细胞完全贴壁后转染pcDNA3.1-EGFP-MyD88质粒与si-MyD88基因干扰片段和相应的对照,转染24 h后弃去培养基,1 500 r/min离心4 min,每管加入1 mL预冷的75%乙醇,重悬细胞,4℃固定12 h,离心后,每管加入500 μL碘化丙啶(propidium iodide,PI)染色液,利用流式细胞仪,标准程序下检测细胞周期,利用FlowJo 7.6软件分析结果。
1.5 流式细胞术检测细胞凋亡将HD11细胞接种于12孔板中,转染pcDNA3.1-EGFP-MyD88质粒与si-MyD88基因干扰片段和相应的对照24 h后,弃去培养基,用无EDTA胰酶消化后,2 500 r/min离心2 min,每管加入1 mL PBS清洗2次,取100 μL细胞悬液于5 mL流式管中,加入5 μL FITC Annexin V(组份 A)和2 μL PI(组份 B),室温避光反应 15 min,加入 400 μL 1×Annexin-binding buffer,混匀后,用流式细胞仪进行检测(激发波长:488 nm;发射波长:530 nm)。
1.6 qRT-PCR检测MyD88对HD11细胞增殖和凋亡标志基因表达水平的影响转染pcDNA3.1-EGFP-MyD88质粒与si-MyD88基因干扰片段和相应对照36 h后,收集细胞,TRIzol 法提取细胞的总RNA,并反转录为cDNA,以cDNA为模板,鸡GAPDH基因为内参,采用qRT-PCR检测增殖和凋亡标志基因CCND1、PCNA、P21和Bax、Caspase 3、Caspase 9、Bcl-2基因的表达变化。引物序列信息见表1。

表1 qRT-PCR引物信息

2 结果
2.1 转染MyD88基因过表达质粒荧光结果将pcDNA3.1-EGFP-MyD88质粒与pcDNA3.1-EGFP空载体质粒转染至HD11细胞24 h后,利用荧光倒置显微镜观察绿色荧光蛋白表达情况。结果如图1所示,细胞内均能观察到EGFP绿色荧光蛋白标签表达,表明所构建的MyD88过表达质粒能够正常转染至HD11细胞,且正常表达EGFP绿色荧光蛋白标签。

A.HD11细胞形态;B.HD11细胞内表达绿色荧光;C.A与B两者融合
2.2 MyD88对HD11细胞活性的影响为检测MyD88对HD11细胞活性的影响,在分别转染pcDNA3.1-EGFP-MyD88质粒与si-MyD88基因干扰片段及其相应对照后,采用CCK-8检测各组细胞的活性。结果显示,与过表达对照组pcDNA3.1-EGFP相比,转染pcDNA3.1-EGFP-MyD88质粒36,48 h HD11细胞活力显著下降(图2A,P<0.05);与NC干扰对照组相比,转染si-MyD88干扰片段36,48 h HD11细胞活力显著高于对照组(图2B,P<0.05)。

A.过表达MyD88对HD11细胞的影响;B.干扰MyD88对HD11细胞的影响;与对照组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同
2.3 MyD88对HD11细胞周期的影响为检测MyD88基因对HD11细胞周期的影响,在分别转染pcDNA3.1-EGFP-MyD88质粒与si-MyD88基因干扰片段及其相应对照后,采用流式细胞术检测各组细胞的细胞周期分布情况。结果显示,转染pcDNA3.1-EGFP-MyD88质粒可显著增加G2期细胞数(P<0.05),极显著降低S期细胞数(P<0.01),抑制HD11细胞增殖(图3A);转染si-MyD88干扰片段可极显著降低G1期细胞数(P<0.01),增加S期细胞数(P<0.01),促进HD11细胞增殖(图3B)。
2.4 MyD88对HD11细胞增殖标志基因mRNA表达水平的影响为进一步确定MyD88对HD11细胞增殖的影响,采用qRT-PCR检测增殖标志基因CCND1、PCNA和P21的mRNA表达水平。结果显示,转染pcDNA3.1-EGFP-MyD88质粒后促增殖标志基因CCND1和PCNA表达水平显著降低(P<0.05),抑增殖基因P21显著升高(P<0.05,图4A);转染si-MyD88干扰片段可显著上调促增殖标志基因PCNA的表达(P<0.05),显著下调抑增殖基因P21的表达(P<0.05,图4B)。此结果与CCK-8和细胞周期结果一致,进一步说明MyD88基因对HD11细胞增殖具有抑制作用。
2.5 MyD88对HD11细胞凋亡和凋亡相关基因表达水平的影响为检测鸡MyD88基因对HD11细胞凋亡的影响,在分别转染MyD88过表达质粒和干扰片段及相应对照后,采用流式细胞术和qRT-PCR法检测MyD88过表达和干扰对细胞凋亡的作用。流式细胞术结果显示,转染MyD88过表达质粒和干扰片段及相应对照后,与对照组相比MyD88过表达组凋亡率极显著升高(P<0.01,图5A);转染MyD88基因干扰片段后可与对照组相比可显著降低HD11细胞凋亡(P<0.05,图5B)。qRT-PCR检测结果显示,转染MyD88过表达质粒可显著上调Bax、Caspase 3和Caspase 9基因的表达水平(P<0.05),下调Bcl-2基因的表达水平(P<0.05)(图6A);转染MyD88基因干扰片段后可显著下调Bax和Caspase 9的表达水平(P<0.05,图6B),结果表明,鸡MyD88基因对HD11细胞凋亡具有促进作用。
3 讨论
细胞增殖是细胞生命活动的重要特征之一,是生物繁育的前提。当机体受到外界不良刺激时,免疫系统一方面可以通过募集组织中巨噬细胞来增强免疫反应;另一方面,巨噬细胞通过快速增殖和自我更新同样可以起到增强免疫反应作用[7-8]。细胞增殖是通过细胞周期来实现的,细胞周期调控异常易发生细胞癌变。细胞增殖伴随多种基因的转录和细胞因子的表达,CCND1是细胞周期从G1期到S期通过限制点调节过渡的关键把关蛋白[9];PCNA是参与DNA代谢过程的重要蛋白质,阻断该基因会抑制DNA合成,进而阻滞细胞周期,由于其在复制中的作用而被认为是增殖的分子标记物[10];细胞周期蛋白激酶抑制剂p21可以通过抑制PCNA的活性,诱导DNA损伤,从而引发细胞周期阻滞,抑制细胞增殖[11-12]。大量研究表明,MyD88的表达与肿瘤、癌症及免疫性疾病有着密切关系。研究发现[13],激活MyD88上游基因TLR7后能够通过抑制T细胞增殖而发挥抗肿瘤的作用。本研究在转染MyD88过表达质粒后,通过流式细胞术和qRT-PCR检测HD11细胞增殖情况,结果发现,MyD88过表达可显著降低细胞周期中DNA合成期S期的占比率,下调增殖标志基因的表达水平,提示MyD88活化后可通过影响HD11细胞的DNA合成来调控HD11细胞的增殖,从而影响HD11细胞的生长发育。
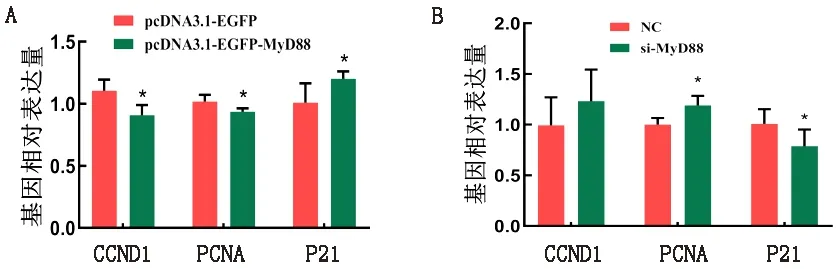
A.过表达MyD88对HD11细胞增殖标志基因的影响;B.干扰MyD88对HD11细胞增殖标志基因的影响

A.过表达MyD88对HD11细胞凋亡标志基因的影响;B.干扰MyD88对HD11细胞凋亡标志基因的影响
细胞凋亡可以使免疫细胞由活化状态进入凋亡状态,从而降低细胞免疫反应,凋亡是由多种凋亡调节因子严格控制的过程,而凋亡过程的紊乱可能与许多疾病的发生有直接或间接的关系[14-15]。其中,Bcl-2可防止细胞凋亡,而Bax位于线粒体外膜,能促进线粒体释放促凋亡因子,引发细胞凋亡[16]。Caspase 9能促进细胞凋亡并参与细胞因子加工[17];Caspase 3是一种常被激活的死亡蛋白酶,参与细胞解体和凋亡小体的形成,被广泛用作凋亡的生物标志物[18]。研究发现,当使用siRNA敲除TLR4基因后,发现能抑制凋亡基因Caspase 3、Caspase 9和Bax的激活从而防止小鼠心肌凋亡[19]。当细胞中MyD88浓度升高到一定水平时可激活NF-κB的大量分泌,破坏细胞免疫平衡,引起炎症因子的大量释放,导致细胞凋亡[20]。本研究通过流式细胞术及qRT-PCR方法检测过表达和干扰MyD88对HD11细胞凋亡的影响,结果显示,MyD88过表达后可显著提高HD11细胞的凋亡率,促进HD11细胞的凋亡;干扰MyD88基因可显著降低HD11细胞的凋亡率,抑制HD11细胞的凋亡。研究发现[13],激活依赖性MyD88信号通路后能够促进肾癌细胞和血管内皮细胞凋亡,其机制是通过依赖Caspase和Bcl-2途径诱导靶基因凋亡。还有研究发现[21],成纤维细胞生长因子21(FGF21)通过抑制MyD88所在的TLR4/MyD88/NF-κB信号通路来抑制细胞凋亡。这与本研究通过干扰MyD88基因降低HD11细胞凋亡率结果一致。
综合以上结果推测,MyD88基因能通过在鸡HD11细胞中高表达,抑制HD11细胞的DNA合成期来抑制细胞的增殖,阻滞细胞周期进程导致细胞异常凋亡,其机制可能是通过激活TLR4/MyD88/NF-κB信号通路,导致HD11细胞产生炎症反应,从而破坏细胞的免疫平衡。

