鹅细小病毒诱导番鸭胚成纤细胞自噬
王 劭,程晓霞,肖世峰,林锋强,朱小丽,陈少莺,陈仕龙
(福建省农业科学院 畜牧兽医研究所 福建省畜禽疫病防治工程技术研究中心,福建 福州 350013)
鹅细小病毒(goose parvovirus,GPV)可以引起1月龄内雏鹅或雏鸭急性肠炎以及心、肝、脾、肾实质脏器炎症等感染性病变[1]。由于GPV不断进行抗原漂移,编码区基因点突变或多点突变累积和基因亚型间的重组极易产生新的水禽细小病毒[2]。番鸭小鹅瘟病毒(muscovy duck-origin goose parvovirus,MDGPV)能引起1月龄内雏番鸭发生以小肠急性卡他性—纤维素性坏死性肠炎为主要临床特征的高度致死性接触性传染病,发病率为50%~70%,病死率为40%~60%,给番鸭养殖业造成了较大的经济损失[3]。作为细小病毒科依赖病毒属的成员,MDGPV与经典鹅源GPV类 B分离株具有共同的理化性质和形态特征,均属于细小病毒科依赖病毒属,是一种小型无包膜单链DNA病毒,含有正链DNA和含有负链DNA的病毒粒子数目基本相等,基因组大小约为5.0 kb,由左右两侧两个开放阅读框(open reading frame,ORF)组成,左侧ORF(LORF)编码非结构蛋白(nonstructural protein,NS)NS1和NS2,右侧ORF(RORF)编码3种结构蛋白(viral capsid protein,VP)VP1、VP2及VP3。NS蛋白和VP蛋白分别具有共同的羧基端,形成套式结构[4]。与其他自主细小病毒一样,GPV NS蛋白参与病毒复制及其致病过程的调控,而VP蛋白负责单链病毒子代DNA的包装以形成传染性子代病毒粒子[5]。近年来,新发短喙矮小综合征鹅细小病毒(goose parvovirus associated with short beak and dwarfism syndrome,SBDS-GPV)引起病鸭短喙长舌、生长发育迟缓、骨骼脆易折断,僵鸭淘汰率高达80%,造成了病鸭养殖业严重的经济损失[6]。因此,研究GPV在宿主细胞内的复制过程,有助于深入探讨病毒与宿主细胞的相互作用,也将为GPV的防治策略提供新思路。
细胞自噬是一系列自噬体结构演变的过程,其标志是形成一种称为自噬体(autophagosome)的瞬时双层膜结构囊泡,与溶酶体(lysosome)融合形成自噬溶酶体(autolysosome),降解细胞内的蛋白聚集体、衰老损伤的细胞器以及侵入细胞的病原体等维持细胞稳态并产生循环能量的途径[7-9]。在自噬发生过程中,胞浆型微管相关蛋白1轻链3(即自噬相关蛋白 LC3-Ⅰ)会酶解掉一小段多肽,脂质化转变为LC3-Ⅱ,定位于自噬体双层膜结构上[10]。因此,膜结合型LC3-Ⅱ增多或LC3-Ⅱ/LC3-Ⅰ的比值升高是鉴定细胞自噬活性的重要指标。p62/sequestosome-1(SQSTM1)是一种重要的选择性自噬接头蛋白[11]。在自噬发生过程中,p62蛋白可以作为泛素化蛋白的接头蛋白,通过结构域分别与泛素化疷物及自噬小体连接,将待降解疷物转运至自噬溶酶体系统,完成泛素化底物降解;也可以通过自身寡聚化和多聚化,作为自噬的选择性底物参与蛋白质的自噬性降解过程[12]。虽然自噬被认为是细胞对各种细胞外和细胞内刺激的一种适应性应答,但也是调节病原体与宿主相互作用的天然防御机制,越来越多的证据表明,许多RNA或DNA病毒已进化出多种策略抵抗、逃逸细胞自噬,甚至利用自噬体结构作为病毒复制平台促进自身增殖[13]。哺乳动物细小病毒能够诱导细胞自噬有利于子代病毒复制[14-15],然而水禽细小病毒在感染宿主细胞过程中诱导自噬的程度仍不清楚。本试验利用MDGPV分离株PT与SBDS-GPV分离株M15细胞适应毒分别感染番鸭胚成纤维细胞(Muscovy duck embryo fibroblasts,MDEFs),检测细胞内自噬相关蛋白的表达;并通过影响自噬产生的信号通路,明确细胞自噬与GPV复制之间的关系。
1 材料与方法
1.1 病毒与细胞MDGPV细胞适应毒(MDGPV-PT)株与SBDS-GPV细胞适应毒(SBDS-GPV M15)株均为本实验室分离并保存。MDEFs为本实验室按常规方法制备。
1.2 主要试剂DMEM培养基、胎牛血清购自赛默飞世尔科技(中国)有限公司;雷帕霉素(Rapamycin,RAPA)(HY-10219)、3-甲基腺嘌呤(3-Methyladenine,3-MA)(HY-19312)、阿洛司他丁(aloxistatin,E64d)(HY-100229)购自MedChem Express公司;Anti-LC3 antibody(L7543)、Anti-p62/SQSTM1 antibody(P0067)、Anti-β-actin antibody(A1978)购自Sigma-Aldrich公司;Anti-Duck IgG (H+L) Antibody、Peroxidase-Labeled(5220-0296)购自KPL公司;HRP Conjugated AffiniPure Goat Anti-mouse IgG (H+L)(BA1051)、HRP Conjugated AffiniPure Goat Anti-rabbit IgG (H+L)(BA1055)、Alexa Fluor 488标记山羊抗兔IgG (H+L)(A0423)、SDS-PAGE凝胶快速配制试剂盒(P0012AC)、硝酸纤维素膜(Nitrocellulose membrane,NC membrane)(FFN02)、脱脂奶粉(P0216-300g)、DAPI(C1002)购自碧云天生物技术有限公司;MDGPV阳性血清与SBDS-GPV阳性血清均由本实验室制备并保存。
1.3 激光共聚焦显微镜观察将MDEFs细胞接种于预先放入了盖玻片的6孔细胞培养板中,待细胞长到覆盖率为80%左右时,利用感染复数(MOI)为1的MDGPV-PT(SBDS-GPV M15)感染细胞24 h,预冷PBS洗涤3次、每次5 min,弃上清;4% 多聚甲醛固定细胞爬片10 min,PBS洗涤3次、每次5 min,弃上清;2% Triton X-100通透细胞10 min,PBS洗涤3次,每次5 min,弃上清;5% BSA封闭2 h,PBS洗涤3次,每次5 min,弃上清;加入兔抗 LC3-Ⅱ 抗体(1∶500)4℃孵育过夜,PBS洗涤3次,每次 5 min;加入Alexa Fluor 488标记山羊抗兔IgG(H+L)(1∶500)37℃ 孵育1 h 后,PBS洗涤3次,每次 5 min;最后用 DAPI 染色并封片,室温孵育5 min,PBS洗涤3次,每次 5 min;置于激光共聚焦荧光显微镜下观察拍照。
1.4 病毒感染与药物处理将处于生长对数期的MDEF细胞接种于 6孔板,培养至细胞密度达80%。病毒感染组,接种1 MOI的MDGPV-PT(SBDS-GPV M15),置于37℃、5% CO2培养箱孵育1 h,无菌PBS洗涤3次,加入含2%胎牛血清的DMEM维持液继续培养,同时设正常细胞对照组。药物处理组,RAPA(100 nmol/L)作用于MDEF细胞,孵育1 h,以1 MOI MDGPV-PT(SBDS-GPV M15)接种细胞,孵育 2 h,无菌PBS 洗涤,随后含有RAPA(100 nmol/L)的细胞维持液继续培养;3-MA(5 mmol/L)作用于MDEF细胞,孵育 1 h,以1 MOI MDGPV-PT(SBDS-GPV M15)接种细胞,孵育 2 h,无菌PBS 洗涤,随后含有3-MA(5 mmol/L)的细胞维持液继续培养;E64d(10 μmol/L)作用于MDEF细胞,孵育 1 h,以1 MOI MDGPV-PT(SBDS-GPV M15)接种细胞,孵育 2 h,无菌PBS 洗涤3次,随后含有E64d(10 μmol/L)的细胞维持液继续培养。
1.5 Western blot分析收集感染组与药物处理组不同时间点MDEFs细胞,用预冷的PBS洗涤细胞2次,并加入裂解液,冰浴裂解30 min。13 000×g离心10 min,取上清,加入SDS-PAGE 上样缓冲液,煮沸 10 min后,12 000×g离心10 min。将处理好的样品进行 SDS-PAGE 电泳,用半干法(15 V,20 min)将蛋白转移至NC膜,用 50 g/L 脱脂牛奶室温封闭 1 h ;一抗4℃ 孵育过夜,然后 TBST 洗膜 3 次、每次 5 min;室温孵育对应的抗兔(抗小鼠或抗鸭)的IgG-HRP二抗 1 h,TBST 洗膜 3 次、每次 5 min;加 ECL 发光液,自显影仪曝光照相。
1.6 实时荧光定量PCR检测自噬对病毒基因拷贝数的影响将MDEFs细胞按80%的汇合度接种于 6孔板,置于37℃、5% CO2细胞培养箱中培养24 h,无菌PBS 洗涤3次,分别对细胞进行自噬诱导剂雷帕霉素(100 nmol/L)或自噬抑制剂3-甲基腺嘌呤(5 mmol/L)预处理2 h,按照1 MOI MDGPV-PT(SBDS-GPV M15),分别在感染病毒24 h时,经过反复冻融3次收集病毒液,-70℃保存备用。根据细胞、组织与血液DNA提取试剂盒操作说明书提取病毒核酸,-20℃保存备用。应用TB Green®Premix Ex TaqTM(Tli RNaseH Plus)试剂盒进行real-time PCR反应,以病毒DNA为模板,设空白对照,每个样品重复3次,其中鸭源β-actin作为相对定量的参照,参照文献[16]合成GPV的VP3基因鉴定引物G5-P1/P2,并参考鸭源β-actin(GenBank登录号:GU564232)基因序列,通过Oligo 7.0软件设计合成鸭源β-actin基因鉴定引物actin-F/R,real-time PCR引物信息见表1。引物均由生工生物工程(上海)股份有限公司合成。反应体系:TB Green Premix Ex Taq (Tli RNaseH Plus)(2×)10 μL,上、下游引物(20 μmol/L)各0.4 μL,ROX Reference Dye(50×)0.4 μL,DNA模板2 μL,加ddH2O补足至20 μL。反应条件:95℃预变性 5 min,95℃变性5 s,60℃退火10 s,72℃延伸15 s,共40个循环。
1.7 TCID50方法检测自噬对病毒复制的影响MDEF细胞培养于25 cm2培养瓶,待细胞生长形成单层后,分别对细胞进行自噬诱导剂雷帕霉素(100 nmol/L)或自噬抑制剂3-甲基腺嘌呤(5 mmol/L)预处理2 h,分别接种1 MOI MDGPV-PT(SBDS-GPV M15),并在感染病毒24 h时,经过反复冻融3次收集病毒液,-70℃保存备用。用细胞维持DMEM 培养液10倍倍比稀释上述收集的病毒液,分别接种到96孔培养板中长满单层的MDEF细胞上,每孔100 μL,每个稀释度接种8孔,并设正常细胞培养对照(加等量无病毒细胞培养维持液),置于37℃、5% CO2细胞培养箱中培养,每天在普通光学显微镜下观察细胞病变,按照Reed-Muench法计算病毒的细胞半数感染量(TCID50)。
表1 荧光定量PCR引物信息
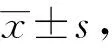
2 结果
2.1 GPV感染MDEFs细胞对LC3蛋白表达的影响LC3蛋白被称之为微管相关蛋白轻链3(microtubule-associated protein 1 light chain 3,LC3),是哺乳动物细胞中酵母ATG8基因的同源物,包括Ⅰ型和Ⅱ型。LC3作为可溶性胞浆蛋白(LC3-Ⅰ)存在于细胞质中,在插入自噬小泡双层膜之前经过磷脂酰乙醇胺(phosphatidyl ethanolamines,PE)修饰成为LC3-Ⅱ。LC3-Ⅱ保留在成熟的自噬体上,直至与溶酶体融合生成自噬溶酶体,因此LC3的合成与降解常用于监测自噬体到自噬溶酶体的变化过程。为了研究GPV感染MDEFs细胞对自噬的影响,以MOI为1的MDGPV-PT和SBDS-GPV M15细胞适应毒分别感染MDEFs细胞,分别于6,12,18,24 h 收集细胞样品,采用Western blot方法检测LC3的表达情况,结果显示,相对于对照组正常细胞,MDGPV-PT与SBDS-GPV M15细胞适应毒随着病毒复制时间的延长,MDEFs细胞内的LC3-Ⅰ逐渐向LC3-Ⅱ转化。MDGPV-PT病毒株在感染12 h时,LC3-Ⅱ的表达量增加,且高于SBDS-GPV M15病毒株,而且随着感染时间的延长,LC3-Ⅱ/LC3-Ⅰ的比值逐渐增加(图 1)。
激光共聚焦显微镜也是用来监测自噬的方法之一。自噬未被激活时,LC3-Ⅰ是没有被脂化的蛋白,弥散分布在细胞质;自噬形成时,膜结合状态的LC3-Ⅱ是自噬体膜的主要组成成分,分布在自噬体内外膜上,使用荧光标记后形成明亮的斑点。Alexa Fluor 488染色LC3-Ⅱ为绿色荧光,DAPI染色细胞核为蓝色荧光。在激光共聚焦显微镜下形成多个明亮的绿色荧光斑点,一个斑点相当于一个自噬体,荧光强弱可一定程度反映细胞自噬强度变化。本研究应用激光共聚焦观察LC3蛋白荧光聚集点,1 MOI MDGPV-PT(SBDS-GPV M15)细胞适应毒感染MDEFs细胞24 h后,LC3阳性绿色荧光强度明显高于正常细胞对照组,而且MDGPV-PT感染组的LC3阳性斑点数多于SBDS-GPV M15感染组(图2)。以上结果表明,GPV感染MDEFs细胞后能够诱导细胞自噬。
A.Western blot检测LC3含量结果;B.LC3-Ⅱ/LC3-Ⅰ蛋白相对表达量 *.P<0.05;**.P<0.01;***.P<0.001。下同
2.2 GPV感染促进细胞自噬通量的增加细胞自噬的发生是一个复杂的动态过程,完整的自噬包括自噬启动、自噬体形成、自噬溶酶体形成与降解及再利用。目前研究表明,p62是SQSTM1编码的泛素结合蛋白,作为一种自噬特异性底物,可与LC3-Ⅱ相互作用渗入到自噬体并通过自噬溶酶体得到有效地降解,在细胞内整体p62水平的表达与自噬活性存在负相关,因此,p62的表达量的变化已被用于确定自噬通量。为了检测GPV感染是否能诱导MDEFs细胞完整的自噬过程,对p62蛋白进行了分析,结果显示,与正常对照细胞相比,在MDGPV-PT或SBDS-GPV M15感染后的6,12,18,24 h,随着GPV复制水平升高,MDEFs细胞中的p62蛋白量表达均减少(图3)。
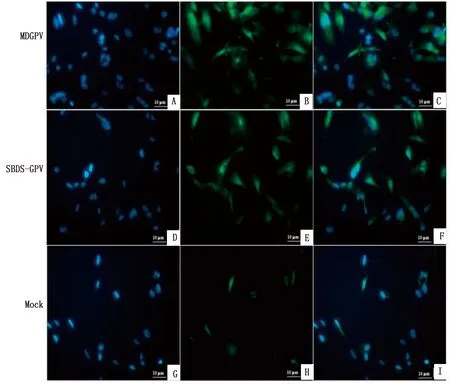
A~C.MDGPV感染的MDEFs细胞;D~F.SBDS-GPV感染的MDEFs细胞;G~I.正常对照组MDEFs细胞
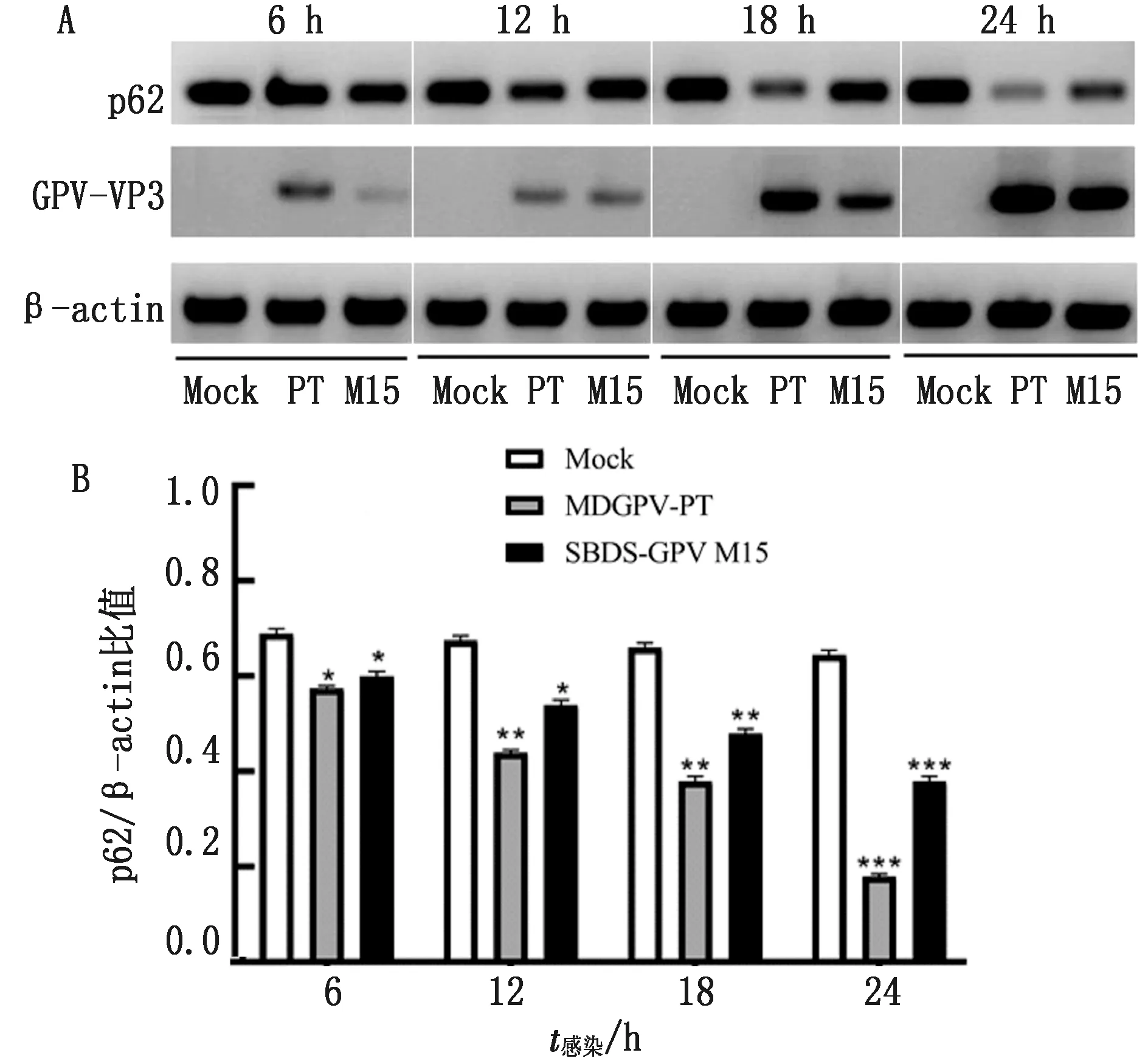
A.Western blot检测p62含量结果;B.p62蛋白相对表达量
E64d是一种半胱氨酸蛋白酶抑制剂,可以抑制自噬物质在自溶酶体内的降解,检测E64d 预处理细胞中LC3-Ⅱ 和 p62 表达量变化,常被作为监视溶酶体依赖性降解中自噬通量水平的方法。本试验使用E64d(10 μmol/L)预处理MDEFs细胞 2 h,1 MOI MDGPV-PT(SBDS-GPV M15)细胞适应毒接种药物处理细胞,并感染 12,24 h 后分别收集细胞。Western blot方法检测LC3-Ⅱ与p62蛋白的表达水平。结果显示E64d处理能增加GPV感染细胞中LC3-Ⅱ与p62蛋白的表达(图4),也能促进GPV结构蛋白(viral particle protein,VP)的表达。以上结果表明p62蛋白作为重要的自噬受体,参与了GPV感染MDEFs细胞诱导的自噬进程。GPV感染会引起宿主细胞中自噬通量的增加。
2.3 细胞自噬促进GPV复制分别将自噬诱导剂RAPA(100 nmol/L)与自噬抑制剂3-MA(5 mmol/L)作用于MDEFs细胞2 h,并在1 MOI MDGPV-PT(SBDS-GPV M15)细胞适应毒感染MDEFs细胞后24 h分别通过荧光定量PCR检测病毒VP基因拷贝数以及TCID50方法测定病毒滴度,并应用Western blot来检测病毒的复制情况。结果显示,与未经药物处理的GPV感染对照组相比,RAPA处理组GPV感染MDEFs细胞24 h,病毒VP基因拷贝数显著增加,然而3-MA处理组GPV感染MDEFs细胞24 h,病毒结构基因拷贝数减少;Western blot检测表明,与未经药物处理的GPV感染对照组相比,自噬诱导剂RAPA增加了LC3-Ⅱ与病毒VP蛋白的表达量,而自噬抑制剂3-MA则降低了LC3-Ⅱ蛋白表达量以及GPV复制水平;TCID50测定发现,RAPA诱导自噬24 h后,MDGPV-PT与SBDS-GPV M15子代病毒产量提高,而3-MA则降低了GPV病毒产量(图5)。结果表明细胞自噬的激活有利于GPV的复制增殖。
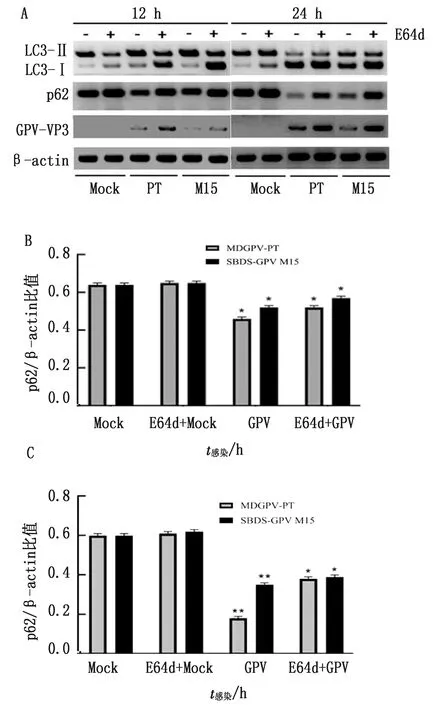
A.Western blot检测p62含量结果;B.p62蛋白相对表达量(E64d处理12 h);C.p62蛋白相对表达量(E64d处理24 h)

A.Western blot检测GPV VP3含量(RAPA);B.Western blot检测GPV VP3含量(3-MA);C.TCID50测定自噬药物处理24 h后GPV滴度;D.荧光定量PCR测定自噬药物处理24 h后GPV拷贝数
3 讨论
自噬是一种在病原微生物感染靶细胞时被激活的免疫机制,其在降解和回收长寿命蛋白质、大蛋白聚集体或受损细胞器以及抵抗细胞内病原体方面发挥着多种生理和病理作用[17]。已有研究表明,自噬对于病毒感染具有双向调节作用,使受侵染宿主体内可以快速启动强大的天然免疫反应以清除病毒,又可能做为病毒增殖的途径以拮抗宿主固有免疫[18]。因此,自噬在病毒生命周期和致病力方面均起到重要作用[19]。在病毒感染过程中,一些病毒会抑制自噬的发生。例如狂犬病病毒磷蛋白P5与 自噬相关基因Beclin1编码的BECN1蛋白卷曲螺旋环结合,通过诱导 BECN1 信号通路依赖的不完全自噬,从而促进病毒复制[20];人乳头瘤病毒和卡波济肉瘤相关疱疹病毒也会限制自噬介导的降解,从而促进肿瘤发生[21]。另外,越来越多的证据表明不同的DNA病毒可能在不同的复制增殖阶段劫持自噬破坏其抗病毒作用,抑制自噬将导致人巨细胞病毒、人类疱疹病毒4型、家蚕核型多角体病毒、鸭病毒性肠炎病毒和猪圆环病毒2型等病毒的滴度降低[22]。大多数的哺乳动物细小病毒可以通过激活细胞内的自噬途径促进子代病毒的复制。PPV在感染PK15细胞早期即可诱导LC3分子的荧光聚点,将胞浆型LC3-Ⅰ转换为(自噬体)膜型LC3-Ⅱ,感染细胞内子代病毒VP2基因拷贝数显著提高,PPV利用自噬促进了自身的复制。CPV-2与人细小病毒B19V在感染过程均可诱导宿主细胞内线粒体自噬,促进病毒在细胞内的复制增殖[23-24]。GPV感染与细胞自噬之间相互作用关系尚未见报道,本研究以MDGPV-PT与SBDS-GPV M15细胞适应毒感染MDEFs细胞,利用激光共聚焦观察到 LC3 标记的绿色自噬荧光颗粒增多,通过蛋白印迹技术检测LC3-Ⅱ表达量的增加,初步确定GPV感染能诱导MDEFs细胞发生自噬。
p62是sequestosome1(SQSTM1)编码的泛素结合蛋白,参与多种细胞信号转导调控及自噬过程[25]。正是依赖p62蛋白枢纽作用,细胞内的泛素蛋白酶体系统和自噬-溶酶体系统两种蛋白降解机制建立了内在的联系。在自噬过程中,p62蛋白与泛素化蛋白质聚集物结合,再与定位于自噬小体内膜上的LC3-Ⅱ蛋白形成复合物,随后被整合到自噬体中,并在自噬溶酶体中被降解[26]。p62作为识别自噬通量的标记蛋白,其含量可以反映自噬小体清除水平与自噬流的完成情况[27]。在本试验中,首先证明 GPV感染引起 p62蛋白表达降低。为了进一步确定p62 蛋白作为自噬受体是否与待降解物一起经自噬-溶酶体系统介导降解,在存在或不存在溶酶体抑制剂E64d预处理的情况下,检测了GPV感染MDEFs细胞中p62的蛋白质表达水平。与对照组相比,E64d处理增加了病毒感染细胞中p62的表达,这表明 GPV感染通过 p62 蛋白传导自噬信号诱导泛素化目标蛋白的降解。
本研究主要探索了GPV复制与细胞自噬之间的关系,选用MDGPV-PT与SBDS-GPV M15两种致病型的细胞适应毒分别以相同感染量同时感染MDEFs细胞,结果发现不同致病型GPV分离株诱导的自噬水平存在差异,推测自噬的差异也有可能是导致MDGPV和SBDS-GPV致病性差异的一个重要原因。本试验还通过使用自噬药物调节剂E64d、RAPA与3-MA 来研究细胞自噬对病毒复制的影响。E64d是一种广谱半胱氨酸蛋白酶抑制剂,抑制溶酶体组织蛋白酶对自噬溶酶体内自噬底物的降解,从而阻断自噬的进展[28];RAPA能特异性靶向抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycine,mTOR),阻止其下游底物p70核糖体蛋白s6激酶(p70s6k)和真核细胞翻译启始因子4E结合蛋白(4EBP1)磷酸化,促进自噬的发生[29];3-MA调控自噬的上游信号通路Ⅱ型PI3K,在自噬体形成的早期,通过抑制自噬效应蛋白BECN1与磷脂酰肌醇 3G 激酶(PtdIns 3KC3)复合物的形成来抑制胞浆可溶性形式LC3-Ⅰ向自噬体膜结合形式LC3-Ⅱ转化,阻断自噬体膜的形成,从而抑制自噬[30]。本试验结果显示,激活自噬有利于促进GPV复制,自噬抑制剂阻断自噬通量可以降低GPV的增殖水平。综上所述, GPV感染MDEFs细胞能诱导细胞自噬,同时细胞自噬又能促进GPV的复制。

