2株烟草病害拮抗细菌的分离鉴定和发酵条件优化研究
施春兰,曾舒泉,王志江,谢永辉,詹莜国,黄永迪,吴国星,高 熹,秦得强*
(1.云南农业大学 植物保护学院,云南 昆明 650201;2.云南省烟草公司 昆明市公司,云南 昆明 650051)
0 前言
烟草是我国的主要经济作物之一,在我国各地广泛种植,栽培效益高。烟草既可以作为工业原料,又具有一定的医疗作用,如麻醉、镇痛等。烟草赤星病、黑胫病、根腐病、靶斑病等是烟草生产上的常见病害,其中烟草黑胫病是由烟草疫霉菌侵染引起的一种毁灭性病害,发病严重时发病率高达80%;据不完全统计,我国每年由烟草黑胫病造成的损失高达1亿元。这些病害一旦发生都会对烟草的产量和质量造成较大的影响[1-4]。生物防治由于具有高效、无污染、无残留、选择性高等特点,在烟草病害的防治中发挥了重要作用。生防芽孢杆菌主要包括枯草芽孢杆菌(Bacillus subtilis)、巨大芽孢杆菌(B. megaterium)、短小芽孢杆菌(B.pumilis)、多粘芽孢杆菌(B. polymyxa)和蜡状芽孢杆菌(B. cereus)等[5]。
卢灿华等[6]以烘烤期烟叶柄部霉病的病原菌为指示菌,进行拮抗菌的筛选,得到了5株有较强抑菌活性的菌株,其中芽孢杆菌(Bacillusspp.)Z002和05-1205菌株对该病的防效都高于70%。李小杰等[7]从健康烟田烟株根际土壤中分离筛选到1株多粘芽孢杆菌LB-9,发现该菌株对烟草疫霉菌的抑制活性达到了60.6%且比较稳定。杨德政等[8]从烟草赤星病发病严重的田块取根际土壤进行生防菌的分离、筛选,得到了1株贝莱斯芽孢杆菌Y6,通过试验证明其对烟草赤星病具有抑制作用。孙晓宇等[9]研究发现,枯草芽孢杆菌对烟草根腐病菌的菌丝生长和孢子形成都有一定的抑制作用。陈丹阳等[10]从四川省攀枝花健康烟田烟株根际土壤分离得到了贝莱斯芽孢杆菌CDY-6,经过初筛试验与复筛试验,发现该菌株对烟草靶斑病菌有显著的拮抗作用。
土壤一直是生防菌的宝库,其生防菌不仅种类多,而且活性好,烟草病害的拮抗菌大多数来自土壤[3]。本课题组从土壤中分离并筛选得到了2株对烟草黑胫病、赤星病、靶斑病、根腐病均具有较好抑制作用的拮抗细菌Gj7和Gj9。本研究通过形态特征观察、生理生化特征测定以及16S rDNA分析,进一步探讨了这2株拮抗菌的分类地位,并优化了其发酵条件,旨在为这2个菌株的后续研究及应用提供参考。
1 材料与方法
1.1 材料
1.1.1 供试土样及菌株 本试验在云南农业大学植物保护学院生物化学实验室进行。2株细菌从健康烟草植株根际土壤中分离得到,土壤采集地为云南省峨山县小街镇,菌株编号为Gj7和Gj9,现保存于云南农业大学农药学实验室。
1.1.2 供试培养基 营养琼脂培养基(NA):牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂15 g/L,121 ℃灭菌20 min。马铃薯培养基(PSA):马铃薯20 g/L,蔗糖2 g/L,琼脂15 g/L,121 ℃灭菌30 min。蛋白胨酵母蔗糖培养基(YSP):蛋白胨10 g/L,酵母浸粉5 g/L,蔗糖20 g/L,琼脂15 g/L,115 ℃灭菌30 min。牛肉膏酵母葡萄糖培养基(NYBD):牛肉浸膏8 g/L,酵母浸粉5 g/L,葡萄糖10 g/L,琼脂15 g/L,115 ℃灭菌30 min。细菌基础培养基(CM):葡萄糖5 g/L,(NH4)2SO42 g/L,柠檬酸钠1 g/L,MgSO4·7H2O 2 g/L,K2HPO44 g/L,KH2PO46 g/L,琼脂15 g/L,121 ℃灭菌20 min。蛋白胨酵母培养基(LB):蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠10 g/L,琼脂15 g/L,121 ℃灭菌20 min[11]。
1.2 生防菌的分离
参考尹福强等[12]的方法(略作改动)。称取待测土样10 g,放入盛有90 mL无菌水的250 mL三角瓶中,于振荡器上振荡20 min后,对土壤悬液进行梯度稀释,分别配制成10-5、10-6、10-7稀释梯度的土壤溶液。再分别取100 μL土壤稀释液至LB培养皿中进行涂布,并于28 ℃恒温培养24 h。待形成细菌单菌落后,用接种环分别挑取少许不同的单菌落于新制备的LB培养皿上,进行划线培养并逐步纯化,直至无杂菌产生。
1.3 生防菌抑菌效果的测定
1.3.1 生防菌的平板对峙效果 使用已灭菌的打孔器(直径5 mm)在已活化的烟草疫霉、根腐病、靶斑病、赤星病菌平板上分别打孔,再分别使用已灭菌的镊子夹取1块菌饼接种于另1个新的PSA平板的中央。采用“十字交叉法”将Gj7和Gj9分别对称接种于PSA平板距菌饼2.5 cm处,再于28 ℃恒温培养2~3 d,待出现抑菌效果后取出平板,计算抑菌率。以不接拮抗菌作为空白对照,每个处理设置3个重复[11]。
1.3.2 生防菌挥发性气体对病原菌的抑制效果 采用对扣法[13]进行试验。将涂有100 μL拮抗菌液的LB固体培养基与接有病原菌的PSA培养基进行对扣培养,将有病原真菌的一方朝下,涂有拮抗菌液体的一方朝上。置于28 ℃恒温培养箱培养,待对照组菌丝长满培养皿后取出平板,计算抑菌率。以不接拮抗菌作为空白对照,每个处理设置3个重复。
1.4 生防菌的鉴定
1.4.1 生防菌的形态特征观察及生理生化特征测定 生防菌的形态特征观察参考兰明先等[14]的方法;生防菌的生理生化特征测定和革兰氏染色分析参考沈萍等[15]《微生物学实验》中的方法。
1.4.2 生防菌系统发育树的构建 分别提取Gj7和Gj9菌株的基因组DNA,以此为模板,选择细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTAGACTT-3′)进行PCR扩增。反应体系50 μL:PCR Mix 25 μL,上、下游引物各2 μL,DNA模板3 μL,Rnase H2O 18 μL。扩增条件为:94.8 ℃预变性2.5 min;98 ℃10 s,55 ℃ 10 s,72 ℃ 20 s,共30个循环;72 ℃延伸2 min。采用1.0%琼脂糖凝胶电泳检测PCR产物,将产物送昆明擎科生物公司测序。得到菌株的16S rRNA基因测序结果后,在数据库中进行BLAST比对。最后,使用Clustal X1.83和MEGA 7软件分析其系统发育进化关系,并构建进化树[11]。
1.5 生防菌发酵条件的优化
1.5.1 种子液制备 挑取菌株Gj7和Gj9的单菌落于100 mL的LB液体培养基中,于28 ℃、180 r/min条件下振荡培养24 h,得到种子液,备用。
1.5.2 最适培养基的优化 参考兰明先等[16]的方法(有所改动),配制YSP、NYBD、NA、LB和CM培养基各100 mL,分别接入50 μL种子液,于28 ℃、180 r/min的摇床中振荡培养24 h,然后测定不同培养基中细菌的OD600值,筛选出最佳培养基[17]。每组重复3次,下同。
1.5.3 最适碳源的筛选 以1.5.2筛选出的最适培养基为基础培养基,分别以乳糖、蔗糖、葡萄糖、麦芽糖、淀粉作为碳源,培养基中的其他成分均保持不变。于28 ℃、180 r/min的摇床中振荡培养24 h,然后测定不同碳源培养基中细菌的OD600值,筛选最佳碳源。
1.5.4 最适氮源的筛选 采用上述最适培养基,分别以氯化铵、酵母浸粉、硝酸铵、酪氨酸、谷氨酸作为氮源,培养基中的其他成分均保持不变。于28℃、180 r/min的摇床中振荡培养24 h,然后测定不同氮源培养基中细菌的OD600值,筛选最佳氮源。
1.5.5 最适接菌量的筛选 采用最适培养基,将种子液分别以0.05%、0.1%、0.5%、1.0%、2.0%、2.5%(体积分数)的接菌量接入培养基中。于28℃、180 r/min的摇床中振荡培养24 h,然后测定不同接菌量处理细菌的OD600值,筛选最佳接菌量。
1.5.6 最适装液量的筛选 采用最适培养基,将初始装液量分别换为30、60、90、120、150 mL,接入种子液。于28 ℃、180 r/min的摇床中振荡培养24 h,然后测定不同装液量处理细菌的OD600值,筛选最佳装液量。
1.5.7 最适初始pH值的筛选 采用最适培养基,分别调节其pH值为4、5、6、7、8、9、10,接入种子液,于28 ℃、180 r/min的摇床中振荡培养24 h,然后测定不同pH值培养基中细菌的OD600值,筛选出培养基的最佳初始pH值。
1.5.8 最适转速的筛选 采用最适培养基,分别设置摇床的转速为120、150、180、210、240 r/min,接入种子液,在优化条件下振荡培养24 h,然后测定培养基中细菌的OD600值,筛选出最佳转速。
1.5.9 最适温度的筛选 采用最适培养基,分别设置培养温度为20、24、28、32、36、40 ℃,接入种子液,在优化条件下振荡培养24 h,然后测定培养基中细菌的OD600值,筛选出最佳培养温度。
1.5.10 发酵时间对细菌生长的影响 采用最适培养基,接入种子液,在上述优化条件下培养,在培养0~24 h期间每隔2 h测量1次OD600值,培养24 h后每隔12 h测量1次OD600值,绘制细菌的生长曲线,筛选出最佳培养时间。
1.6 数据分析
使用SPSS 20.0、GraphPad Prism 8.0和Excel 2010软件对试验数据进行处理分析和图表制作;采用Duncan’s新复极差法检验不同处理间的差异显著性。
抑菌率的计算公式[11]为:抑菌率(%)=[(对照平板菌落直径-处理平板菌落直径)/对照平板菌落直径]×100%。
2 结果与分析
2.1 生防菌的抑菌效果
2.1.1 平板对峙结果 由表1和图1可以看出:Gj7和Gj9菌株对烟草黑胫病、赤星病、靶斑病以及根腐病菌均有一定的抑制效果,平板抑制效果均超过了60%;这2株菌对烟草靶斑病菌的平板抑制效果最好,抑制率分别达到了76.10%和77.30%。

图1 2株生防菌对4种烟草病原真菌的抑制效果

表1 Gj7和Gj9菌株对烟草不同病原菌的平板对峙效果
2.1.2 生防菌的挥发性气体对烟草病菌的抑制效果 由表2可以看出:Gj7和Gj9菌株的挥发性气体对烟草黑胫病、赤星病、靶斑病、根腐病菌均有抑制效果,其中Gj7对4种病原菌的平板抑制率都超过了55%;Gj9对烟草黑胫病和赤星病菌的平板抑制率都超过了55%,但该菌株对烟草靶斑病和根腐病菌的平板抑制率不高。

表2 Gj7和Gj9的挥发性气体对烟草不同病原菌的抑制效果
2.2 生防菌的鉴定结果
2.2.1 拮抗菌的形态特征观察及生理生化特征测定 由图2可以看出:Gj7在LB培养基培养3 d后,单菌落为圆形、乳白稍黄菌落,表面粗糙不规则,有很多隆起、褶皱,菌体为杆状,芽孢椭圆形;Gj9单菌落为淡黄色不透明菌落,表面隆起,边缘不规则,杆状菌体,芽孢椭圆形;这2个菌株均为革兰氏阳性菌,其生理生化特征测定结果如表3所示。
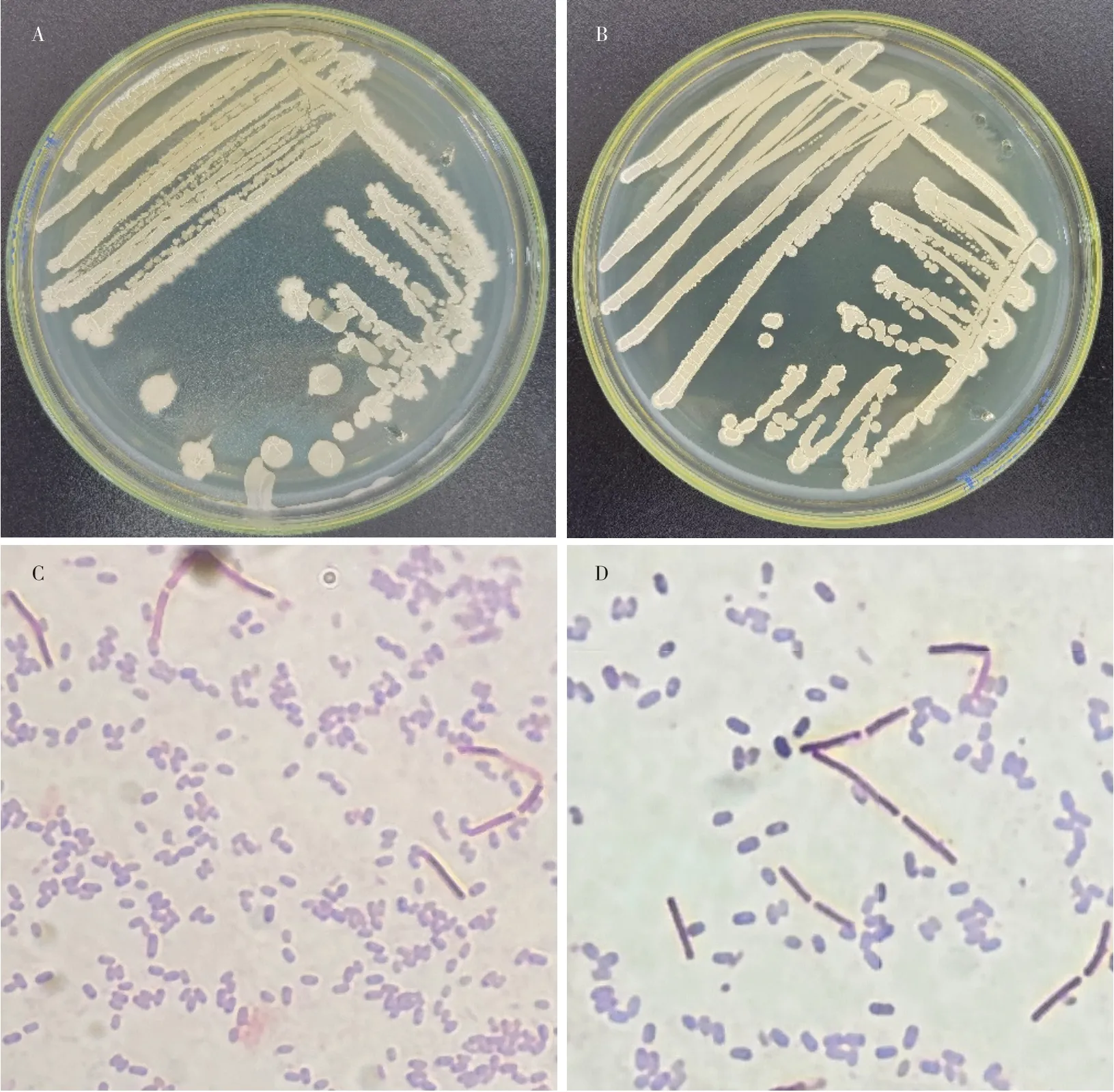
图2 2个菌株的菌落形态及革兰氏染色结果

表3 菌株Gj7和Gj9的生理生化特征测试结果
2.2.2 拮抗菌的分子鉴定结果 将Gj7和Gj9校对后的序列提交至GenBank数据库并进行比对,比对结果表明:Gj7与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)具有较高的相似性,Gj9与枯草芽孢杆菌(Bacillus subtilis)具有较高的相似性。下载同源性较高的序列,使用ClustalX 1.83和MEGA 7软件对这2个菌株进行进化树的构建。根据构建的进化树(图3、图4),并结合其形态特征和生理生化特征,初步鉴定菌株Gj7为解淀粉芽孢杆菌(B.amyloliquefaciens),Gj9为枯草芽孢杆菌(B. subtilis)。

图3 基于16S rDNA基因序列构建的Gj9的进化树

图4 基于16S rDNA基因序列构建的Gj7的进化树
2.3 发酵条件优化结果
2.3.1 培养基对细菌生长的影响 从图5可以看出,Gj9和Gj7菌株在供试的5种培养基上均可生长,但生长情况在不同培养基间存在显著性差异。具体来说,Gj9、Gj7均在YSP培养基上生长最快,其OD600值分别达到了2.15和2.11;Gj9和Gj7均在CM培养基上生长最慢,其OD600值分别只有0.39和0.03。因此,Gj9和Gj7菌株的最适培养基均为YSP培养基。

图5 培养基对Gj9、Gj7菌株生长的影响
2.3.2 不同碳源对细菌生长的影响 如图6所示:Gj9、Gj7菌株在5种碳源培养基上均可生长;蔗糖为Gj9菌株的最适发酵碳源,其OD600值达1.99;葡萄糖为Gj7菌株的最适发酵碳源,其OD600值达2.03;Gj9和Gj7在碳源为淀粉的培养基上生长均较差,其OD600值分别仅为0.86和0.95。

图6 不同碳源对Gj9、Gj7菌株生长的影响
2.3.3 不同氮源对细菌生长的影响 如图7所示:Gj9、Gj7菌株在NH4Cl、酵母膏、NH4NO3、酪氨酸这4种氮源培养基上均可生长;酵母膏是2个菌株的最适氮源,其OD600值分别达到了2.24和2.12;Gj9和Gj7均几乎不能在氮源为谷氨酸的培养液中生长,其OD600值分别仅为0.004和0.022。
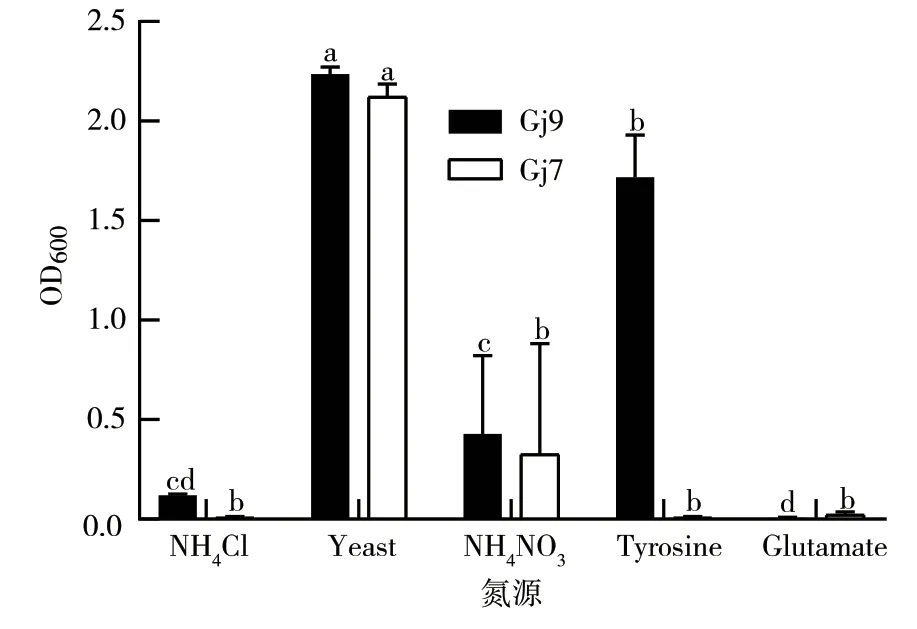
图7 不同氮源对Gj9、Gj7菌株生长的影响
2.3.4 初始接菌量对细菌生长的影响 从图8可以看出:当初始接菌量为100 μL时,Gj7的OD600值最大,为2.24,因此,100 μL为Gj7的最适初始接菌量;当初始接菌量为2000 μL时,Gj9的OD600值最大(2.11),因此,2000 μL是Gj9的最适初始接菌量。
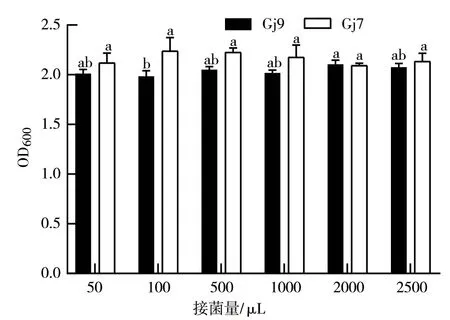
图8 初始接菌量对Gj9、Gj7菌株生长的影响
2.3.5 装液量对细菌生长的影响 由图9可见:在不同装液量处理之间2个菌株的生长均存在显著性差异;当装液量为30 mL时,Gj9、Gj7的OD600值均最大,分别达到了2.28和2.48,因此,30 mL是这2个菌株发酵培养的最适装液量。

图9 装液量对Gj9、Gj7菌株生长的影响
2.3.6 初始pH值对细菌生长的影响 如图10所示,在不同pH值处理之间2个拮抗细菌菌株的生长均存在显著性差异。Gj9生长的适宜pH值范围为6~9,最适pH值为8,此时其OD600值达2.29;Gj7生长的适宜pH值范围为6~10,最适pH值为10,此时其OD600值达2.36。
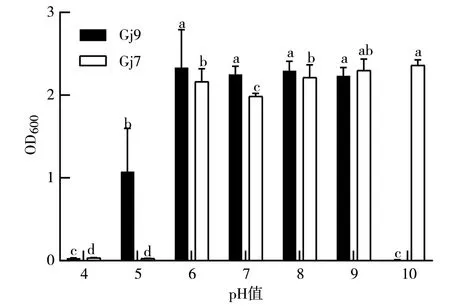
图10 初始pH值对Gj9、Gj7菌株生长的影响
2.3.7 转速对细菌生长的影响 如图11所示,在不同转速条件下细菌的生长存在显著性差异。当转速为240 r/min时,Gj9、Gj7菌株的生长量均达到最大,其OD600值分别达2.24和2.26,所以240 r/min是这2个菌株发酵培养的最适转速。
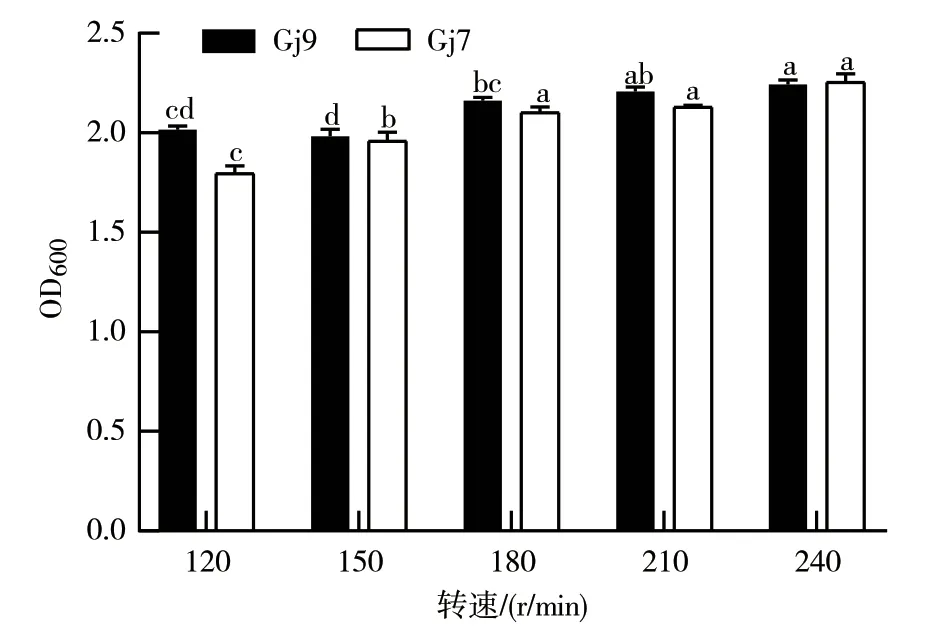
图11 不同转速对Gj9、Gj7菌株生长的影响
2.3.8 温度对细菌生长的影响 从图12可以看出:Gj9、Gj7在20~40 ℃的温度范围内均可生长;Gj9菌株生长的最适温度为24 ℃,在此条件下其OD600值达2.08;Gj9菌株在40 ℃下的OD600值显著降低;Gj7菌株生长的最适温度为36 ℃左右,在此温度条件下其OD600值为2.15;在20 ℃下Gj7菌株的生长量显著降低。
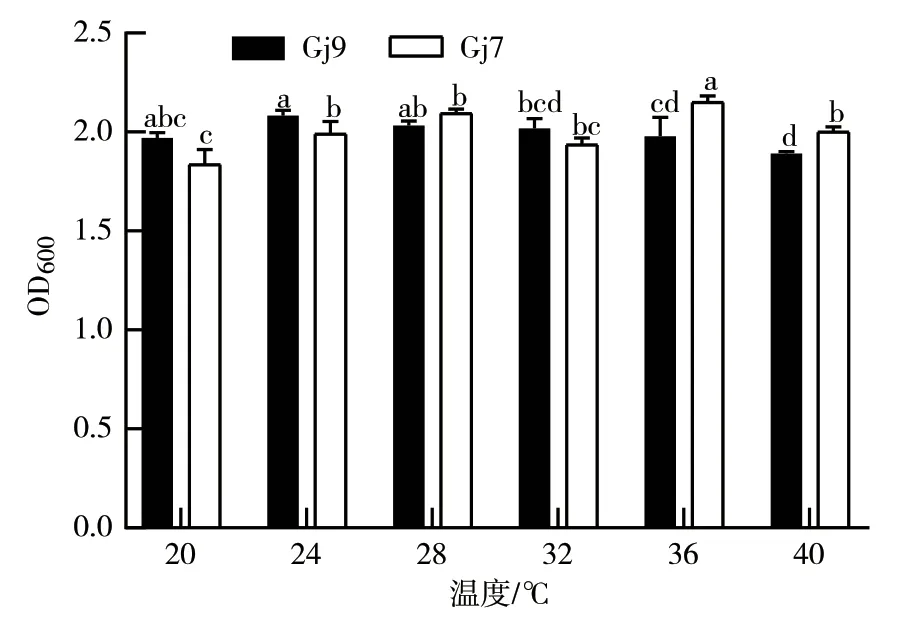
图12 不同温度对Gj9、Gj7菌株生长的影响
2.3.9 发酵时间对细菌生长的影响 如图13所示,Gj9、Gj7菌株的生长曲线均类似于“S”形。具体而言,在培养0~4 h期间,2个菌株的生长较为缓慢,该时期为细菌生长的迟缓期;在培养4~14 h期间,Gj7菌株的生长量开始迅速增加,该时期为该菌株生长的对数增长期,在第14 h时其生长速率最高,此时OD600值为2.14;培养4~16 h期间为Gj9菌株生长的对数增长期,该菌株在16 h时达到最大生长量,此时OD600值为2.28;在培养14~22 h期间为Gj7菌株的生长稳定期,16~36 h为Gj9菌株的生长稳定期;第22 h后,Gj7菌株的生长量开始呈现下降趋势,为生长衰亡期,而Gj9菌株的生长衰亡期在36 h以后。
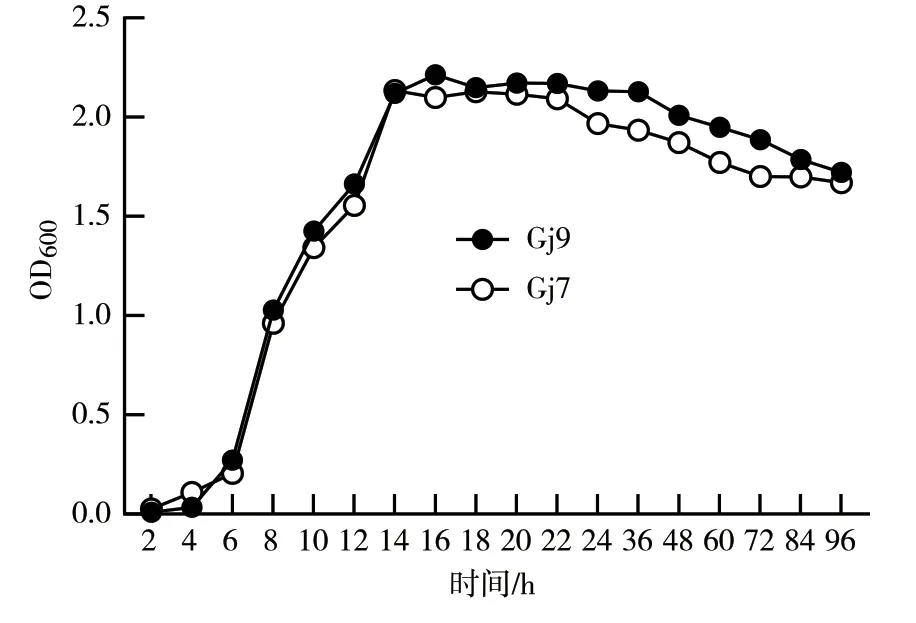
图13 发酵时间对Gj9、Gj7菌株生长的影响
3 讨论与结论
芽孢杆菌具有使用安全、生长迅速等特性,可以产生耐高温的芽孢,对逆境有较强的抵抗力,在有氧或无氧环境下均可以生长,而且可以产生诸如伊枯草菌素、细菌素和表面活性素等具有抑菌活性的次级代谢产物,在抑制病原菌生长和繁殖方面具有举足轻重的作用。芽孢杆菌的生防机制有竞争、拮抗、溶菌、诱导植物产生抗病性和促进植物生长等[18-21]。烟草病害的拮抗菌大多数来源于土壤和植物本体,说明土壤和植物生防菌资源丰富[3]。
笔者从烟草根际土壤中分离得到了2株细菌Gj7和Gj9,这2株菌在平板对峙试验中对烟草黑胫病、赤星病、根腐病以及靶斑病菌都有较好的抑制效果。枯草芽孢杆菌是芽孢杆菌中的模式菌,该类细菌可以产生包括肽类、酯肽类、氨基酸类等在内的70多种抗菌物质,通过分泌这些抗菌物质对病原真菌和细菌的细胞壁、细胞膜造成破坏,进而发挥抑制作用[22]。枯草芽孢杆菌在细菌性病害、真菌性病害以及病毒病害防治方面都可以发挥作用,例如,芽孢杆菌SH7的代谢产物以及枯草芽孢杆菌T2G6均可以防治烟草青枯病,枯草芽孢杆菌Tpb55对烟草TMV有很好的钝化、预防治疗效果[23]。何明川等[11]从美洲大蠊肠道分离得到的枯草芽孢杆菌MC4-2可用于烟草黑胫病的防治。解淀粉芽孢杆菌作为一类根际促生菌[17],其在土壤改良以及植物生长方面可以发挥很大的作用,它通过代谢物的拮抗作用、影响致病菌的定殖以及调控植物代谢途径等方式在植物病害防治方面也可以发挥较大的作用,对由链格孢菌[24]、平头炭疽菌、番茄灰霉病菌、油菜菌核病菌、腐皮镰刀菌、甘蔗鞭孢堆黑粉菌以及稻梨孢菌等众多病原菌引致的病害均具有一定的防治效果[25]。
芽孢杆菌在生长过程中能产生芽孢和多种活性物质,可以提高菌株对环境的耐受力[18]。因此通过发酵条件优化试验探索芽孢杆菌菌株的最适生长条件非常有必要。本研究采用单因素试验对Gj7和Gj92菌株的基本培养基和发酵条件进行了优化,得出Gj7菌株的最佳发酵培养基配方为蛋白胨1.00 g,酵母浸粉0.50 g,蔗糖2.00 g,蒸馏水100 mL;最佳发酵条件为pH值8,转速240 r/min,装液量60 mL,温度24 ℃,发酵时间22 h。Gj9菌株的最佳发酵培养基配方为蛋白胨1.00 g,酵母浸粉0.50 g,葡萄糖2.00 g,蒸馏水100 mL;最佳发酵条件为pH值6,转速240 r/min,装液量30 mL,温度36 ℃,发酵时间14 h。将Gj7菌株与何明川等[11]从美洲大蠊肠道分离得到的MC4-2枯草芽孢杆菌、张梦君等[26]从根际土壤中分离得到的HXP-5枯草芽孢杆菌的发酵条件进行比较,发现三者的最适温度分别为24、32、27 ℃,2株来自土壤的枯草芽孢杆菌Gj7和HXP-5的最短温度相近,而从肠道分离的MC4-2的最适温度高于30 ℃;三者的最适装液量分别为60、100、30 mL,相差不大;三者的最佳转速分别为210、210、240 r/min,无明显差异;三者的最适氮源均为蛋白胨和酵母浸粉;MC4-2和Gj7的最适碳源均为蔗糖;3株菌生长的最适pH值都在7~8范围内;菌株MC4-2在培养60 h时生长量达到最大,而Gj7菌株在培养22 h时生长量达到最大。除了最适温度、最佳发酵时间差异较大外,三者的其他最适条件差异均不明显。将Gj9菌株与分离自坚尼草的JNC2菌株[27]、分离自土壤的LJ1菌株[28]进行比较,发现三者的最适温度均在30~34 ℃;最适转速均在210~240 r/min;最适pH值在5~6之间;Gj9和JNC2的最适氮源均为蛋白胨和酵母浸粉;Gj9和LJ1的最适碳源均为蔗糖;JNC2菌株在培养72 h时生长量达到最大,而LJ和Gj9菌株均在培养14 h时达到最大生长量。综上所述,即使为同一种菌株,由于来源、生境条件等不同,其生理生化特性及最佳发酵条件也会存在差异。
拮抗细菌的代谢产物在抑制病原菌过程中能发挥重要作用。王智敏等[29]对解淀粉芽孢杆菌JK的挥发性物质进行了研究,发现其挥发性物质含有醛类、酯类、酮类等,其中己醛具有较好的抑菌作用。通过GC-MS分析,发现4-乙基苯酚、2-丙基环己酮这2种成分可能是解淀粉芽孢杆菌LJ02发挥抑菌活性最重要的气体成分,对黑腐皮壳菌、草莓灰霉病菌、枣浆胞病等病原菌都有很好的抑制作用[30]。通过气质联用(GC/MS)法,Chaurasia等[31]发现由1株拮抗枯草芽孢杆菌产生的挥发性物质能导致病原真菌菌丝和孢子的畸形。
上述研究结果为解淀粉芽孢杆菌和枯草芽孢杆菌在植物病害生物防治中的应用提供了科学依据。在本研究中,2株菌对不同的烟草真菌性病菌有较好的抑制效果,其挥发性物质对烟草病原菌也有一定的抑制作用,说明两者均具有较大的生防潜力。但对其在平板上扩散的抗菌物质与挥发性抗菌物质还有待于深入分析,以提高其应用价值。

