M2 型肿瘤相关巨噬细胞参与胃癌细胞转移及免疫逃逸的机制研究
陈华敏,何志军,涂 伟,吴晓明,黄光钺
(海南医学院第二附属医院胃肠肿瘤外科,海南 海口 571000)
胃癌是世界范围内最常见的癌症之一,也是癌症相关死亡的第二大原因,严重威胁人类生命健康[1-3]。肿瘤微环境是由肿瘤细胞、免疫细胞和其他基质细胞组成的高度异质性生态系统。其中,肿瘤相关巨噬细胞(tumour associated macrophages,TAM)是主要的肿瘤浸润性免疫细胞之一,通常分为两种功能相反的亚型,即经典激活的M1 型和交替激活的M2 型。M1 型TAM 通常发挥抗肿瘤作用,包括直接介导细胞毒性和抗体依赖性细胞介导的细胞毒性来杀死肿瘤细胞[4];M2 型TAM 可促进肿瘤细胞的增殖和转移,抑制T 细胞介导的抗肿瘤免疫反应,加快肿瘤进展[5]。M1 型TAM 和M2 型TAM 都具有高度可塑性,因此能够在肿瘤微环境变化或治疗干预中相互转化,其中靶向M2型TAM现已成为一种新的癌症治疗策略。
越来越多的证据表明,免疫逃逸对于肿瘤的生存和发展至关重要。在肿瘤微环境中,肿瘤细胞可以募集免疫抑制细胞(如CD4+T细胞),从而破坏CD8+T细胞的细胞毒功能[6]。程序性死亡配体-1(programmed death ligand-1,PD-L1)是B7 家族的配体,可与其受体程序性死亡蛋白-1(programmed death protein-1,PD-1)结合,影响肿瘤特异性T 细胞,诱导细胞凋亡并抑制CD8+T 细胞的活性,导致肿瘤免疫逃避[7]。临床上越来越多的研究表明,用抗PD-1 抗体阻断PD-1 检查点是各种癌症的有效免疫治疗方法[8]。有研究揭示,从胃癌组织中分离的TAM 主要为M2 型,该表型巨噬细胞能够促进胃癌细胞转移并增强上皮间质转化过程[9]。但M2 型TAM 的这一作用是否涉及调控PD-L1表达目前尚未明确。鉴于此,本研究通过靶向抑制胃癌细胞PD-L1 表达后建立其与M2 型TAM 共培养体系,观察胃癌细胞转移及免疫抑制因子分泌的变化,以期为胃癌的临床治疗提供参考。
1 材料与方法
1.1 主要材料与试剂
人单核细胞株THP-1 和人胃癌细胞系MKN-45(中国细胞系资源库),胎牛血清(杭州四季青生物公司),RPMI 1640 培养基、佛波酯(phorbol 12-myristate 13-acetate,PMA)和白细胞介素-4[(interleukin-4,IL-4)美国Sigma 公司],Transwell 小室(美国Corning 公司),Triton X-100 免疫染色通透液和DAPI 染料(北京索莱宝生物公司),Magic™ siRNA 转染试剂(北京安必奇生物公司),TRIzol 试剂盒、反转录试剂盒及荧光定量检测试剂盒(日本Takara 公司),Matrigel 胶(上海碧云天生物研究所),血管内皮生长因子(vascular endothelial growth factor,VEGF)、转化生长因子-β(transforming growth factor-β,TGF-β)和白细胞介素-6(interleukin-6,IL-6)特异性ELISA 检测试剂盒(江苏凯基生物公司),兔抗CD206 单克隆抗体、兔抗PD-L1 单克隆抗体及Alexa Fluor 488标记荧光二抗(英国Abcam公司)。
1.2 THP-1细胞的培养与诱导
在THP-1 细胞中添加含10%胎牛血清的RPMI 1640培养基,置于37 ℃、5%CO2条件下培养,待细胞呈对数生长时,调整密度为2×105/mL植入6孔板内,更换为含50 ng/mL PMA 的新鲜培养基培养24 h,弃去培养液,换用含20 ng/mL IL-4的新鲜培养基诱导72 h,以建立M2型TAM 体系。通过倒置显微镜观察诱导前后细胞形态变化,并拍照。
1.3 细胞免疫荧光染色
将诱导前后的THP-1 细胞或各组MKN-45 细胞接种于玻片表面,爬片后,PBS 洗涤,4%多聚甲醛固定,浸入0.1%Triton X-100 中室温通透20 min,再加入蛋白酶处理。山羊血清室温封闭30 min,诱导前后的THP-1 细胞滴加兔抗CD206 单克隆抗体(1∶100)进行标记,各组MKN-45 细胞滴加兔抗PD-L1 单克隆抗体(1∶200),置于4 ℃孵育过夜。次日,加入Alexa Fluor 488 标记荧光二抗(1∶500),置于37 ℃孵育1 h,DAPI避光染核10 min,PBS 洗涤,封片剂封片,晾干。通过荧光显微镜观察蛋白荧光表达并拍照,Image J 软件分析各蛋白染色荧光强度。
1.4 实验分组与处理
将人胃癌细胞系MKN-45分为对照组(未经转染的MKN-45 细胞)、siPD-L1 组(将siPD-L1 转染至MKN-45细胞)、M2 组(在Transwell 小室上室接种M2 型TAM,下室接种MKN-45 细胞)和siPD-L1+M2 组(在Transwell 小室上室接种M2 型TAM,下室接种转染siPD-L1的MKN-45细胞)。将以上各组置于37 ℃、5%CO2条件下培养48 h 后,收集MKN-45 细胞进行后续实验。其中,siRNA 转染严格根据Magic™ siRNA 试剂盒说明书操作,将siNC 或siPD-L1 转染至MKN-45 细胞中,分别记为siNC 组、siPD-L1 组,并进行RT-qPCR 实验检测转染效果。
1.5 RT-qPCR实验
TRIzol 法提取转染后的MKN-45细胞总RNA,通过逆转录反应合成cDNA,采用荧光定量PCR试剂盒检测细胞内PD-L1 表达。以GADPH 为内参,引物序列:PD-L1 上游引物5'-GCTGCACTAATTGTCTATTGG GA-3',下游引物5'-AATTCGCTTGTAGTCGGCACC-3';GADPH上游引物5'-TGCACCACCAACTGCTTAGC-3',下游引物5'-GGCATGGACTGTGGTCATGAG-3'。反应体系根据试剂盒说明书配制,在定量检测系统上设置程序进行扩增,结果采用2-ΔΔCt法计算,比较各组MKN-45细胞PD-L1 mRNA相对表达量。
1.6 流式细胞术
收集各组MKN-45 细胞,PBS 清洗,调整细胞密度为1×106/mL,取100 μL 悬液置于流式管内,加入10 μL PE 标记PD-L1单克隆抗体,在4 ℃下避光孵育30 min,PBS 洗涤并重悬细胞,流式细胞仪检测各组PD-L1 阳性表达。
1.7 体外划痕实验
将各组MKN-45 细胞接种于6 孔板中,置于37 ℃、5%CO2条件下培养,待细胞铺满板底后,在培养板背后垂直于板底均匀划痕,吸去细胞培养液,PBS清洗划痕下的细胞碎片。培养24 h后取出,倒置显微镜下观察划痕愈合情况并拍照,Image J软件分析划痕愈合率,划痕愈合率=细胞迁移后的表面积/总表面积×100%。
1.8 Transwell实验
在Transwell 小室上室内表面涂稀释的Matrigel胶,置于37 ℃下使其形成基质屏障层。以不含胎牛血清的新鲜培养液将各组MKN-45 细胞密度调整为2×104/mL,吸取200 μL 悬液加入上室,吸取600 μL 含胎牛血清的新鲜培养液加入下室。将小室孵育24 h后取出,擦去未穿膜细胞,4%多聚甲醛固定,0.1%结晶紫染色10 min,在光学显微镜下观察并拍照,统计各组中穿膜数目,即为侵袭数目。迁移数目检测除不涂Matrigel胶外,其余步骤与上述步骤一致。
1.9 ELISA
收集各组MKN-45细胞培养液,以4 000 r/min低温离心5 min,获取上清,使用ELISA 检测试剂盒,分别检测各组细胞培养液上清中VEGF、TGF-β和IL-6水平。
1.10 统计学分析
采用SPSS 23.0 软件进行数据分析,GraphPad Prism 8.30 软件绘制统计图。符合正态分布的计量资料以均数±标准差(x-±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 THP-1细胞诱导后鉴定结果
诱导前的THP-1细胞为悬浮状态,大小均匀,呈圆形或椭圆形;经PMA 与IL-4诱导后,细胞贴壁生长,形态多样,多数呈长梭形或多边形,且伸出伪足,呈典型的M2型TAM形态,见图1。

图1 倒置显微镜观察诱导前后THP-1细胞形态(×200)
免疫荧光染色结果显示,与诱导前的THP-1 细胞比较,经PMA与IL-4诱导后的细胞内CD206荧光染色强度明显增加(图2)。说明成功构建M2型TAM模型。

图2 免疫荧光染色观察诱导前后THP-1 细胞CD206 表达(×200)
2.2 不同处理下MKN-45细胞内PD-L1表达
MKN-45 细胞经转染后,siPD-L1 组细胞内PD-L1相对表达量为(0.29±0.02),显著低于对照组的(1.00±0.06)和siNC 组的(1.00±0.08),差异有统计学意义(P<0.05)。
免疫荧光染色结果显示,各组MKN-45 细胞内红色荧光强度不一,说明PD-L1 表达不同;与对照组比较,siPD-L1 组细胞内PD-L1 荧光强度显著减弱(P<0.05),M2组则显著增强(P<0.05);与M2组比较,siPD-L1+M2 组细胞内PD-L1 荧光强度显著减弱(P<0.05),见图3。
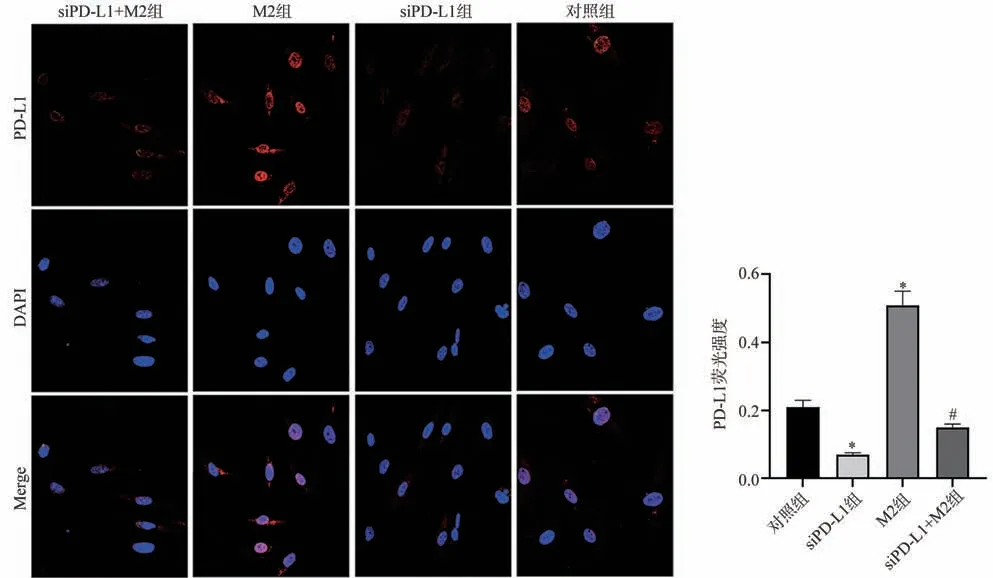
图3 免疫荧光染色观察MKN-45细胞内PD-L1表达(×200)
流式细胞术结果显示,与对照组比较,siPD-L1 组MKN-45 细胞表面PD-L1 表达显著降低(P<0.05),而M2 组显著升高(P<0.05);与M2 组比较,siPD-L1+M2组MKN-45 细胞表面PD-L1 表达则显著降低(P<0.05),见图4。

图4 流式细胞术检测MKN-45细胞表面PD-L1表达
2.3 MKN-45细胞划痕愈合率比较
划痕实验结果显示,与对照组比较,siPD-L1 组MKN-45 细胞划痕愈合率显著降低(P<0.05),M2 组划痕愈合率显著升高(P<0.05);与M2 组比较,siPD-L1+M2组划痕愈合率显著降低(P<0.05),见图5。

图5 划痕实验检测MKN-45细胞划痕愈合能力(×100)
2.4 MKN-45细胞迁移与侵袭数目比较
Transwell 结果显示,与对照组比较,siPD-L1 组MKN-45细胞迁移数目与侵袭数目均显著减少(P<0.05),M2 组迁移数目与侵袭数目均显著增加(P<0.05);而siPD-L1+M2组迁移数目与侵袭数目均显著少于M2组(P<0.05),见图6。

2.5 MKN-45细胞免疫抑制因子表达水平比较
ELISA 结果显示,与对照组比较,siPD-L1 组VEGF、TGF-β和IL-6水平均显著降低(P<0.05),M2组VEGF、TGF-β和IL-6水平均显著升高(P<0.05);与M2组比较,siPD-L1+M2 组VEGF、TGF-β 和IL-6 水平均显著降低(P<0.05),见图7。

图7 ELISA法检测MKN-45细胞培养液上清中VEGF、TGF-β和IL-6水平
3 讨论
由于胃癌早期症状不明显,大多数患者确诊时已处于胃癌晚期,高转移率与复发率是影响患者生存的主要原因[2]。此外,青少年胃癌的发病率也逐年上升[10]。因此,阐明胃癌进展的病理机制以寻找有效的治疗靶点,对于胃癌患者的诊疗至关重要。在不同的肿瘤基质中TAM 具有高可塑性,主要表现为M2型,这与患者的肿瘤转移和较差的预后密切相关[9]。然而,在肿瘤微环境中产生M2型TAM 的潜在机制目前尚未可知。肿瘤细胞对巨噬细胞向M2 型极化的影响及两者之间的相互作用已成为研究的热点。
本研究结果显示,与M2型TAM共培养后的MKN-45细胞,其细胞划痕愈合率升高,细胞迁移与侵袭数目均增加,这表明M2 型TAM 可能提高了MKN-45 细胞的转移能力。Yan 等[11]的研究表明,高水平的M2 型TAM 浸润与胃癌侵袭性特征有关,并且是胃癌中的独立预后因素,可作为胃癌患者预后的一项重要检测指标。Zhou 等[12]研究指出,早期胃癌组织内CD163 标记的M2 型TAM 数目与患者的肿瘤复发率呈正相关,且M2 型TAM 可在体外促进人胃癌细胞MKN-45 的增殖和侵袭,并促进异种移植模型的肿瘤生长。Zheng等[13]研究表明,胃癌组织内M2 型巨噬细胞标志物Fizz1、Ym1和Arg-1的表达水平升高,将M2型TAM 与人胃癌细胞HGC-27 共培养后,HGC-27 细胞的增殖、迁移和侵袭能力均增强。由此可见,M2 型TAM 能够促进胃癌转移,加速肿瘤进程。
免疫疗法是近十年来的一种新型抗癌疗法,目前已经建立了各种免疫治疗方式,包括免疫检查点抑制剂、疫苗和溶瘤病毒等[14]。其中,PD-1及其配体PD-L1的抗体是主要的免疫检查点抑制剂。在正常情况下,PD-L1 是维持自身耐受性和防止T 细胞介导的免疫刺激所必需的因子,然而肿瘤细胞可以通过PD-L1的表达获得免疫逃逸的特性,即PD-L1能够促进肿瘤细胞的免疫逃逸[15]。已知TAM是PD-1/PD-L1轴的关键介质,能够抑制抗肿瘤免疫反应,目前,关于肿瘤细胞中PD-L1表达与TAM 之间的关系正被逐步揭示。Harada 等[16]研究表明,M2 型TAM 浸润与胃腺癌细胞中PD-L1 表达高度相关;Zhu 等[17]指出PD-L1 的高表达与M2 型TAM 极化相关,PD-L1 介导的免疫抑制可能归因于TAM 浸润及其向M2 型极化。本研究结果显示,与M2型TAM 共培养的人胃癌细胞MKN-45 中,PD-L1 荧光强度增加,细胞表面PD-L1 表达升高,说明M2 型TAM可能促进了MKN-45细胞中PD-L1表达。鉴于此,本研究进一步通过siRNA 干扰抑制MKN-45 细胞中PD-L1表达,与M2 型TAM 共培养后发现,MKN-45 细胞不仅表现出细胞划痕愈合率降低、迁移与侵袭数目均减少,同时细胞PD-L1荧光强度减弱,细胞表面PD-L1表达降低,提示M2 型TAM 促进胃癌细胞转移的作用可能与调控PD-L1表达相关。
胃癌免疫逃逸现象与多种机制有关,其中肿瘤微环境中分泌的多种细胞因子与机体免疫抑制作用密切相关,该类细胞因子称为免疫抑制因子,其参与调节复杂的免疫网络,影响免疫细胞对肿瘤细胞的杀伤作用[18]。VEGF 作为一种中枢调节因子,是调控肿瘤细胞迁移、侵袭的重要指标,除了参与肿瘤血管生成外,其还与树突状细胞的功能异常相关[19];TGF-β 调节许多免疫细胞类型的生成和效应功能,控制先天免疫系统,是免疫抑制的核心因子[20];IL-6 除了促进肿瘤进展外,还可以将髓源性抑制细胞募集到肿瘤微环境中,发挥免疫抑制功能,从而增加肿瘤细胞的免疫逃逸能力[21]。本研究结果显示,MKN-45 细胞与M2 型TAM 共培养后其分泌VEGF、TGF-β 和IL-6 的水平明显上升,而抑制PD-L1 表达的MKN-45 细胞与M2 型TAM 共培养后其分泌VEGF、TGF-β 和IL-6 的水平则明显下降,因此,推测M2型TAM 促进胃癌细胞免疫逃逸,该作用可能与调控PD-L1表达有关。
综上所述,M2 型TAM 促进胃癌细胞的转移及免疫抑制因子表达,进而介导其免疫逃逸的发生,该作用可能与促进胃癌细胞PD-L1 表达有关,这为明确抑制胃癌转移与免疫逃逸的作用机制提供了实验依据。然而,有关M2 型TAM 激活胃癌细胞中PD-L1 表达的机制还需要进一步探索。

