迷迭香酸通过PI3K/AKT/mTOR 信号通路抑制喉癌细胞的增殖和迁移
延 青,杨花荣,王娜娜
(延安大学附属医院鼻咽喉科,陕西 延安 716000)
喉癌是头颈部最常见的恶性肿瘤之一,主要病理类型为喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)。由于该病早期通常无明显临床症状,大多数LSCC 患者就诊时已处于具有高侵袭性的晚期阶段[1]。尽管手术和放疗可以延长LSCC 患者的生存期,但仍有约30%的患者出现复发或转移。肿瘤侵袭转移是导致LSCC 患者生存率低的主要原因[2-3]。因此,迫切需要寻找更有效的治疗策略。迷迭香酸(rosmarinic acid,RA)是一种常见于唇形科植物中的酚类化合物[4],具有抗癌活性,能有效抑制肝癌[5]、乳腺癌[6]细胞的增殖和迁移,还可以调节与细胞增殖、侵袭相关的信号通路。据报道,RA 可通过抑制PI3K/AKT/mTOR信号通路抑制肝癌细胞的增殖和侵袭[7]。但RA 是否能通过抑制PI3K/AKT/mTOR 信号通路抑制LSCC细胞恶性进展仍不清楚。因此,本研究主要通过观察RA对LSCC细胞增殖和迁移的影响,分析其潜在机制。
1 材料与方法
1.1 药物及细胞
RA(批号:M-024)购自成都瑞芬思生物科技有限公司,纯度≥98%。人LSCC细胞系Hep-2(批号:CCL-23)购自美国ATCC 细胞库;人LSCC 细胞系TU686(批号:A3079)购自上海酶研生物科技有限公司。
1.2 主要试剂及仪器
CCK-8 试剂盒(批号:210508)购自北京索莱宝科技有限公司;细胞总蛋白提取试剂盒(批号:20200815)购自上海雅酶生物医药科技有限公司;BCA试剂盒(批号:210317)购自上海碧云天生物公司;Ki-67、MMP-2、MMP-9、GAPDH 兔多克隆抗体及辣根过氧化物酶标记的羊抗兔IgG 二抗(批号:20210506、20210814、20210913、20210425、20211004)均购自英国Abcam 公司;PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR(批号:210807、210705、210413、210610、210920、210924)购自美国Thermo Fisher Scientific 公司;PI3K/AKT/mTOR 信号通路激活剂胰岛素生长因子1(insulin-like growth factor 1,IGF-1)重组蛋白(批号:211104)购自美国Med Chem Express公司。
细胞培养箱(型号:LW-80A-Ⅲ)购自上海利闻科学仪器有限公司,酶标仪(型号:BIO-RAD-550)购自北京京科瑞达科技有限公司。
1.3 细胞培养、分组与形态观察
将Hep-2 和TU686 细胞置于含有10% FBS 与90%DMEM培养基中,于37 ℃、5% CO2条件下进行常规传代培养,每3 d 更换1 次培养基。取对数生长期的Hep-2和TU686 细胞,于添加20 μmol/L RA、50 μmol/L RA、100 μmol/L RA、10 nmol/mL IGF-1、10 nmol/mL IGF-1+100 μmol/L RA 的培养基中培养48 h[7],分别作为低剂量组、中剂量组、高剂量组、IGF-1 组、IGF-1+RA 组,另设置对照组(正常培养的对数生长期的Hep-2 和TU686细胞)。培养48 h后,使用倒置显微镜观察各组Hep-2和TU686细胞形态,并拍照。
1.4 检测细胞增殖能力
将各组Hep-2 和TU686 细胞以2×105个/孔接种到24 孔板中,每组分别设置6 个复孔,按照1.3 项下方法分组处理48 h,然后向每孔加入10 μL CCK-8 溶液,5% CO2、37 ℃孵育2 h,利用酶标仪检测450 nm波长处的吸光度。
1.5 检测细胞迁移能力
取对数生长期的各组Hep-2 和TU686 细胞,消化重悬。细胞以2×105个/孔的密度培养于24 孔板中,待细胞贴壁后,每孔划出相等距离线条,于37 ℃、5% CO2的条件下持续培养48 h,倒置显微镜下观察划痕愈合情况并拍照,测量划痕距离,计算划痕愈合率。划痕愈合率(%)=(0 h的划痕距离-48 h的划痕距离)/0 h的划痕距离×100%。
1.6 检测蛋白表达水平
使用RIPA 裂解缓冲液提取细胞中总蛋白。通过BCA 试剂盒测定蛋白浓度,平衡蛋白浓度后,使用10% SDS-PAGE 进行电泳分离获得蛋白,并转至PVDF膜上,用5%脱脂牛奶封闭1 h。随后,加入一抗PI3K(1∶3 000)、AKT(1∶3 000)、mTOR(1∶1 000)、p-PI3K(1∶3 000)、p-AKT(1∶3 000)、p-mTOR(1∶1 000)、Ki-67(1∶1 000)、MMP-2(1∶2 500)、MMP-9(1∶2 000)、GAPDH(1∶1 000)在4 ℃下孵育过夜,再加入羊抗兔IgG 二抗(1∶2 000)在室温下孵育2 h。使用ECL 化学发光试剂盒将蛋白可视化,通过Image J软件对目标条带的灰度值进行分析。
1.7 统计学分析
使用SPSS 25.0 软件对实验所得数据进行统计学分析,结果均以均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验,P<0.05为差异具有统计学意义。
2 结果
2.1 各组Hep-2和TU686细胞形态
与对照组比较,低剂量组、中剂量组、高剂量组Hep-2 和TU686 细胞数量均减少,细胞严重皱缩,并有大量细胞碎片出现,且RA 浓度越高,Hep-2 和TU686细胞数量越少;而IGF-1组Hep-2和TU686细胞数量增多,细胞形态无明显改变;与高剂量组比较,IGF-1+RA组Hep-2 和TU686 细胞数量增多,贴壁细胞数更多,见图1。

图1 各组Hep-2和TU686细胞形态(×400)
2.2 各组Hep-2和TU686细胞增殖能力
与对照组比较,在48 h 时低剂量组、中剂量组、高剂量组Hep-2和TU686细胞OD450值显著降低(P<0.05),而IGF-1 组Hep-2 和TU686 细胞OD450值显著升高(P<0.05);与高剂量组比较,在48 h 时IGF-1+RA 组Hep-2和TU686细胞OD450值显著升高(P<0.05),见图2。

图2 各组Hep-2和TU686细胞的增殖活性
2.3 各组Hep-2和TU686细胞迁移能力
与对照组比较,低剂量组、中剂量组、高剂量组Hep-2和TU686细胞划痕愈合率显著降低(P<0.05),而IGF-1 组Hep-2 和TU686 细胞划痕愈合率显著升高(P<0.05);与高剂量组比较,IGF-1+RA 组Hep-2 和TU686细胞划痕愈合率显著升高(P<0.05),见图3。

图3 各组Hep-2和TU686细胞愈合率比较
2.4 各组Hep-2 和TU686 细胞中增殖、迁移相关蛋白表达情况
与对照组比较,中剂量组、高剂量组Hep-2 和TU686 细胞中Ki-67、MMP-2、MMP-9 蛋白表达水平显著降低(P<0.05),而IGF-1 组Hep-2 和TU686 细胞中Ki-67、MMP-2、MMP-9蛋白表达水平显著升高(P<0.05);与高剂量组比较,IGF-1+RA 组Hep-2 和TU686 细胞中Ki-67、MMP-2、MMP-9蛋白表达水平显著升高(P<0.05),见图4~5。

图4 各组Hep-2细胞中增殖、迁移蛋白表达

图5 各组TU686细胞中增殖、迁移蛋白表达
2.5 各组Hep-2 和TU686 细胞中PI3K/AKT/mTOR 信号通路相关蛋白表达情况
与对照组比较,中剂量组、高剂量组Hep-2 和TU686细胞中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR水平显著降低(P<0.05),而IGF-1 组Hep-2 和TU686 细胞中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR 水平显著升高(P<0.05);与高剂量组比较,IGF-1+RA组Hep-2和TU686 细胞中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR水平显著升高(P<0.05),见图6~7。
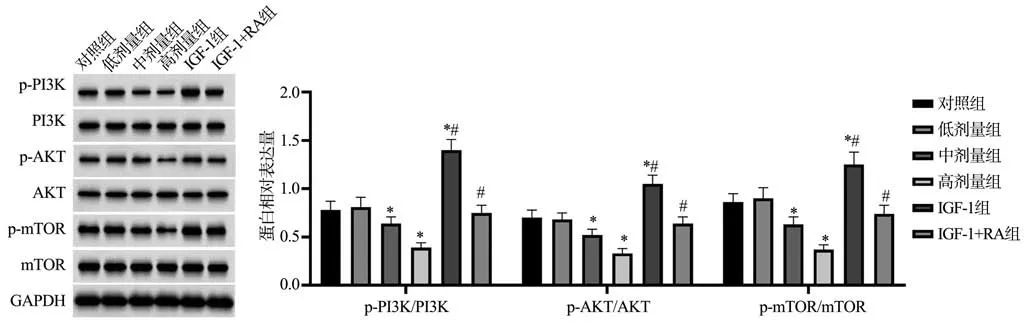
图6 各组Hep-2细胞中PI3K/AKT/mTOR信号通路相关蛋白

图7 各组TU686细胞中PI3K/AKT/mTOR信号通路相关蛋白
3 讨论
LSCC发展到晚期时,较差的预后和有限的治疗方式对患者生命造成严重威胁[8-10]。因此,寻找安全、有效、低毒的治疗药物具有重要意义。RA 作为一种天然活性成分,具有广泛的生物学活性,如抗炎、抗氧化、抗感染和保肝[11-12]。此外,RA 对多种恶性肿瘤(如乳腺癌[6]、肝癌[7]、结直肠癌[13]和黑色素瘤[14])的恶性进展具有抑制作用。本研究结果显示,RA 可抑制Hep-2和TU686 细胞增殖、迁移,这与上述研究一致。有研究证实Ki-67 在癌组织中高表达,参与癌症的发展进程[15];MMP-2、MMP-9 在癌细胞中高表达,能有效促进癌细胞的迁移和侵袭,导致癌症恶化[16]。本研究结果显示,RA能降低Ki-67、MMP-2、MMP-9蛋白水平,表明RA 能够有效抑制LSCC 细胞的增殖和迁移,提示RA可能是LSCC的潜在治疗药物。
PI3K/AKT/mTOR 信号通路在癌症进展中具有关键作用,可调控多种过程,包括新陈代谢、细胞生长、存活、迁移和分化[17-18]。研究显示,PI3K/AKT/mTOR 信号通路的过度激活,参与多种癌症进展[19-20]。因此,PI3K/AKT/mTOR 信号通路被认为是治疗癌症的重要靶点。有研究报道,RA 在体内外抑制肝癌细胞增殖、侵袭和肿瘤生长的作用与抑制PI3K/AKT/mTOR 信号通路的激活密切相关[7]。本研究发现,中、高剂量的RA可显著降低Hep-2和TU686细胞中p-PI3K、p-AKT、p-mTOR 的蛋白表达水平,表明RA 可抑制PI3K/AKT/mTOR 信号通路的激活。因此,可以推测RA 对LSCC细胞恶性生物学行为的抑制作用可能与抑制PI3K/AKT/mTOR 信号通路有关。为了验证这一机制,本研究在RA 处理的基础上,使用PI3K/AKT/mTOR 激活剂IGF-1 进行干预,结果显示,IGF-1 可以有效减轻RA 对LSCC 细胞恶性生物学行为的抑制作用。提示RA 对LSCC 细胞增殖、迁移的抑制作用可能是通过抑制PI3K/AKT/mTOR信号通路实现的。
综上所述,RA 可能通过抑制PI3K/AKT/mTOR 信号通路,从而抑制LSCC 细胞增殖、迁移。本研究进一步明确了RA 发挥抗LSCC 作用的分子机制,为RA 的应用提供理论依据,表明RA 有望成为LSCC 的潜在治疗药物。但需要进一步的体内实验研究来验证RA 对LSCC的抗癌作用。

