基于石墨烯掺杂的CuMOF/Cu(OH)2纳米棒阵列自支撑电极的制备及用于葡萄糖检测
王晓莹 涂昊宇 李琪 张志恒 樊莹 蒋健章张成燕 王明艳 许瑞波
(江苏海洋大学, 江苏省先进材料功能调控技术重点实验室1,药学院2,环境与化学工程学院3, 连云港 222005)
葡萄糖是细胞的能量来源和新陈代谢的中间产物,为生物的主要供能物质。人体内血糖浓度异常,会导致糖尿病、肾衰竭和心脏病等并发症,因此,检测血糖水平已成为分析科学的一个重要课题[1]。目前,测定葡萄糖浓度的方法主要有分光光度法[2]、荧光光谱法[3]和液相色谱法[4]等。这些方法通常需要昂贵的仪器以及复杂的样品制备过程。常用的血糖仪多利用葡萄糖氧化酶和葡萄糖脱氢酶将葡萄糖氧化从而实现对血液中葡萄糖的检测,但由于生物酶的成本高,并且易受检测环境(如pH 值和温度等因素)影响而失活,不能满足快速、便捷地检测血液中葡萄糖浓度的需求[5]。因此,需要开发针对血液的无酶葡萄糖传感器。
金属有机框架(Metal organic frameworks,MOFs)材料具有大的比表面积和高孔隙率,将其作为电极修饰材料修饰于电极表面,可有效提高电解液中被测物质在电极表面的富集和传质效率,从而放大被检测物的电化学响应信号,提高检测灵敏度[6-7]。同时,MOFs 材料可通过构筑不同催化活性位点以及调控配体取代基和功能基团,形成特定大小和结构各异的孔洞结构,实现对待测物的选择性吸附及调制分离,从而完成对待测物的选择性催化及测定。因此,近年来MOFs 材料在电化学传感领域得到了广泛的研究和应用[7-8]。Kim 等[8]采用水热法合成了双金属有机框架Cu@Ni MOFs,将其修饰在玻碳电极(GCE)表面,对葡萄糖具有优异的电催化活性,对葡萄糖检测具有较高的灵敏度和选择性。Shahrokhian 等[9]通过在GCE 表面直接生长CuMOFs 膜,制备了CuMOFs 膜自支撑修饰电极,可高效、选择性地检测葡萄糖。然而,MOFs 材料的导电性较差,这也限制了其作为电化学传感器的进一步应用。
活性炭(Activated carbon,AC)、石墨烯(Graphene,GE)和碳纳米管(Carbon nanotube,CNT)等碳材料具有高导电性、高稳定性以及生物兼容性好等优点,将MOFs 材料与这些碳材料复合用于修饰电极,构建电化学传感器,可有效解决MOFs 材料导电性差的问题。目前,已有研究者将MOFs 与碳纤维、CNT、介孔碳和GE 等多种类型的碳材料复合后用于制备传感器[10-13]。Feng 等[11]制备了碳纤维/ZIF-67复合材料并修饰于GCE,该修饰电极对硝基苯和L-半胱氨酸表现出优异的电催化性能,提高了对硝基苯和L-半胱氨酸检测的灵敏度。Rani 等[12]采用溶剂热法合成了Sn-MOF,将其与CNT 复合制得Sn-MOF@CNT,将之滴涂于金电极表面,获得对H2O2具有良好的催化性能的修饰电极,可有效提高对H2O2的检测性能。Li 等[13]在GCE 上滴涂CuMOF-氧化石墨烯(Graphene oxide,GO)复合材料,再将CuMOF-GO电化学还原转化为CuMOF-RGO,获得了对邻苯二酚和对苯二酚具有高灵敏度的修饰电极。
然而,无论是MOFs 还是碳纳米材料,通常为粉末形态,将其修饰在电极表面时,需要添加粘合剂才可将其固定在电极表面。这不仅降低了修饰材料的催化活性,而且这些修饰材料易脱落,造成修饰电极的稳定性变差和检测灵敏度下降。针对这些问题,本研究采用简单的溶剂法,在泡沫铜(Copper foam,CF)基底上原位生长直立Cu(OH)2纳米棒阵列,然后通过水热法,以Cu(OH)2纳米棒阵列为核,均苯三甲酸(Trimesic acid,TMA)为配体,同时引入GE 纳米片,一步构建了基于CF 基底掺杂GE 纳米片的核壳异质自支撑电极GE-CuMOF/Cu(OH)2@CF,基于此,构建了检测葡萄糖的传感方法。本方法基于CF 原位生长CuMOF/Cu(OH)2异质结构,避免了添加粘合剂;GE 的引入增加了电极的导电性;CuMOF 大的比表面积和特殊的孔道结构有利于提高传感器的灵敏度和选择性。此传感器的各组分之间的协同作用有效提高了传感器的灵敏度、稳定性和选择性。
1 实验部分
1.1 仪器与试剂
D8-advanced 型X 射线衍射仪(德国布鲁克公司);JSM6700F 型扫描电子显微镜(日本电子株式会社);ESCALAB 250XI 型X 射线光电子能谱仪、EVLUTION 220 型紫外-可见光谱仪(美国赛默飞世尔公司);CHI760E 电化学分析仪(上海辰华仪器有限公司)。
CF(苏州佳士德泡沫金属有限公司);GE(昂星新型碳材料常州有限公司);TMA(上海百研生物科技有限公司);人血清(北京索莱宝科技有限公司);葡萄糖、果糖、核糖、半乳糖和半胱氨酸(国药集团化学试剂有限公司)。所用试剂均为分析纯;实验用水为去离子水。
1.2 实验方法
1.2.1 Cu(OH)2@CF电极的制备
CF(3 cm×1 cm)依次用丙酮、水和无水乙醇超声清洗10 min,氮气吹干。1 mL 1 mol/L(NH4)2S2O8、2 mL 10 mol/L NaOH、1 mL NH3·H2O 和10 mL 水混合均匀,将CF 置于混合溶液中,90 min 后取出,依次用水和无水乙醇各清洗3 次,自然干燥,得到Cu(OH)2@CF 电极。
1.2.2 GE-CuMOF/Cu(OH)2@CF电极的制备
以N,N-二甲基甲酰胺(N,N-Dimethyl formamide,DMF)为溶剂配制1 mg/mL GE 溶液,备用。
取0.2 mmol TMA 溶于8 mL DMF-2 mL 无水乙醇的混合溶液中,加入适量GE 溶液(1 mg/mL), 搅拌均匀后转移至高压反应釜中,将制得的Cu(OH)2@CF 电极斜放于反应釜中,密封后于120 ℃反应24 h,自然冷却,制得GE-CuMOF/Cu(OH)2@CF 电极,用无水乙醇和水反复淋洗,室温下干燥,备用。
采用相同的方法,在水热过程中不加入GE,制得CuMOF/Cu(OH)2@CF 电极。改变GE 溶液的加入量(1、3 和5 mL),制得一系列GE-CuMOF/Cu(OH)2@CF 电极材料,考察GE 用量对复合电极检测葡萄糖灵敏度的影响。
1.2.3 电化学测试
所有电化学实验均在室温下采用三电极体系进行:GE-CuMOF/Cu(OH)2@CF 为工作电极,Ag/AgCl 电极为参比电极,铂丝电极为对电极,0.1 mol/L NaOH 溶液为电解液。循环伏安法(Cyclic voltammetry,CV)的测试电位范围为-0.2~0.8 V,扫速为50 mV/s, 葡萄糖浓度为5 mmol/L。计时安培法(Chronoamperometry,CA)的初始电位设定为0.5 V, 稳定时间为60 s, 向20 mL 0.1 mol/L NaOH 溶液中连续加入10 μL 不同浓度的葡萄糖溶液进行检测。电化学交流阻抗法(Electrochemical impedance spectroscopy,EIS)的测试频率范围为0.1~10000 Hz, 振幅0.005 V, 电解液为含有5 mmol/L K3[Fe(CN)6]的0.1 mol/L KCl 溶液。
1.2.4 实际样品测试
将400 μL 血液样本加至20 mL 0.1 mol/L NaOH,搅匀后,在最佳测试条件下,按照1.2.3 节的方法进行检测,并进行加标回收实验,计算回收率。
2 结果与讨论
2.1 扫描电镜(SEM)表征
图1A~1C 为Cu(OH)2@CF 在不同放大倍数下的扫描电镜(SEM)图,与CF(图1A 插图)相比,Cu(OH)2@CF 样品的表面粗燥,被直立的Cu(OH)2纳米棒均匀覆盖,而CF 样品的表面呈现光滑的金属状态。由图1C 可见,Cu(OH)2纳米棒的长度约为10~15 μm,宽度约为1 μm,厚度约为50~100 nm。图1D~1F 为CuMOF/Cu(OH)2@CF 样品不同放大倍数的SEM 图,经水热反应后CuMOF/Cu(OH)2@CF 电极保持了CF 基底的三维多孔框架结构,Cu(OH)2纳米棒阵列未发生坍塌和变形。以Cu(OH)2纳米棒为核,CuMOF 颗粒在直立的Cu(OH)2纳米棒表面均匀生长,使得Cu(OH)2纳米棒明显变粗,直径达到1~2 μm,形成了由CuMOF 纳米颗粒均匀包覆Cu(OH)2的棒状核壳异质结构。图1G~1I 是GE-CuMOF/Cu(OH)2@CF 的不同放大倍数的SEM 图。在水热过程中加入GE 纳米片,GE 纳米片会均匀地与CuMOF 同时生长在Cu(OH)2@CF 电极表面(图1G 插图),GE 纳米片覆盖或交织在CuMOF/Cu(OH)2纳米棒阵列结构中,得到基于CF 基底、GE 掺杂的GE-CuMOF/Cu(OH)2@CF 电极。

图1 不同放大倍数下Cu(OH)2@泡沫铜(CF)(A~C)、铜金属有机框架(CuMOF)/Cu(OH)2@CF(D~F)和石墨烯(GE)-CuMOF/Cu(OH)2@CF(G~I)的扫描电镜(SEM)图,其中,图A 中的插图为泡沫铜,图G 中插图为GE-CuMOF/Cu(OH)2@CFFig.1 Scanning electron microscopy (SEM) images of Cu(OH)2@copper foam (CF) (A-C), copper metal organic framework(CuMOF)/Cu(OH)2@CF(D-F)and graphene(GE)-CuMOF/Cu(OH)2@CF(G-I)with different magnifications, among which, the inset in Fig.1A is CF, and in Fig.1G is GE-CuMOF/Cu(OH)2@CF
2.2 X-射线衍射(XRD)表征
CF 和Cu(OH)2@CF 电极品的XRD 图谱如图2A 所示。CF(曲线a)在2θ=44.2°、51.6°和76.1°处观察到3 个强衍射峰,对应于CF 的(111)、(200)和(220)晶面[14]。Cu(OH)2@CF(曲线b)的XRD 图中除了上述3 个CF 衍射峰外,在2θ=16.7°、23.8°、34.1°、35.9°、39.8°和53.4°处出现对应于正交晶系Cu(OH)2的(020)、(021)、(002)、(111)、(130)和(132)特征峰(JCPDS:80-0656)[15]。图2B 是样品CuMOF、CuMOF/Cu(OH)2@CF 和GE-CuMOF/Cu(OH)2@CF 的XRD 图谱,样品CuMOF/Cu(OH)2@CF(曲线b)和GE-CuMOF/Cu(OH)2@CF(曲线c)的XRD 图谱中出现了一系列与CuMOF(曲线a)一致的衍射峰,说明通过水热法已成功引入CuMOF[16]。加入GE 纳米片后,GE-CuMOF/Cu(OH)2@CF 的XRD 衍射峰没有明显改变,在2θ为26°~28°时出现了一个大的宽峰,此峰与GE 的特征峰位置对应[17]。这说明已经成功制得GE-CuMOF/Cu(OH)2@CF,与SEM 表征结果一致。
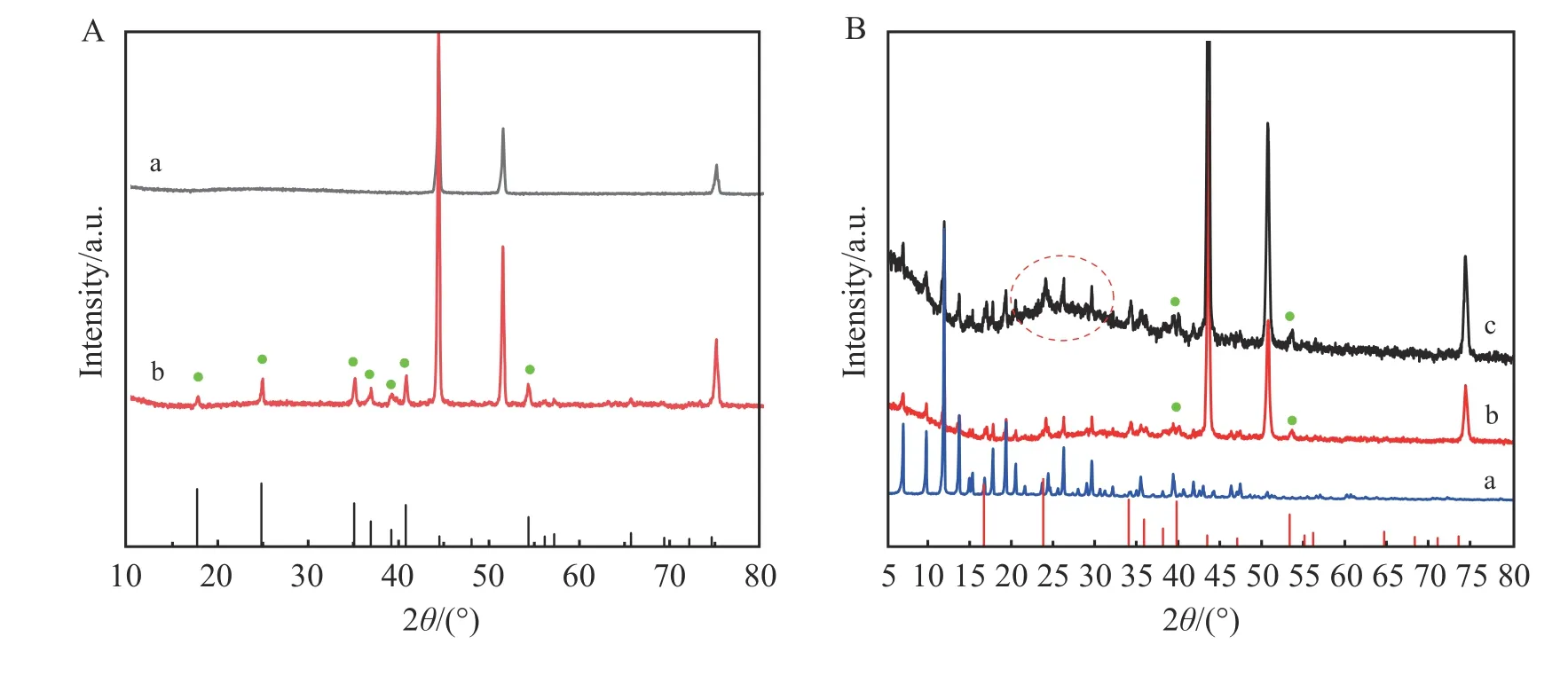
图2 (A)CF(a)和Cu(OH)2@CF(b)的X-射线衍射(XRD)图谱;(B)CuMOF(a)、CuMOF/Cu(OH)2@CF(b)和GE-CuMOF/Cu(OH)2@CF(c)的XRD 图谱Fig.2 (A) X-ray diffraction (XRD) patterns of CF (a) and Cu(OH)2@CF (b); (B) XRD patterns of CuMOF (a),CuMOF/Cu(OH)2@CF (b) and GE-CuMOF/Cu(OH)2@CF (c)
2.3 傅里叶变换红外(FTIR)光谱表征
图3 为Cu(OH)2(曲线a)、CuMOF(曲线b)和GE-CuMOF/Cu(OH)2(曲线c)的红外图谱。对比3 条曲线,发现3 个样品在3200~3500 cm-1间均出现了一个宽且强的振动峰,归属于样品中的羟基伸缩振动。而GE-CuMOF/Cu(OH)2和Cu(OH)2样品在3570 cm-1附近有一个尖锐衍射峰,可归属于样品中Cu(OH)2形成的分子内氢键[18]。样品CuMOF 和GE-CuMOF/Cu(OH)2在1650、1574 和1380 cm-1处出现较强的特征峰,归属于样品中CuMOF 的羧基的对称和不对称伸缩振动峰[19],在700 和1450 cm-1附近的红外吸收峰对应于C—H 的弯曲振动以及苯环的拉伸和变形振动[18],在488 cm-1附近的吸收峰归属于Cu—O的拉伸振动[18-20]。在样品GE-CuMOF/Cu(OH)2图谱(曲线c)中未见位于830 和1270 cm-1左右对应于C—O—C(环氧键)的吸收带,表明掺杂的GE 纳米片还原程度较高[21]。综上可知,GE-CuMOF/Cu(OH)2被成功合成。

图3 Cu(OH)2 (a)、CuMOF (b)和GE-CuMOF/Cu(OH)2 (c)的傅里叶变换红外光谱(FTIR)图Fig.3 Fourier transform infrared (FTIR) spectra of Cu(OH)2 (a), CuMOF (b) and GE-CuMOF/Cu(OH)2 (c)
2.4 X-射线光电子能谱(XPS)表征
对GE-CuMOF/Cu(OH)2@CF 进行了XPS 表征,结果如图4A 所示。GE-CuMOF/Cu(OH)2@CF 的XPS全谱中出现了对应于C 1s、O 1s 和Cu 2p 的特征峰,表明样品中含有C、O 和Cu 元素。图4B 中Cu 2p XPS 光谱在934.2 和954.1 eV 处的Cu 2p3/2和Cu 2p1/2衍射峰以及在943.8 和962.1 eV 处的卫星峰说明复合电极中存在Cu2+;在932.2 eV 处的Cu 2p3/2衍射峰、位于941.1 eV 处的卫星峰和952.7 eV 处出现的Cu 2p1/2衍射峰可归属于Cu0/Cu+[14,22]。因为Cu0和Cu+的Cu 2p 衍射峰很接近,进一步测试Cu LMM 俄歇峰确认其归属。图4C 为Cu LMM XPS 图谱,未出现位于570 eV 处Cu+的特征峰,说明复合电极中铜元素主要为Cu2+和Cu0[23-25]。这些结论和前述XRD 结果相符合。在C 1s 光谱中,284.6、285.8 和288.3 eV处出现的峰分别归属于C 的C—C/C=C、C—O 和C=O 键(图4D)[21]。样品的O 1s 光谱在530.2 和531.6 eV 处出现2 个特征峰,分别归属于Cu—O 和C—O 键(图4D 插图)[14]。XPS 表征结果进一步证实已成功制备GE-CuMOF/Cu(OH)2@CF。
2.5 传感器检测葡萄糖的电化学性能测试
Cu(OH)2@CF、CuMOF/Cu(OH)2@CF 和GE-CuMOF/Cu(OH)2@CF 电极在含有及不含葡萄糖的电解质溶液中的CV 曲线如图5A 所示,在不含葡萄糖的电解液中,扫描电压为-0.2~0.8 V 时,Cu(OH)2@CF出现一对氧化还原峰,其阳极峰电位为0.546 V,阴极峰电位为0.366 V,对应于Cu2+/Cu 的氧化还原反应[26]。CuMOF/Cu(OH)2@CF 电极的阳极和阴极电流强度均增大,这是因为修饰CuMOF 后,电极具有更大的比表面积和更多的活性位点,有利于物质在电极表面吸附、传递和扩散,使修饰电极的电流强度增大[27]。引入导电性能优异的GE 纳米片后,GE-CuMOF/Cu(OH)2@CF 电极的电流强度进一步增大,引入GE 纳米片不仅提高了复合电极的比表面积,而且加快了电极的电子的传递速度,使复合电极的电化学信号进一步增强。

图5 (A)Cu(OH)2@CF、CuMOF/Cu(OH)2@CF 和GE-CuMOF/Cu(OH)2@CF 电极在不含有及含有5 mmol/L 葡萄糖的0.1 mol/L NaOH 溶液中的循环伏安(CV)图;(B)GE-CuMOF/Cu(OH)2@CF 电极在不同扫描速度下对1 mmol/L 葡萄糖溶液测定的CV 图,插图为葡萄糖氧化峰电流和扫描速率平方根的关系曲线Fig.5 (A) Cyclic voltammograms (CV) of Cu(OH)2@CF, CuMOF/Cu(OH)2@CF and GE-CuMOF/Cu(OH)2@CF electrodes in the absence or presence of 5 mmol/L glucose in 0.1 mol/L NaOH solution; (B) CV curves of GE-CuMOF/Cu(OH)2@CF electrode at different scan rates in the presence of 1 mmol/L glucose in 0.1 mol/L NaOH solution. Inset is relationship between oxidation peak current and square root of scan rate
在电解质溶液中加入5 mmol/L 葡萄糖后,GE-CuMOF/Cu(OH)2@CF 表现出最优的催化性能,不仅催化氧化葡萄糖的起始峰电位明显负移至0.1 V,而且峰电流强度明显增大,约为CuMOF/Cu(OH)2@CF 电极的1.5 倍和Cu(OH)2@CF 电极的2 倍,这表明GE-CuMOF/Cu(OH)2@CF 电极催化氧化葡萄糖的活性最大,检测葡萄糖的灵敏度最高。
在不同扫描速率下,GE-CuMOF/Cu(OH)2@CF 电极在1 mmol/L 葡萄糖溶液中的CV 图如图5B 所示,可见随着扫描速率增加,葡萄糖氧化峰峰电流(Ipa)逐渐增大。图5B 插图为葡萄糖氧化峰电流和扫描速率(v)平方根的关系图,在20~150 mV/s 范围内,回归方程为Ipa(mA)=1.129v1/2((mV/s)1/2)-1.168,相关系数为0.9979,表明葡萄糖在电极上的电化学反应是扩散控制过程。
2.6 修饰电极的EIS表征
通过EIS 进一步分析了Cu(OH)2@CF、CuMOF/Cu(OH)2@CF 和GE-CuMOF/Cu(OH)2@CF 电极的界面性质(图6)。Nyquist 图起点到阻抗图形横轴的第一个交点对应于由电极以及溶液自身引起的欧姆阻抗(RΩ),第一个半圆为电解质离子穿透电极表面引起的阻抗(RSEI),第二个半圆表示法拉第反应引起的电荷转移电阻(Rct)[28]。如图6 所示,GE-CuMOF/Cu(OH)2@CF 电极的RΩ较小,是因为GE 具有优良的导电性能,使得GE-CuMOF/Cu(OH)2@CF 电极的RΩ下降。CuMOF/Cu(OH)2@CF 和GE-CuMOF/Cu(OH)2@CF 电极的RSEI和Rct相对较小,这是因为CuMOF 的多孔结构为电极反应提供了更大的表面积和更丰富的电活性位点,有利于电解质和被测物在电极表面扩散。EIS 结果进一步解释和验证了GE-CuMOF/Cu(OH)2@CF 电极具有较好的电化学灵敏度。

图6 Cu(OH)2@CF、CuMOF/Cu(OH)2@CF 和GE-CuMOF/Cu(OH)2@CF 的交流阻抗谱(EIS)Fig.6 Electrochemical impedance spectroscopy (EIS) characterization of Cu(OH)2@CF, CuMOF/Cu(OH)2@CF and GE-CuMOF/Cu(OH)2@CF electrodes
2.7 GE用量及测试电位的选择
在0.1 mol/L NaOH 电解液中连续加入30 μmol/L 葡萄糖后,采用计时电流法(Chronoamperometry,CA)测试修饰电极的电流响应曲线,考察了GE 用量和测试电位对葡萄糖检测的影响。由图7A 可知,当GE 用量为3 mg 时,制备的GE-CuMOF/Cu(OH)2@CF 电极对葡萄糖的响应电流最大。这是因为当GE 用量较少时,不能有效提高电极的导电性能;当GE 用量较大时,GE 片之间发生团聚,阻碍电解质扩散,不利于葡萄糖在电极上的电化学反应。因此,在后续实验中制备复合电极的GE 用量为3 mg。

图7 (A)采用不同量GE 制备的GE-CuMOF/Cu(OH)2@CF 电极在0.1 mol/L NaOH 溶液中连续加入30 μmol/L 葡萄糖后的电流响应(GE 用量a:1 mg;b:3 mg;c:5 mg);(B)在不同检测电位下,GE-CuMOF/Cu(OH)2@CF 电极在0.1 mol/L NaOH 溶液中连续加入30 μmol/L 葡萄糖后的电流响应(检测电位a: 0.3 V; b: 0.4 V; c: 0.5 V; d:0.6 V; e: 0.7 V)Fig.7 (A) Current response of GE-CuMOF/Cu(OH)2@CF electrode prepared with different amounts of GE in 0.1 mol/L NaOH solution with successive addition of 30 μmol/L glucose (Amount of GE a: 1 mg; b: 3 mg;c: 5 mg); (B) Current response of GE-CuMOF/Cu(OH)2@CF electrode in 0.1 mol/L NaOH solution with successive addition of 30 μmol/L glucose at different potentials(a:0.3 V;b:0.4 V;c:0.5 V;d:0.6 V;e:0.7 V)
不同检测电位下,在0.1 mol/L NaOH 溶液中连续加入30 μmol/L 葡萄糖后,GE-CuMOF/Cu(OH)2@CF电极的电流响应如图7B 所示。在较低电位下,葡萄糖不能在修饰电极上充分氧化,电流强度较小;当测试电位达到0.5 V 时,葡萄糖催化电流达到最大;当测试电位大于0.5 V 时,电极材料发生自身氧化,引起电极活性降低,葡萄糖在电极上的催化电流下降。
2.8 传感器对葡萄糖的分析性能
在0.1 mol/L NaOH 溶液中连续加入不同浓度葡萄糖,记录GE-CuMOF/Cu(OH)2@CF 电极的CA 曲线,如图8A 所示,修饰电极的电流响应随着葡萄糖浓度增加而增大。GE-CuMOF/Cu(OH)2@CF 电极的电流响应与葡萄糖浓度在两段浓度范围内呈线性关系,电流响应(I/mA)-葡萄糖浓度(C/mmol/L)工作曲线如图8B所示,在0.001~0.597 mmol/L 范围内,线性方程为I=0.468+4.623C(R2=0.995);在0.597~2.847 mmol/L范围内,线性方程为I=2.856+1.401C(R2=0.994),电极的检出限为0.3 μmol/L(S/N=3)。
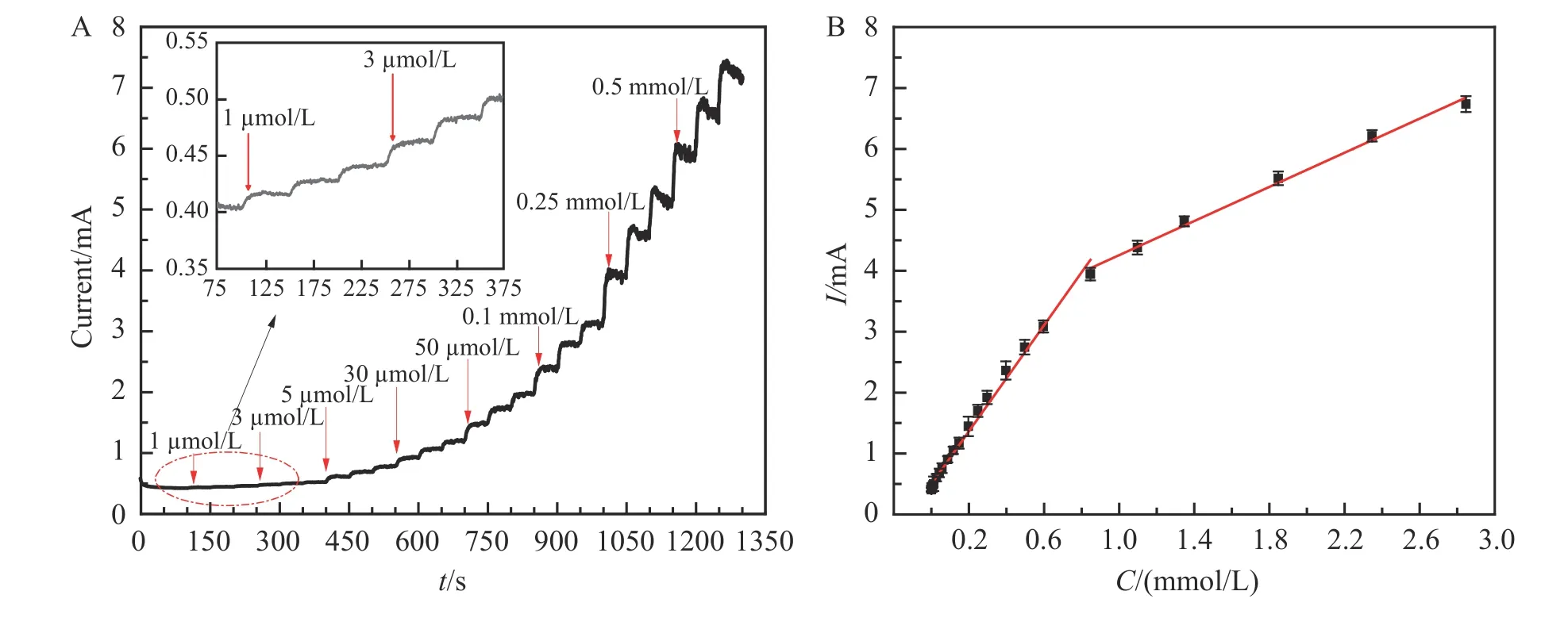
图8 (A) 在0.1 mol/L NaOH 溶液中连续添加不同浓度的葡萄糖时GE-CuMOF/Cu(OH)2@CF 电极的电流响应,插图为在低浓度下(1~12 μmol/L)GE-CuMOF/Cu(OH)2@CF 电极的电流响应;(B)响应电流与葡萄糖浓度线性关系拟合曲线Fig.8 (A) Current response of GE-CuMOF/Cu(OH)2@CF electrode in 0.1 mol/L NaOH solution at 0.5 V after successive addition of glucose; (B) Linear relationship of current response vs. glucose concentration
本方法与其它基于MOFs 材料及其衍生物的葡萄糖电化学传感器性能比较见表1。相比于文献报道的方法,本传感器的检测范围宽,检出限低至0.3 μmol/L, 符合痕量葡萄糖无酶检测要求,具有较好的实际应用前景。

表1 制备的电极与文献报道的基于MOFs电极的性能对比Table 1 Comparison of electrochemical performances of this electrode with other MOFs-based electrodes in references
2.9 GE-CuMOF/Cu(OH)2@CF电极的抗干扰能力和稳定性
考察了GE-CuMOF/Cu(OH)2@CF 电极检测葡萄糖时的抗干扰能力。测试了传感器对50 μmol/L 的葡萄糖、果糖、核糖、半乳糖、半胱氨酸、抗坏血酸、多巴胺和尿酸的电流响应-时间曲线(图9A),GE-CuMOF/Cu(OH)2@CF 电极在加入葡萄糖时,曲线有较大的阶跃,而加入等浓度的干扰物质后,曲线并未出现明显的电流阶跃,再次加入葡萄糖后,GE-CuMOF/Cu(OH)2@CF 电极又出现了明显的电流阶跃,可见电极对干扰物质响应较小,具有良好的选择性和抗干扰能力。为了考察传感器的储存稳定性,将电极在常温干燥条件下保存,采用同一电极在30 d 内重复测试50 μmol/L 葡萄糖的电流响应,每3 d 进行一次测试,结果如图8B 所示。30 d 后,电极的电流响应为初始响应的85.6%,表明此传感器具有良好的存储稳定性。采用相同方法平行制备8 支电极,测定50 μmol/L 葡萄糖溶液的电流响应的相对标准偏差为4.37% (n= 8),表明所制备的葡萄糖传感器具有良好的重现性。

图9 (A) GE-CuMOF/Cu(OH)2@CF 电极对50 μmol/L 葡萄糖、果糖、核糖、半乳糖、半胱氨酸、抗坏血酸、多巴胺和尿酸的电流响应(0.5 V); ( B) GE-CuMOF/Cu(OH)2@CF 电极的储存稳定性Fig.9 (A)Current-time responses to glucose,fructose,galactose,ribose,cysteine,ascorbic acid,dopamine,and uric acid (50 μmol/L) at 0.5 V; (B) Storage stability of GE-CuMOF/Cu(OH)2@CF electrode
2.10 实际样品检测
为了考察GE-CuMOF/Cu(OH)2@CF 电极的实际应用能力,采用所构建的电极按照1.2.4 节的方法对人血清样品中的葡萄糖进行检测,进行加标回收率实验,结果如表2 所示,此传感器检测葡萄糖的加标回收率在97.3%~104.5%之间。同时,采用市售医用血糖仪对所测样品(未稀释)进行对比测定,发现两种方法的测定结果基本一致,表明所构建的传感器可用于实际血样中葡萄糖的分析检测。

表2 血清中葡萄糖的检测结果Table 2 Detection results of glucose in serum samples
3 结论
采用原位生长的方法成功制备了GE-CuMOF/Cu(OH)2@CF 复合电极,并用于血清中葡萄糖的检测。首先在CF 基底上原位生长Cu(OH)2纳米棒阵列,再通过水热法以Cu(OH)2纳米棒为核,将CuMOF颗粒均匀包覆于Cu(OH)2纳米棒表面,然后掺杂GE 纳米片后,制得GE-CuMOF/Cu(OH)2@CF 复合电极。此复合电极对葡萄糖的电化学氧化具有良好的电催化性能,采用CA 法测定葡萄糖的线性范围为0.001~0.597 mmol/L 和0.597~2.847 mmol/L, 检出限为0.3 μmol/L。此传感器的抗干扰能力强且稳定性好,可用于人血清中葡萄糖检测,加标回收率在97.3%~104.5%之间,检测结果与医用血糖仪测定结果基本一致,具有较好的应用前景。

