猪流行性腹泻病毒RAA-CRISPR/Cas13a检测方法的建立与初步应用
刘 华,殷冬冬,邵 颖,宋祥军,王振宇,潘孝成,涂 健,何长生,朱良强*,祁克宗*
(1.安徽农业大学,合肥 230036;2.安徽省动物疫病预防与控制中心,合肥 230091;3.安徽省农业科学院畜牧兽医研究所,合肥 230031)
猪流行性腹泻(porcine epidemic diarrhea, PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的接触性传染病[1]。PED于1971年首次在英国报道,随后在整个欧洲流行[2]。2010年前,PED在我国区域性流行,但在2010年10月以后,PED在我国南方开始大规模流行,并很快在全国各地流行,严重损害了我国的养猪业健康发展[3-4]。
PEDV属于冠状病毒属成员,为单链正义RNA,基因组全长约为28 kb,包含5′、3′端非编码区、ORF1a、ORF1b、ORF2、ORF3、ORF4、ORF5、ORF6等非结构蛋白及 S、M、E和N等结构蛋白[5]。其中,N基因在不同的PEDV毒株之间高度保守,可以作为PEDV感染诊断的靶标[4]。
目前,通常采用病毒分离、定量实时PCR、环介导等温扩增和ELISA等方法来检测猪是否感染PEDV[6-7],但这些方法操作相对复杂,工作量较大。因此,需要一种新的技术方案来解决上述问题。研究发现,CRISPR/Cas13a在特异性crRNA的引导下切割目标RNA后,其“附属切割”活性被激活,可高效切割体系中非特异单链RNA[8-9]。基于这一原理,通过设计两端标记荧光基团的RNA探针,可使CRISPR/Cas13对RNA模板的检测和信号放大,实现对目标分子的特异性检测。重组酶辅助扩增 (recombinase aided amplification, RAA) 技术是一种恒温快速扩增核酸的技术。该技术在37~42 ℃ 等温条件下可短时间内对模板进行指数级扩增,但常规RAA需要琼脂糖凝胶电泳,结果判读复杂[10]。基于CRISPR/cas13a技术的检测方法已被应用于检测猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)、禽流感病毒(avian influenza virus, AIV)、埃博拉病毒(Ebola virus, EBOV)及登革热病毒(dengu evirus, DENV)等病毒[11-13]。因此,本研究将 CRISPR/Cas13a与RAA 技术相结合,针对 PEDVN基因设计特异性引物和探针,建立操作简单,特异性强,灵敏度高的PEDV检测方法,以期为PED的防控提供技术支持。
1 材料与方法
1.1 毒株与临床样本
猪圆环病毒1型(porcine circovirus type 1, PCV1)、猪圆环病毒2型(porcine circovirus type 2, PCV2)、猪圆环病毒3型(porcine circovirus type 3, PCV3)、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)、猪瘟病毒(classical swine fever virus, CSFV)及伪狂犬病病毒(pseudorabies virus,PRV)等阳性病料均由作者所在实验室保存。40 份腹泻哺乳仔猪肠道和肛门拭子样品由第三方检测机构收集并提供。
1.2 主要试剂
病毒基因组DNA/RNA提取试剂盒购自天根生化科技(北京)有限公司;LwCas13a和RAA检测试剂盒购自安徽微分基因科技有限公司;HiScribe T7 Quick High Yield RNA合成试剂盒、T7 RNA聚合酶及RNase酶抑制剂购自NEB公司;NucawayTM离心柱购自Invitrogen公司;RNAXP 磁珠购自南京诺唯赞生物科技股份有限公司。
1.3 引物设计与合成
N基因长度为1 326 bp,其在不同的PEDV毒株之间高度保守,根据GenBank公布的PEDV毒株N基因序列(登录号:KU646831、JN173276、MK584552、KM089829、MZ364314、JX647847、ON571549、MN759311、ON649885、MH726391),参照RAA引物设计原则,设计N基因特异性RAA引物见表1(单下划线为T7启动子序列)。此外,根据Cas13a蛋白crRNA识别靶序列的特性,在PEDV的N基因序列上设计3对特异性的crRNA探针(PEDV-crRNA1-3),引物序列如表1所示(双下划线为茎环结构序列)。引物由生工生物工程(上海)股份有限公司合成。

表1 PEDV crRNA引物序列Table 1 PEDV crRNA primer sequences
1.4 质粒标准品和crRNA 的制备
根据GenBank公布的PEDV AH2012/12株(登录号:KU646831),由生工生物工程(上海)股份有限公司将N基因合成,并连接至载体pUC57,重组质粒分别命名为pUC-N,测序正确的重组质粒即为质粒标准品。将“1.3”中合成的两条PEDV-crRNA1-3的上、下游引物退火形成双链(终浓度为10 μmol·L-1),随后利用HiScribe T7 Quick High Yield RNA 合成试剂盒进行体外转录,转录产物利用RNAXP 磁珠进行纯化,-80 ℃保存备用。
1.5 RAA扩增
参照RAA核酸检测试剂盒说明书配制反应体系(50 μL):25 μL预混液,3 μL MgOAc,RAA上、下游引物(10 μmol·L-1)各2 μL,1 μL待检样本cDNA或DNA,用RNase free H2O补至50 μL,将反应体系震荡离心,37 ℃孵育30 min,制备RAA产物。
1.6 CRISPR/Cas13a检测
利用LwCas13a核酸酶(45 nmol·L-1),crRNA探针(22.5 nmol·L-1),FT-RNA报告分子(125 nmol·L-1),RNase inhibitor(0.25 μL),dNTPs(1 mmol·L-1)和T7聚合酶(0.4 μL),检测缓冲液补充至9 μL,RAA扩增产物1 μL,在QuantStudioTM 6 Flex实时荧光定量PCR 37 ℃反应 40 min,每间隔5 min收集荧光信号。
1.7 crRNA的筛选
以pUC-N为模板,采用“1.5”和“1.6”中的检测方法,分别对3组crRNA进行筛选,通过扩增曲线的荧光值及起峰时间,选择最佳检测PEDV 的crRNA探针。
1.8 灵敏度试验
将pUC-N标准质粒稀释为1.0×108~ 1.0×100copies·μL-1等 9个浓度。用已建立的RAA-Cas13a检测方法,以稀释后的各浓度阳性质粒为模板,通过扩增曲线确定该方法的灵敏度,同时设置RNase free H2O作为阴性对照,每组进行3次重复。
1.9 特异性试验
选取PCV1、PCV2、PCV3、PRRSV、CSFV和PRV等病毒作为特异性检测对象,参照病毒基因组DNA/RNA提取试剂盒说明书对上述病毒进行核酸提取。用已建立的RAA-Cas13a方法进行检测,同时设置阴性对照,分析该检测方法的特异性。
1.10 临床样本检测
对40份临床腹泻哺乳仔猪肠道和肛门拭子样本进行检测,采用本研究建立的RAA-Cas13a检测方法和RT-qPCR检测方法[14]进行PEDV检测,并使用SPSS软件进行Kappa一致性检验,以评估该方法的临床实用性。
2 结 果
2.1 crRNA的筛选
将合成的N基因进行PCR验证,结果显示,在目标大小处有特异性条带,经测序证实为PEDV N基因(图1)。此外,由图2A可知,RAA引物扩增产物检测峰图在222 bp处有单峰,表明引物特异性良好。通过建立的RAA-Cas13a方法比较和筛选已制备的3组PEDV-crRNA,结果如图2B所示crRNA-2与其他2组相比,荧光值最高且起峰时间最短。因此,选择PEDV-crRNA-2用于后续试验。
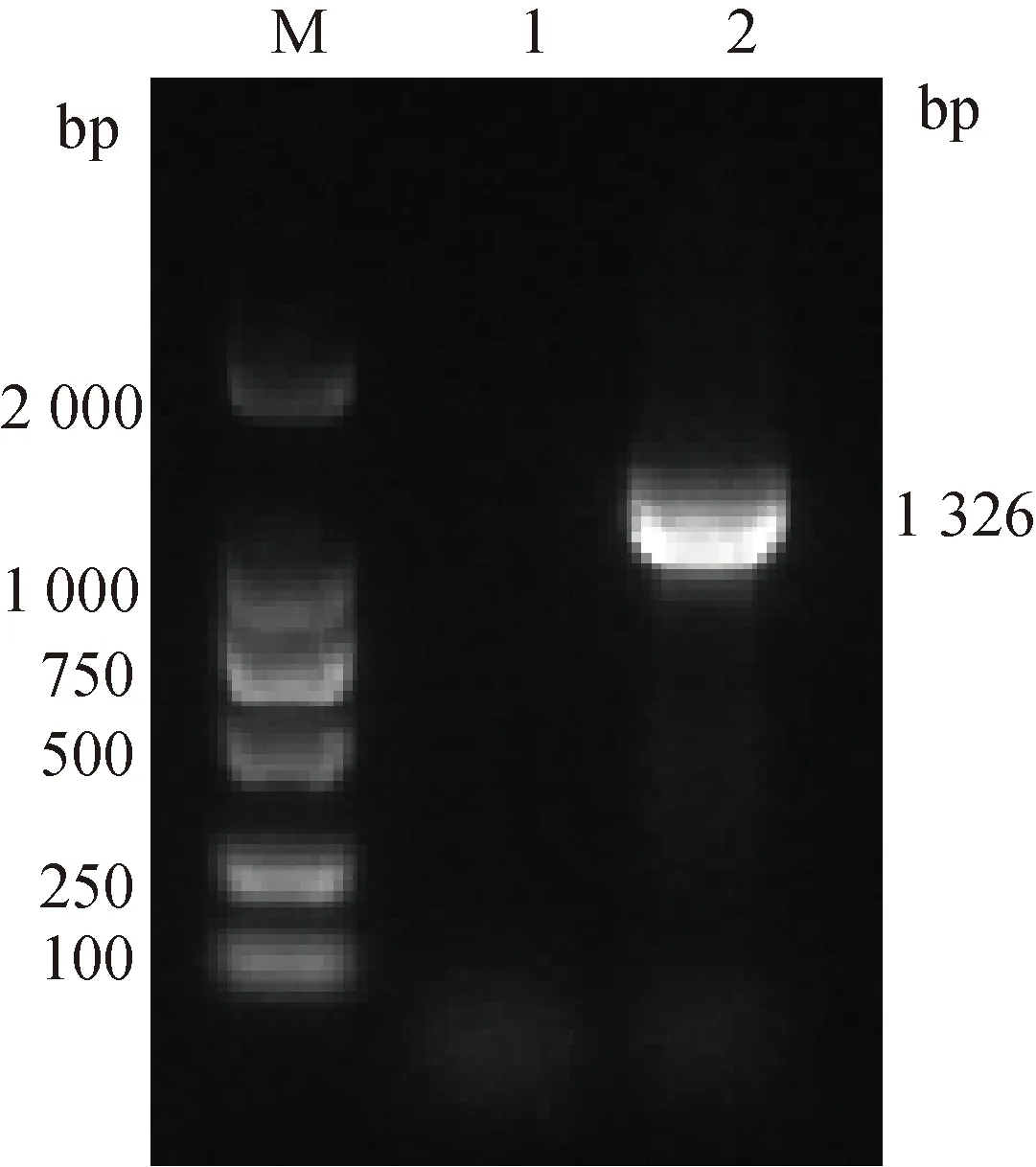
图1 pUC-N质粒PCR扩增结果Fig.1 The results of PCR amplification of pUC-N plasmid

A. RAA引物扩增产物检测峰图;B. crRNA筛选结果A. RAA primer amplification product detection peak; B. The screening result of crRNA图2 RAA引物验证及crRNA筛选Fig.2 The results of validation of RAA primers and crRNA screening
2.2 PEDV RAA-Cas13a 检测方法的灵敏度评价
以9个梯度稀释(1.0×108~ 1.0×100copies·μL-1)的标准质粒及RNase free H2O作为模板进行RAA-Cas13a方法的灵敏度评价。结果如图3所示,在反应5 min时即可检测到1.0×101copies·μL-1的信号,表明本研究建立的RAA-Cas13a 检测方法的检测限为101copies·μL-1。

图3 RAA-Cas13a 灵敏度试验结果Fig.3 Sensitivity detection results of RAA-Cas13a
2.3 PEDV RAA-Cas13a 检测方法的特异性评价
RAA-Cas13a 的分析特异性试验检测结果如图4所示,仅PEDV出现扩增曲线,PCV1、PCV2、PCV3、PRRSV、CSFV、PRV及阴性对照均无检测信号,表明本研究建立的方法能特异性扩增检测出PEDV,而不与其他病毒核酸发生交叉反应,说明本检测方法特异性强。
2.4 临床样本检测效果评价
RAA-Cas13a分别应用本试验建立的RAA-Cas13a方法和RT-qPCR方法,对临床上采集的40份样品进行检测。结果显示,RAA-Cas13a的阳性率为72.5%(29/40),RT-qPCR方法的阳性率为67.5%(27/40),阳性符合率为100%,阴性符合率为84.6%(表2),总一致性为95%,Kappa=0.881(Kappa≥0.75,表示可重复性极好)。

表2 RAA-Cas13a 和 RT-qPCR 方法对临床样本中的 PEDV检测结果Table 2 Detection results of clinical samples in RAA-Cas13a and RT-qPCR assays
3 讨 论
PED是一种高度传染性的传染病,可引起哺乳仔猪的腹泻、呕吐和脱水等临床症状,有高致死率,给我国养猪业带来严重的经济损失[3,15-16]。目前,PEDV的疫苗保护效果较差,甚至注射过疫苗都能感染。因此,建立高效、灵敏且特异性强的PEDV检测方法,对PEDV的流行病学调查和早期诊断具有重要意义。PEDV的实验室检测方法很多,但大多数检测方法需要专业操作或特殊设备,需要在专业实验室进行。CRISPR/Cas13a系统可以特异性切割目标RNA,且具有非特异性附带切割活性,基于该原理可在反应体系中加入非特异RNA报告探针,实现对靶基因的特异检测,这为CRISPR/Cas13a系统在核酸检测领域的应用提供了新思路[8,17]。此外,RAA技术引物设计简单,扩增效率高,因此,本研究将RAA技术与CRISPR/Cas13a系统结合,实现了两种技术优势互补,提高检测系统性,增强特异性。
本研究建立的RAA-Cas13a检测方法的检测限达到101copies·μL-1。Wang等[18]建立的实时荧光定量PCR方法仅能检测出300 copies·μL-1的标准质粒;Liu等[6]开发的基于ORF3基因建立的TaqMan探针的荧光定量PCR的检测限为37 copies·μL-1;翟刚等[19]基于M基因建立的TaqMan检测方法最低检测下限为1.09×101copies·μL-1;冉伟等[20]建立SYBR Green Ⅰ荧光定量PCR方法,最低可检测102copies·μL-1的质粒。本研究建立的RAA-Cas13a检测法比上述方法的灵敏度更高。同时,该方法与其他6种猪源病原核酸没有交叉反应,表明建立的方法对 PEDV 具有强特异性。为了评估该技术在临床应用中的可靠性,计算了RAA-Cas13a检测与RT-qPCR的符合率,结果显示,40份疑似样品中,用RAA-Cas13a方法检测出29份阳性,RT-qPCR法检测出27份阳性,这27份阳性样品在RAA-Cas13a中的检测结果均为阳性,说明建立的RAA-Cas13a检测方法比RT-qPCR灵敏度更高。此外,RAA反应和CRSIRR/Cas13a检测均在37 ℃下进行,全部反应都可在一台便携的恒温荧光检测仪中完成,对硬件要求不高。
综上所述,本研究建立的PEDV RAA-Cas13a检测方法具有特异性强、灵敏度高、对实验室设备要求不高等优势,本研究结果可为PEDV检测提供一种新方法,为今后PED的诊断及流行病学调查提供技术支持。
4 结 论
本研究将RAA技术与CRISPR/Cas13a系统结合,建立了PEDV RAA-Cas13a检测方法,该方法特异性强、灵敏度高、对实验室设备要求不高、操作简单,可为PED的诊断及流行病学调查提供技术支持。

