川藏香茶菜丙素抑制NLRP3 炎症小体活化并缓解小鼠脓毒性休克
曹海若,张 玮,李明远,杨燕青,李玉云
1蚌埠医学院肿瘤基础研究与临床检验诊断重点实验室,安徽 蚌埠 233030;2蚌埠医学院第一附属医院检验科,安徽 蚌埠 233004;3蚌埠医学院慢性疾病免疫学基础与临床安徽省重点实验室,安徽 蚌埠233030
NLRP3炎症小体是一种响应多种细胞应激而组装的多聚蛋白复合物[1],由3种不同的蛋白质组成:NOD样受体蛋白3(NLRP3),含有半胱天冬酶募集结构域的细胞凋亡相关斑点样蛋白(ASC)和半胱天冬酶原-1(Pro-caspase-1)[2],其受危险相关分子模式和病原体相关分子模式的调节。NLRP3炎症小体组装活化后剪切Pro-capase-1并产生有活性的caspase-1,进一步将pro-IL-1β和pro-IL-18剪切为成熟的IL-1β和IL-18,诱导细胞焦亡[3]。正常炎症小体的活化对组织稳态非常重要,但其过度活化与多种炎症、自身免疫病以及退行性和代谢性疾病息息相关,如冷吡啉相关周期性综合征[4]、帕金森病[5]、亨廷顿舞蹈病[6]等。近年来,炎性疾病的发病率在全球范围内逐年增加[7],类固醇、非类固醇抗炎药物和免疫抑制剂等化学合成药物是治疗这些疾病最常用的抗炎药物,虽然这类药物见效快,但它们通常有严重的副作用,价格昂贵[8]。中草药因其副作用小、价格低廉和容易获得的特点,在预防和治疗炎性疾病方面变得越来越重要,因此中草药来源的小分子抑制剂的研究和开发对于炎性疾病预防和治疗体现出其重要意义[9]。有研究表明,NLRP3炎症小体与LPS诱导的脓毒性休克有关[10],血浆中IL-1β的水平与休克的严重程度呈正相关。此外,通过基因编辑靶向NLRP3炎症小体可以缓解LPS诱导的急性炎症[11]。考虑到NLRP3炎症小体在脓毒性休克发病机制中的重要作用,找到一种能够应用于临床缓解脓毒性休克的中药来源抑制剂迫在眉睫。
川藏香茶菜丙素(Iso C)是来源于四川西南部的川藏香茶菜中的主要活性成分。根据《中华本草》记载,Iso C具有良好的抗炎抗菌作用,曾被应用于驱蛔虫,祛翳等方面。Iso C具有显著抗肿瘤活性,通过显著上调E-钙粘蛋白的表达、抑制非小细胞肺癌细胞生长、干预非小细胞肺癌侵袭和迁移以及显著延长患有非小细胞癌裸鼠的寿命以发挥其抗肿瘤作用[12];胚胎转录因子Slug的高表达已被证明与多种恶性肿瘤密切相关[13],有研究证明Iso C能下调A549、H1299和H1975等细胞中Slug的表达,发挥其抗肿瘤作用[12];体外高效抑制K562细胞的增殖活性,半数最大抑制浓度(IC50)为4.33 μg/mL[14]。此外,Iso C还具有抗菌性,特别针对革兰阳性细菌变形链球菌、金黄色葡萄球菌和枯草芽孢杆菌等[15]。以上研究表明,Iso C在抗肿瘤,抗菌中有良好表现,但其抗炎作用鲜有报道。鉴于炎症在肿瘤发生发展以及细菌感染中具有重要作用,且炎症与NLRP3炎症小体密切相关,因此探讨Iso C对NLRP3炎症小体活化的影响具有重要意义。本实验拟通过体外细胞学实验和体内构建动物模型实验探究Iso C对于NLRP3炎症小体活化是否有影响,以及对NLRP3炎症小体相关炎性疾病的作用,以期为临床治疗NLRP3炎症小体相关疾病提供新的思路与策略。
1 材料和方法
1.1 实验动物及细胞
C57BL/6J小鼠购买于江苏集萃药康生物科技股份有限公司,饲养于无特定病原体(SPF)环境。人THP-1细胞系,受赠于蚌埠医学院钱中清教授课题组。本研究所有动物实验操作及规程均经蚌埠医学院伦理认证,并按照蚌埠医学院中国动物保护利用委员会发布的指导方针进行,本研究经蚌埠医学院伦理委员会审核批准(批准号为伦动科批字[2020]第057号)。
1.2 试剂
Isodopharicin C(上海陶术生化);RPMI 1640培养基、高糖DMEM 培养基、OPTI-MEM 培养基、胎牛血清(FBS)(Gibco);尼日利亚菌素(Nigericin)(MCE);三磷酸腺苷(ATP)、尿酸盐结晶(MSU)、poly A:T(Sigma);巨噬细胞集落刺激因子(M-CSF)(Novoprotein);LPS、三酰脂肽(Pam3CSK4)、lipo2000(Invivogen);ELISA试剂盒(Mouse IL-1β、IL-6、TNF-α,Human IL-1β、TNF-α ELISA kit)(R&D);anti-mouse caspase-1(AdipoGen);anti-human caspase-1(Cell Signaling Technology);anti-β-actin(Proteintech)。
1.3 细胞培养
鼠骨髓来源巨噬细胞(BMDM)的培养:选取7~8周龄雄性小鼠,颈脱臼处死后,取股骨及胫骨中的巨噬细胞,随后加入含有M-CSF的DMEM完全培养基分化细胞,分化4~6 d后根据细胞生长状态使用。人THP-1细胞的培养:复苏细胞,选取生长状态良好的细胞,在THP-1细胞中加入含有佛波酯(PMA)的RPMI 1640完全培养基刺激过夜,待细胞贴壁分化成梭形后使用。
1.4 细胞刺激
在细胞分化密度及生长状态良好的情况下,将细胞分至细胞培养板中培养过夜。LPS(500 ng/mL)或者Pam3CSK4(200 ng/mL)预刺激细胞3 h,加入0.5、1、2 μmol/L剂量梯度的Iso C培养30 min。随后分别加入多种激动剂活化经典NLRP3 炎症小体:Nigericin(3 μmol/L)刺激30 min;ATP(2.5 mmol/L)刺激30 min;MSU(150 μg/mL)刺激3 h。利用lipo2000(1 μL)转染poly A:T(0.5 μg/mL)刺激3 h活化AIM2炎症小体。利用lipo2000(1 μL)转染LPS(1.5 μg/mL)刺激16 h活化非经典NLRP3炎症小体。
1.5 蛋白免疫印迹实验(Western blot)
收集细胞上清及细胞裂解液中的蛋白,加入1.5×sample buffer 后金属浴10 min。根据蛋白分子大小选择不同浓度的聚丙烯酰胺凝胶进行电泳,将蛋白转移到PVDF膜上。与一抗抗体(1∶1000)在4 ℃条件下摇床孵育过夜,PBST洗膜3次后与相应的第二抗体继续孵育后用凝胶成像系统对膜上的蛋白质条带进行可视化,并使用ImageJ软件对蛋白质条带进行定量。
1.6 酶联免疫吸附实验(ELISA)
根据试剂盒说明书检测鼠和人细胞培养上清中IL-1β、IL-6和TNF-α分泌水平,检测小鼠血清及腹腔灌洗液中IL-1β、IL-6和TNF-α表达水平。
1.7 细胞内钾离子检测
待BMDM 细胞分化完毕后,将其接种到6 孔板中,使用Nigericin 按常规方法刺激细胞,随后加入浓硝酸裂解细胞,将浓硝酸溶液转移到烧杯中,利用金属加热器加热至200 ℃,烧杯中出现浅黄色粉末。加入双蒸水不断冲刷,直到浅黄色粉末完全溶解,随后利用电感耦合等离子体发射光谱仪测定溶液中钾离子的含量。
1.8 构建脓毒性休克模型
挑选SPF级体质量相近的C57BL/6J小鼠(周龄8周,雄性)随机分为3组,每组6只:第1组为空白对照组(Control组)。第2组为脓毒性休克组(LPS组),腹腔注射与第3组Iso C溶液等体积无菌PBS,50 min后腹腔注射20 mg/kg LPS。第3 组为Iso C 治疗组(LPS+Iso C组),每只小鼠腹腔注射10 mg/kg Iso C,50 min 后腹腔注射20 mg/kg LPS。用以下两种方式获得数据:(1)注射LPS 4 h后摘小鼠眼球取血,随后牺牲小鼠,静置离心后获得上层血清。用无菌PBS灌洗小鼠腹腔,获得腹腔灌洗液。检测血清和腹腔灌洗液中促炎细胞因子的分泌水平;(2)注射LPS后观察小鼠48 h内生存时间,绘制小鼠生存曲线。
1.9 统计学分析
使用Graphpad 软件进行显著性分析,符合正态分布的统计数据间采用均数±标准差进行统计学描述,两组间比较采用独立样本t检验,多组比较采用方差分析,用Log-rank法进行生存曲线比较。P<0.05时表明差异有统计学意义。
2 结果
2.1 Iso C抑制Nigericin诱导的经典NLRP3炎症小体活化
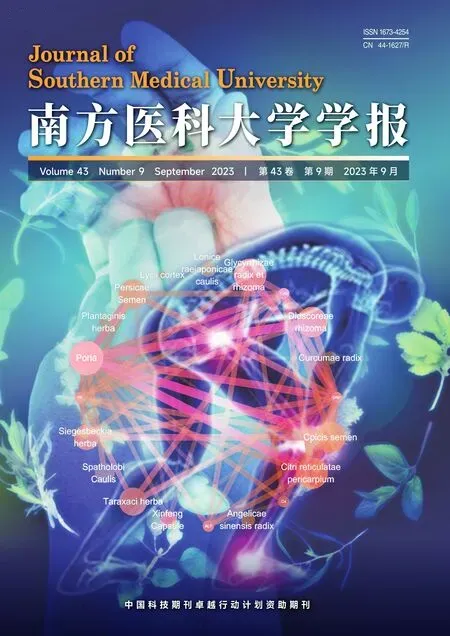
Western blot 检测结果显示,在鼠BMDM 中,随着Iso C 浓度逐渐升高,对p20 表达的抑制程度逐渐增加,当Iso C 浓度达到2 μmol/L 时,可显著抑制p20的表达(0.19±0.06vs1.21±0.003,P<0.01,图1A),对Pro-caspase-1的表达无显著抑制作用(P>0.05,图1A)。ELISA 检测结果显示,随着Iso C 浓度逐渐升高,对IL-1β分泌水平的抑制程度逐渐增加,当Iso C浓度达到2 μmol/L 时,显著抑制IL-1β分泌(316.52±58.95vs2022.20±37.73,P<0.001,图1B),但对非炎症小体相关细胞因子TNF-α、IL-6的分泌无显著抑制作用(P>0.05,图1C、D)。评估人THP-1细胞中NLRP3炎症小体活化后的产物表达水平,Western blot检测结果显示,随着Iso C浓度逐渐升高,对p20的表达抑制程度逐渐增加,当Iso C浓度达到5 μmol/L时,可显著抑制p20的表达(0.05±0.02vs0.79±0.01,P<0.001,图1E),对Pro-caspase-1的表达无显著抑制作用(P>0.05,图1E)。ELISA 检测结果显示,随着Iso C 浓度逐渐升高,对IL-1β分泌水平的抑制程度逐渐增加,当Iso C 浓度达到5 μmol/L时,显著抑制IL-1β分泌(279.10±7.37vs1296.57±91.36,P<0.001,图1F),但对非炎症小体相关细胞因子TNF-α的分泌无显著抑制作用(P>0.05,图1G)。
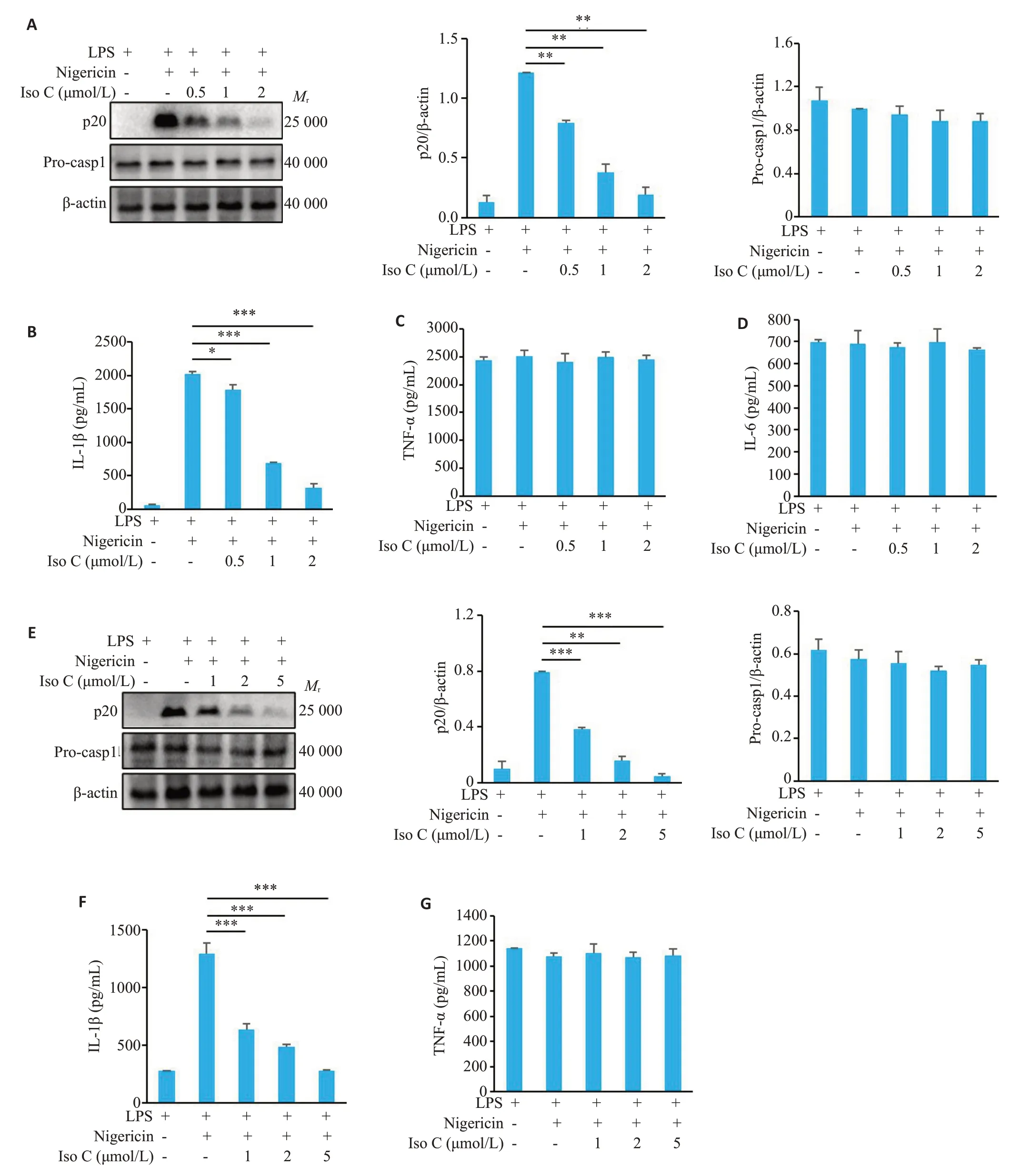
图1 Iso C抑制Nigericin诱导的NLRP3炎症小体活化Fig.1 Isodopharicin C (Iso C) inhibits nigericin-induced NLRP3 inflammasome activation in BMDM and human THP-1 cells.A,E:Western blotting of cleaved caspase-1(p20)in culture supernatants(SN)and pro-caspase-1(Pro-casp1)in lysates of BMDM (A) and THP-1 cells (E).B-D: ELISA of IL-1β (B),TNF-α (C) and IL-6 (D) in BMDM culture supernatants.F,G:ELISA of IL-1β(F)and TNF-α(G)in THP-1 cell culture supernatants.*P<0.05,**P<0.01,***P<0.001
2.2 Iso C抑制多种激动剂诱导的NLRP3炎症小体活化
Western blot检测结果显示,随着Iso C浓度逐渐升高,对p20表达的抑制程度逐渐增加,当Iso C浓度达到2 μmol/L时,显著抑制MSU诱导的p20的表达(0.12±0.07vs1.32±0.07,P<0.01,图2A)以及ATP诱导的p20的表达(0.31±0.07vs2.05±0.08,P<0.001,图2B),但对Pro-caspase-1的表达无显著抑制作用(P>0.05,图2A、B)。ELISA检测结果显示,随着Iso C浓度逐渐升高,对IL-1β分泌水平的抑制程度逐渐增加,当Iso C浓度达到2 μmol/L 时,显著抑制MSU 诱导的IL-1β分泌(408.27±67.84vs1244.68±57.18,P<0.001,图2C)以及ATP 诱导的IL-1β分泌(645.29±116.22vs2723.70±192.11,P<0.001,图2D)。
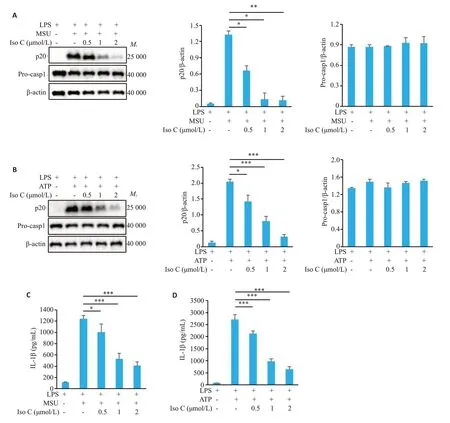
图2 Iso C抑制MSU和ATP诱导的NLRP3炎症小体活化Fig.2 Iso C inhibits MSU-and ATP-induced activation of NLRP3 inflammasomes in BMDM.A,B:Western blotting of p20 in the supernatants(SN)and Pro-casp1 in the lysates of BMDM.C,D:ELISA of mature IL-1β in the culture supernatant of BMDM.*P<0.05,**P<0.01,***P<0.001.
2.3 Iso C抑制非经典NLRP3炎症小体活化
Western blot检测结果显示,随着Iso C浓度逐渐升高,对p20表达的抑制程度逐渐增加,当Iso C浓度达到2 μmol/L时,显著抑制胞内转染LPS诱导的p20的表达(0.20±0.05vs1.62±0.06,P<0.01,图3A、B),但对Procaspase-1的表达无显著影响(P>0.05,图3A、C)。ELISA检测结果显示,随着Iso C浓度逐渐升高,对IL-1β分泌水平的抑制程度逐渐增加,当Iso C浓度达到2 μmol/L时,显著抑制胞内转染LPS 诱导的IL-1β 的分泌(260.78±20.46vs3378.99±49.70,P<0.001,图3D)。
图3 Iso C抑制非经典NLRP3炎症小体活化Fig.3 Iso C inhibits non-canonical NLRP3 inflammasome activation in BMDM.A:Western blotting of p20 in the culture supernatants (SN) and Pro-casp1 in BMDM lysates.B,C:Relative quantitative analysis of the expressions of p20(B)and Pro-casp1(C)in BMDM.D:ELISA of mature IL-1β in the culture supernatant of BMDM.*P<0.05,**P<0.01,***P<0.001.
2.4 Iso C对AIM2炎症小体活化无抑制作用
Western bot 结果显示,与Iso C 抑制Nigericin 诱导的NLRP3炎症小体活化相比,Iso C对poly A:T诱导AIM2 炎症小体活化产生的p20 无显著抑制作用(P>0.05,图4A、B),并对Pro-caspase-1的表达无显著抑制作用(P>0.05,图4A、C)。ELISA检测结果显示,与Iso C抑制Nigericin诱导的IL-1β分泌相比,Iso C对poly A:T诱导的IL-1β分泌无显著影响(P>0.05,图4D)。
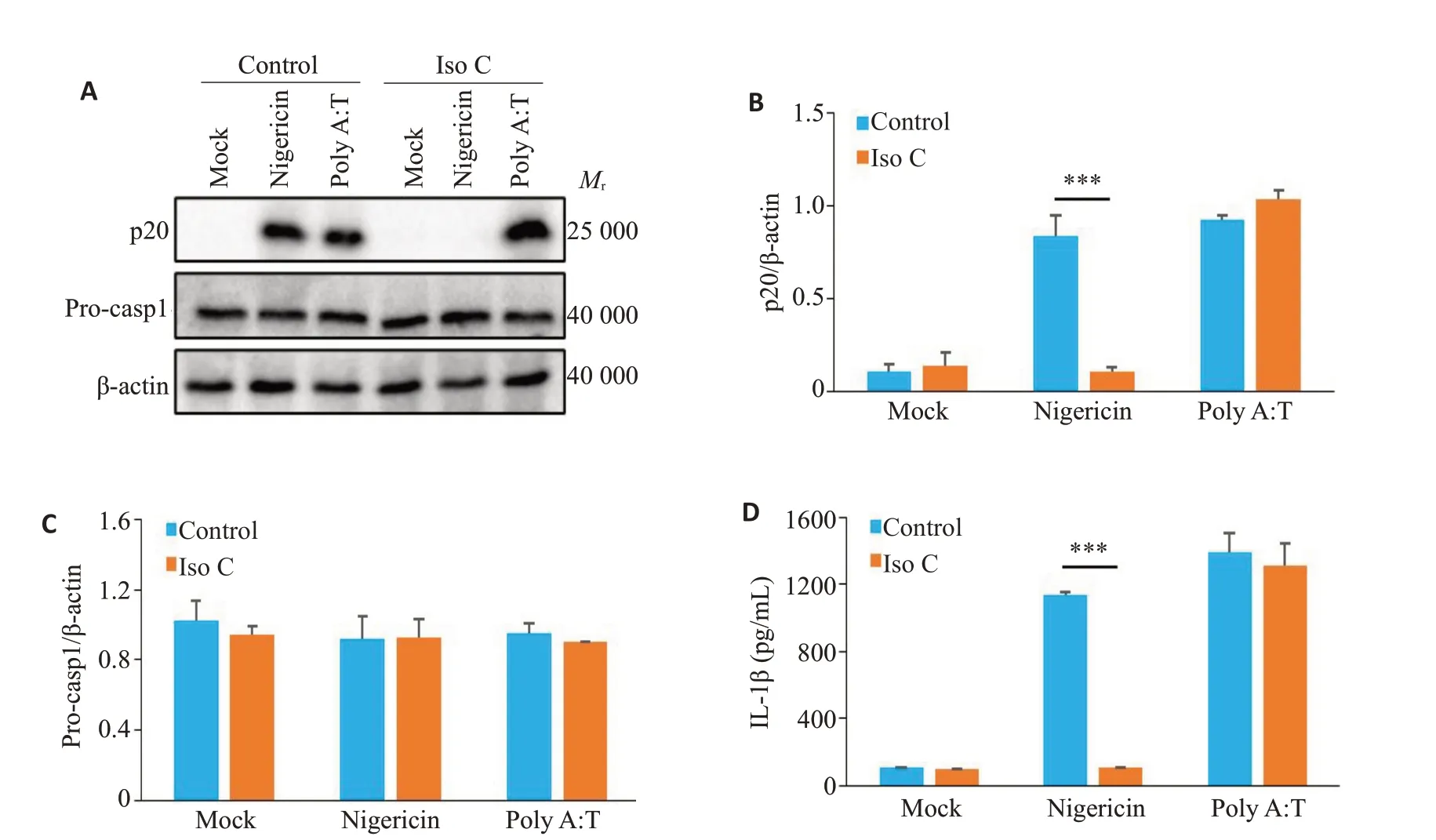
图4 Iso C对AIM2炎症小体活化无影响Fig.4 Iso C has no effect on AIM2 inflammasome activation.A: Western blotting of p20 in culture supernatants (SN) and Pro-casp1 in lysates of BMDM.B,C: Relative quantitative analysis of the expressions of p20 (B) and Pro-casp1 (C) in BMDM.D: ELISA of mature IL-1β in the culture supernatant of BMDM.***P<0.001.
2.5 Iso C不影响NLRP3炎症小体活化过程中的钾离子外流
Nigericin能促进细胞内钾离子外流进而介导下游NLRP3炎症小体活化,电感耦合等离子体发射光谱仪检测结果显示,Iso C对于Nigericin引起的胞内钾离子外流没有显著影响(P>0.05,图5)。
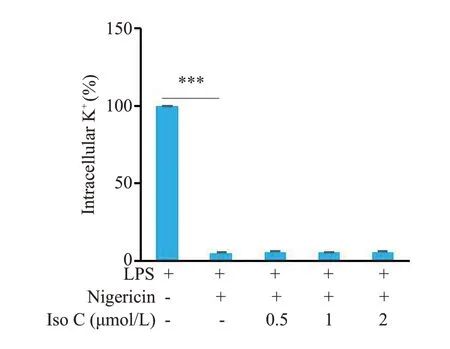
图5 Iso C 不影响NLRP3 炎症小体活化过程中的钾离子外流Fig.5 Iso C has no effect on potassium efflux during NLRP3 inflammasome activation.Intracellular K+was detected using by inductively coupled plasma-optical emission spectrometry(ICP-OES).***P<0.001.
2.6 Iso C对于小鼠脓毒性休克的影响
ELISA检测结果显示,与脓毒性休克组相比,Iso C治疗组小鼠腹腔灌洗液与血清中IL-1β分泌水平显著降低(133.97±17.39vs239.63±29.39,387.65±24.54vs573.99±106.93,P<0.05,图6A、D),但对于非炎症小体相关细胞因子TNF-α、IL-6的分泌无显著影响(P>0.05,图6B、C、E、F)。观察小鼠注射LPS后48 h内生存状态,生存曲线结果显示脓毒性休克组小鼠16 h开始死亡,20 h小鼠死亡率达到100%。而Iso C治疗组21 h开始死亡(P<0.05,图6G)。
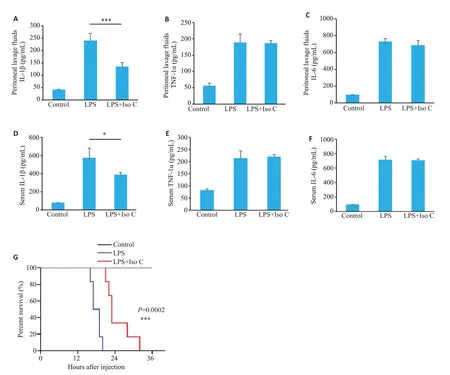
图6 Iso C缓解LPS诱导的小鼠脓毒性休克Fig.6 Iso C alleviates LPS-induced septic shock in mice.A-C: Levels of IL-1β(A),TNF-α (B) and IL-6 (C) in the peritoneal lavage fluid from C57BL/6J mice in Control,LPS-treated and LPS plus Iso C-treated mice detected by ELISA.D-F: Serum levels of IL-1β (D),TNF-α (E) and IL-6 (F) in the mice detected with ELISA.G: Survive curve of the mice within 48 h after LPS injection.*P<0.05,***P<0.001 vs LPS group.
3 讨论
NLRP3炎症小体由NLRP3蛋白、Pro-caspase-1和ASC组成[16],其中NLRP3是一种胞内模式识别受体,在感知外界病原体感染或组织损伤后能产生抵抗机体受到伤害性刺激的保护性反应[17]。NLRP3炎症小体的正常活化对组织稳态非常重要,但其异常活化过程中会产生大量促炎细胞因子如IL-1β和IL-18,引起组织损伤并导致多种炎性疾病如炎性肠病[18]、矽肺病[19]、石棉肺[20]和脓毒性休克[21]等。这提示我们,抑制NLRP3炎症小体活化可以成为治疗相关疾病的新思路。根据《中华本草》记载,Iso C 具有良好的抗炎抗菌作用,但其作用机制是否与NLRP3炎症小体相关尚不清楚。本实验通过体内和体外实验,探究Iso C在NLRP3炎症小体过度活化过程中的作用,并对其机制做出初步探讨。
Nigericin作为炎症小体经典激活剂之一,是一种源自吸湿性链霉菌的抗生素,利用Nigericin激活NLRP3炎症小体,结果显示,Iso C除了可以抑制鼠BMDM细胞中经典NLRP3炎症小体活化,还可以在人THP-1细胞中抑制经典NLRP3炎症小体活化,表明Iso C在鼠和人细胞中都具有抑制炎症小体活化的作用。同样是中草药来源的豆蔻素(Cardamonin)抑制Nigericin诱导的NLRP3炎症小体活化的浓度约为10 μmol/L[22]、刺甘草查尔酮(Echinatin)抑制Nigericin诱导的NLRP3炎症小体活化的浓度约为40 μmol/L[23],与二者相比Iso C 的作用浓度仅为2 μmol/L,表现出更好抑制NLRP3炎症小体活化的作用。曲尼司特是一种通过抑制NLRP3炎症小体活化而起到抗炎作用的临床的一线药物,其体外实验抑制NLRP3炎症小体活化所需剂量为100 μmol/L,Iso C表现出更低的剂量优势。NLRP3炎症小体可被多种病原菌和细胞内DAMPs激活,其中MSU是最有效的促炎刺激之一,MSU能被免疫系统识别为危险信号,导致NLRP3炎症小体的激活。ATP是一种高能磷酸化合物,在炎症环境中积累于细胞外。ATP 作为一种DAMP,通过激活免疫细胞中的嘌呤能P2X 受体7(P2X7)诱导NLRP3炎症小体活化[24]。实验结果显示,Iso C 可以抑制除Nigericin 以外的两种激动剂MSU、ATP诱导的经典炎症小体活化,证实Iso C抑制NLRP3炎症小体活化具有广谱性。与NLRP3炎症小体经典活化途径中诱导caspase-1的活化不同,NLRP3炎症小体活化还存在一种涉及caspase-11活化的非经典途径[25],其直接响应胞质LPS,以TLR4非依赖性方式响应细胞溶质LPS激活炎症小体[26]。利用胞内转染LPS诱导非经典NLRP3炎症小体活化,证实Iso C可以抑制非经典NLRP3炎症小体活化。为了探究Iso C抑制NLRP3炎症小体活化的作用是否具有特异性,我们选取了研究广泛的AIM2炎症小体。它可以感应dsDNA,介导对入侵病原体(包括细菌、病毒、真菌和寄生虫)的保护反应[27]。实验证实Iso C对poly A:T诱导的AIM2炎症小体的激活并无显著影响,仅特异性的抑制NLRP3 炎症小体活化。
NLRP3炎症小体活化分为两个过程,即启动过程和激活过程[28]。为了探究Iso C抑制NLRP3炎症小体活化的具体机制,首先对Iso C是否抑制启动过程进行验证。结果显示,Iso C对启动过程中的NF-κB信号通路相关细胞因子的分泌无显著影响,这提示Iso C可能影响激活过程。激活过程涉及多种细胞和分子事件,包括钾离子外流、线粒体损伤和活性氧产生等。有研究证明,钾离子外流信号传导参与NLRP3炎症小体的激活[29],饱和脂肪酸可通过促进其外流从而激活NLRP3炎症小体[30],因此钾离子外流被认为是NLRP3炎症小体活化的重要上游信号。胞外ATP和穿孔毒素(如Nigericin)能通过促进胞内钾离子外流而引发NLRP3炎症小体活化[31]。本研究利用电感耦合等离子体发射光谱仪检测细胞内钾离子含量,该实验结果排除了Iso C通过影响钾离子外流抑制NLRP3炎症小体活化,进一步机制探究包括验证Iso C是否通过影响NLRP3炎症小体组装而抑制NLRP3炎症小体活化。
脓毒性休克与NLRP3炎症小体异常活化密切相关,基于小鼠腹腔内注射LPS的模型,是与人类脓毒性休克最相似,也是最早的模型之一[32]。该模型的主要优点在于它们高度标准化,可调整疾病的严重程度,并可应用于研究特定问题的相关性[33],例如血清和腹腔液中促炎细胞因子与NLRP3炎症小体相关的脓毒性休克之间的联系。在该疾病发生过程中伴有全身炎症反应,血清和腹腔液中促炎细胞因子如IL-1β、TNF-α和IL-6分泌水平上升。本实验通过该模型发现经10 mg/kg Iso C治疗后能够显著降低小鼠IL-1β分泌水平,延长小鼠生存时间。与中草药来源的二氢丹参酮I(Dihydrotanshinone I)缓解小鼠脓毒性休克的作用剂量为40 mg/kg[34]相比,Iso C作用剂量更低。Iso C对于NLRP3炎症小体活化启动过程相关的促炎细胞因子TNF-α、IL-6的分泌无显著影响。以上结果显示Iso C 治疗可以在体内缓解NLRP3炎症小体介导的脓毒性休克和炎症,这表明Iso C 可能具有治疗NLRP3炎性小体相关疾病的潜力。
综上所述,本实验证实Iso C广谱地抑制多种激动剂诱导的NLRP3炎症小体活化,对于NLRP3炎症小体活化的抑制作用具有相对特异性,在鼠和人细胞中都表现出良好的抑制效果,Iso C并不通过影响钾离子外流抑制NLRP3炎症小体活化,在体内Iso C可有效缓解LPS诱导的脓毒性休克。本研究有助于继续深入探究Iso C抑制NLRP3炎症小体活化的作用机制,同时也为寻找新的治疗脓毒性休克以及其他NLRP3炎症小体相关疾病的药物提供了重要的借鉴意义。
- 南方医科大学学报的其它文章
- miRNA-128-3p inhibits malignant behavior of glioma cells by downregulating KLHDC8A expression
- 高表达CAMSAP2通过上调TGF-β信号促进胃癌细胞的侵袭和转移
- 长链非编码RNA H19 促进血管钙化:基于抑制Bax 抑制因子1/视神经萎缩蛋白1通路
- 长链非编码RNA ABHD11-AS1 促进胃癌细胞糖酵解并加速肿瘤恶性进展
- 阿美替尼具有较好的抗神经母细胞瘤作用:基于下调MMP2 和MMP9的表达
- 参芪温肺方减轻慢性阻塞性肺疾病大鼠的肺气虚证:基于调节NLRP3/GSDMD细胞焦亡通路