诺西那生钠治疗5q型脊髓性肌萎缩患儿68例病例系列报告
马 凯 郭晓华 于春梅 金瑞锋 刘芳芳 高 敏
脊髓性肌萎缩(SMA)是一种好发于婴幼儿期的常染色体隐性遗传病,也是最常见的致死性神经遗传性疾病之一。我国大陆地区SMA的发病率约为14.34/10万活产婴儿,携带者频率约1/50[1]。临床中SMA常特指5q型SMA,由位于5q13.2区域的运动神经元存活基因1(SMN1)纯合缺失(95%)或复合杂合变异(5%)导致[2]。SMA病理下表现为脊髓前角α-运动神经元的变性和坏死,临床表现为进行性、对称性的肢体无力和肌肉萎缩,下肢重于上肢,肢体近端重于远端,可伴有肋间肌肉无力,未经干预治疗的患者肌无力和肌萎缩呈进行性加重,常伴有多系统器官损害[3],但患者的认知功能正常。SMA患者的生存时间取决于肺部功能[4]。
2019年2月诺西那生钠在中国上市,并于2021年12月被纳入国家医保,越来越多的SMA患者开始接受诺西那生钠治疗。本文回顾性分析接受诺西那生钠治疗的SMA患儿临床资料,积累国内SMA的治疗经验。
1 方法
1.1 伦理和知情同意 本文病例临床资料的收集、分析和用途经山东大学附属儿童医院伦理委员会批准(审批号:SDFE-IRB/T-2023041),均获取患儿家长知情同意。
1.2 5q型SMA诊断方法 (1)采用多重连接依赖探针扩增(MLPA)技术或荧光定量PCR(qPCR)技术检测SMN1基因7号外显子,符合以下任意1项即确诊5q型SMA,①纯合缺失;②拷贝数为1且经Sanger测序检测到SMN基因微小突变,长片段PCR结合巢式PCR进一步验证该突变位于SMN1基因上;③拷贝数为2,且PCR结合巢式PCR技术验证SMN1基因存在双等位基因突变。(2)采用MLPA技术检测SMN2基因7号外显子拷贝数。
1.3 临床分型[5]依据患儿发病年龄和所获得的最大运动功能里程碑进行临床分型。
1.4 病例来源 纳入2020年1月至2023年6月30日我院神经内科以诺西那生钠为单药初始治疗≥14个月的5q型SMA患儿。
1.5 诺西那生钠用药方案 行超声引导下或常规腰椎穿刺,鞘内注射给药,①治疗第1、15、29和64天使用负荷剂量,每次12 mg(5 mL);负荷剂量结束后每隔120 d使用1次维持剂量,每次12 mg(5 mL)。③每次用药前行实验室检查(血常规、血生化、凝血功能、尿常规)和心电图检查,注射后敷贴部位常规按压5~10 min,避免脑脊液渗漏,同时嘱患儿去枕平卧2~4 h。
1.6 结局指标
1.6.1 主要结局指标 由接受过专业培训、具有评分资质的康复医师完成运动功能评分量表。对于运动能力改善较大的患儿依据其实际情况更换相应的运动功能评分量表。采集用药前和第7次鞘内给药前患儿的运动功能量表评分。①Ⅰ型SMA婴幼儿和不能独坐的患儿应用费城儿童医院神经肌肉评估量表(CHOP INTEND),评分增加≥4分认为运动功能改善具有临床意义;②Ⅱ和Ⅲ型能独坐的患儿应用修订的上肢模块测试(RULM)、汉默史密斯运动功能扩展量表(HFMSE),RULM评分增加≥2分或HFMSE评分增加≥3分时认为运动功能改善有临床意义[6];③可行走的患儿另行6 min步行试验(6MWT)[7],步行距离提升≥30 m认为运动功能改善具有临床意义。
1.6.2 次要结局指标 在超声引导下或常规腰椎穿刺后留取5 mL脑脊液标本(排除混血的标本),用于低蛋白神经纤维丝轻链蛋白(NFL)检测,采用NFL吸附管(Axygen)收集2 mL标本,2℃~8℃冷藏运送至杭州欧蒙未一医学检验实验室。检测仪器为TECAN Sunrise酶标仪,采用酶联免疫吸附测定(ELISA)法,检测步骤依据TECAN Sunrise酶标仪说明书进行。
1.7 不良事件 不良事件:用药后发生的所有导致患儿不适的医学事件;严重不良事件:用药后出现死亡、危及生命、永久或者严重的残疾或者功能丧失、受试者需要住院治疗或者延长住院时间的医学事件。
1.8 一般信息采集 从住院电子病历中采集患儿性别、出生日期、发病日期、基因确诊日期、接受药物治疗日期、基因类型、临床分型;药物治疗前头颅影像学(头颅CT或MR);药物治疗前后的实验室检查结果。
1.9 统计学方法 数据统计处理由SPSS 26.0(Armonk, NY; IBM Corp.)软件完成。计量资料符合正态分布的以xˉ±s表示,组间比较采用F检验或配对t检验;计量资料不符合正态分布的以M(Q1,Q3)表示,组间比较采用F检验塔姆黑尼法或Wilcoxon符号秩和检验;P<0.05(双侧检验)为差异有统计学意义。
2 结果
2.1 一般资料 68例用药时间≥14个月的SMA患儿进入本文分析,表1显示,女32例(47.0%)。总体中位发病年龄为10(7,13.8)月龄,中位确诊年龄为17.5(12,37)月龄,Ⅲ型中位发病年龄和中位确诊年龄均最大,其次为Ⅱ型,Ⅰ型最小,差异有统计学意义。中位确诊时长(发病到确诊的时间)为7(3,18.8)个月,Ⅲ型最长,其次为Ⅱ型,Ⅰ型最短,差异有统计学意义。
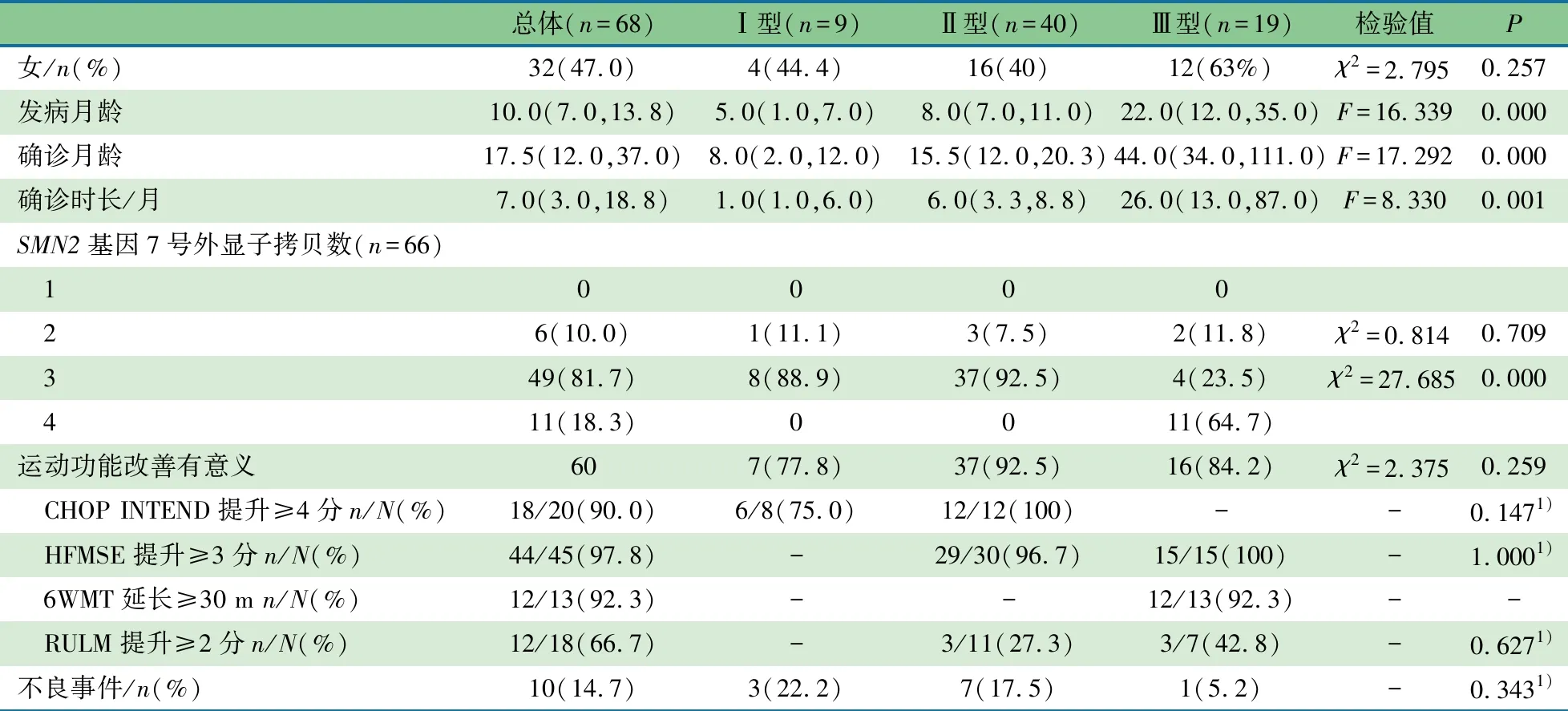
表1 诺西那生钠治疗脊髓性肌萎缩患儿基本资料[M(Q1,Q3)]
SMN1基因7号外显子纯合缺失64例(94.1%),SMN1基因突变4例。Ⅰ型SMA患儿9例(13.2%),均为Ⅰc型;Ⅱ型SMA患儿40例(58.8%),Ⅱa型31例,Ⅱb型9例;Ⅲ型SMA患儿19例(27.9%),Ⅲa型14例,Ⅲb型5例。66例SMA患儿行SMN2基因7号外显子拷贝数检测,拷贝数为1、2、3和4的患儿分别为0、6(10.0%)、49(81.7%)和11例。SMN2基因7号外显子拷贝数为3的例数最常见,其中Ⅱ型患儿最多,Ⅰ型次之,Ⅲ型最少,差异均有统计学意义。
2例(2.9%)患儿用药前存在脑积水,其余患儿头颅影像学未见异常。
2.2 运动功能量表评分 60例(88.2%)运动功能改善具有临床意义,其中Ⅰ型7例、Ⅱ型37例、Ⅲ型16例。7例(10.3%)运动功能有改善,但未达临床意义,Ⅰ型2例、Ⅱ型2例、Ⅲ型3例;1例(Ⅱ型)运动功能保持稳定。
行CHOP INTEND量表评分20例,治疗前(28.2±14.7)分,治疗后43(33.8,49.8)分, 评分增加≥4分18例(90.0%)。
行HFMSE量表评分45例,治疗前19(12.5,34.5)分,治疗后(30.4±16.4)分, 评分提升≥3分44例(97.8%)。
行6WMT评分13例,治疗前行走距离(243.4±128.2)m,治疗后(312.1±134.0)m,行走距离延长≥30 m 12例(92.3%)。
行RULM评分18例,治疗前(20.5±10.8)分,治疗后(25.0±8.8)分,提升≥2分12例(66.7%)。
2例治疗后获得新的运动功能里程碑,其中1例(Ⅰc型)用药3个月后实现独坐,另1例(Ⅲa型)用药12个月后可以双腿跳跃。
2.3 NFL水平 仅纳入2021年1月以后的病例,15例有NFL水平记录,均为Ⅱ型;女5例(33.3%);治疗前脑脊液中NFL水平为176.6(104.5,199.6) pg·mL-1,负荷剂量治疗结束后(用药后第184天)NFL水平为69.2(40.5,89.3) pg·mL-1,差异有统计学意义(Z=-3.24,P<0.05)。
2.4 不良事件 发热3例,Ⅲ型1例(用药后第4天),Ⅱ型2例(分别是用药后第62和177天),均自行缓解;呼吸道感染2例,Ⅰ型(上呼吸道感染,用药后第305天,对症治疗后缓解)和Ⅱ型(肺炎,用药后第498天,住院治疗9 d后治愈)各1例;便秘(用药后第5天)、肌痛(用药后第242天)和咳嗽(用药后第177天)各1例,均为Ⅱ型,均自行缓解;眩晕1例,Ⅰ型(用药后第2天),自行缓解;肝功能异常1例,Ⅱ型(用药后14天),住院治疗7 d治愈。未发生严重不良事件。
64例行常规腰椎穿刺,2例脊柱融合术后患儿、2例严重脊柱侧弯患儿在超声引导下行腰椎穿刺术。腰椎穿刺的不良事件包括头痛、腰痛、腿疼等,多数发生在第1或2针注射后第2或3天,4~5 d自行缓解。
3 讨论
SMA的致病基因位于5q13.2区域[8]。SMN1基因可以编码全长SMN蛋白,广泛表达于人体,对维持生命起至关重要的作用。SMN2基因表达截短的无功能的SMN蛋白(SMN△),但同时也能表达约10%的全长SMN蛋白,可以部分补偿SMN1基因的缺失[9]。因此,SMA疾病的严重程度与SMN2基因的拷贝数在一定程度上呈负相关[10],SMN2基因拷贝数越高,患者的临床症状往往越轻。本文结果显示,SMN2基因7号外显子拷贝数为1、2、3和4的患儿分别为0、6(10.0%)、49(81.7%)和11例。88.9%Ⅰ型和92.5%Ⅱ型SMA患儿SMN2基因拷贝数为3,64.7%Ⅲ型SMA患儿SMN2基因拷贝数为4。
SMA呈进行性加重且具有致残性[11],在SMA患者自然病史中,0型多数于生后不久夭折;Ⅰ型患者的生存率较低[12],约2/3的患儿于2岁内死亡,剩余的1/3伴有严重的残疾;Ⅱ型和Ⅲ型患者临床症状相对较轻。本文68例患儿,以Ⅱ型(58.8%)和Ⅲ型(27.9%)为主,治疗期间生存率100%,无事件生存率95.6%。不同临床分型间发病年龄差异有统计学意义,Ⅲ型最大[22.0(12.0,35.0)月龄],其次为Ⅱ型[8.0(7.0,11.0)月龄],Ⅰ型最小[5.0(1.0,7.0)月龄]。Ⅱ型和Ⅲ型SMA患儿存在明显的诊断延迟情况,确诊时长分别为 26.0(13.0,87.0)个月和6.0(3.3,8.8)个月。
诺西那生钠上市后有效地改善了SMA的疾病病程,提高了SMA患者的生活质量。Ⅰ型患儿应用诺西那生钠3年后运动功能持续改善,且80%的患儿不良事件的发生情况与自然病史中相同[13]。国内目前关于诺西那生钠治疗SMA的真实世界研究数据极少,目前仅毛珊珊等[14]发表了1篇诺西那生钠治疗SMA患儿(n=15)的病例报告,15例中13例(86.7%)获得有临床意义的运动功能改善。本文纳入68例治疗≥14个月的SMA患儿,其中60例(88.2%)运动功能改善具有临床意义,Ⅰ型7例(75%)、Ⅱ型37例(92.5%)、Ⅲ型16例(84.2%)。90.0%(18/20)患儿CHOP INTEND提升≥4分,97.8%(44/45)患儿HFMSE提升≥3分,92.3%(12/13)患儿6WMT延长≥30 m,72.7%(8/11) 患儿RULM提升≥2分,说明诺西那生钠治疗14个月后SMA患儿运动功能明显改善。但本文病例中无SMN2基因7号外显子拷贝数为1的患儿,拷贝数为2的患儿比例较低。提示治疗效果好可能与本文病例临床症状较轻有关。
NFL是一种神经元特异性的结构蛋白,是神经元受损的敏感指标。当神经元受损时,NFL从神经元中释放,因此血和脑脊液中可检测到明显增高的NFL,该水平越高提示神经元损伤越重[15,16]。本文15例Ⅱ型SMA患儿治疗前脑脊液NFL水平为176.6(104.5,199.6) pg·mL-1,经诺西那生钠负荷剂量治疗结束后(用药后第184天)NFL水平为69.2(40.5,89.3) pg·mL-1,差异有统计学意义,提示NFL可能作为早期治疗效果和预后判断的生物学标志物。值得注意的是:1例患儿因为骨折延长了用药时间,脑脊液NFL再次升高,提示药物代谢完后可能又存在新的神经元损伤,可能说明诺西那生钠对神经元具有一定保护作用。
本文诺西那生钠治疗SMA的相关不良事件包括发热、呼吸道感染、便秘、咳嗽、眩晕、肌痛、肝功能异常,可自行缓解或治愈,未出现严重不良事件,提示安全性好。本文SMA患儿使用诺西那生钠治疗的平均时间尚短,不同临床分型的SMA患儿是否持续有效及远期安全性,需要进一步的随访观察。
利益冲突:所有作者均声明不存在利益冲突

