低能量激光对人牙周膜细胞白细胞介素-6、肿瘤坏死因子-α、骨保护素、核因子-κB受体活化因子配体表达的影响
汤盟 崔占琴 王阳阳 陈增国 李文静 张翠萍
1.河北医科大学第二医院口腔正畸科,石家庄 050000;
2.河北医科大学第二医院口腔内科,石家庄 050000;
3.福建省龙岩市永定区医院口腔科,龙岩 364100
糖尿病是当前较为常见的代谢性疾病[1],患病人数逐年递增。与此同时伴随着人们对口腔健康意识的增强,对口腔颌面部审美要求的提升,在口腔正畸领域,越来越多的糖尿病群体寻求正畸治疗。以往研究[2]证实,糖尿病患者体内的炎症因子水平显著升高,在正畸治疗的过程中,这种异常水平的炎症因子会造成骨改建过程中一系列信号转导通路发生改变,引起骨质丢失,使骨吸收的量远大于骨生成的量,导致骨改建失衡[3]。显然,这无益于正畸治疗过程中的牙齿移动及牙周组织的改建。
骨保护素(osteoprotegerin,OPG)/核因子-κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)/核因子-κB 受体活化因子(receptor activator of nuclear factor-κB,RANK)系统是骨改建过程中重要的信号通路,且在人牙周膜细胞(human periodontal ligament cell,HPDLC)中有表达[4]。OPG/RANKL的比值可反应骨吸收的状态,比值增大时表明骨吸收活动减弱,比值减小时提示骨吸收活跃。研究证实,糖尿病患者牙周组织的高血糖环境会上调RANKL的表达并下调OPG 的表达,使糖尿病患者的牙槽骨出现骨质疏松,影响正畸牙移动及整个正畸治疗进程。
在正畸过程中,当矫治力施加于被移动牙后,分布于牙齿周围的牙周膜细胞收到这一力学刺激信号后会分泌多种细胞因子,其中,炎症因子的表达可以反映骨改建的程度及牙周组织的健康状况。白细胞介素(interleukin,IL)-6 及肿瘤坏死因子(tumor necrosis factor,TNF)-α 是介导牙周组织炎症过程中的重要因子,且对于牙周炎症的评估具有较强的敏感性及特异性,并参与骨改建的调控。
低能量激光(low-level laser,LLL)具有杀菌、降低炎症反应水平的作用,对创口愈合及骨组织愈合等均有良好的生物刺激作用,在牙周炎的治疗方面应用广泛[5]。但关于LLL 是否可以通过减轻糖尿病正畸患者牙周组织的炎症,近而调控破骨通路中相关因子的表达,从而保证糖尿病患者正畸过程中骨代谢平衡的研究鲜有报道。因此本实验通过体外培养HPDLC,分别用低糖型杜氏改良Eagle 培养基(Dulbecco’s modification of Ea‐gle’s medium,DMEM)和高糖型DMEM 模拟体内的正常血糖和高血糖水平,在给予LLL 干预后,使用自制的持续静压力装置模拟正畸治疗过程中牙齿压力侧受力情况,研究高糖环境下LLL 对受压力刺激的HPDLC中IL-6、TNF-α及OPG、RANKL 表达情况的影响,以期探讨LLL 疗法能否对糖尿病患者正畸治疗过程中的骨代谢紊乱情况产生影响,为糖尿病人群正畸治疗过程中骨改建的调控提供理论依据。
1 材料和方法
1.1 主要实验试剂
DMEM(GIBCO 公司,美国),青霉素/链霉素溶液(上海碧云天生物科技有限公司),胎牛血清(PAN 公司,德国),0.25%胰蛋白酶、磷酸缓冲液(phosphate buffer saline,PBS)(BI公司,以色列),CK19(杭州华安生物技术有限公司),通用型SP 试剂盒(上海中杉金桥生物技术有限公司),细胞冻存液(上海雅酶生物医药科技有限公司),人OPG、RANKL、IL-6、TNF-α 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELI‐SA)试剂盒(上海爱萌优宁生物技术有限公司)。
1.2 HPDLC的取材及培养
HPDLC 取材自就诊于河北医科大学第二医院口腔颌面外科12~18周岁患者因正畸减数治疗而拔除的健康前磨牙,所有患者无全身系统性疾病,所取牙齿牙周状况良好,无龋病及其他牙体牙髓疾病,取材前已事先告知患者所取牙用途,并取得患者及家属知情同意,同时获得河北医科大学第二医院伦理委员会批准,伦理编号为(2022-R752)。牙脱位后,在无菌条件下取材,采用组织块法进行HPDLC 的原代培养,取传代第4 代的HPDLC用于后续实验。
1.3 HPDLC组织来源鉴定
取传代第4 代生长状况良好的HPDLC 制作细胞爬片,进行苏木精-伊红(hematoxylin-eosin,HE)染色和免疫组织化学染色,鉴定其组织来源。
1.4 HPDLC生长曲线的绘制
将第4 代HPDLC 消化离心后制成细胞悬液,调整细胞密度以每毫升3×104个,接种于24 孔板中,每孔1 mL,置于CO2细胞培养箱内培养,24 h后随机取3孔细胞进行计数,求取平均值,同一时间点连续计数8 d,最后进行细胞生长曲线的绘制。
1.5 实验分组
根据实验设计,将HPDLC 随机分为A、B、C、D 组。A 组:低糖型DMEM+压力刺激;B 组:高糖型DMEM+压力刺激;C 组:低糖型DMEM+LLL 照射+压力刺激;D 组:高糖型DMEM+LLL照射+压力刺激。C、D 组根据激光能量密度值的不同又分为1 组和2 组,其中C1、D1 组的能量密度值为3.75 J/cm2;C2、D2 组的能量密度值为5.625 J/cm2。分别在0、12、24、48、72 h 共5 个时点定时收集细胞培养上清,每个时点采集3 个样本。
1.6 LLL照射
本实验采用pilot-半导体激光仪,波长为810 nm,光纤直径400 nm,无线频率2.46 Hz,功率100 mw,光斑面积9.6 cm2。参照以往文献[6]结果,照射时间=能量密度/功率密度。对C1、C2、D1、D2 组细胞在压力加载前进行LLL 照射,为避免激光散射对实验结果造成的影响,只选择6孔板对角线上的2 孔(图1 中红色标记处)进行细胞接种实验,6 孔板相邻孔间用4%台盼蓝染液(图1中蓝色标记处)进行分隔,并在6孔板底铺置不透光黑纸,整个操作过程在暗室中进行。
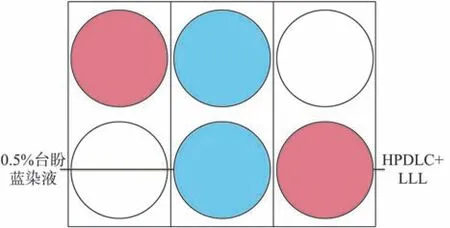
图1 LLL照射HPDLC的装置Fig 1 LLL therapy device for HPDLCs
1.7 细胞静压力加载装置
本实验参考黄生高等[7]的机械压力模型构建方法,沿用本课题组原持续静压力加载装置[8]如图2所示,用以模拟正畸治疗时压力侧牙周组织的受力情况。该装置主要由圆形玻璃片(规格为直径30 mm,厚4 mm,密度2.5×103kg/m3)加载在铺满单层HPDLC 的平底6 孔板上组成。细胞所受压力计算公式:P=ρh,其中P 为细胞所受压力,ρ为玻璃密度,h 为玻璃厚度。参照以往文献[2]报道,本实验所使用的压强值为 2 g/cm2。
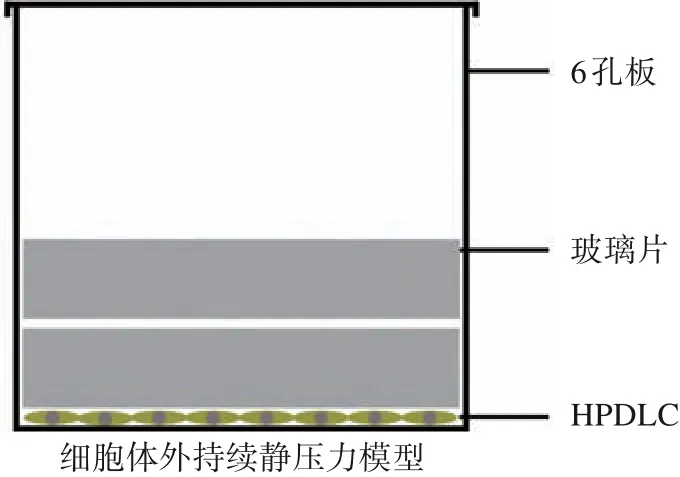
图2 HPDLC 持续静压力加载装置Fig 2 Static mechanical pressure sketch map of HPDLCs
1.8 LLL与压力刺激干预HPDLC
取生长状态良好的第3 代HPDLC,经胰酶消化离心后用于实验,以每孔1×105个细胞的密度接种于6 孔板对角线位置的2 个培养皿中。接种完毕后,将6 孔板移至CO2培养箱内培养24 h,次日对各孔细胞进行换液处理,其中A、C 两组仍使用含双抗和20%FBS的低糖型DMEM 培养基进行换液,B、D 两组更换为含双抗和20%FBS 的高糖型DMEM 培养基进行换液,2 d 后再次重复上述方式进行换液,每次换液后于镜下观察细胞生长情况,待细胞生长接近平底6孔板的板底时,按上述分组给予相应的激光干预和压力刺激,分别在0、12、24、48、72 h 共5 个时点,定时进行细胞培养上清液的收集并记录。按照实验设计,计时收集HP‐DLC 培养液后在1 000 r/min 下离心10 min,取上清液,分装后于-20 ℃冰箱进行保存,待所有上清液收集完毕,统一将收集的上清液解冻并用ELI‐SA 试剂盒检测各组IL-6、TNF-α、OPG、RANKL的表达情况。
1.9 统计学分析
应用 SPSS 22.0 软件包进行统计学分析,实验所得数据均以平均数±标准差表示,使用t检验方法进行各组间均数的两两比较,P<0.05 被视为差异有统计学意义。
2 结果
2.1 牙周膜细胞的原代培养结果
在原代细胞的培养中,最快5~7 d 即可在显微镜下看到细胞从组织块周围爬出,慢的则需要20 d左右。图3A所示为HPDLC原代培养10 d,镜下可见爬出的细胞胞体形态为长梭形,胞浆透明,胞质丰富,胞核居细胞中央,呈圆形或椭圆形,包含核仁;大约20 d 可见细胞生长至培养瓶底的80%,如图3B 所示为HPDLCS 原代培养21 d,此时即可对细胞进行传代培养,传代后的细胞生长速度较快,约4~5 日即可进行下一次传代;图3C所示为HPDLCS传代3代镜下所见。

图3 HPDLC的培养 倒置相差显微镜 × 100Fig 3 Culture of HPDLCs Inverted phase contrast microscope × 100
2.2 牙周膜细胞来源鉴定结果
细胞经HE 染色后,镜下观察如图4A 所示:细胞呈长梭形或多角形,胞核呈圆形或椭圆形,蓝染嗜碱性,内含1~5个核仁,胞浆丰富红染嗜伊红。免疫组织化学染色镜下可见:抗角蛋白染色如图4B 所示呈阴性,胞浆未见染色;细胞抗波形丝蛋白染色如图4C 所示呈阳性,胞浆棕黄色。综上判断细胞符合间充质来源的细胞特征,并结合所取组织部位可判定为所培养细胞为HPDLC。
2.3 细胞生长曲线
将细胞接种于24孔板,观察细胞的生长状态,镜下见细胞生长状态良好。根据细胞生长状况绘制如图5所示的细胞生长曲线,绘制出的生长曲线接近S 形,整个生长周期分为3 个阶段,分别为:停滞期、对数生长期和平台期。接种后的1~2 d,细胞生长较缓慢,未见明显增殖;3 d 后细胞生长迅速进入对数生长期;生长至7 d,细胞增殖速度减慢,细胞间出现生长抑制,细胞的增殖进入平台期。整个过程符合体外培养细胞的生长规律。
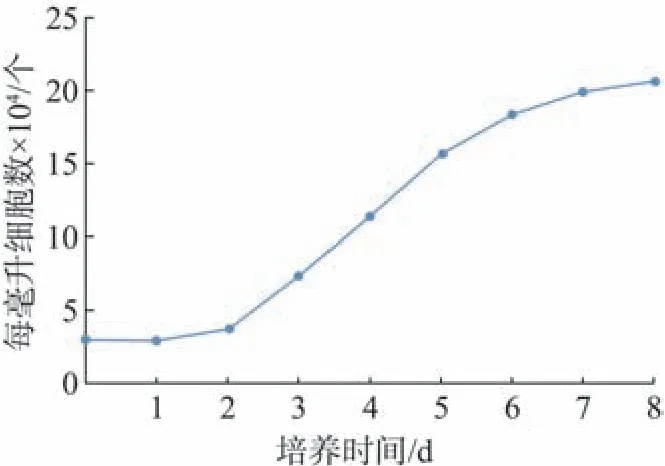
图5 HPDLC的生长曲线Fig 5 Grow curve of HPDLCs
2.4 各组炎症因子的蛋白表达
各组炎症因子IL-6、TNF-α 的表达水平如图6所示,由图可见这两者的蛋白浓度均随时间逐渐上升。

图6 各组炎症因子的表达情况Fig 6 The expression of inflammatory factors in each group
各组IL-6的表达检测结果如表1所示。各组组间经两两独立样本t检验可知,12 h 后组间比较,A 组与B、C1、C2 组(P<0.05)和B 组与D1、D2组(P<0.01)的差异均有统计学意义。
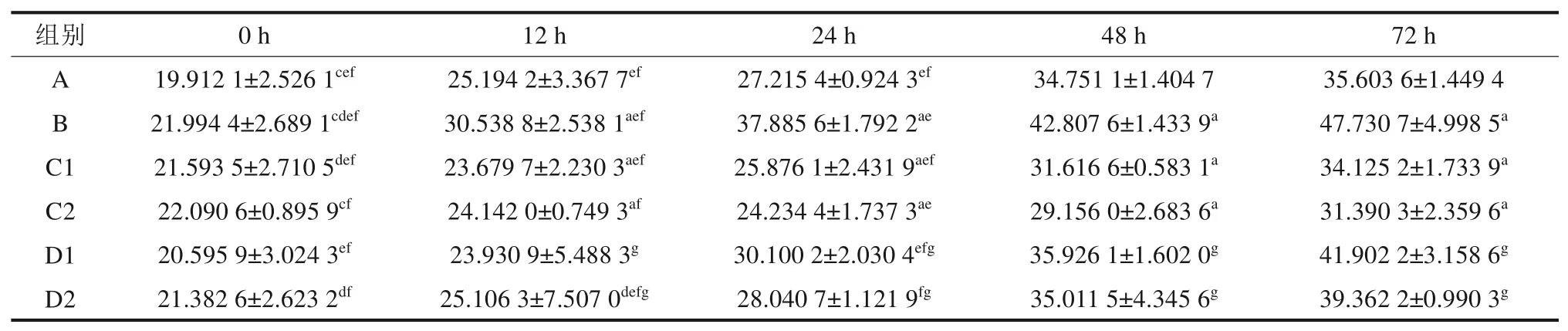
表1 ELISA 检测各组IL-6蛋白的浓度表达情况Tab 1 The expression of IL-6 protein was detected by ELISApg/mL
对各组组内的不同时点采用配对样本t检验,统计结果显示:A 组0 h 与12、48、72 h,12 h 与48、72 h,24 h 与48、72 h;B 组0 h 与12、24、48、72 h,12 h 与48、72 h,24 h 与48 h;C1 组0 h与24、48、72 h,12 h与48、72 h;C2组0 h与12、72 h,12 h 与72 h,24 h 与48 h;D1 组0 h 与48、72 h,24 h与48、72 h;D2组0 h与24、72 h,12 h 与24、48、72 h,24 h 与72 h 间比较的IL-6 蛋白浓度差异均有统计学意义(P<0.05)。
TNF-α 的蛋白表达情况如表2 所示,各组经组间两两独立样本t检验可知,12 h 后组间比较,A组与B、C1、C2组(P<0.05)和B组与D1、D2组(P<0.01)间的差异均有统计学意义。
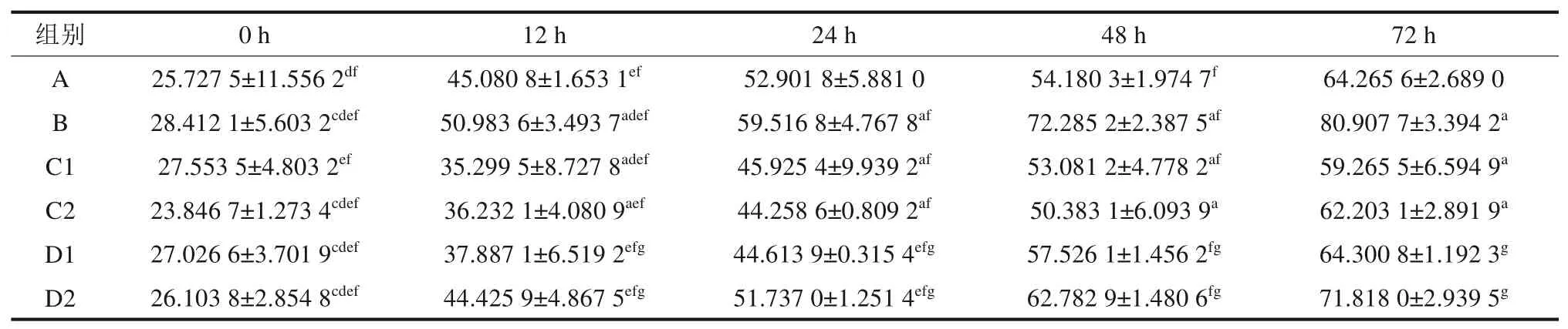
表2 ELISA 检测各组 TNF-α蛋白浓度表达Tab 2 The expression of TNF-α protein was detected by ELISApg/mL
针对各组组内不同时点采用配对样本t检验进行差异性检验,统计结果显示:A 组0 h 与24、72 h,12 h 与48、72 h,48 h 与72 h;B 组0 h 与12、24、48、72 h,12 h 与24、48、72 h,24 h 与72 h,48 h 与72 h;C1 组0 h 与48、72 h,12 h 与24、48、72 h,24 h 与72 h,48 h 与72 h;C2 组0 h 与12、24、48、72 h,12 h 与48、72 h,24 h与72 h;D1 组0 h 与12、24、48、72 h,12 h 与48、72 h,24 h 与48、72 h,48 h 与72 h;D2 组0 h 与12、24、48、72 h,12 h 与48、72 h,24 h 与48、72 h,48 h 与72 h 间比较的TNF-α 蛋白浓度差异均有统计学意义(P<0.05)。
2.5 各组骨改建相关因子的蛋白表达
各组骨改建相关因子的蛋白表达如图7 所示,其中OPG 蛋白浓度变化如图7A所示,总体呈现先上升后下降的趋势,以24 h 为界,在0~24 h 内均呈现上升趋势,24 h 后逐渐下降;RANKL 蛋白浓度变化如图7B 所示,各组RANKL 蛋白浓度总体呈逐步上升的趋势;OPG/RANKL蛋白浓度的比值变化如图7C 所示,各组OPG/RANKL 蛋白浓度比值总体呈现逐步下降的趋势。
各组OPG 蛋白浓度表达如表3 所示,经组间两两独立样本t检验可知,12 h 后组间比较,A 组与B、C1、C2组和B组与D1、D2组间的差异均具有统计学意义(P<0.05)。
此外,对各组组内的不同时间点采用配对样本t检验进行差异性检验,结果发现:A 组0 h 与12、24 h,12 h 与24 h,24 h 与48、72 h,48 h 与72 h;B 组0 h 与12、24、48 h,12 h 与24、48、72 h,24 h 与48、72 h,48 h 与72 h;C1 组0 h 与12、24、48 h,12 h 与24 h;C2 组0 h 与12、24、48、72 h,12 h 与24、48 h,24 h 与72 h,48 h 与72 h;D1 组0 h 与24、72 h,24 h 与72 h;D2 组0 h 与12、24、48、72 h,12 h 与24、72 h,24 h与72 h 间的OPG 蛋白浓度差异有统计学意义(P<0.05)。
各组RANKL 的蛋白浓度表达如表4 所示,经组间两两独立样本t检验可知,12 h 后组间比较,A 组与B、C1、C2组和B 组与D1、D2组的差异均具有统计学意义(P<0.05)。针对各组组内的不同时点采用配对样本t检验可知,A、B、C1、D2 组不同时间点RANKL蛋白浓度差异均具有统计学意义(P<0.05);C2 组0 h 与24、48、72 h,12 h 与24、48、72 h,24 h 与48、72 h,48 h 与72 h;D1组0 h 与12、24、48、72 h,12 h 与24、48、72 h,24 h 与48、72 h 间比较,RANKL 蛋白浓度的差异均有统计学意义(P<0.05)。
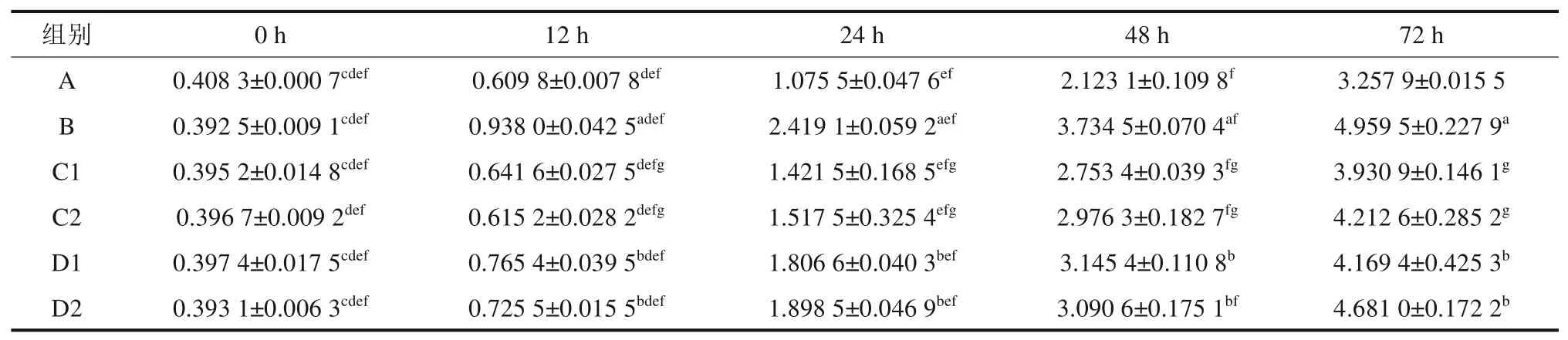
表4 ELISA 检测各组 RANKL 蛋白浓度表达Tab 4 The expression of RANKL protein was detected by ELISApg/mL
各组的OPG/RANKL 蛋白浓度比值如表5 所示,经组间两两独立样本t检验可知,12 h 后组间比较,A 组与B、C1、C2组和B 组与D1、D2组的差异均有统计学意义(P<0.05)。
对各组组内的不同时点采用配对样本t检验,其中A、B、D2组组内各时点间OPG/RANKL蛋白浓度比值差异均有统计学意义(P<0.05)。C1 组0 h 与24、48、72 h,12 h 与24、48、72 h,24 h与48、72 h;48 h 与72 h;C2 组0 h 与24、48、72 h,12 h 与24、48、72 h,24 h 与48、72 h 间OPG/RANKL 比值的差异具有统计学意义(P<0.05)。D1 组0 h 与12、24、48、72 h,12 h 与24、48、72 h,24 h 与48、72 h,48 h 与72 h 间OPG/RANKL比值的差异具有统计学意义(P<0.05)。
3 讨论
在正畸牙移动的过程中,位于牙根与牙槽骨之间的牙周膜将加载在牙齿上的力传递至牙槽骨上,而接收到这一力学信号的牙周组织会发生一系列的重塑和改建,表现为与牵引力方向相同的受压一侧的牙槽骨发生吸收,与牵引力方向相反受牵张的一侧出现骨质新生。这是正畸治疗过程中的生理学基础。牙周膜细胞作为牙周膜的主要效应细胞,具有向各种细胞分化的潜能,在受到外力刺激时会分泌多种细胞因子参与骨改建的调控,这是组织重塑与改建的生物学基础。
OPG/RANKL/RANK 系统在骨改建的过程中发挥重要作用,参与调控破骨细胞的形成、分化和成熟。RANKL和OPG主要由成骨细胞谱系中的细胞产生。对破骨细胞的生成分化起抑制作用。RANK 位于破骨细胞前体的细胞膜上,在破骨细胞的形成中发挥重要作用。RANKL 通过与破骨细胞前体上的同源受体RANK 结合,触发破骨细胞前体分化为多核破骨细胞,从而导致骨吸收。这种相互作用可被RANKL 的诱饵受体OPG 所阻断,OPG 通过竞争性结合RANKL 从而阻止RANKL 与其受体RANK 结合来调节过度的骨吸收[4,9-11]。因此,OPG与RANKL的比例关系对于正常骨改建的维持具有重要意义。该比值减小时提示破骨细胞分化增多,骨吸收活跃。该比值增大时,破骨细胞的分化减少,骨吸收反应被抑制,故OPG/RANKL 的比值是评估正畸治疗过程中骨吸收的客观指标之一。
糖尿病作为常见的代谢性疾病,以血液中出现的较高水平的血糖浓度为其主要特征,这种异常的高血糖状态会干扰正常的机体代谢,如引起糖、脂肪和蛋白质等的代谢紊乱,另一方面会影响心血管系统、神经系统、肾、眼等器官的功能障碍。对于口腔的影响主要表现为对牙周组织炎症反应的促进作用。糖尿病患者血糖水平的升高会干扰微循环系统正常运行,影响正常血液循环,造成组织缺氧,且会加强血小板的黏附和聚集,降低抗凝因子水平,红细胞脆性的增加会进一步引起组织缺氧,损害血管内皮,为细菌及其毒素的入侵创造了条件[12-14]。相关的研究[15]证实,糖尿病与牙周炎之间存在双向促进关系。高水平的血糖环境会造成晚期糖基化终末产物(advanced gly‐cation end product,AGE)的增加,AGE 通过与其多配体受体(receptor for advanced glycation end product,RAGE)结合,激活AGE/RAGE 通路引发免疫应答,使得IL-6、TNF-α等大量炎症因子释放,从而引发或加重牙周组织的炎症反应。在众多的炎症因子中,IL-6 及TNF-α 在介导牙周炎症的过程中发挥重要作用[16-18],对牙周炎的评估具有较强的敏感性及特异性。以往的研究[19]发现,糖尿病患者牙周组织IL-6 及TNF-α 的表达显著升高。IL-6 是由免疫细胞分化形成的一种多功能的细胞因子,可诱导破骨细胞的骨吸收反应。在炎症性牙周组织中IL-6 水平显著升高。Irwin 等[20]的研究显示,IL-6与牙周组织的破坏密切相关。Yakovlev等[21]对青少年人群的牙周炎进行研究发现,在其龈沟液中也检测到了IL-6 水平的升高。TNF-α 是破骨细胞激活因子,可诱导破骨细胞分化, 在低浓度条件下即可明显增强破骨细胞形成[22-23]。在体外实验中发现,TNF-α 可能会抑制OPG 合成,进而导致骨量减少。Takeichi 等[22]研究发现,在慢性根尖周炎的根尖周病变中检测到TNF-α,TNF-α 会刺激炎症和骨吸收的发生。Gaspersic 等[23]认为,TNF-α 对大鼠实验性牙周炎的进展有促进作用。Lee 等[24]报道TNF-α 在牙周炎的龈沟液中增加,促进牙槽骨吸收。因此本研究选取IL-6、TNF-α 及OPG、RANKL 这4 个细胞因子作为检测指标对骨改建水平进行评估。
LLL 又称低强度激光或弱激光等,通常其输出功率小于250 mw,常用的波长范围为600~950 nm[25],常见的He-Ne激光、半导体激光都属于此类。利用半导体作为增益介质的激光器称为半导体激光,铝、镓、砷、铟化物等是常见的半导体激光介质,不同的介质也决定了激光的波长,常见范围在800~980 nm。本实验中所用激光为半导体激光,其良好的组织穿透性和热效应使其在临床中获得了广泛的应用,半导体激光能被内源性发色团如血红蛋白和黑色素吸收,它对血红蛋白的吸收率最高,在有血液存在的情况下表现最好,且体积小巧,操作便捷,故为当前在牙周组织疾病尤其是牙周炎的治疗中应用最广泛的一种LLL 疗法[26],其中本研究所应用的810 nm 的镓铝砷激光器和980 nm 的铟镓砷化激光器为半导体家族中应用最广泛的2种。
LLL 已经过一系列的体内和体外的研究证实有缓解牙周组织炎症的作用,为探究LLL 能否通过减少糖尿病患者的牙周组织炎症反应,降低相关炎性因子的表达,进而抑制其对OPG/RANKL/RANK 信号通路的不良影响导致的骨代谢异常。本研究通过体外培养HPDLC,在体外持续静压力模型上模拟临床正畸治疗过程中压力侧的HPDLC受力情况,在加力前给予LLL 干预,探究在高糖环境下LLL对受压力刺激HPDLC 的IL-6、TNF-α、OPG、RANKL 表达的影响,以期探讨在临床中是否可以应用LLL 对糖尿病正畸患者治疗过程中的炎症反应和骨改建进行调控。
本研究采用组织块法体外培养HPDLC,选择传代第4代的细胞进行试验。实验所用细胞加力装置沿用了本课题组之前的持续静压力加载模型,此种方法的压强值只受玻片自身厚度及密度的影响,故操作过程中易于控制所加载力值的大小,压力持续加载,整个实验过程中可避免对细胞生长环境的改变,且板底细胞受力均匀。由于玻片自身透明,所以整个操作过程中,可随时在镜下观察细胞的状态,亦不会影响到细胞正常生长状态下的温度及湿度,操作简便,可以模拟临床中正畸加力后压力侧牙周组织的受压状况。黄生高等[7]和张建兴等[27]采用四唑盐比色(methyl thiazo‐lyl tetrazolium,MTT)法进行检测了压力对于细胞的毒性损伤及增值率的影响,对比压力培养组与对照组之间的吸光度值(optical density,OD),发现只有4 g/cm²的较大应力组会对细胞毒性产生影响,其余组细胞损伤均在可接受范围内,可以得知玻片产生的压力对于细胞生长并未产生明显损伤。本实验设定的持续静压力值为2 g/cm²,研究认为此时压力侧的骨改建最为活跃,细胞状态较佳。较小的力值不利于相关因子的充分表达,过大的压力反而会使相关的细胞因子表达水平下降,这可能是由于过大的应力超过了细胞所能承受的力值范围,会干扰细胞的正常生理功能。也再次印证了正畸临床过程中,过大的应力加载不仅不会加快牙齿的移动,反而使牙齿的移动发生停滞。这提示临床医生在接诊患有糖尿病的正畸患者时,应重视治疗过程中的施力方式,避免因正畸矫治力过大而引起牙槽骨的异常吸收、牙齿松动甚至脱落,所以本研究最终设定的持续静压力值为2 g/cm²。
关于LLL 治疗的参数设定,国内外学者做过大量的研究[28-30],认为波长在600~950 nm 的波长范围内,激光能发挥较好的生物刺激作用,激光的透射量接近最大值,此外,红外辐射在血红蛋白和水中的吸收系数较低,在组织中的穿透深度较高[31],本实验所用的pilot 砷化镓铝半导体激光(810 nm)即在此波长范围内。对于LLL 治疗效应影响较大的另一重要参数为能量密度,能量密度较小时会产生正向刺激作用,当能量密度超过一定范围,则会产生抑制作用。Wang 等[5]使用Nd:YAG 激光对炎症状态下的人牙周膜干细胞(hu‐man periodontal ligament stem cell,HPDLSC) 进行照射,结果显示8 J/cm2的LLL 可有效调节HP‐DLSC 的成骨潜力,4~8 J/cm2的LLL 能促进HP‐DLSC中的氧化应激水平,降低HPDLSC中炎症细胞因子的表达和活性氧基团或分子(reactive oxy‐gen species,ROS)水平;16 J/cm2的LLL 可显著抑制HPDLC 的增殖和成骨分化,并促进炎性细胞因子和ROS水平。Rigi-Ladez等[32]用波长为810 nm和940 nm 的二极管激光器对牙周膜干细胞进行照射后发现,2 种波长的LLL 均在2.5 J/cm2组时细胞有显著增殖。后续的学者[6]研究发现,LLL 治疗的理想能量密度值为2~12 J/cm2,能量密度计算公式:(功率×时间)/光斑面积,通过公式可知,由于6孔板底面积是确定的,所以只能通过改变照射时长来调整能量密度值。考虑到在实际操作过程中6孔板底面积及接受LLL照射时长等因素,本实验设定2 个能量密度值分别为3.75、5.625 J/cm²,以探究不同能量密度值对骨改建的影响是否存在差异。
根据本课题组以往的研究[8]发现,HPDLC 在正常培养条件下仅有少量的OPG、RANKL 表达分泌,而较低浓度的因子表达不足以引起骨改建反应的发生,故本研究未设定空白对照组。以往的文献[2]报道,高糖环境及压力刺激会促进HPDLC炎症因子IL-6、TNF-α的表达。本研究发现,当给予HPDLC 持续静压力刺激后,IL-6、TNF-α 浓度随时间逐渐上升,与低糖环境组相比高糖环境组中,IL-6、TNF-α 增长的趋势更加明显,在24 h 前增幅较大,24 h 后缓慢增长。高水平表达的IL-6、TNF-α 会进一步刺激OPG 的下降和RANKL 的上升,与此同时,同时点OPG/RANKL 的比值较正常组明显降低,这表明高糖环境会促进压力侧骨吸收。有学者[33]曾进行动物实验,建立大鼠牙移动的模型,最终通过显微CT 对牙移动后压力侧的牙周组织切片观察发现,在对被移动牙进行施力的过程中,OPG、RANKL 均呈现增加趋势,且二者均表现为受压早期增加,后期出现降低,相较之下RANKL 对这种刺激的反应出现更早,即RANKL 的表达峰值先于OPG。另外的研究[34]则发现,在给予HPDLC 压力刺激后,OPG 的表达出现下降,RANKL 的表达升高。刘长庚等[35]对在不同时段正畸力作用下的HPDLC 进行提取和培养,利用聚合酶链式反应(polymerase chain reaction,PCR)对压力区的OPG 进行检测发现,在牙移动的最初,几乎不能检测到OPG,牙移动3 个月时OPG 表达达到高峰,牙移动结束时该因子又出现下降,这表明OPG 在牙齿移动过程不同阶段的表达,呈现先升高后降低的趋势。本研究发现,OPG 蛋白浓度以24 h 为界,24 h 之前OPG 呈现上升趋势,24 h 后OPG 的浓度随时间逐渐下降。RANKL 的蛋白浓度在0~72 h 之间随时间逐渐上升,且在12 h后增幅明显。OPG/RANKL的比值随时间呈下降趋势,可见在以往的研究中关于压力刺激下HPDLC 分泌OPG 的变化并未有明确的规律。相较于OPG 的表达,OPG/RANKL 的表达可能更具有客观性,更能表达牙周组织改建的状态。本研究发现,当给予实验组LLL 干预后,会降低炎症因子IL-6、TNF-α 的表达,并上调OPG,下调RANKL 的表达,以对抗高糖环境产生的影响,从而使OPG/RANKL 的比值趋近于正常对照组,表明LLL 可拮抗高糖环境引起的炎症因子水平升高以及OPG/RANKL 的比值下降。实验中还观察到,在3.75~5.625 J/cm²这一能量密度范围内,随LLL 剂量的增大,其产生的调控作用增强,表明在一定能量密度范围内,LLL 的作用发挥随剂量增加而增强,由此可以得出相关的细胞学结论,即LLL 具有降低高糖环境中受压力刺激的HPDLC炎症因子IL-6、TNF-α分泌水平的作用,并可参与对骨改建相关因子OPG与RANKL的调控。
尽管有相当多的体外实验、动物模型实验和临床对照实验证实了其有效性,但在临床应用LLL 的过程中还存在很多争议,主要原因是目前针对LLL 发挥效应的真正机制尚未完全清楚还有待进一步的研究。不同的参数设定会影响LLL 效应的发挥,例如波长、功率、能量密度、照射时间、频次及相关剂量等,同时实验对象和操作方法的差异也会对实验结果产生影响。与此同时,不同的实验对象和操作方法也需要对激光的波长进行进一步相应的探索,这是本实验需要下一步需要探索的目标。本研究通过体外实验初步证实了LLL 对于高糖环境下受静压力刺激的HPDLC 的炎症因子及相关的骨改建因子有调控作用,由此可以推测,在临床中,可以尝试应用LLL 来减轻糖尿病患者正畸治疗过程中牙周组织的炎症反应进而调节骨代谢失衡。为LLL 应用于糖尿病患者的正畸治疗提供理论依据及临床指导。在实验设计方面本研究尚存在一定的不足,在对LLL 疗法的参数设定时没有探究更大范围的能量密度值对实验结果产生的影响。所以能够根据治疗需要制定出标准化、统一化、规范化的参数,对于LLL疗法在临床中的应用具有重要意义,也需要进一步探索。
利益冲突声明:作者声明本文无利益冲突。

