持续干旱下接种PGPR对核桃苗抗氧化系统的影响
刘方春,马海林*,刘丙花,井大炜,彭 琳,刘幸红,杜振宇
(1.山东省林业科学研究院 山东省森林植被生态修复工程技术研究中心,山东 济南 250014;2.德州学院 生态与资源环境学院,山东 德州 253023)
干旱是限制植物生长的主要胁迫因子之一,遭受干旱逆境胁迫时,植物体内活性氧类物质(ROS)含量明显升高,细胞膜脂氧化损伤程度加剧[1-2]。为维持植株的正常代谢,植株组织通过增强细胞内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)等酶活性和提高还原型谷胱甘肽(GSH)、还原型抗坏血酸(AsA)等非酶类抗氧化物质含量来有效清除过量的ROS,以缓解干旱胁迫对植株正常代谢造成的影响[3-4]。任家慧等[5]对马铃薯的研究表明,随着干旱胁迫程度增加,4个马铃薯品种的叶片过氧化氢(H2O2)含量呈上升趋势,且AsA、GSH含量以及APX、谷胱甘肽还原酶(GR)活性均显著高于对照。杨伟等[6]对老芒麦的研究认为,干旱胁迫时,抗旱性强的老芒麦的SOD与CAT活性增幅更大,清除ROS的潜在速率更高。江洪强等[7]研究发现,干旱胁迫显著降低了大豆地上部干物质量,叶片中丙二醛(MDA)含量与ROS水平显著升高,且SOD、POD、CAT、APX、单脱氢抗坏血酸还原酶(MDHAR)、GR活性显著升高。由此可见,如何在干旱逆境下进一步提升植物的抗氧化防御系统,增强其干旱适应能力显得尤为重要。
植物根际促生细菌(PGPR)是指存活在植物根圈范围内,对植物生长有促进或对病原菌有拮抗作用的有益细菌[8]。近年来,随着全球气候变暖与干旱程度的不断加剧,借助接种PGPR来增强植物在干旱生境中的适应性,已成为国内外PGPR的研究热点。Jochum等[9]认为,芽孢杆菌(Bacillus) 12D6和肠杆菌(Enterobacter) 16I可以产生吲哚乙酸(IAA)和赤霉素(GA)。温宏伟等[10]研究表明,一些 PGPR能够显著提高SOD、CAT、APX等抗氧化酶活性,诱导小麦的抗氧化防御,减轻干旱胁迫所导致的氧化损伤。还有研究认为[11],侧柏在干旱生境下接种PGPR,能够通过调节保护酶活性与渗透调节物质含量来减轻干旱对植物生长造成的伤害。可见,针对PGPR增强植物抗氧化防御系统方面的研究报道较多,但多数是通过调控土壤含水量来设置不同的干旱胁迫强度,而关于持续干旱胁迫生境下接种PGPR且在核桃上的研究报道则较少。
核桃(Juglansregia)是一种重要的坚果与木本油料果树,在干旱瘠薄山地、城镇绿化、道路建设中有巨大的应用潜力[12]。本研究以1年生鸡爪绵核桃苗为供试植物,研究持续干旱胁迫下接种PGPR对核桃苗株高和茎粗生长、叶片ROS积累和膜脂过氧化产物以及抗氧化酶活性、非酶类抗氧化物质含量的影响,旨在为阐明PGPR提升植物耐旱性的作用机理提供理论依据,也为增强核桃苗在干旱逆境下的适应能力提供新方法。
1 材料与方法
1.1 试验地点与供试材料
试验于2021年7-9月在泰安市北方园艺科学研究所、山东省林科院核桃良种基地试验大棚进行。供试苗木为1年生鸡爪绵核桃种子苗。供试土壤为潮土,基本理化性状为:碱解N、有效P、速效K分别为149.03、49.60、43.48 mg·kg-1,盐分为0.079%,有机质含量为20.13 g·kg-1,pH为6.84。
试验选用的PGPR为课题组前期从植物根际土壤中筛选出的1株假单胞菌属(Pseudomonassp.)X123,该菌株已于2012年12月31日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.7668。
1.2 试验设计与方法
试验共设4个处理,每个处理10盆,分别为:1)CK,正常浇水;2)DR,持续干旱胁迫;3)DR+PGPR,持续干旱+X123液体菌剂;4)CK+PGPR,正常浇水+X123液体菌剂。
X123液体菌剂的制备方法:将X123接种NA液体培养基,于37 ℃、180 r·min-1条件下摇床培养2 d后得到液体菌剂,菌剂浓度为5.3×108CFU·mL-1。
采用盆栽试验,每盆装土10.5 kg。挑选生长较一致的核桃容器苗移植于花盆中,每盆1株。7月4日装盆,缓苗。其中DR+PGPR、CK+PGPR处理的核桃苗缓苗后,分别于2021年7月13日和2021年8月6日,将20 mL液体菌剂稀释5倍,均匀浇灌于核桃苗根系周围(1.0×106CFU·g-1土),共接种2次。所有处理于2021年8月6日浇透水,除CK和CK+PGPR处理正常浇水外,其他处理不再浇水,开始持续干旱胁迫试验。
1.3 测定项目与方法
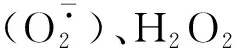
1.4 数据分析
采用Excel 2013和SPSS 22.0分析软件进行相关统计分析,采用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)比较不同处理间的差异(α=0.05)。
2 结果与分析
2.1 株高和茎粗
不同处理对核桃苗株高与茎粗生长的影响见图1,可以看出,株高和茎粗呈现出基本一致的变化规律。正常浇水时,接种PGPR对核桃苗株高与茎粗均未有显著影响。在持续干旱条件下,无论是否接种PGPR,核桃苗的株高和茎粗均显著降低,DR和DR+PGPR处理的株高分别较CK显著降低19.47%和10.51%,茎粗分别较CK降低15.49%和6.50%;而DR+PGPR处理的株高和茎粗分别较DR处理提高11.14%和10.64%,差异达显著水平。以上分析可知,正常水分条件下接种PGPR对核桃苗株高与茎粗的影响较小,而在持续干旱逆境下接种PGPR则能显著促进株高与茎粗的生长,这对于增强核桃苗的干旱逆境适应能力具有重要意义。
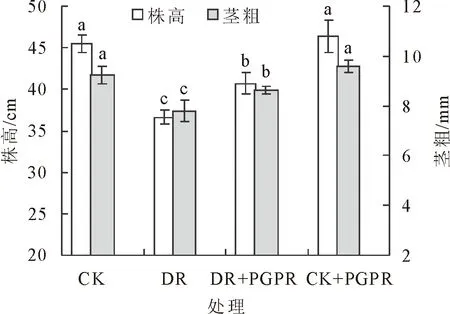
平均值±标准误,不同字母表示处理间差异显著(5%)。下同。图1 不同处理对核桃苗株高和茎粗的影响Fig.1 Effects of different treatments on the plant height and stem diameter of J.regia seedling
2.2 ROS积累
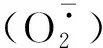
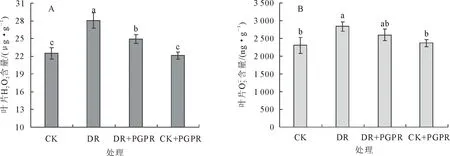
图2 不同处理对核桃苗叶片H2O2和含量的影响Fig.2 Effects of different treatments on the contents of H2O2 and in the leaves of J.regia seedling
2.3 膜脂过氧化产物
由图3可以看出,DR和DR+PGPR处理的MDA含量较CK分别显著高出19.31% 和9.40%,而DR+PGPR处理较DR处理降低8.30%,差异达显著水平。同时可知,CK+PGPR处理与CK无显著性差异。由此可见,在持续干旱胁迫下接种PGPR,能有效减弱核桃苗的细胞膜脂过氧化程度,进而有助于增强细胞膜的完整性。
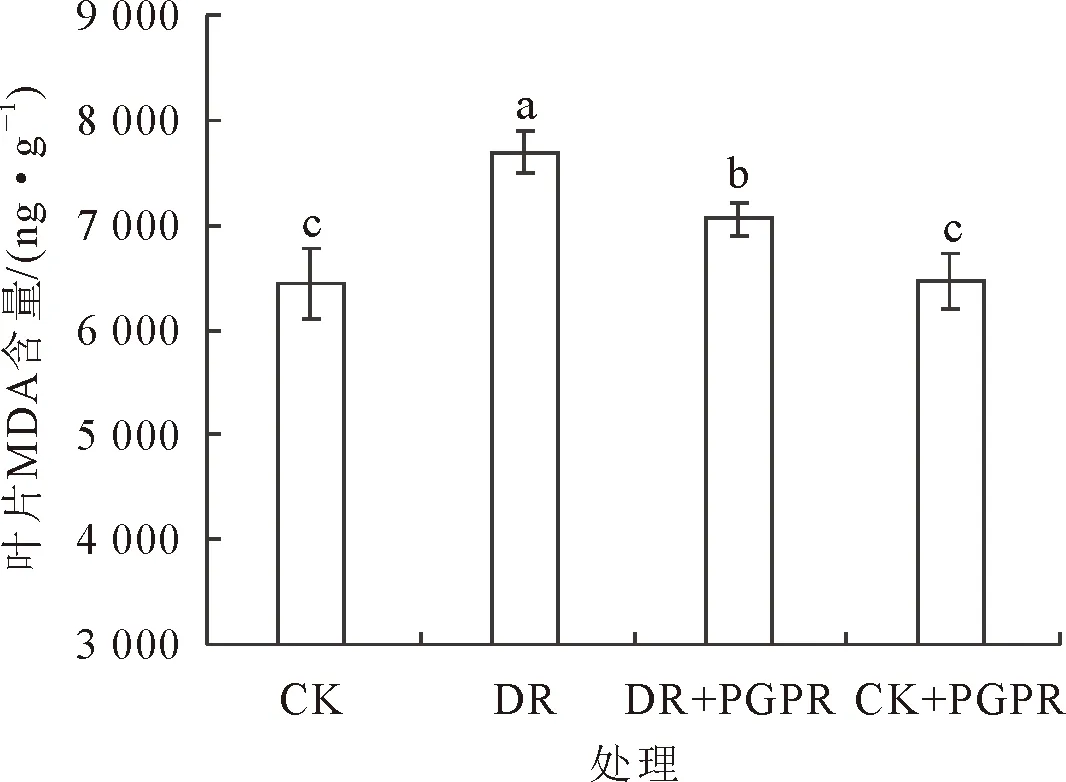
图3 不同处理对核桃苗叶片MDA含量的影响Fig.3 Effects of different treatments on the MDA content in the leaves of J.regia seedling
2.4 抗氧化酶活性
由表1可以看出,核桃苗叶片的SOD、CAT活性呈现出相类似的变化趋势。正常浇水条件下,接种PGPR对SOD和CAT活性均无显著影响;在持续干旱胁迫条件下,DR处理的SOD和CAT活性分别较CK提高13.28%和29.68%,差异达显著水平,这表明核桃苗本身具有较强的抗旱性。同时,DR+PGPR处理的SOD、CAT活性较DR处理显著升高19.76%、13.19%。可见,在持续干旱逆境下接种PGPR能有效提高核桃苗叶片的SOD和CAT活性。叶片APX活性的大小顺序为:DR+PGPR>DR>CK≈CK+PGPR,DR和DR+PGPR处理的APX活性分别较CK显著提高11.07%和27.39%,而DR+PGPR处理较DR处理显著提高14.69%。叶片各处理间的MDHAR活性差异显著,说明无论水分状态如何,接种PGPR均能提高核桃苗叶片的MDHAR活性。此外,DR和DR+PGPR处理的叶片GR活性相比CK均显著升高,而DR+PGPR处理较DR处理虽有一定提高,但差异未达显著水平。上述分析可知,在持续干旱生境下接种PGPR能不同程度增强核桃苗叶片的抗氧化酶活性。

表1 不同处理对核桃苗叶片抗氧化酶活性的影响Table 1 Effects of different treatments on the antioxidant enzyme activity in the leaves of J.regia seedling
2.5 抗氧化物质
不同处理对核桃苗叶片AsA和GSH含量的影响见图4,可以看出,CK+PGPR处理的AsA含量与CK无显著性差异,DR处理的AsA含量较CK显著降低19.96%,而DR+PGPR处理相比DR处理提高13.05%,差异达显著水平。同时,叶片GSH含量的变化规律为:DR+PGPR>DR>CK+PGPR≈CK,可见,正常浇水条件下接种PGPR对GSH含量的影响较小,而在持续干旱胁迫下接种PGPR可显著提高GSH含量,DR处理较CK显著提高9.98%,DR+PGPR处理较DR处理显著提高15.83%。此外,各处理的AsA/DHA比值分别为2.59、1.92、2.16和2.74,GSH/GSSG比值分别为2.65、2.46、2.52和2.78。以上分析可知,在持续干旱逆境下接种PGPR能够不同程度地提高核桃苗叶片的AsA、GSH含量以及AsA/DHA和GSH/GSSG值,进而可增强清除ROS的能力。
3 结论与讨论
株高和茎粗可以反映植物在逆境下的生长状况。杨伟等[6]研究表明,干旱胁迫14 d和21 d后,老芒麦的株高生长明显受到了抑制。还有研究认为[13],接种PGPR能够显著促进红枣植株生长发育,提高植株株高、生物量、叶片氮及磷的含量。本研究结果表明,持续干旱胁迫环境使核桃苗的株高与茎粗显著降低,而在持续干旱胁迫条件下接种PGPR能够显著促进核桃苗株高与茎粗的生长。
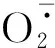
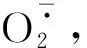
研究表明,当植物受到逆境胁迫时,AsA-GSH循环中的酶活性显著升高,而且高浓度内源AsA与GSH能够缓解ROS对叶片的氧化损伤程度[21-22]。本研究中,持续干旱胁迫环境使核桃苗叶片的APX活性显著升高,通过消耗AsA与GSH,快速清除过量的H2O2,降低核桃苗叶片的活性氧水平;而叶片中MDHAR与GR活性也显著升高,这有助于促进AsA和GSH的再生。同时,持续干旱逆境下接种PGPR可显著提高叶片APX和MDHAR活性,对叶片GR活性也有一定程度的提高,表明接种PGPR有助于增强AsA-GSH循环再生能力。此外,AsA/DHA和GSH/GSSG反映了植株遭受氧化损伤的程度[23]。有研究认为[24],细胞内AsA/DHA和GSH/GSSG值越高,植物的抗氧化能力越强。本研究表明,持续干旱胁迫降低了核桃苗叶片的AsA/DHA和GSH/GSSG值,这与杨伟等[6]在老芒麦上的研究结果基本一致。同时,在持续干旱胁迫下接种PGPR可以在一定程度上提高AsA/DHA和GSH/GSSG的值,这说明在持续干旱逆境下接种PGPR能够维持细胞内相对较高的AsA/DHA和GSH/GSSG,从而提高核桃苗叶片的抗氧化能力,有效减少ROS的积累。

