‘清香’核桃叶片叶绿素含量高光谱估测模型研究
陈学兄,杨天剑,张小军,刘群龙*
(1.山西农业大学 资源环境学院,山西 太谷 030801;2.山西农业大学 园艺学院,山西 太谷 030801)
叶绿素是植物光合作用的主要载体,其含量是植株营养状况的重要指标,能够反映植物叶片光合作用能力强弱、对营养胁迫的反应以及植株健康状况[1-4]。叶绿素含量与光合能力及氮素状况之间具有较强相关性,对其含量的测定分析是评价植物长势的有效手段[5-6]。因此,快速、准确地估测植物叶片的叶绿素含量及其变化,对于植物营养状况监测、肥水科学管控等具有指导意义[3]。传统的叶绿素测量方法主要是室内化学分析法,对植株具有破坏性,且难以实现大量样品叶绿素含量的实时监测。已有研究表明,果实不同生育期叶片绿色度(SPAD值)与叶片叶绿素含量呈显著正相关,可以用作衡量叶片叶绿素含量的有效指标[7-8]。通过便携式叶绿素测定仪测量叶片SPAD值,可实现叶片叶绿素含量的无损、快速估测,但该技术仅能进行某个点或小范围叶绿素SPAD值的测量,不利于大范围叶绿素含量的监测。
随着遥感技术的不断发展,利用高光谱遥感技术对植物养分的诊断监测与理化指标参数的提取研究,已成为该技术的主要发展方向[9]。近年来,有关高光谱与叶绿素含量关系的研究大多集中在小麦[1,10]、水稻[11]、玉米[7,12-14]、棉花[8,15]、大豆[16]、苹果[3-5,17]、葡萄[18]和桃[19]、杨树[20]和石楠[21]等植物上,而有关核桃叶绿素含量高光谱估测的研究相对较少。核桃是具有明显地方特色的优势干果经济林树种,已成为核桃产区特色农业支柱产业之一[22]。然而,当前核桃生产上普遍存在产量低、品质低下、效益慢等问题,主要是由于核桃栽培中施肥与养分管理不科学、低效率所致[22]。因此及时了解作物的营养状况,科学、合理和精准施肥是山西省核桃产业提质增效亟待解决的关键问题之一。目前,已有研究开展了部分核桃品种叶绿素含量高光谱估算相关研究,如王鑫梅等[23]使用RVI、DVI和NDVI指数对5年生‘香玲’核桃不同生育期冠层叶绿素含量进行了高光谱估算研究,而对山西省主栽品种‘清香’核桃(Juglansregia‘Qingxiang’)叶片叶绿素含量高光谱监测方面的研究则鲜有报道。鉴于此,本研究以晚实‘清香’核桃为对象,分析核桃果实不同生育期(速生期、硬核期、脂化期和成熟期)叶片的高光谱特征,选取多种光谱特征参量构建‘清香’核桃果实不同生育期叶片SPAD值的最佳估测模型,以期为核桃的营养诊断、高产栽培及遥感估产提供理论依据和技术支持。
1 材料与方法
试验地位于山西省晋中市榆次区北田镇小赵村的威特生态庄园核桃示范园(37°59′N,112°76′E),试验材料为‘清香’核桃树,南北行向栽植,株行距5 m×6 m,树龄10 a,树形为疏散分层型,常规管理。
1.1 试验设计
选取生长状况良好的核桃树120株,于2021年核桃萌芽前进行不同水平N肥(尿素N≥45%)处理。施肥试验采用单因素随机区组设计,设4个水平:N0,不施氮肥;N1,最佳施氮肥量的0.5倍(纯N,0.75 kg·株-1);N2,最佳施氮肥量(纯N,1.50 kg·株-1);N3,最佳施氮肥量的1.5倍(纯N,2.25 kg·株-1)。P肥(过磷酸钙,P2O5≥18%)和K肥(硫酸钾,K2O≥40%)按常规施肥,施肥量(纯量)分别为:0.70 kg·株-1和0.30 kg·株-1。每处理重复3次,10株为1小区,共12个试验小区。采用沟施,每一处理施N肥、常规P肥和K肥于树冠的2/3处,且采用环状沟施的方式,环状沟深为50 cm。将肥料与表土混合均匀后施入沟底,生土填平,所有肥料在核桃萌芽前一次性施入。
于核桃果实不同生育期:速生期(5月26-27日)、硬核期(7月4-5日)、脂化期(8月12-13日)、成熟期(9月10-11日),在冠层外围东、南、西、北4个方位随机采集充分展开、无损伤、无病虫害的健康功能叶片各1片,尽量涵盖不同长势的叶片。将采集的叶片迅速装入保鲜袋内封口,并按植株进行编号,然后放到盛有冰块的泡沫保鲜箱中,带回实验室进行光谱和叶绿素含量测定。
1.2 光谱数据采集与预处理
采用ASD FieldSpec 4地物光谱仪测定,在能控制光照条件的暗室内进行,测定前用标准白板进行校正,并用脱脂棉将测定光谱的叶片表面擦拭干净;测定时将叶片单层平整置于黑色橡胶垫(反射率近似为0)上,光谱仪视场角为10°,探头距样品表面的距离为0.13 m;使用光谱仪自带的50 W卤化灯为光源,其距样品表面的距离为0.50 m,方位角为60°,探头垂直向下分别正对待测叶片的前、中、后3个部位,每次观测记录10个采样光谱,总计测定30个采样光谱,取其平均值作为该叶片的光谱反射率值,并将同棵树4片叶的光谱反射率平均值作为该棵的光谱反射率。
利用ViewSpec Pro6.2对光谱反射率进行初步处理,先剔除异常光谱曲线,然后对其他光谱曲线进行平均、平滑处理,为了进一步消除噪音和背景干扰等的影响,对光谱反射率计算一阶微分光谱。使用OriginPro 9.1软件做图。
1.3 叶片叶绿素含量的测定
使用SPAD-502便携式叶绿素测定仪(KONICA MINOLTA公司,日本)测定核桃叶片的SPAD值。每株树测4片,每片叶测定前、中、后3个部位6个位点(注意避开叶脉部分),取6个位点数值的平均值作为该叶片的SPAD值。
1.4 数据分析
选用对叶绿素含量具有较好预测性的光谱特征参量23种:1)“三边”特征参量:蓝边幅值(Db)、蓝边位置(λb)、蓝边面积(SDb)、黄边幅值(Dy)、黄边位置(λy)、黄边面积(SDy)、红边幅值(Dr)、红边位置(λr)、红边面积(SDr)。2)光谱指数特征参量:红边蓝边面积比值(SDr/SDb)、红边黄边面积比值(SDr/SDy)、红边蓝边面积的归一化值[(SDr-SDb)/(SDr+SDb)]、红边黄边面积的归一化值[(SDr-SDy)/(SDr+SDy)]、红色归一化差值指数(NDVI)、绿色归一化差值指数(GNDVI)、红边指数(VOG2)、叶绿素吸收比率指数(CARI)、转换叶绿素吸收比率指数(TCARI)、修正叶绿素吸收比率指数(MCARI)、优化型土壤调节植被指数(OSAVI)、TCARI/OSAVI、MCARI/OSAVI和MERIS陆地叶绿素指数(MTCI)。其中,蓝边位置、黄边位置和红边位置分别为蓝边幅值、黄边幅值和红边幅值所对应的波长位置(nm),其他光谱特征参量的计算公式详见文献[24]。
应用Pearson相关分析计算叶绿素含量与各光谱特征参量的相关系数,并使用双侧法检验‘清香’核桃叶片叶绿素含量与光谱特征参量的相关性;采用线性函数、指数函数、幂函数、对数函数、二次函数和三次函数模型建立叶片叶绿素含量光谱特征参量估算模型。
2 结果与分析
2.1 不同N肥处理对不同生育期叶片SPAD值的影响
叶片SPAD值在果实脂化期最高,速生期最低,总体呈现随生育期推进先增加后降低的变化趋势,且不同N肥处理对不同生育期叶片SPAD值的影响各不相同(图1)。果实速生期叶片SPAD值42.16~43.74,施肥处理为N1时叶片SPAD值最低,处理为N0时值最高,二者间表现为显著性差异;施肥处理为N1、N2和N3时叶片SPAD值相近,三者间均表现为差异不显著。果实硬核期叶片SPAD值为48.26~49.48,施肥处理为N0时值最高,与施肥处理N1相比,二者的叶片SPAD值接近,表现为差异不显著;施肥处理为N2和N3时叶片SPAD值相近,表现为差异不显著,与施肥处理N0、N1时相比较,均表现为显著性差异。果实脂化期叶片SPAD值为50.84~51.35,4个施肥处理之间的叶片SPAD值相近,均表现为差异不显著。果实成熟期叶片SPAD值为48.23~51.13,施肥处理为N3时其值最低,处理为N0时其值最高,是前者的1.06倍,且表现为差异性显著,与其余2个处理相比,前者均表现为显著性差异,后者均表现为差异不显著。

误差线表示30个独立重复的标准差。不同小写字母表示在0.05水平上的差异显著性。图1 不同N肥处理对果实不同生育期叶片SPAD值的影响Fig.1 Effect of different nitrogen fertilizer treatments on leaf SPAD values in different fruit growth periods
2.2 果实不同生育期叶片光谱的变化规律
果实不同生育期核桃叶片的高光谱曲线见图2。从图2可以看出,速生期、硬核期、脂化期和成熟期核桃叶片原始光谱曲线的总体变化趋势基本一致。在可见光550 nm附近有1个小反射峰,称作“绿峰”,这是由于核桃叶片反射绿光形成的,果实不同生育期的绿峰位置无明显差异;在670 nm附近形成1个吸收谷,称作“红谷”,这是由于核桃叶片吸收红光进行光合作用引起的,其中速生期的红谷位置为667~671 nm,硬核期为666~671 nm,脂化期为666~673 nm,成熟期为664~672 nm;在700~720 nm是一个陡坡,称作“红边”,反射率急剧增高;在720~1 300 nm是一个高反射率平台,其中脂化期的平台最高,其次是成熟期,速生期的平台最低;在1 450 nm和1 925 nm附近有2个吸收谷,是核桃叶片对水汽进行吸收形成的。
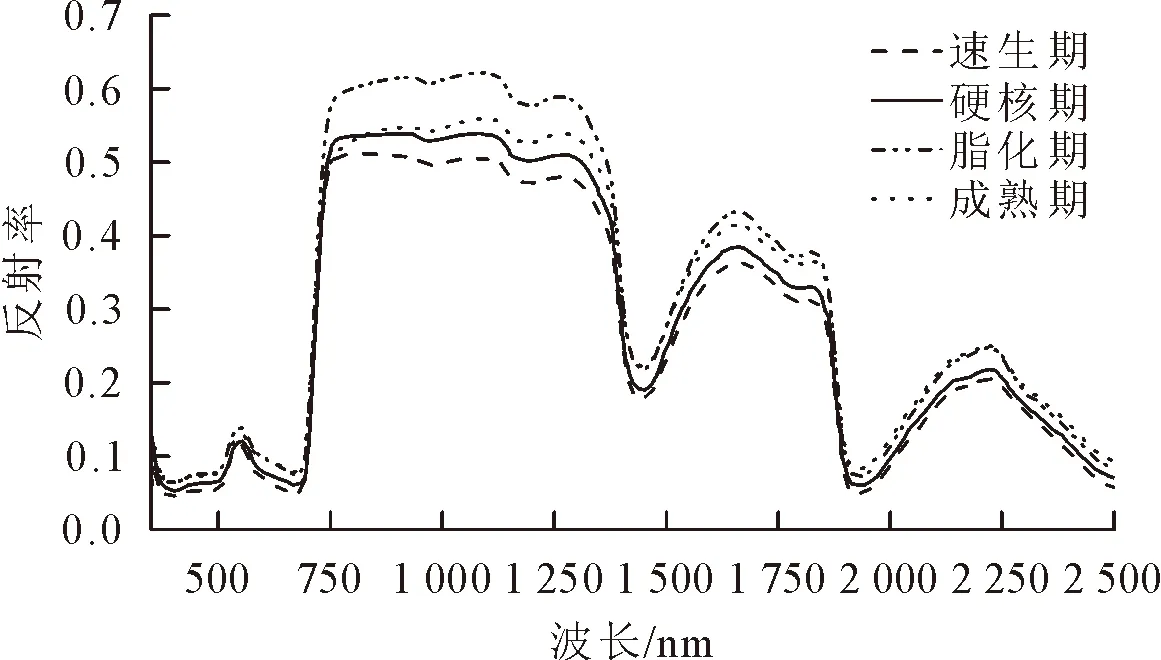
图2 核桃果实不同生育期叶片的高光谱曲线Fig.2 Hyperspectral curves of walnut leaves in different fruit growth periods
2.3 果实不同生育期叶片SPAD值与光谱相关性分析
核桃果实不同生育期叶片SPAD值与原始光谱和一阶微分光谱相关性见图3、图4。

图3 核桃果实不同生育期叶片SPAD值与原始光谱相关性Fig.3 Correlation between the SPAD values and original spectrum of J.regia in different fruit growth periods
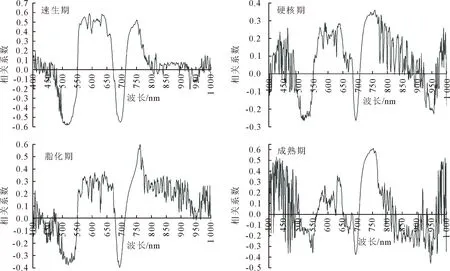
图4 核桃果实不同生育期叶片SPAD值与一阶微分光谱相关性Fig.4 Correlation between the SPAD values and first-order differential spectrum in different fruit growth periods
从图3可以看出,核桃果实不同生育期叶片SPAD值与原始光谱的相关性曲线差异显著。速生期叶片SPAD值与原始光谱的所有波段呈负相关关系,529~568 nm相关系数达0.40以上,在波段549 nm处相关系数达到0.426 9;702~707 nm相关系数达0.45以上,在波段705 nm处相关系数高达0.456 5。硬核期叶片SPAD值与原始光谱在527~573、699~715 nm处呈负相关关系;在753~1 321 nm相关系数达0.17以上,在波段1 068 nm处相关系数最大,为0.191 9。脂化期叶片SPAD值与原始光谱在542~556、702~720 nm处呈负相关关系,且相关系数极小;在波段417、672 nm处相关系数较高,分别为0.312 7和0.275 0。成熟期叶片SPAD值与原始光谱在350~384、698~712、1 408~1 520 nm和1 870~2 500 nm处呈负相关关系;785~868、1 046~1 127 nm的相关系数达0.34以上,在波段822 nm处相关系数达到最大,为0.346 1,1 094 nm处相关系数为0.344 5。
从图4可以看出,速生期叶片SPAD值与一阶微分光谱在482~551、672~713 nm处呈负相关关系,波段513 nm处相关系数达到最大,为0.585 2;在552~671、714~797 nm处呈正相关关系,最大相关系数达到0.58以上。硬核期叶片SPAD值与一阶微分光谱在494~550、684~707 nm处呈负相关关系,最大相关系数达到0.26以上;在551~683、708~840 nm处呈正相关关系,在波段758 nm处相关系数最大(0.358 5)。脂化期叶片SPAD值与一阶微分光谱在480~550、678~711 nm处呈负相关关系,551~677、712~942 nm处呈正相关关系,在波段761 nm处相关系数达到最大,为0.594 1。成熟期叶片SPAD值与一阶微分光谱在504~562、651~678、683~705 nm处呈负相关关系,563~626、628~650、706~794 nm处呈正相关关系,波段753 nm处相关系数达到最大,为0.607 9。与原始光谱相比,核桃果实不同生育期叶片SPAD值与一阶微分光谱的相关系数有所提高。在长波段上叶片SPAD值与一阶微分光谱的极显著相关波段不作为光谱特征参量选取的依据。
2.4 果实不同生育期叶片SPAD值与光谱特征参量的相关性
利用Pearson相关分析分别计算果实不同生育期叶片SPAD值与“三边”光谱参量和光谱指数的相关系数,结果见表1。

表1 果实不同生育期核桃叶片SPAD值与光谱特征参量相关系数Table 1 Correlation coefficients between leaves SPAD value and spectral characteristic parameters in different fruit growth periods
从表1可以看出,‘清香’核桃速生期、硬核期、脂化期和成熟期的叶片SPAD值均与红边位置、SDr/SDb、(SDr-SDb)/(SDr+SDb)、GNDVI和MTCI呈极显著正相关(P<0.01),而与SDr/SDy、(SDr-SDy)/(SDr+SDy)、VOG2、CARI、TCARI、MCARI、TCARI/OSAVI和MCARI/OSAVI呈极显著负相关(P<0.01)。‘清香’核桃速生期,叶片SPAD值与“三边”光谱参量Db和SDb呈极显著负相关(P<0.01),而与Dy、SDy和λr呈极显著正相关(P<0.01);叶片SPAD值与λy呈显著负相关(P<0.05),而与Dr和SDr均未达到显著水平(P>0.05)。‘清香’核桃硬核期,除λb和NDVI外,其他参量与叶片SPAD值均达到极显著水平(P<0.01),其中与光谱指数(SDr-SDb)/(SDr+SDb)的相关性最强,相关系数达到0.814,与蓝边位置λb和光谱指数NDVI未达到显著水平(P>0.05)。‘清香’核桃脂化期,叶片SPAD值与“三边”光谱参量Db、SDb、SDy和λr呈极显著相关(P<0.01),而与其他参量均未达到显著水平(P>0.05);与光谱指数NDVI呈显著负相关(P<0.05),与OSAVI未达到显著水平(P>0.05)。‘清香’核桃成熟期,叶片SPAD值仅与“三边”光谱参量Dy、λr和SDr极显著正相关(P<0.01),与Db、SDb、SDy和Dr呈显著相关(P<0.05);与光谱指数NDVI和OSAVI均未达到显著水平(P>0.05)。
2.5 叶片叶绿素SPAD值光谱特征参量估测模型及精度检验
对建立核桃叶片SPAD值估测模型的样本随机分组:2/3样本用于建模,1/3用于模型检验。选取表1中与‘清香’核桃叶片SPAD值呈极显著相关(相关系数0.6以上)的光谱特征参量作为自变量(x),以叶片SPAD值为因变量(y),分别建立各参量的线性函数、幂函数、指数函数、对数函数、二次函数和三次函数模型,选出回归决定系数(R2)最大的模型(表2)。

表2 果实不同生育期核桃叶片SPAD值与光谱特征参量估测模型Table 2 Estimation models of the walnut leaf SPAD value and spectral characteristic parameters in different fruit growth periods
表2中所有模型的回归显著性概率均<0.01,说明拟合回归模型方程均达到极显著。在此基础上,根据决定系数(R2)最大的优选原则,进一步对速生期、硬核期、脂化期和成熟期叶片SPAD值估测效果最佳模型进行筛选,从表2可以看出,果实速生期光谱指数(SDr-SDb)/(SDr+SDb)与叶片SPAD值的关系以指数模型为最佳,其决定系数(R2)为0.664;果实硬核期MTCI与叶片SPAD值的关系以线性模型和二次多项式模型最优,决定系数均为0.612;果实脂化期对叶片SPAD值估测以(SDr-SDb)/(SDr+SDb)的二次多项式模型最优,其决定系数为0.552;果实成熟期以MTCI的二次多项式模型估测叶片SPAD值最优,其决定系数为0.503。为检验估测模型的可靠性,评价叶片SPAD值实测值(x)与估测值(y)之间的拟合效果,使用检验集样本的各光谱特征参量作为变量,分别估测其对应叶片的SPAD值,然后与实测值进行比较,采用斜率(Slope)、决定系数(R2)、均方根误差(RMSE)和相对误差(RE)对实测值和估测值之间的拟合程度进行精度检验,结果见表3。

表3 果实不同生育期核桃叶片SPAD值与光谱特征参量估测模型精度检验Table 3 Precision test of models for estimating the walnut leaf SPAD value and spectral characteristic parameters in different fruit growth periods
从表3可以看出,光谱指数(SDr-SDb)/(SDr+SDb)可较好地估测‘清香’核桃果实速生期和脂化期叶片的SPAD值,这2个时期叶片SPAD值的实测值与估测值拟合方程的均方根误差分别为0.476 8、0.532 3,相对误差分别为0.886 2和0.776 6,均较小;MTCI可较好地估测果实硬核期和成熟期叶片的SPAD值,其中果实硬核期MTCI与叶片SPAD值的关系以线性模型的检验精度更高,该时期叶片SPAD值的实测值与估测值拟合方程的均方根误差和相对误差分别为0.504 0和0.844 2,而果实成熟期以MTCI的二次多项式模型估测叶片SPAD值最优,检验模型决定系数为0.821 1,均方根误差和相对误差分别为0.957 6、1.481 9,表明模型能较好地估测核桃叶片SPAD值。
3 结论与讨论
1)核桃果实不同生育期叶片原始光谱曲线总体变化趋势基本一致,但红边位置差异较明显;不同生育期叶片SPAD值与原始光谱和一阶微分光谱的相关性差异显著,其中果实速生期叶片SPAD值与原始光谱的所有波段呈负相关关系,在波段705 nm处相关系数高达0.456 5。
2)确定了‘清香’核桃果实不同生育期叶绿素含量的最佳估测模型:速生期为指数函数SPAD=8.172e2.048[(SDr-SDb)/(SDr+SDb)];硬核期为线性函数SPAD=6.537MTCI+33.021;脂化期为二次多项式函数SPAD=-849.591[(SDr-SDb)/(SDr+SDb)]2+1 475.402[(SDr-SDb)/(SDr+SDb)]-587.703;成熟期为二次多项式函数SPAD=-8.313MTCI2+37.415MTCI+9.868,以上模型为快速、无损、精确监测‘清香’核桃果实不同生育期叶片叶绿素含量提供了方法和参考,对核桃的营养诊断及长势监测具有一定的指导意义和参考价值。
叶绿素作为光合作用的主要载体,其含量是评估果树长势及其产量的主要参数,已有研究利用RVI、DVI和NDVI指数构建了5年生‘香玲’核桃果实膨大期、硬核期、油脂转化期和成熟期冠层叶绿素含量的高光谱估算模型,发现NDVI指数可有效反演不同生育期的冠层叶绿素含量[21],这与本研究的分析结果不太一致,本研究分析得出速生期叶片SPAD值与NDVI指数呈极显著正相关(P<0.01),相关系数仅为0.295,脂化期呈显著负相关(P<0.05),相关系数为0.213,硬核期和成熟期均未达到显著水平(P>0.05),相关系数很小,分别为-0.077和-0.028,原因可能是气候条件、土壤、季节、树龄和品种、栽培管理等自然和人为因素的影响,使核桃叶片的高光谱信息有所不同,且试验材料为早实核桃品种,所用光谱指数也较单一。另外,已有研究采用果树离体叶片测定SPAD值,并在一个能控制光照条件的暗室内,将叶片置于反射率近似为零的黑色橡胶垫上,无噪音和背景干扰的情况下测定光谱数据,进而构建了叶片SPAD值估测模型,如朱西存等[4]以不同物候期红富士苹果的离体叶片为研究对象,构建了基于红边参数的叶片SPAD值估测模型;刘京等[15]以苹果离体叶片为研究对象,利用SVR算法对其叶绿素含量进行了高光谱反演;吴文强等[17]以桃树离体叶片为研究对象,使用PCA-BP神经网络算法构建了叶片SPAD值光谱估算模型。本研究在已有研究基础上,在人工定量施肥干扰下,对10年生晚实‘清香’核桃果实不同生育期(速生期、硬核期、脂化期和成熟期)叶片光谱反射率和叶片SPAD值进行了测定,构建了不同生育期叶片SPAD值的估测模型,并利用同一区域相应生育期的样本数据对估测模型进行了验证,确保模型的可信度和适应性,但该模型是否可用于不同区域、不同品种、不同树龄核桃树叶绿素含量的监测还有待进一步研究。

